через какие мембранные рецепторы sars cov 2 предположительно проникает в клетку
Через какие мембранные рецепторы sars cov 2 предположительно проникает в клетку
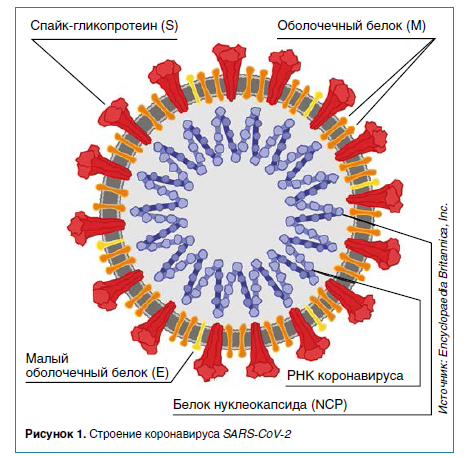
В журнале Nature опубликован очень подробный обзор, характеризующих особенности строения и жизненный цикл SARS-CoV2, механизмы инфицирования и избегания своевременного иммунного ответа, обозначены потенциальные мишени для создания противовирусных препаратов. Также представлены результаты компьютерного моделирования строения вируса и механизмов проникновения в клетку.
Особенностью данного вируса является наличие очень большого количества гликанов на поверхности спайк-протеина, маскирующих его от иммунной системы человека. Поэтому на первом этапе заболевания вирус подобен «волку в овечьей шкуре» и остается невидим для иммунной системы. В дальнейшем, когда вирус уже размножился, иммунный ответ может развиться даже избыточно, что, по-видимому, лежит в основе тяжелого течения заболевания.
В S2- субъединице спайк-протеина есть три участка, делающих «ножку» спайк-протеина гибкой, что позволяет ей «искать» рецепторы на клетках хозяина более эффективно. Такая структура довольно редка для вирусов, обычно аналогичные «шипики» на поверхности вириона ригидны (такова, например, ситуация у вируса гриппа).
Важной частью спайк-протеина является RBD-домен, функцией которого является связь с рецептором ACE2 на поверхности клетки-хозяина. У SARS-CoV2 эта связь в 2-4 раза сильнее, чем у вируса SARS. Во время взаимодействия с рецептором этот домен «выдвигается» из-за двух маскирующих его молекул гликанов. Исследования in vitro показали, что мутации в этих двух гликанах могут полностью нарушать процессы проникновения вируса в клетку. Для эффективного взаимодействия RDB и ACE2 предпочтительна более «высокая» позиция этого домена на остальными структурами. У альфа варианта вируса найдено 10 дополнительных мутаций, приводящих RBD – домен в более «высокое» положение, а у дельта вируса – еще 3 мутации.
Попав в клетку, вирус подавляет экспрессию генов клетки-хозяина, в том числе – образование интерферонов, сигнализирующих о вирусной инфекции. Для ковидной инфекции типична очень низкая концентрация интерферонов в крови.
В дальнейшем может происходить формирование синцитиев из клеток легочной ткани. Считается, что синцитии позволяют дольше и эффективнее вырабатывать вирусные белки. Такой тип агрессии типичен для персистирующих вирусов – например, ВИЧ. SARS-CoV2 индуцирует даже формирование синцитиев клеток респираторного эпителия с лимфоцитами, что мешает нормальному иммунному ответу. Такой тип «маскировки» от иммунитета типичен для опухолей, а не вирусов.
В дальнейшем перестраивается эндоплазматический ретикулум с формированием шарообразных двухмембранных структур, в которых происходит активный синтез белков вируса. Выход вирионов наружу осуществляется в лизосомах, формирующихся в комлексе Гольджи, путем экзоцитоза. Считается, что молекулярные механизмы, ответственные за описанные процессы, могут быть мишенями для противовирусной терапии.
В месте соединения S1 и S2 субъединиц спайк-протеина есть зона, которая способна связывать и быть расщепленной фурином – протеазой клетки-хозяина, содержащейся в лизосомах. Такое предварительное расщепление значительно упрощает в дальнейшем взаимодействие с трансмембранной протеазой TMPRSS2 и значительно увеличивает проникновение вирусной частицы в следующую клетку. Для вируса SARS показано, что порядка 10% вирусных частиц на выходе из клетки – хозяина связано с фурином. У вируса SARS-CoV2 в соответствующем локусе, отвечающем за связь с фурином, идентифицированы мутации. Как следствие, до 50% вирионов альфа-разновидности SARS-CoV2, выходящих из клетки-хозяина, связаны с фурином, а в случае дельта-вируса – до 90%, что, по-видимому, и объясняет более агрессивное распространение этого варианта вируса. Есть данные, что у пациентов с дельта-формой в тканях легких и носоглотки содержание вирионов достоверно выше, чем у носителей альфа-формы.
По материалам: Megan Scudellari. How the coronavirus infects cells — and why Delta is so dangerous. Nature 595, 640-644 (2021). doi:
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета “Педиатрия сегодня” №6, 2021
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
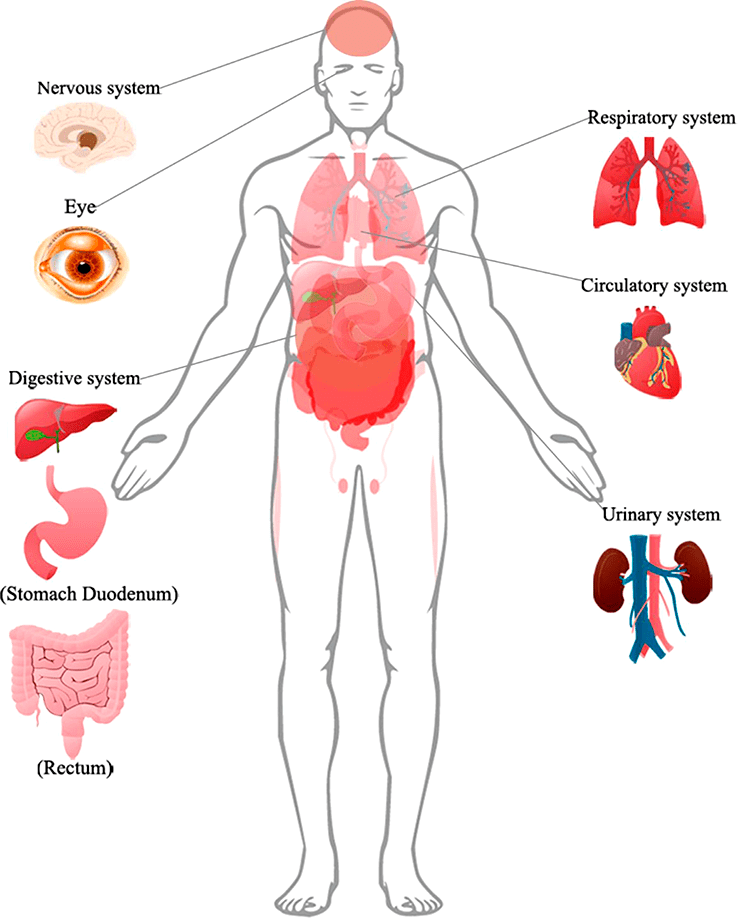
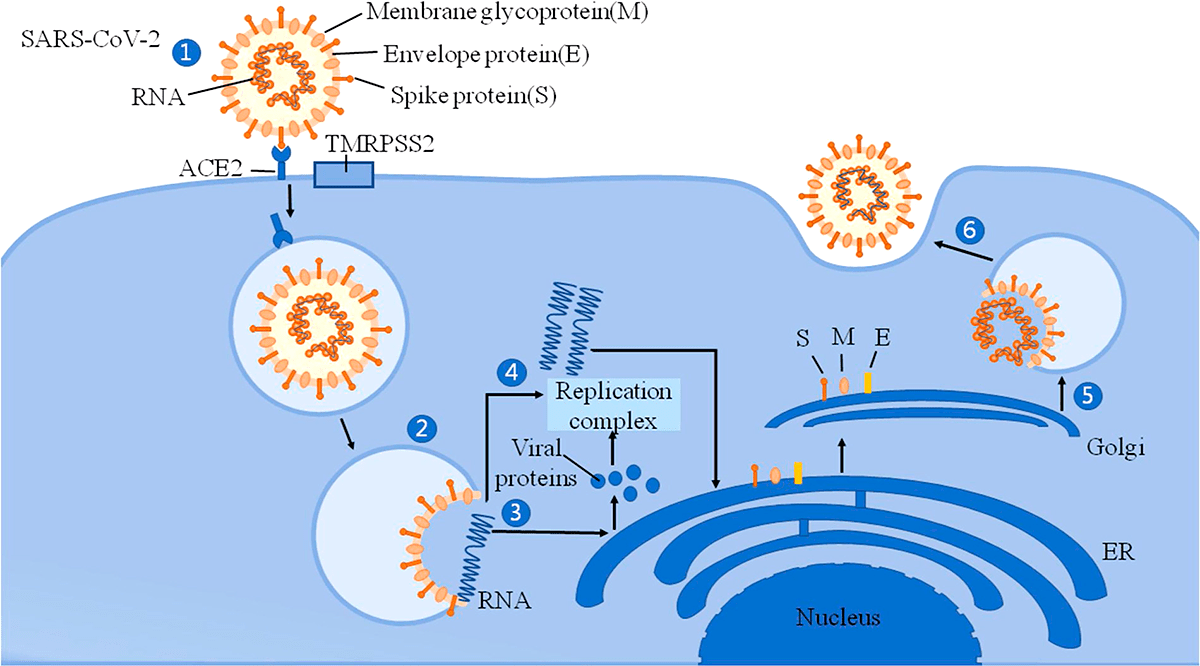
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
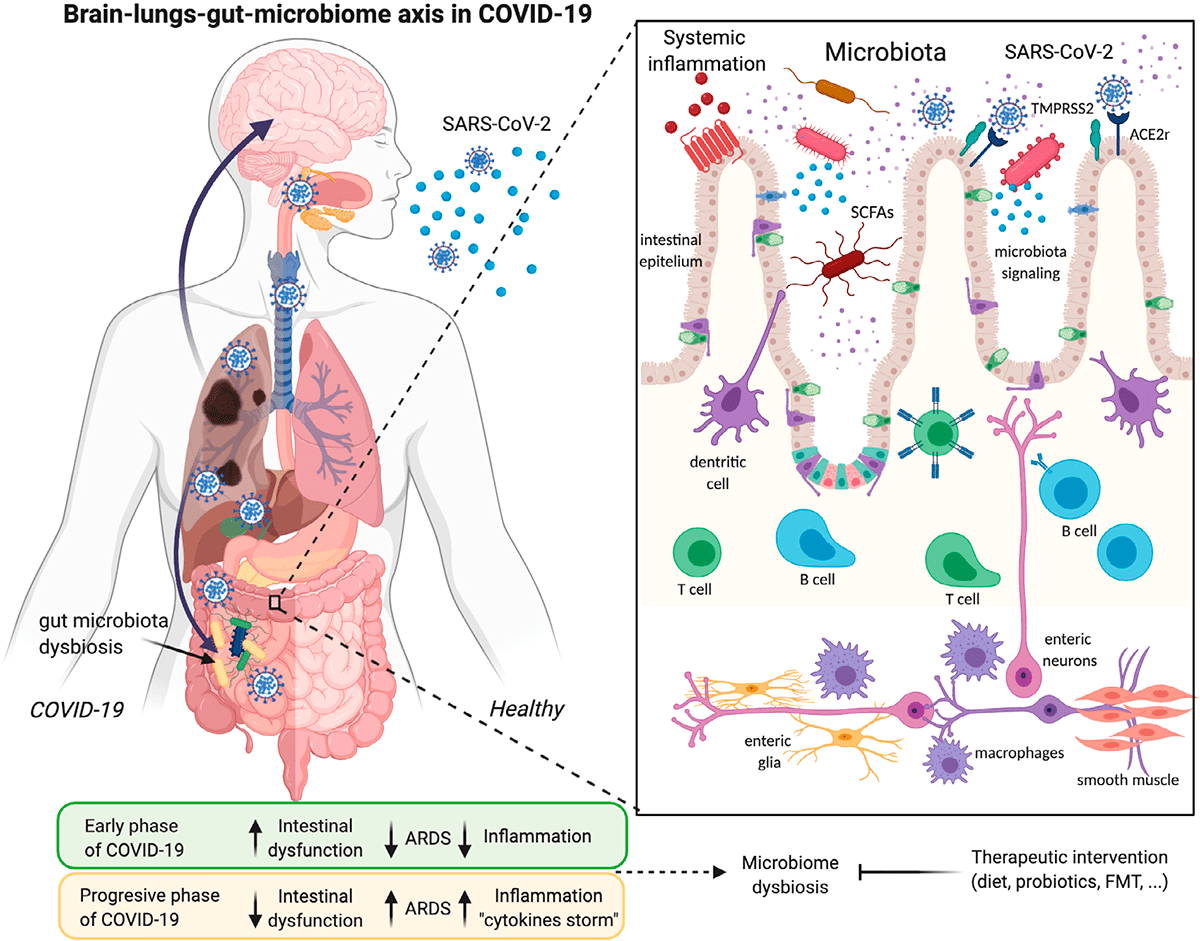
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
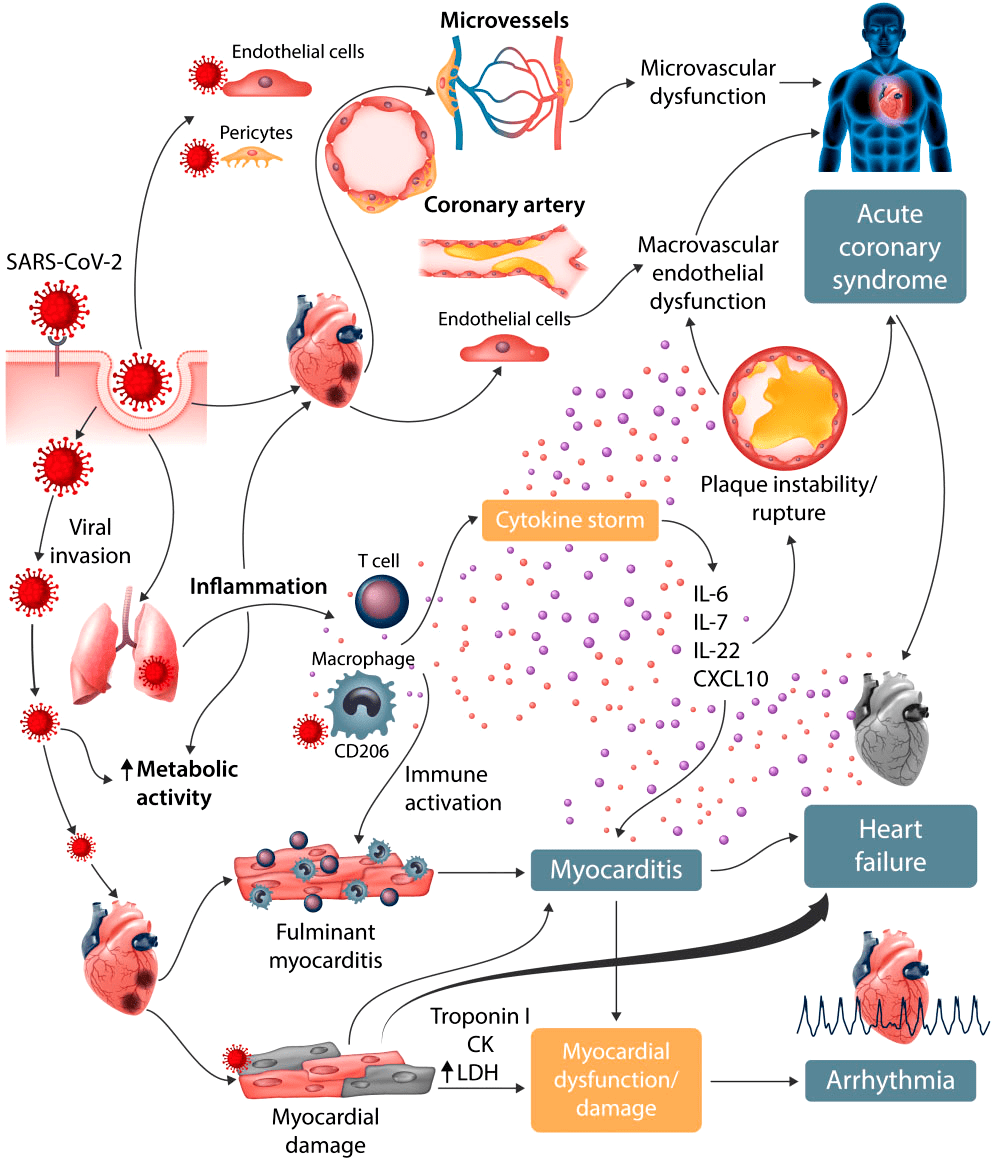
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
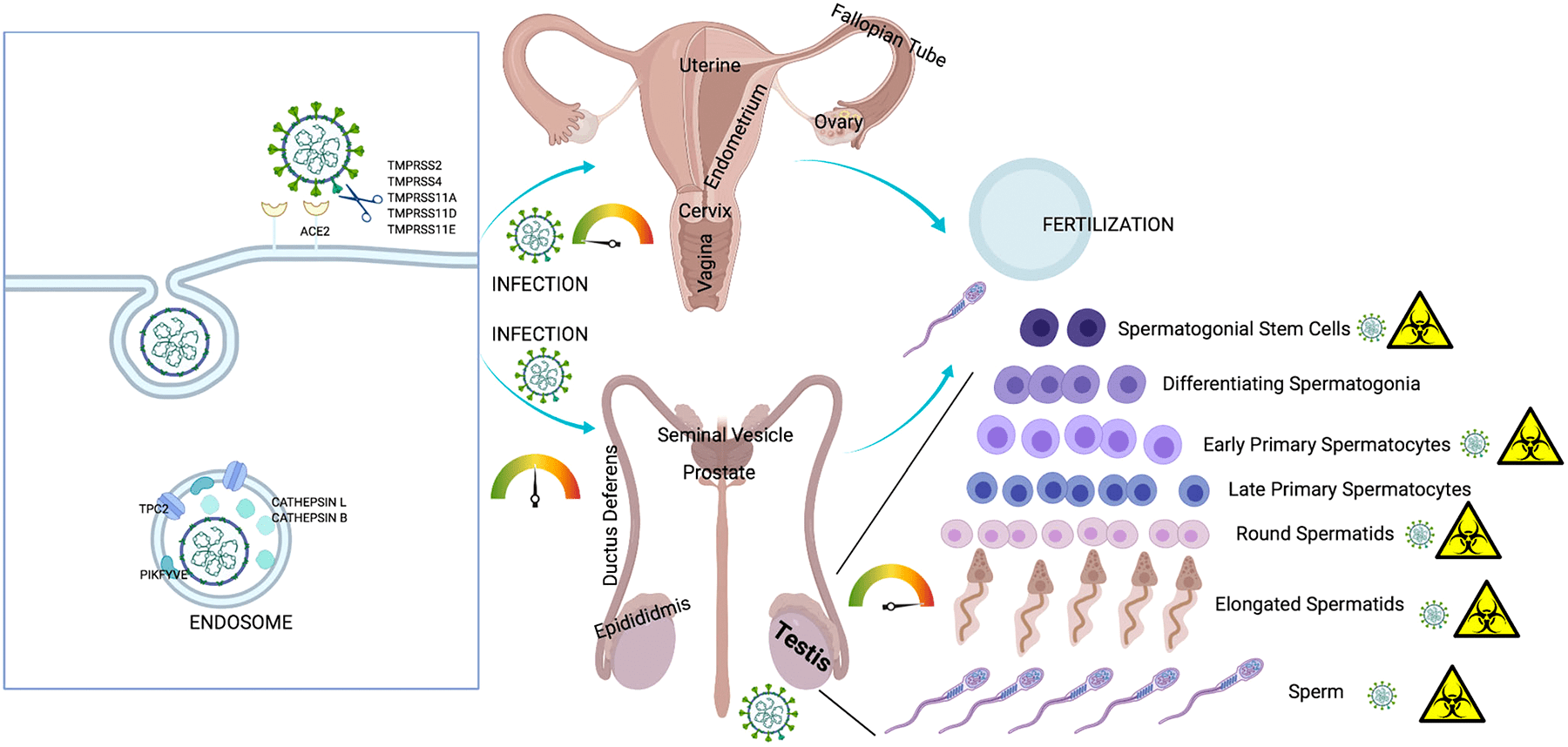
SARS-CoV-2 и мочеполовая система
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.