через какие рецепторы sars cov 2 проникает в клетки мишени
Коронавирус: патофизиология, механизмы пневмонии, вызванной SARS-CoV-2. Часть 2
» data-image-caption=»» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/12/koronavirus-patofiziologija-mehanizmy-pnevmonii-vyzvannoj-sars-cov-2-900×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/12/koronavirus-patofiziologija-mehanizmy-pnevmonii-vyzvannoj-sars-cov-2.jpg» title=»Коронавирус: патофизиология, механизмы пневмонии, вызванной SARS-CoV-2. Часть 2″>
Александр Попандопуло, студент медицинского института УЛГУ. Редактор А. Герасимова
КоВ представляют собой оболочечные вирусы с положительной цепью РНК с нуклеокапсидом. Для изучения патогенетических механизмов SARS-CoV-2 необходимо учитывать его вирусную структуру и геном.
Патофизиология коронавируса
В CoVs геномная структура организована в + оцРНК длиной примерно 30 т.п.н. – это самые большие известные РНК-вирусы – и имеет 5′-кэп-структуру и 3′-поли-А-хвост. Исходя из вирусной РНК, в хозяине осуществляется синтез полипротеина 1a / 1ab (pp1a / pp1ab). Транскрипция осуществляется через комплекс репликации-транскрипции (RCT), организованный в пузырьках с двойной мембраной, и через синтез последовательностей субгеномных РНК (sgRNAs).
Следует отметить, что терминация транскрипции происходит в регуляторных последовательностях транскрипции, расположенных между так называемыми открытыми рамками считывания (ORF), которые работают как матрицы для продукции субгеномных мРНК. В атипичном геноме CoV может присутствовать по крайней мере шесть ORF. Среди них сдвиг рамки между ORF1a и ORF1b направляет продукцию полипептидов pp1a и pp1ab, которые процессируются вирусной кодируемой химотрипсин-подобной протеазой (3CLpro) или основной протеазой (Mpro), а также одной или двумя папаиноподобными протеазами для получения 16 с известными или предполагаемыми функциями синтеза и модификации РНК неструктурных белков (nsps 1-16).
Последовательности генома SARS-CoV MERS-CoV и SARSCoV-2
Последовательности генома SARS-CoV MERS-CoV и SARSCoV-2
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/12/posledovatelnosti-genoma-sars-cov-mers-cov-i-sarscov-2.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/12/posledovatelnosti-genoma-sars-cov-mers-cov-i-sarscov-2.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/12/posledovatelnosti-genoma-sars-cov-mers-cov-i-sarscov-2.jpg» alt=»Последовательности генома SARS-CoV MERS-CoV и SARSCoV-2″ width=»900″ height=»424″ srcset=»https://unclinic.ru/wp-content/uploads/2020/12/posledovatelnosti-genoma-sars-cov-mers-cov-i-sarscov-2.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/12/posledovatelnosti-genoma-sars-cov-mers-cov-i-sarscov-2-768×362.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Коронавирус: патофизиология, механизмы пневмонии, вызванной SARS-CoV-2. Часть 2″> Последовательности генома SARS-CoV MERS-CoV и SARSCoV-2
Помимо ORF1a и ORF1b, другие ORF кодируют структурные белки, включая белки шипа, мембраны, оболочки и нуклеокапсида, а также одну или две папаиноподобные протеазы для продуцирования 16 неструктурных белков с известными или предсказанными функциями синтеза и модификации РНК (nsps 1-16) и вспомогательные белковые цепи. Различные CoV представляют собой специальные структурные и вспомогательные белки, транслируемые специальными sgRNA.
Патофизиология и механизмы вирулентности CoV, а следовательно, и SARS-CoV-2 связаны с функцией nsps и структурных белков. Например, исследования выявили, что nsp способен блокировать врожденный иммунный ответ хозяина.
Среди функций структурных белков решающую роль в патогенности вируса играет оболочка, поскольку она способствует сборке и высвобождению вируса. Однако многие из этих свойств (например, nsp 2 и 11) еще не описаны. Другие элементы, на которых обязательно должны сосредоточиться исследования, – это ORF3b, не имеющий гомологии с таковым у SARS-CoV, и секретируемый белок (кодируемый ORF8), который структурно отличается от таковых SARS-CoV.
Среди структурных элементов CoVs есть гликопротеины шипов, состоящие из двух субъединиц (S1 и S2). Гомотримеры белков S образуют шипы на поверхности вируса, управляя связью с рецепторами хозяина. Следует отметить, что в SARS-CoV-2 субъединица S2, содержащая слитый пептид, трансмембранный домен и цитоплазматический домен, является высококонсервативной. Таким образом, он может быть мишенью для противовирусных (анти-S2) соединений или вакцин.
Напротив, спайковый рецептор-связывающий домен (RBD) имеет только 40% аминокислотную идентичность с другими SARS-CoV. RBD является фундаментальным пептидным доменом в патогенезе инфекции. Он представляет собой элемент связывания рецептора человеческого ангиотензин-превращающего фермента 2 (ACE2). Хотя изначально предполагалось, что ингибиторы ренин-ангиотензин-альдостероновой системы не увеличивают риск госпитализации по поводу COVID-19 и тяжелого заболевания, RBD является наиболее изменчивым и имеет решающее значение для видовой специфики.
Хотя структурный и функциональный анализ демонстрирует, что домен RBD шипового белка очень близок к человеческому рецептору ACE2, компьютерный анализ соответствующей последовательности выявляет несколько важных аминокислот, которые совместимы, но не идеальны для связывания рецептора ACE2. Это могло свидетельствовать о серии адаптивных мутаций, а не о производстве вируса in vitro (соответствие было бы прямым).
Интересно, что поскольку нет различий в экспрессии ACE2 в зависимости от пола, возраста и расы, различия в частоте и тяжести заболевания, вероятно, связаны с разными иммунными факторами, а не с рецепторным связыванием. С другой стороны, курение сигарет и воспалительная передача сигналов могут усиливать экспрессию рецепторов в легких.
Другие факторы входят в патогенетический каскад и требуют более подробного объяснения. Например, нам нужно понять, почему смертность и более тяжелые формы заболеваний у мужчин выше, чем у женщин. Вероятно, ключевую роль в этом различии играет гормональный фон. В простате, например, андрогены индуцируют экспрессию сериновой протеазы TMPRSS2, используемой Sars-CoV-2 для праймирования S-белка.
Таким образом, спайковый RBD позволяет связываться с рецептором ACE2 в легких и других тканях. Присутствие в спайковом белке аминокислотного элемента (многоосновного элемента) позволяет функционально обрабатывать его ферментом фурином (протеазой) человека. Этот процесс позволяет выявить последовательности слияния и, следовательно, слияние вирусной и клеточной мембран, что является необходимым проходом для проникновения вируса в клетку.
В международных генных банках, таких как GenBank, исследователи опубликовали несколько последовательностей генов Sars-CoV-2. Картирование генов имеет фундаментальное значение, позволяя исследователям проследить филогенетическое древо вируса и, прежде всего, распознавать штаммы, которые различаются в зависимости от мутаций.
Согласно недавнему исследованию, спайковая мутация, которая, вероятно, произошла в конце ноября 2019 года, спровоцировала скачки на людей. В частности, Angeletti et al. сравнили последовательность гена Sars-Cov-2 с последовательностью гена Sars-CoV. Они проанализировали трансмембранные спиральные сегменты в ORF1ab, кодируемые 2 (nsp2) и nsp3, и обнаружили, что позиция 723 представляет серин вместо остатка глицина, в то время как положение 1010 занято пролином вместо изолейцина.
Эти данные предоставляют нам важную информацию о потенциальном происхождении вируса. Интересно, что Covs панголина (Manis javanica) имеют домен RBD, идентичный домену спайкового белка SARS-CoV2 человека. Однако ни CoV летучих мышей, ни те, что присутствуют у панголинов, не имеют последовательности многоосновного элемента фурина, что позволяет предположить, что естественный отбор также должен благоприятствовать приобретению этого элемента для перехода к передаче от человека к человеку. Вопрос о вирусных мутациях является ключевым для объяснения потенциальных рецидивов болезни.
Механизмы пневмонии, вызванной SARS-CoV-2
Патогенетический механизм, вызывающий пневмонию, кажется особенно сложным. Клинические и доклинические исследования должны будут объяснить многие аспекты, лежащие в основе конкретных клинических проявлений болезни. Доступные к настоящему времени данные, по-видимому, указывают на то, что вирусная инфекция способна вызывать чрезмерную иммунную реакцию у хозяина. В некоторых случаях имеет место реакция, которую в целом называют «цитокиновым штормом». Эффект – обширное повреждение тканей с дисфункциональной коагуляцией.
Микрососудистый тромбоз легких
Микрососудистый тромбоз легких
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih-750×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih-750×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih.jpg» alt=»Микрососудистый тромбоз легких» width=»900″ height=»720″ srcset=»https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih-750×600.jpg 750w, https://unclinic.ru/wp-content/uploads/2020/12/mikrososudistyj-tromboz-legkih-768×614.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Коронавирус: патофизиология, механизмы пневмонии, вызванной SARS-CoV-2. Часть 2″> Микрососудистый тромбоз легких
IL-6 производится в основном активированными лейкоцитами и действует на большое количество клеток и тканей:
Хотя основную роль для IL-6 играет провоспалительный процесс, он также может оказывать противовоспалительное действие. В свою очередь, IL-6 увеличивается при воспалительных заболеваниях, инфекциях, аутоиммунных нарушениях, сердечно-сосудистых заболеваниях и некоторых типах рака. Он также участвует в патогенезе синдрома высвобождения цитокинов (CRS), который представляет собой острый системный воспалительный синдром, характеризующийся лихорадкой и полиорганной дисфункцией.
Ил-6 – не единственный главный герой. Было доказано, например, что связывание SARS-CoV-2 с толл-подобным рецептором (TLR) индуцирует высвобождение про-IL-1β, который расщепляется на активный зрелый IL-1β, опосредующий воспаление легких, до фиброза. Он также участвует в патогенезе синдрома высвобождения цитокинов (CRS), который представляет собой острый системный воспалительный синдром, характеризующийся лихорадкой и полиорганной дисфункцией.
Клетки-мишени для SARS-CoV-2 в дыхательном тракте – их идентичность и «рассадка»
В бурном потоке публикаций, посвященных COVID-19 и SARS-CoV-2, не так уж часто встречаются работы, в которых пытаются разобраться в фундаментальных аспектах этой инфекции. Одним из таких аспектов является идентификация клеток-мишеней и определение их «места жительства» в органах и тканях. До сих пор мне была известна только одна серьёзная работа, посвящённая этому вопросу (о ней здесь: https://prof-afv.livejournal.com/11969.html).
Первый шаг в этом направлении сделан. В журнале Cell опубликована статья, в которой представлены прямые доказательства того какие клетки способны поддерживать полный цикл репликации SARS-CoV-2 и как они распределены в дыхательном тракте. Препринт этой статьи здесь: https://doi.org/10.1016/j.cell.2020.05.042 (точнее это окончательный вариант статьи, доступный на сайте журнала, но опубликована эта статья будет в июльском номере Cell). Статья большая – даже в журнальном варианте это 32 страницы. Я бы отнёс эту работу к категории «высший пилотаж» (что не значит, что она закрывает проблему). Не вдаваясь в детали об основных результатах этого исследования:
2. Плотность клеток-мишеней (определяемая по способности поддерживать полный цикл репликации вируса) варьирует на разных уровнях дыхательного тракта. Причём имеется четко выраженный градиент плотности: от самой высокой в носовой полости до самой низкой на уровне альвеол. Иными словами, в носовой полости клеток-мишеней много, а в альвеолах их мало.
3. Попутно «сделаны» важные исследовательские инструменты – молекулярные клоны «зловредных» коронавирусов SARS-CoV, MERS-CoV и SARS-CoV-2. Эти искусственные вирусы по кинетике репликации in vitro неотличимы от природных штаммов. Каждый из молекулярных клонов сделан в 3х вариантах – первый это точная копия природного вируса и два других со вставками в гене ORF7. Эти вставки генерируют сигнал (в одном случае флуоресцентный, в другом смешанный – флуоресцентно/люминисцентный). Благодаря этому «меченные» вирусы легко обнаружить в клетках, тканях и органах. У этих «инструментов» есть масса потенциальных применений, в частности, они очень удобны для определения вирус-нейтрализующих антител.
В этой статье есть ещё много интересного, но это уже слишком специально для научно-популярного освещения её содержания.
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
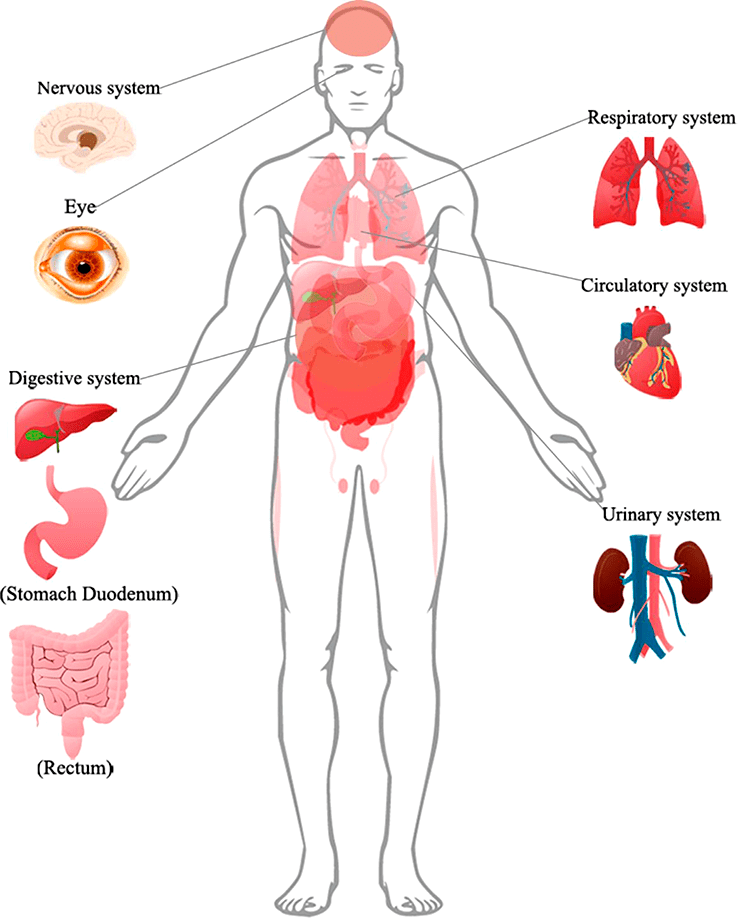
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
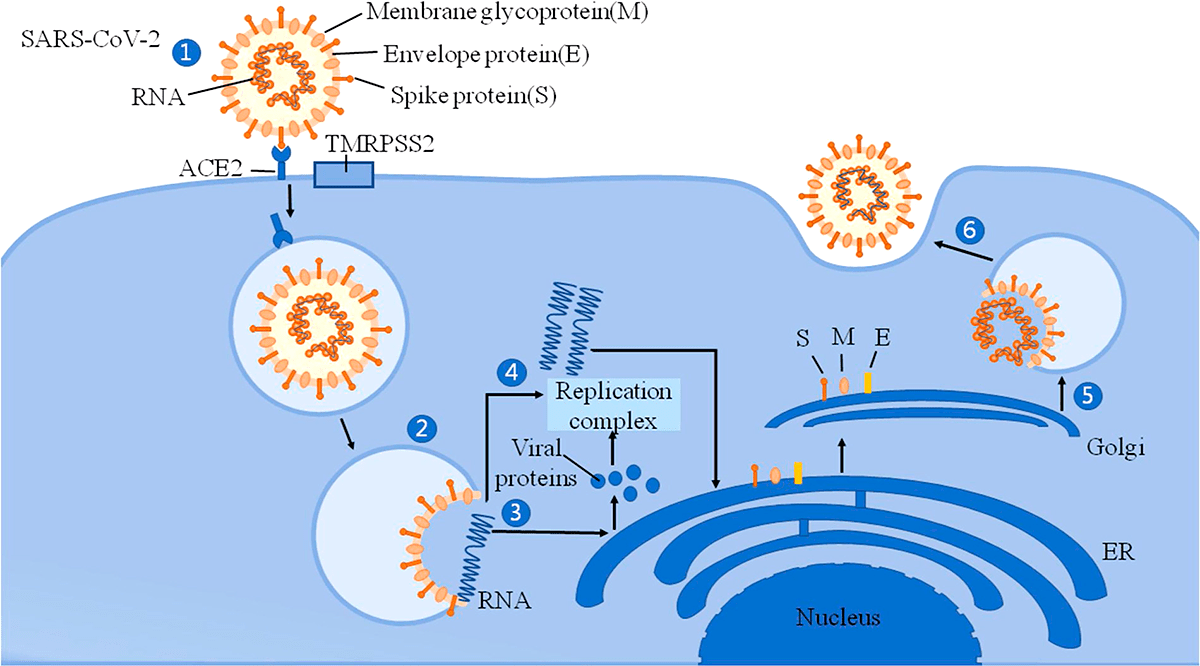
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
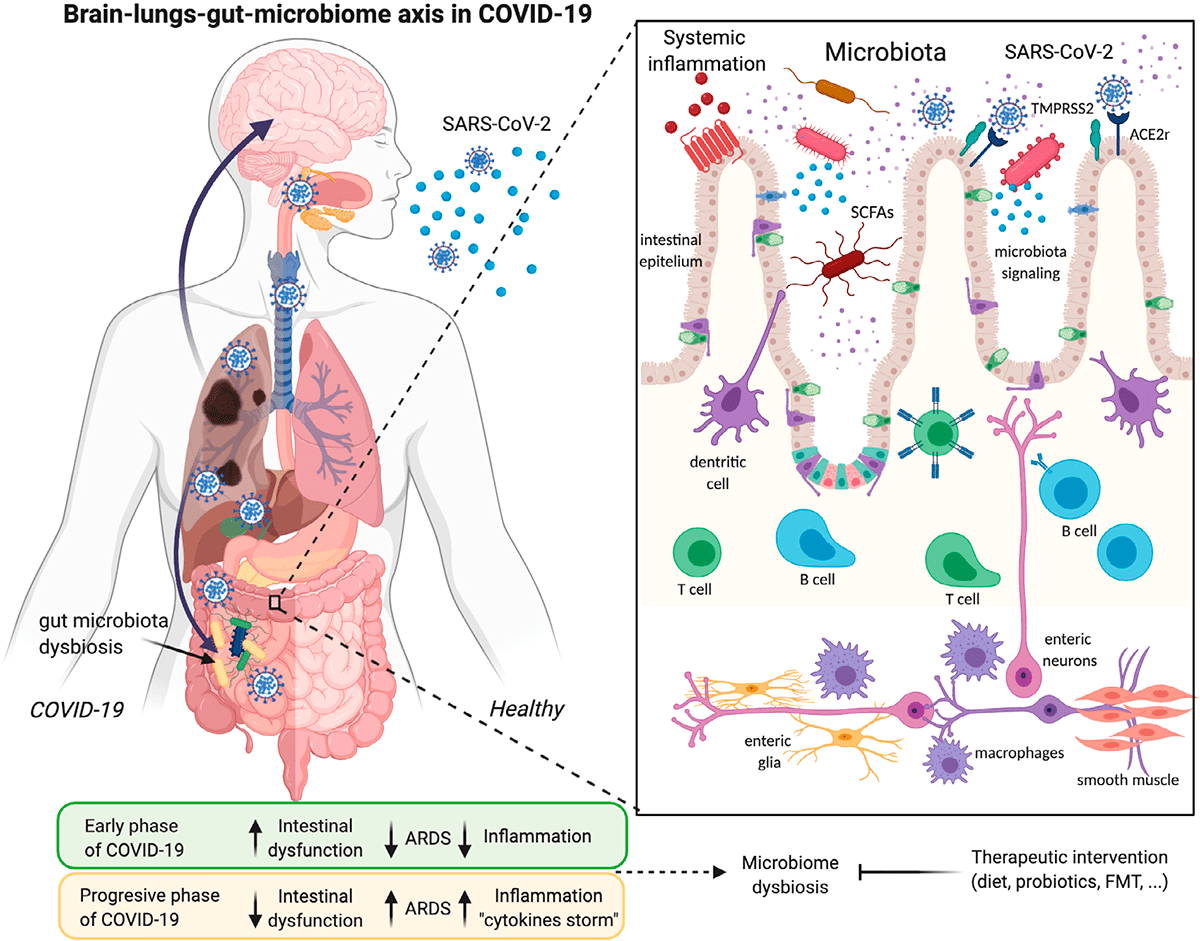
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
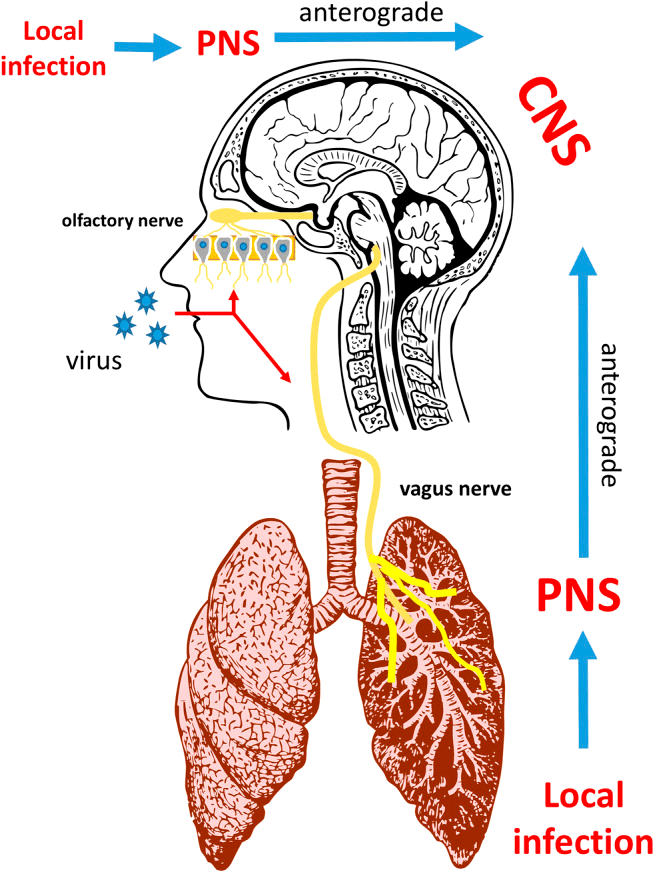
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
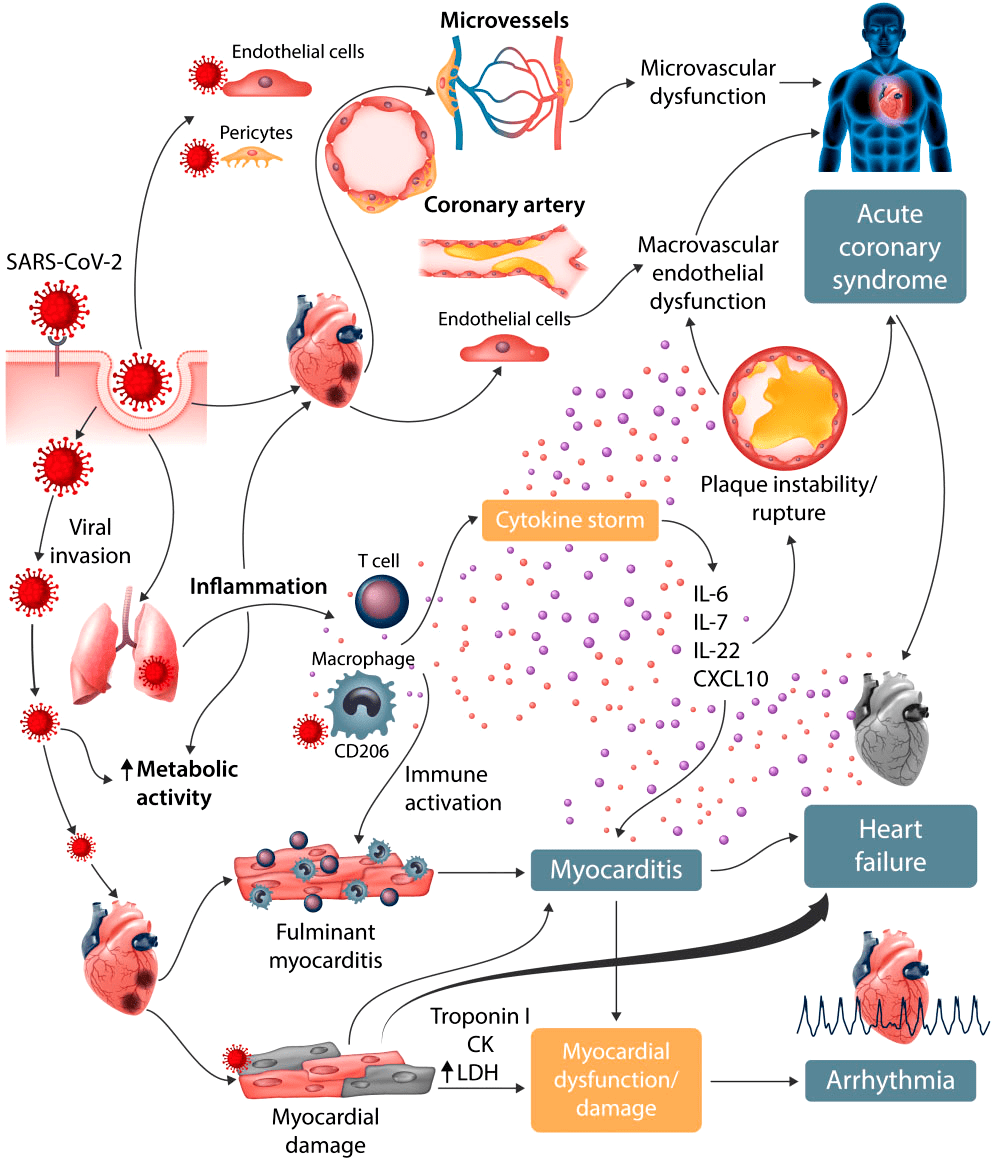
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
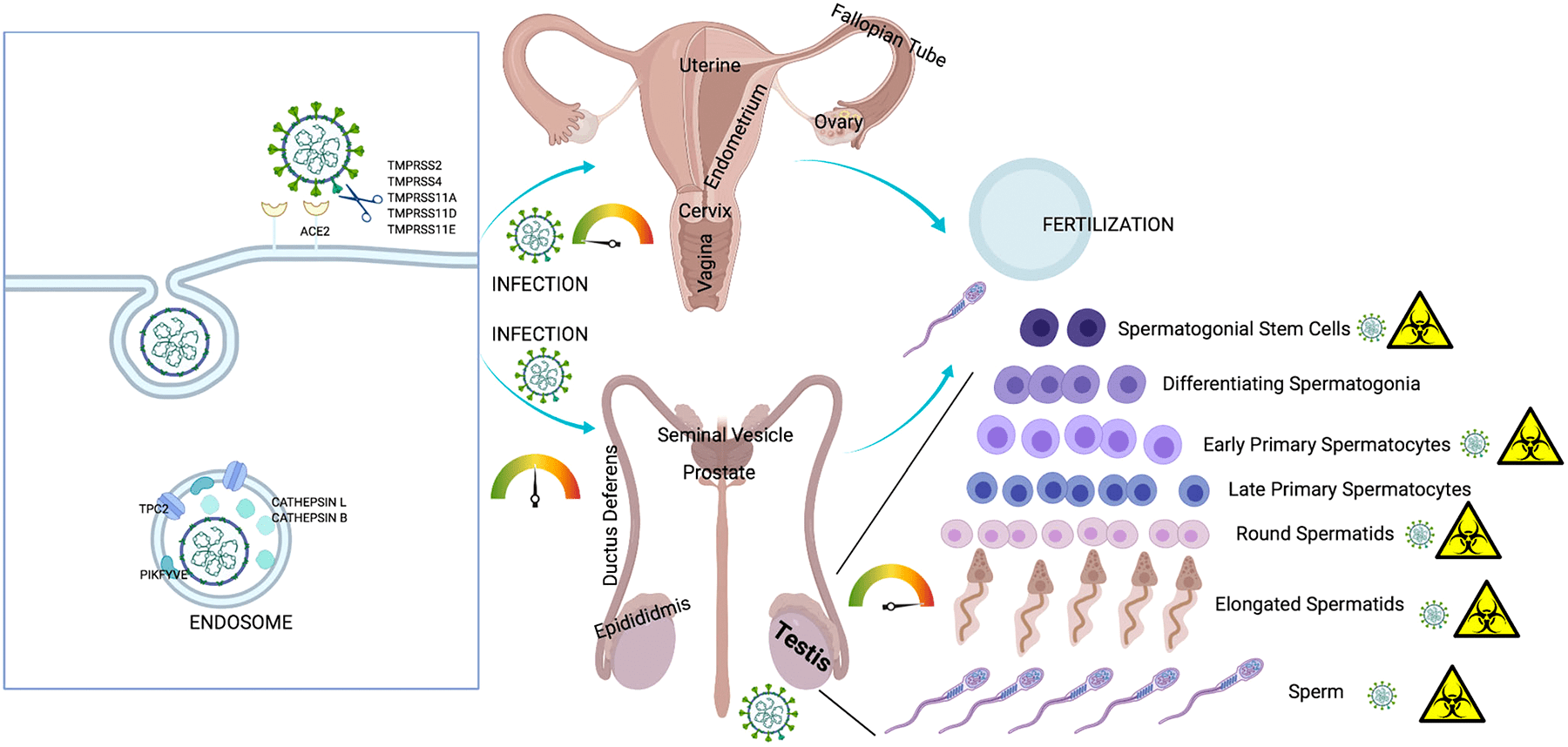
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Троица COVID-19: иммунитет, воспаление и вторжение
Аннотация
Коронавирус-2 (SARS-CoV-2), сопряженный с тяжелым острым респираторным синдромом, является возбудителем текущей пандемии коронавирусной болезни 2019 года (COVID-19). Наряду с исследованиями вирусологии SARS-CoV-2, понимание фундаментальных физиологических и иммунологических процессов, лежащих в основе клинических проявлений COVID-19, жизненно важно для идентификации вируса и рационального дизайна эффективных методов лечения. В данном обзоре будет рассмотрена патофизиология инфекции SARS-CoV-2. Мы описываем взаимодействие SARS-CoV-2 с иммунной системой и последующий вклад дисфункциональных иммунных реакций в прогрессирование заболевания. Помимо анализа сообщений, описывающих течение SARS-CoV-2, мы делаем выводы на основе патофизиологических и иммунологических особенностей других коронавирусов человека, преимущественно поражающих нижние дыхательные пути, вызывающих тяжелый острый респираторный синдром (SARS-CoV) и ближневосточный респираторный синдром (MERS-COV).
Таким образом, существует неотложная необходимость в лучшем понимании биологии взаимодействия хозяин-патоген при COVID-19, поскольку это даст важную информацию для определения тактики ведения заболевших, включая установление новых методов лечения. Здесь мы рассмотрим литературу по патофизиологии SARS-CoV-2, его взаимодействию с клетками-мишенями и иммунному ответу на вирус, включая вклад дисфункционального иммунного ответа в прогрессирование заболевания. В частности, мы подчеркиваем значение специфических особенностей инфекции для разработки многообещающих методов лечения, которые могут быть направлены на вирус или дисфункциональный иммунный ответ. Кроме того, исследования, посвященные адаптивному иммунному ответу, будут иметь решающее значение для разработки вакцин и препаратов моноклональных антител.
Патогенез COVID-19
Известно, что коронавирусы вызывают заболевания у людей и животных. Четыре из них (человеческие коронавирусы 229E, NL63, OC43 и HKU1) обычно поражают только верхние дыхательные пути и вызывают относительно легкие симптомы [2]. Однако существует три коронавируса (коронавирус тяжелого острого респираторного синдрома (SARS-CoV), коронавирус ближневосточного респираторного синдрома (MERS-CoV) и SARS-CoV-2, которые могут реплицироваться в нижних дыхательных путях и вызывать пневмонию с вероятностью смертельного исхода. SARS-CoV-2 относится к роду бета-коронавирусов. Его ближайший родственник среди коронавирусов человека — SARS-CoV, с 79 % генетического сходства [3]. Однако среди всех известных генетических последовательностей коронавирусов SARS-CoV-2 наиболее похож на коронавирус летучей мыши RaTG13 со сходством 98 % [4]. Также высокое сходство наблюдается с геномом коронавируса панголина (чешуйчатый муравьед) [5].
Как и другие респираторные коронавирусы, SARS-CoV-2 передается в основном воздушно-капельным путем, также возможен, но не доказан фекально-оральный путь передачи. Средний инкубационный период инфекции составляет приблизительно 4–5 дней до появления симптомов [6–9], у 97,5 % пациентов симптомы развиваются в течение 11,5 дней [8]. На момент госпитализации у пациентов с COVID-19 обычно наблюдается лихорадка и сухой кашель; реже пациенты также испытывают затрудненное дыхание, боли в мышцах и/или суставах, головную боль, головокружение, диарею, тошноту и кровохарканье [6, 10–15]. В течение 5–6 дней после появления симптомов вирусная нагрузка SARS-CoV-2 достигает своего пика, что значительно раньше, чем у схожего SARS-CoV, при котором вирусная нагрузка достигает пика примерно через 10 дней после появления первых симптомов [16–19]. Тяжелые случаи COVID-19 прогрессируют до острого респираторного дистресс-синдрома (ОРДС) в среднем за 8–9 дней от начала заболевания [11, 20].
Патофизиология развития инфекции SARS-CoV-2 очень похожа на таковую при заражении SARS-CoV: агрессивная воспалительная реакция с вовлечением дыхательных путей [21]. Следовательно, тяжесть заболевания у пациентов обусловлена не только вирусной инфекцией, но и реакцией организма хозяина. Корреляция степени тяжести с возрастом также, в целом, соответствует эпидемиологии SARS-CoV и MERS-CoV [6, 11, 14].
ОРДС, наблюдаемый при тяжелом течении COVID-19, характеризуется затрудненным дыханием и низким уровнем кислорода в крови [22]. В результате у некоторых пациентов могут развиться вторичные бактериальные и грибковые инфекции [14]. ОРДС может привести к дыхательной недостаточности, которая является причиной смерти в 70 % случаев летальных исходов COVID-19 [22]. Кроме того, мощный выброс цитокинов иммунной системой в ответ на вирусную инфекцию и/или вторичные инфекции могут привести к цитокиновому шторму и симптомам сепсиса, который является причиной смерти в 28 % летальных случаев COVID-19 [22], вследствие неконтролируемого воспаления, приводящего к полиорганной недостаточности, особенно поражая сердечную, печеночную и почечную системы (рис. 1). Большинство пациентов с SARS-CoV инфекцией, у которых развивалась почечная недостаточность, в конечном итоге умирали [23].
Инфицирование клетки-хозяина и его предупреждение
Первым этапом заражения является связывание вируса с клеткой-хозяином через рецептор-мишень. Ранее проведенная работа над исследованием SARS-CoV показала, что этот вирус главным образом нацелен на эпителиальные клетки дыхательных путей, альвеолярные эпителиальные клетки, эндотелиальные клетки сосудов и альвеолярные макрофаги, которые имеют на своей поверхности рецептор ангиотензин-превращающего фермента 2 (АПФ2), используемый SARS-CoV в качестве рецептора-мишени [24 –26] (рис. 2). Поскольку SARS-CoV-2 использует тот же рецептор проникновения, эти клетки, вероятно, являются также мишенью и для него [4, 27, 28]. Инфицирование SARS-CoV снижает экспрессию АПФ2 в клетках легких. Поскольку потеря функции АПФ2 в легких связана с острым повреждением легких, вызванное вирусом подавление АПФ2 может играть важную роль в патофизиологии заболевания [29–32]. Как было доказано, АПФ2 регулирует ренин-ангиотензиновую систему (РАС) [32]. Следовательно, снижение функции АПФ2 после инфицирования вирусом может привести к дисфункции РАС, оказывающей влияние на кровяное давление и водно-электролитный баланс, а также увеличивающей воспаление и проницаемость сосудов в дыхательных путях.
При COVID-19 наблюдается разница в уровне летальности между мужчинами (2,8 %) и женщинами (1,7 %) [33]. Поскольку АПФ2 расположен на Х-хромосоме, могут присутствовать аллели, которые придают устойчивость к COVID-19, что объясняет более низкую летальность среди женщин. Кроме того, половые гормоны эстроген и тестостерон имеют различные иммунорегуляторные функции, которые могут влиять на иммунную защиту и, следовательно, тяжесть заболевания [34].
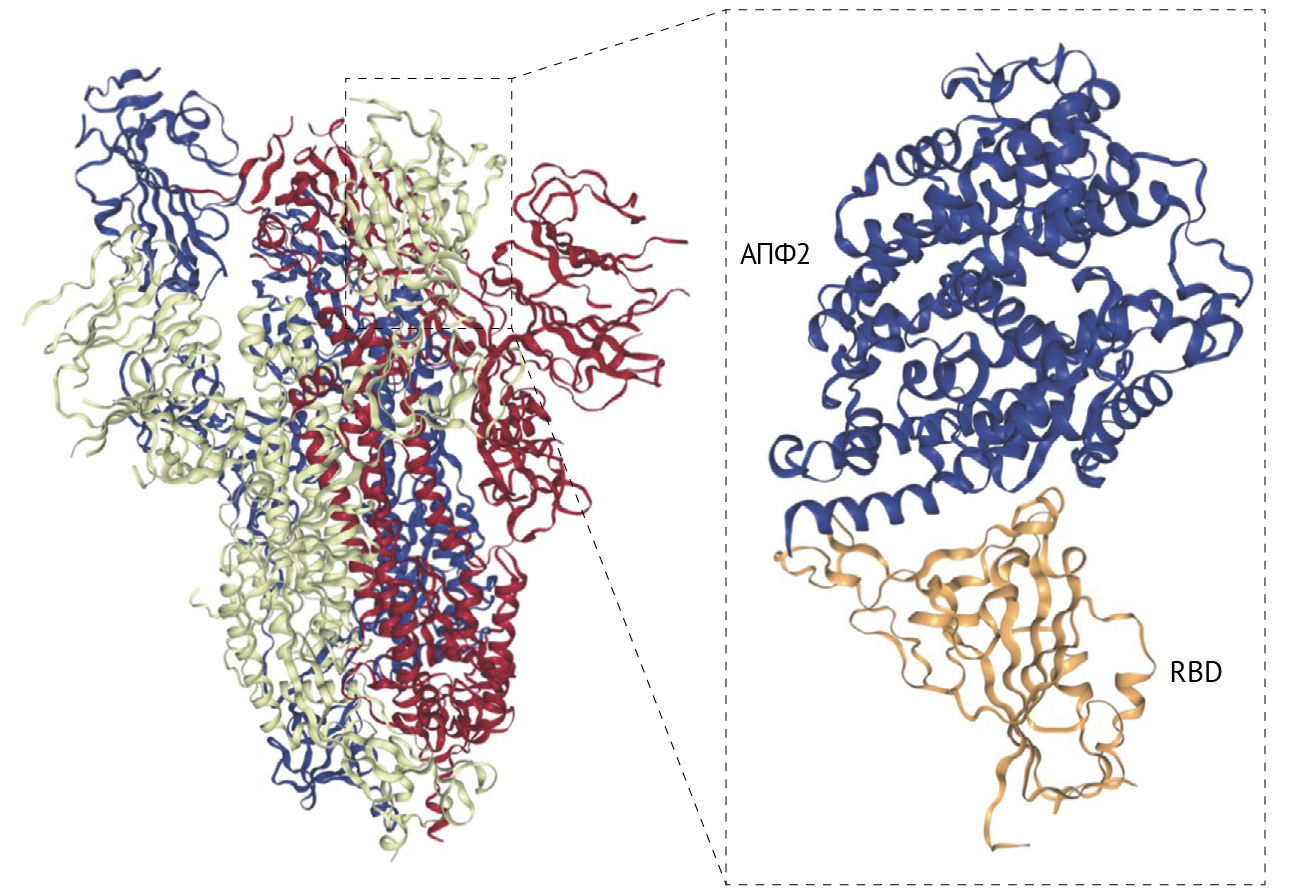
SARS-CoV-2 имеет 79 % совпадения последовательности генома с SARS-CoV [4]. Шиповидный белок экспрессируется на поверхности вирусных частиц, придавая им характерный «коронованный» вид. Шиповидный белок состоит из двух субъединиц: S1 и S2. Субъединица S1 состоит из амино-терминального домена и рецептор-связывающего домена (RBD), который в SARS-CoV простирается от аминокислотного остатка 318 до аминокислотного остатка 510 [35–37]. RBD связывается с АПФ-2 клетки-хозяина как с рецептором-мишенью, запуская тем самым процесс инфицирования [4]. Связывание RBD с АПФ-2 запускает эндоцитоз вириона SARS-CoV-2 и подвергает его воздействию эндосомных протеаз [38]. Субъединица S2 состоит из области пептида слияния (FP) и двух областей гептадных повторов: HR1 и HR2 [39, 40]. Внутри эндосомы субъединица S1 отщепляется, обнажая пептид слияния, который внедряется в мембрану клетки-хозяина. Затем область S2 складывается сама для объединения областей HR1 и HR2. Это приводит к слиянию мембран и высвобождает вирусное содержимое в цитоплазму хозяина.
Существует 72 % сходства в аминокислотной последовательности RBD SARS-CoV и SARS-CoV-2, также у них очень похожи третичные структуры. Вычислительное моделирование и биофизические измерения показывают, что аффинность RBD SARS-CoV-2 к АПФ2 более высокая, чем у SARS-CoV [41, 42]. Кроме того, шиповидный белок SARS-CoV-2 содержит фурин-подобный сайт расщепления (аналогично MERS-CoV и человеческому коронавирусу OC43), который не обнаружен у SARS-CoV [43]. Эти характеристики могут способствовать повышенной контагиозности SARS-CoV-2 по сравнению с SARS-CoV. В дополнение к предварительному расщеплению фурином, для правильной обработки шиповидного белка SARS-CoV-2 и облегчения проникновения в клетку-хозяина также необходима клеточная сериновая протеаза TMPRSS2 [44].
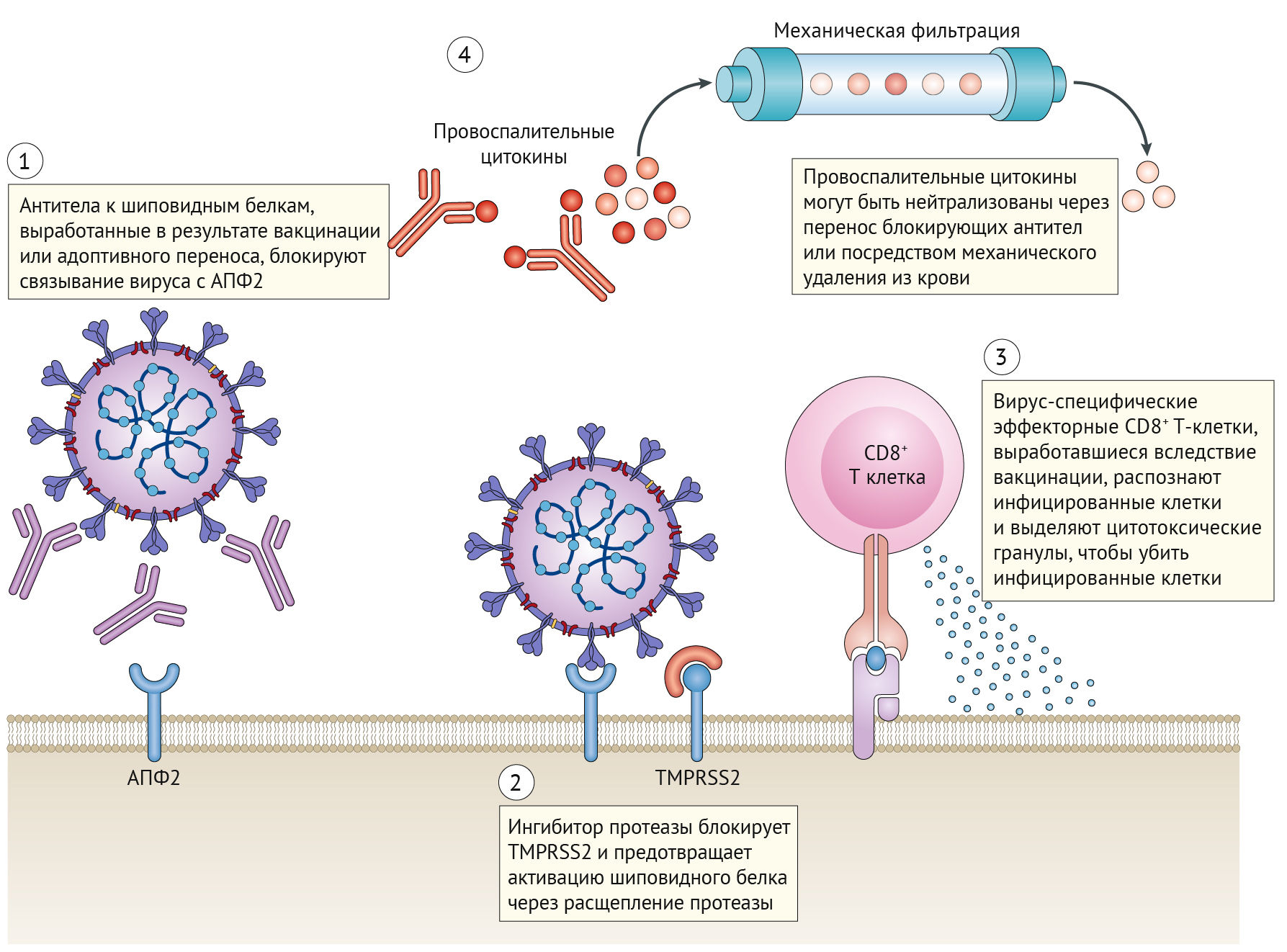
Одним из путей разработки терапевтических средств против SARS-CoV-2 является блокирование целевого рецептора АПФ2 хозяина или TMPRSS2 (рис. 3). В настоящее время существуют соединения, нацеленные на эти молекулы, которые были одобрены для лечения других заболеваний. Например, алгоритмы нейросетей предсказывают, что барицитиниб, ингибитор янус-киназы (JAK), одобренный для лечения ревматоидного артрита, может ингибировать опосредованный АПФ2 эндоцитоз [45]. Другой ингибитор JAK, руксолитиниб, будет опробован в клинических испытаниях для лечения COVID-19 в конце этого года [46]. Альтернативная стратегия заключается в доставке высоких концентраций растворимой формы АПФ2, что потенциально может снизить проникновение вируса в клетки-мишени. Этот принцип тестируется с APN01, рекомбинантной формой АПФ2, разработанной APEIRON, которая в настоящее время проходит клинические испытания [47]. Моноклональные антитела к шиповидным белкам также могут ингибировать проникновение вируса в клетку и дополнительно обсуждаются в разделе «В-клеточный иммунитет».
Нафамостат мезилат [48, 49] и камостат мезилат [44] являются известными ингибиторами фермента TMPRSS2 и в настоящее время одобрены в нескольких странах для лечения других заболеваний. Хотя на момент написания статьи не проводилось никаких клинических испытаний, специально тестирующих эти препараты против COVID-19, когда мезилат камостата был протестирован на вирусе SARS-CoV-2, выделенном от пациента, он предотвращал проникновение вируса в клетки легкого [44, 50]. Если этот подход покажет свою эффективность, быстрое перепрофилирование таких препаратов будет рабочей и своевременной мерой в борьбе с COVID-19.
Воспалительный иммунопатогенез
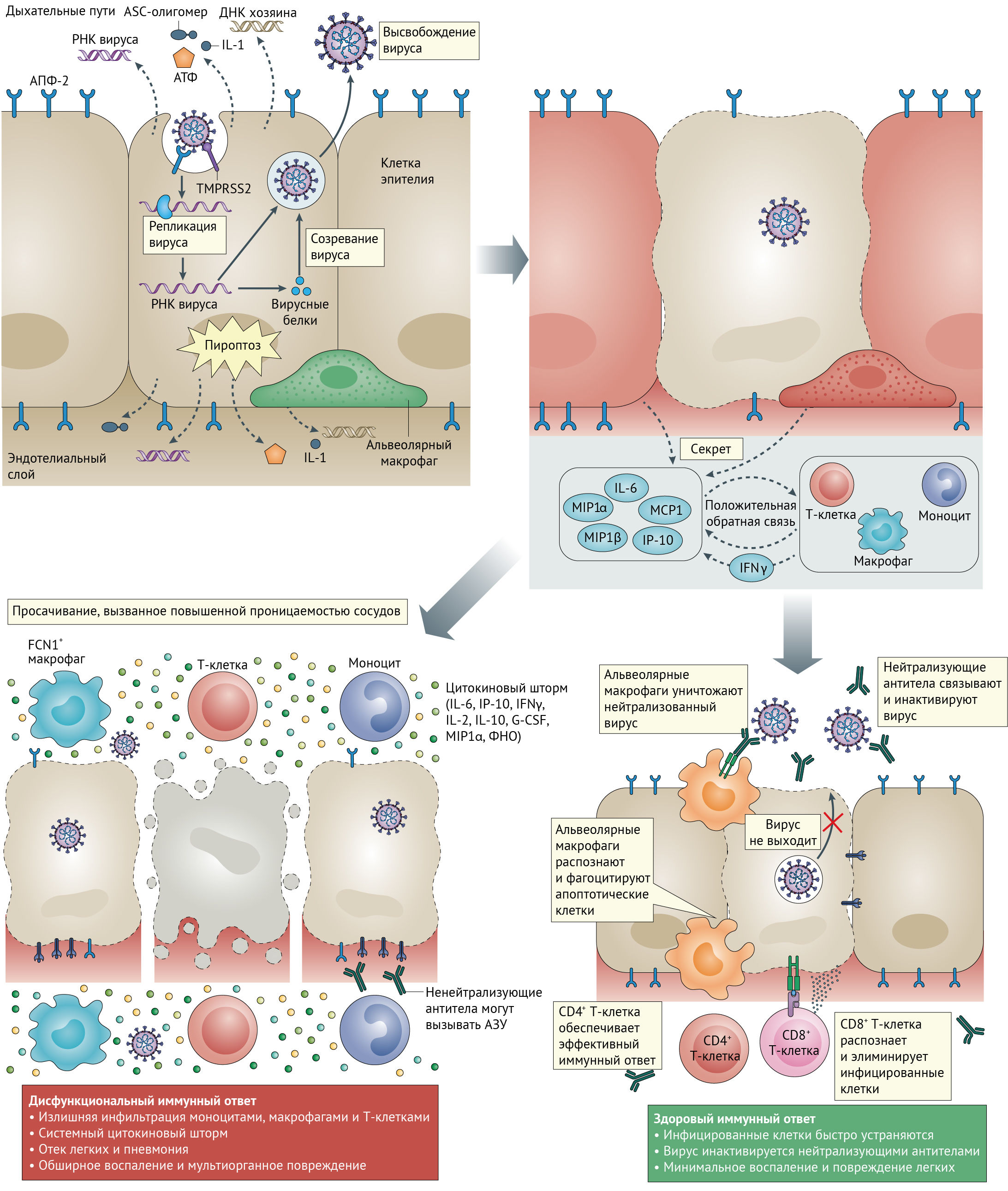
Инфекция SARS-CoV-2 и разрушение клеток легких запускают местный иммунный ответ с привлечением макрофагов и моноцитов, которые отвечают на инфекцию, высвобождают цитокины и первичные адаптивные иммунные ответы T- и B-клеток. В большинстве случаев этот процесс способен привести к разрешению инфекции. Однако в некоторых случаях возникает дисфункциональный иммунный ответ, который может вызвать тяжелую легочную или даже системную патологию.
Цитопатические вирусы, включая SARS-CoV-2 [51], вызывают повреждение или гибель инфицированных вирусом клеток и тканей в ходе репликативного цикла вируса. Репликация вируса в эпителиальных клетках дыхательных путей [52] может вызывать высокий уровень связанного с вирусом пироптоза с ассоциированной повышеной проницаемостью сосудов, как это наблюдается у пациентов с SARS-CoV [53]. Пироптоз является воспалительной формой запрограммированной гибели клеток, которая обычно наблюдается при цитопатической вирусной инфекции [54]. Это вероятный триггер для последующего воспалительного ответа [55]. Во время инфекции SARS-CoV-2 повышается уровень IL-1β, важного цитокина, высвобождаемого во время пироптоза [11]. Используя различные паттерн-распознающие рецепторы (PRR), альвеолярные эпителиальные клетки и альвеолярные макрофаги обнаруживают высвобожденные патоген-ассоциированные молекулярные структуры (PAMP), такие как вирусная РНК, и связанные с повреждением молекулярные структуры (DAMP), включая АТФ, ДНК и ASC олигомеры. Возникает волна локального воспаления, стимулирующая повышенную секрецию провоспалительных цитокинов и хемокинов IL-6, IFNγ, MCP1 и IP-10 в кровь [11, 22]. Эти цитокины являются индикаторами поляризованного ответа T-хелперов 1 типа (Тх1), что аналогично наблюдениям, проведенным для SARS-CoV и MERS-CoV [56]. Секреция таких цитокинов и хемокинов привлекает иммунные клетки, в частности моноциты и Т-лимфоциты, но не нейтрофилы, из крови в очаг инфекции [57, 58]. Рекрутирование иммунных клеток из кровотока в легкие и инфильтрация дыхательных путей лимфоцитами может объяснить лимфопению и увеличение соотношения нейтрофилов и лимфоцитов, наблюдаемого примерно у 80 % пациентов с инфекцией SARS-CoV-2 [6, 59].
У большинства людей рекрутированные клетки элиминируют инфекцию в легких, иммунный ответ уменьшается, и пациенты выздоравливают. Однако у некоторых пациентов возникает дисфункциональный иммунный ответ, который запускает цитокиновый шторм, опосредованно вызывающий выраженное воспаление в ткани легких. Было отмечено, что у пациентов с тяжелой формой COVID-19, нуждающихся в интенсивной терапии в больницах, наблюдались более высокие уровни IL-2, IL-7, IL-10, гранулоцитарного колониестимулирующего фактора (G-CSF), IP-10, MCP1, макрофагального воспалительного белка 1α (MIP1α) и фактора некроза опухоли (ФНО) в плазме крови [11]. Уровни IL-6 у этих пациентов продолжали увеличиваться с течением времени и являлись относительно более высокими у погибших, чем у выживших [60].
Примечательно, что в жидкости бронхоальвеолярного лаважа у пациентов с тяжелым течением COVID-19 определяется обширная воспалительная моноцитарная популяция макрофагов FCN1+ [61]. Кроме того, у пациентов с тяжелым заболеванием значительно выше процент воспалительных моноцитов CD14+ и CD16+ в периферической крови, чем у пациентов с легким течением болезни [62]. Эти клетки секретируют воспалительные цитокины, включая MCP1, IP-10 и MIP1α, которые способствуют развитию цитокинового шторма (рис. 1).
Механизмы, с помощью которых SARS-CoV-2 подрывает врожденные функции противовирусных цитокинов, еще предстоит изучить, но исследование SARS-CoV показывает, что множественные структурные и неструктурные белки вируса противодействуют интерфероновому ответу. Антагонизм возникает на различных этапах передачи сигналов интерферона, в том числе путем предотвращения распознавания паттерн-распознающим рецептором (PRR) вирусной РНК 65, путем предотвращения передачи сигналов PRR через TBK1 / ингибитор субъединицы ε киназы транскрипционного фактора NF-κB (каппа-би) (IKKε), TRAF3 и IRF3 [63, 66], предотвращая передачу сигналов интерферона далее через STAT1 [67] и способствуя деградации мРНК хозяина, ингибируя трансляцию белка [68]. Весьма вероятно, что по крайней мере некоторые из этих механизмов аналогичны и для SARS-CoV-2. Антагонизм белков вируса по отношению к интерфероновому ответу способствует репликации вируса, что приводит к увеличению высвобождения продуктов пироптоза, которые могут дополнительно вызывать аберрантные воспалительные реакции.
Неограниченная воспалительная инфильтрация клеток сама по себе может привести к повреждению легких через чрезмерную секрецию протеаз и активных форм кислорода в дополнение к прямому повреждению, вызванному вирусом. Вместе они приводят к диффузному альвеолярному повреждению, включая десквамацию альвеолярных клеток, образование гиалиновых мембран и отек легких [57, 58]. Это ограничивает эффективность газообмена в легких, вызывая затруднение дыхания и приводя к снижению уровня кислорода в крови. Легкие также становятся более уязвимыми для вторичных инфекций.
Вдобавок к локальному повреждению, цитокиновый шторм производит волновые эффекты по всему телу. Повышенные уровни цитокинов, таких как ФНО, могут вызывать септический шок и полиорганную недостаточность. Это может привести к повреждению миокарда и нарушению кровообращения, наблюдаемым у некоторых пациентов [69]. Пожилые пациенты (в возрасте старше 60 лет) и люди с сопутствующими заболеваниями более склонны к развитию такого дисфункционального иммунного ответа, который способствует развитию патологии, а также не позволяет уничтожить возбудителя. Точные причины этого неясны, хотя одной из причин может быть старение микросреды легких, вызывающее измененное созревание дендритных клеток, миграцию в лимфоидные органы [70] и, следовательно, дефектную активацию Т-клеток. Напротив, дети, как правило, не склонны к развитию тяжелой формы заболевания, несмотря на то, что у них могут наблюдаться высокие вирусные титры [71]. Во всех возрастных группах моложе 18 лет более 50 % детей испытывали легкие симптомы или не имели симптомов вовсе, у менее чем 6 % детей развивались тяжелые симптомы [72]. Таким образом, в то время как вышеупомянутые исследования описывают важные достижения, полная картина критических иммунных факторов, которые лежат в основе развития более тяжелых воспалительных реакций у некоторых пациентов, неясна.
Вопрос о том, необходимо ли сохранение вируса для нанесения постоянного ущерба, остается спорным. Пик вирусных титров в образцах клеток дыхательных путей при инфекциях SARS-CoV и SARS-CoV-2 может наблюдаться еще до появления симптомов пневмонии [17, 19]. Тем не менее большое ретроспективное когортное исследование показало, что вирусная РНК обнаруживалась у не выживших пациентов вплоть до момента смерти, что позволяет предположить корреляцию между устойчивостью вируса и неблагоприятным исходом заболевания [60]. Поскольку вирусная РНК может задерживаться даже после активной инфекции и не является показателем инфекционности вируса, вопрос о том, связан ли исход с количеством инфекционных частиц, дискуссионен. Кроме того, более ранние исследования SARS-CoV показали, что вирус, кроме клеток легких, может инфицировать и другие мишени. Примечательно, что вирус был обнаружен в Т-лимфоцитах [73], макрофагах [74–76] и дендритных клетках, происходящих из моноцитов [77]. Непосредственное уничтожение вируса лимфоцитами может способствовать возникновению лимфопении, наблюдаемой у пациентов [73]. Вирусная инфекция в иммунных клетках, таких как моноциты и макрофаги, может привести к аберрантной выработке цитокинов, даже если вирус активно не размножается [74–77]. Степень тропности SARS-CoV-2 к этим клеткам остается неясной. Понимание точных причин иммунной дисфункции имеет решающее значение для применения соответствующих иммуномодулирующих методов лечения.
Несколько иммуносупрессивных методик лечения, направленных на ограничение иммуноопосредованого повреждения при COVID-19, находятся на различных этапах разработки и перечислены в таблице 1. В настоящее время проводятся испытания кортикостероидов для лечения COVID-19 [78], хотя этот класс препаратов не рекомендовался во время эпидемии SARS-CoV 2003 г. [79, 80]. Кроме того, проводятся клинические испытания антагониста IL-6 тоцилизумаба для проверки его эффективности [81], а также исследуется сарилумаб [82]. В других клинических испытаниях тестируются эффекты воздействия на колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), например, с помощью гимсилумаба [83], лензилумаба [84] и намилумаба [85]. Еще одним новым методом вспомогательной терапии является цитосорб [86], который поглощает разнообразные цитокины, DAMP и PAMPs с целью снижения их уровня в крови и смягчения иммунопатологических процессов.
Талидомид, препарат с иммуномодулирующими свойствами, также был успешно применен у одного пациента с COVID-19 [87]. В результате на сегодняшний день было начато два клинических испытания, чтобы проверить его потенциал для уменьшения повреждения легких [88, 89]. В контексте инфекции SARS-CoV предлагался, но не был проверен антагонист ФНО, впрочем он также не был проверен на пациентах с COVID-19 [90]. Небольшое открытое нерандомизированное исследование показало, что комбинация гидроксихлорохина (известного противомалярийного средства) и азитромицина (распространенного антибиотика) может оказаться эффективной для лечения пациентов с тяжелой формой COVID-19 [91]. Хотя влияние гидроксихлорохина на прямое ингибирование вируса [92] и его противовоспалительная и иммуномодулирующая активность известны [93], еще предстоит определить, действуют ли эти механизмы в отношении COVID-19 [94].
Т-клеточный иммунитет
Т-клеточный и В-клеточный иммунный ответ на SARS-CoV-2 реализуется примерно через 1 неделю после появления симптомов COVID-19. CD8+ T-клетки важны для прямой атаки и уничтожения инфицированных вирусом клеток, тогда как CD4+ T-клетки имеют решающее значение для активации как CD8+ T-клеток, так и B-клеток. CD4+ T-клетки также ответственны за выработку цитокинов, которые управляют рекрутментом иммунных клеток. Первое вскрытие пациента с COVID-19 выявило накопление мононуклеарных клеток (вероятно, моноцитов и Т-клеток) в легких в сочетании с низким уровнем гиперактивных Т-клеток в периферической крови [57]. Наряду с сообщениями о лимфопении и снижении уровня периферических Т-клеток у пациентов [6, 95–97], эти данные свидетельствуют о том, что Т-клетки привлекаются из кровотока в очаг инфекции для контроля вирусной инфекции. У пациентов с COVID-19 интенсивное истощение Т-клеток и снижение функционального разнообразия указывали на развитие тяжелого течения болезни [98]. Несмотря на ослабленный ответ у пациентов, которые выздоровели от инфекции SARS-CoV, развились специфические для коронавируса Т-клетки памяти, которые были обнаружены через 2 года после выздоровления [99, 100].
SARS-CoV-специфичные CD4+ T-клетки экспрессируют IFNγ, ФНО и IL-2, что позволяет предположить, что у пациентов с инфекцией SARS-CoV проявляется Тх1-клеточный ответ, и для контроля инфекции используется в основном клеточный иммунитет [101, 102]. Хотя такой провоспалительный профиль может быть фактором, ухудшающим иммунопатогенез, было предположено что T-клетки CD4+ угнетают SARS, поскольку истощение пула этих клеток у мышей приводило к более медленной элиминации вируса из клетки хозяина и более выраженному воспалению легких [103]. При использовании адаптированного для мышей штамма SARS-CoV иммунизация дендритными клетками, несущими пептиды SARS-CoV, привела к увеличению числа вирус-специфических CD4+ и CD8+ T-клеток, которые накапливались в легких и способствовали увеличению выживаемости [104, 105]. Кроме того, введение SARS-CoV-специфических CD4+ и CD8+ T-клеток иммунодефицитным мышам приводило к улучшению защиты против адаптированного для мышей штамма SARS-CoV [105].
Несмотря на доказательства важной роли Т-клеток в борьбе с инфекцией, несколько вакцин против SARS-CoV, ранее протестированных на животных моделях, выявили признаки иммунопатологии, связанной с Тх2-опосредованной эозинофильной инфильтрацией [106,107]. В частности, у старых мышей, которые были вакцинированы, наблюдалось скорее усугубление иммунной патологии, а не защита [108]. Дальнейшее изучение природы защитного и дисфункционального Т-клеточного ответа необходимо для определения оптимальных стратегий использования Т-клеток в разработке вакцин [109]. Коронавирус-специфические Т-клетки, несомненно, важны для устранения вируса и контроля развития заболевания и должны учитываться в стратегиях вакцинации. Однако вопрос о том, способен ли Т-клеточный иммунный ответ предотвращать инфекцию у людей, еще предстоит прояснить. Эти знания будут важны для разработки вакцин.
В-клеточный (гуморальный) иммунитет
B-клеточный иммунный ответ у пациентов с COVID-19 возникает одновременно с реакцией T-хелперных фолликулярных клеток примерно через 1 неделю после появления симптомов [110]. У пациентов с инфекцией SARS-CoV B-клеточный ответ обычно возникает в первую очередь против белка нуклеокапсида (N). В течение 4–8 дней после появления первых симптомов обнаруживается повышение титра антител к шиповидным белкам [111, 112]. Нейтрализующие антитела к шиповидным белкам начинают вырабатываться ко 2 неделе заболевания, а у большинства пациентов нейтрализующие антитела вырабатываются к 3 неделе [113, 114]. Учитывая, что вирусная нагрузка достигает пика для SARS-CoV-2 раньше, чем для SARS-CoV [16–19], выработка антител также может начинаться раньше. Похоже, что у некоторой части пациентов долгосрочные антитела к SARS-CoV-2 могут не вырабатываться [115]. Остается неизвестным, подвержены ли эти пациенты повторному заражению, о котором есть отдельные сообщения [116, 117].
Вероятно, против SARS-CoV-2 будут эффективны антитела: образцы реконвалесцентной плазмы были применены в отношении COVID-19 с хорошими клиническими результатами [118], также они ранее успешно использовались при лечении ОРДС [119–121].
Хотя механистические корреляты защиты у людей еще не идентифицированы, считается, что нейтрализация вируса является одной из важных функций антител, хотя конкретный титр и специфичность требуемого для защиты набора антител остаются неопределенными. В SARS-CoV основной мишенью нейтрализующих антител является RBD [122], содержащий 193 аминокислотных остатка (аминокислоты 318–510) в шиповидном белке, которые могут независимо связываться с рецептором АПФ2 — мишенью клетки-хозяина [35–37]. Хотя некоторые из ранее идентифицированных моноклональных антител к SARS-CoV также связываются и с SARS-CoV-2 [123], большинство все же не делают этого [124], что может быть связано со значительными различиями в RBD SARS-CoV-2 и SARS-CoV (рис. 4). В частности, из 33 аминокислот в регионе 460–492 аминокислоты шиповидного белка SARS-CoV, содержащего ключевые остатки, связывающиеся с АПФ2 [125], менее половины (15/33) сохраняются в SARS-CoV-2. Тем не менее мышиная антисыворотка против белка SARS-CoV может перекрестно нейтрализовать псевдовирус SARS-CoV-2, что указывает на перекрывающиеся нейтрализующие эпитопы между двумя вирусами [28, 126].
В Китае больницы начали использовать плазму реконвалесцентов в качестве источника поликлональных антител для лечения COVID-19, и ранние данные свидетельствуют о положительном влиянии в виде снижения вирусной нагрузки и смертности [127, 128]. В настоящее время предпринимаются усилия для разработки терапевтических моноклональных антител против SARS-CoV-2 с использованием таких подходов, как отображение фаговой библиотеки, традиционная иммунизация мыши и создание гибридомы, а также клонирование B-клеточных последовательностей людей-реконвалесцентов [129–132]. SARS-CoV, по-видимому, не имеет механизмов для предотвращения нейтрализации антителами, таких как экранирование гликаном сайта связывания рецептора антителом [133]. Это дополнительно подтверждается тем фактом, что организм пациентов с инфекцией SARS-CoV, как правило, был способен вырабатывать нейтрализующие антитела. Фрагмент рекомбинантного шиповидного белка, который включал в себя RBD SARS-CoV, показал самую высокую иммунногенность по сравнению с другими протестированными фрагментами рекомбинантного шиповидного белка, что позволяет предположить, что иммунная система способна эффективно нацеливаться на нейтрализующие эпитопы [134]. Таким образом, если SARS-CoV-2 ведет себя так же, как и SARS-CoV в этом отношении, вполне вероятно, что усилия по разработке нейтрализующих моноклональных антител будут оправданы.
Возможно, изменения в шиповидном белке сделают SARS-CoV-2 устойчивым к некоторым моноклональным антителам, особенно когда он мутирует. На данный момент весь RBD остается неизменным, и существует только четыре известных редких несинонимических изменения в шиповидном белке: V483A, L455I, F456V и G476S135. Изменение V483A сопоставляется с аналогичным естественным изменением, обнаруженным в MERS-CoV, I529T, где оно снижает связывание вирусного белка с рецептором-мишенью хозяина, а также повышает устойчивость к нейтрализации антителами из образцов сыворотки от пациентов с MERS [136]. Изменения F456V и G476S также соответствуют сходным позициям изменения у SARS-CoV (L443R и D463G), которые были обнаружены на панели избежавших нейтрализации мутантных вирусных частиц [137].
Так или иначе выбор кандидатов для терапии антителами должен включать тщательное рассмотрение возможных нежелательных побочных эффектов. Например, ранее существующие антитела к другим коронавирусам могут обострять инфекцию SARS-CoV посредством антителозависимого усиления [138–140]. Кроме того, предыдущие исследования на животных показали, что при инфекции SARS-CoV нейтрализирующие антитела к шиповидным белкам могут потенциально усиливать тяжелое повреждение легких, усугубляя воспалительные реакции [141]. Также наблюдалась корреляция между развитием ОРДС и сероконверсией противовирусного IgG у 80 % пациентов [19]. У пациентов, организм которых выработал нейтрализирующие антитела к шиповидным белкам ранее, заболеваемость была выше; пациентам, умершим от инфекции, потребовалось в среднем всего 14,7 дня, чтобы достичь пиковых уровней активности нейтрализующих антител, в отличие от 20 дней у пациентов, которые выздоравливали [142]. Аналогично для MERS: у пациентов с более тяжелым течением заболевания титры антител, по-видимому, выше, чем у пациентов с легким заболеванием [143, 144], хотя в одном исследовании подвергается сомнению тот факт, что задержка в выработке антител связана с заболеванием [145]. Связывание иммунных комплексов антитело-вирус с активирующими Fc-рецепторами на альвеолярных макрофагах может индуцировать экспрессию провоспалительных факторов, включая IL-8 и MCP1, которые присоединяются к иммуностимулирующей среде [146]. Такие комплексы могут также активировать систему комплемента и приводить к дальнейшему нежелательному воспалению [141]. Таким образом, важно рассмотреть вопрос о разработке терапевтических антител, обладающих низкой или отсутствующей провоспалительной активностью, но сохраняющих свою способность нейтрализовать вирусы [147]. Например, могут быть внесены изменения в области Fc и/или проведено его гликозилирование, чтобы изменить аффинность связывания для активации рецепторов Fc [146, 148].
Выводы
В этом обзоре представлены различные патофизиологические механизмы инфекции SARS-CoV-2 и иммунопатогенеза COVID-19. Контроль воспалительного ответа может быть столь же важным, как таргетированное воздействие на вирус. Препараты, ингибирующие вирусную инфекцию и регулирующие дисфункциональные иммунные реакции, могут быть использованы совместно для борьбы с патологией в несколько этапов. В то же время связь между иммунной дисфункцией и тяжестью исхода заболевания у пациентов с COVID-19 должна служить предостережением при разработке и оценке вакцины. Необходимы дальнейшие исследования иммунного ответа хозяина на SARS-CoV-2, в том числе подробное изучение детерминант благоприятных и дисфункциональных исходов. Они также помогут идентифицировать биомаркеры для определения иммунных коррелятов защиты и тяжести заболевания для эффективной сортировки пациентов.