через какое время белок попадает в мышцы
Сколько белка можно есть за один раз? Миф про 30 грамм
Есть мнение, что организм может усвоить за один прием пищи определенное количество белка. Обычно ограничение срабатывает на цифре 30 грамм. Так ли это? Пропадет ли остальной белок? Разбираемся!
Коротко о пищеварении
Попадая в желудок, любая белковая еда распадается на мелкие цепочки аминокислот с помощью соляной кислоты и фермента пепсиногена. Дальше они идут в тонкий кишечник. Там цепочки аминокислот окончательно «разрезаются» ферментами на отдельные аминокислоты, после этого поступают в кровоток и используются организмом.
В тонком кишечнике усваивается почти весь съеденный белок — около 95% (1, 2). Примерно две трети этого белка будет использоваться внутренними органами (печенью и кишечником), остальное отправится в мышцы.
Неусвоенный в тонком кишечнике белок (оставшиеся +-5%) идет в толстый кишечник. Там живет микрофлора, которая делает для человека много полезных вещей. Для роста и размножения ей нужны аминокислоты, которые обрабатываются собственными ферментами бактерий. Это называют страшным словом «гниение», но по сути, это нормальный процесс анаэробного сбраживания или ферментирования.
Остаток же непереработанного белка выходит из организма естественным путем, и это очень небольшой процент от съеденного.
Скорость усвоения белка
В зависимости от источника белка, организм усваивает 5-10 грамм аминокислот в час — такова «пропускная способность» стенок тонкого кишечника. Значит ли это, что есть больше за один раз бессмысленно? Нет. Организм подстраивается под самое разное количество поступающего белка, увеличивая время пищеварения, если нужно, пока все не усвоится.
Так, в ответ на попадание белка в желудок организм вырабатывает гормон холецистокинин (3). Он замедляет сокращение стенок и опустошение тонкого кишечника, давая аминокислотам больше времени находиться в нем, чтобы усвоиться (4, 5, 6).
Кроме того, сам кишечник умеет поглощать и удерживать большое количество свободных аминокислот, создавая что-то вроде временного хранилища (7, 8). Он выпускает их в кровоток во время больших перерывов в еде или ночью.
Это же защищает организм от резкого увеличения уровня аминокислот в крови, которые ему пришлось бы окислить с образованием большого (и тем вредного, токсичного) количества мочевины, как продукта распада белка.
В исследовании, проведенном на женщинах, получение более 54 грамм белка за один прием пищи ничем не отличалось от того же количества, но поделенного на четыре приема (9). Еще ученые обнаружили, что редкие, но высокобелковые приемы пищи эффективнее для пожилых женщин (10).
Исследования, проведенные во время периодического голодания, тоже показали, что тело может справиться с гораздо большим количеством белка, чем принято думать (11, 12).
Почему именно 30 грамм белка?

Цифра пришла из исследования, которое изучало конкретные вещи: влияние количества белка на скорость синтеза новых мышц. Участники получали разное количество белка после силовой тренировки, а ученые смотрели, где находится порог, после которого нет изменений. Оказалось, что рост мышечных волокон ускорялся при 10-20 грамм незаменимых аминокислот, что соответствует 20-25 граммам пищевого белка. А выше этих цифр никаких изменений не наступало. Почему появилась цифра 30 грамм, не известно. Может быть, для округления.
Это исследование посвящено очень узкой проблеме — анаболическому ответу организма на поступление разного количества белка после тренировки. Его нельзя использовать для обсуждения усвояемости белка и того, сколько в принципе за один раз можно съесть. Усвоение белка и синтез белка — совершенно разные вещи.
Усвоение — то, как и с какой скоростью аминокислоты поступают в кровоток во время пищеварения. А синтез белка связан с использованием этих аминокислот для строительства тканей тела.
Выводы
Нет смысла беспокоиться, сколько белка организм сможет усвоить за один прием пищи. На сегодняшний день нет доказательств, что есть порог усвоения белка, и много доказательств в пользу того, что тело может усвоить все питательные вещества, которые вы поставляете.
Самая большая разница между высокобелковой и низкобелковой едой на тарелке — во времени ее усвоения. Если за один раз было съедено много белка, он дольше останется в кишечнике, пока не усвоится, потому что это очень ценный для организма материал. Так что можно есть больше 30 грамм белка за один раз.
Фитнес-мифы: пропустил еду — потерял мышцы
Набирающие мышцы фитнесисты одержимы идеей есть как можно чаще. Они боятся, что даже из-за одного пропуска еды и особенно белка их мышцы начнут гореть, поэтому стараются есть каждые 1-3 часа. Они носят с собой шейкеры с протеином и контейнеры с куриной грудкой, чтобы питательные вещества и особенно аминокислоты текли к мышцам без перерыва. Можно предположить, что идеальный вариант для некоторых одержимых мышцами людей — непрерывная внутривенная капельница с углеводами, аминокислотами и жирными кислотами.
В организме есть пул свободных аминокислот
Каждый день внутри нас распадается много белка, и каждый день этот распавшийся белок снова используется. Разные ткани обновляются с разной скоростью. Белки плазмы обновляются за несколько часов. Белки мышц — за несколько дней. Сухожилия и связки — за месяцы и даже годы.
При обычном питании человек среднего роста и веса может обернуть до 300 грамм белка в день. Это значит, что 300 грамм белка распадётся, и большая его часть будет использована заново. То, что будет потеряно в процессе, мы должны восполнять с едой.
Со стороны это выглядит немного странным: зачем разрушать и строить то же самое снова? Но такой оборот белка важен. Постоянно находящиеся в крови свободные аминокислоты могут быть моментально использованы для ремонта тканей — при травмах, ожогах и других стрессах, а так же для поддержания иммунной системы.
Таким образом, в организме человека есть «банк» свободных аминоксилот. С одной стороны, он пополняется за счет распадающегося белка тела. С другой — за счет белка, который поступает с едой.
Всего организм таким образом хранит около 100 грамм белка, и это количество остается относительно неизменным, независимо от питания и других условий. Основные места хранения — тонкий кишечник и печень. Они создают из них свои «временные» белки, которые распадаются между приемами пищи, во время больших перерывов в еде или во время сна. Благодаря этому тело все 24 часа получает нужное количество аминокислот равномерно. Во время голода первыми распадаются именно эти белки, а не белки мышц.
Белок усваивается долго
Когда люди едят каждые один-два часа, чтобы не потерять мышцы, они не учитывают скорость усвоения белка. Самый быстрый — сывороточный. Скорость его усвоения — 10 г/час. Но и здесь наибольшая концентрация аминокислот занимает целый час. Затем на протяжении четырех часов она постепенно снижается. Самый медленный белок — казеин, которым богаты творог и сыр. Так, 40 грамм чистого казеина будут выпускать аминокислоты в кровь до 8 часов. Есть данные и для других белков, хотя цифры очень приблизительные:
Сырой яичный белок 1,4 г/час
Приготовленный яичный белок 2,9 г/час
Белок бобовых 3,5 г/час
Молочный белок 3,5 г/час
Изолят соевого белка 3,9 г/час
Изолят казеина 6.1 г/час
Изолят сыворотки 8-10 г/час
Вырезка свинины 10,0 г/час
Таким образом, средняя скорость усвоения белка — 5-6 г/час. Один только омлет из трех белков будет поставлять аминокислоты в кровь 3,5 часа.
Не учитывают обычно и то, что человек ест вместе с белком. Другая еда может замедлить скорость усвоения белка — например, это делают жиры. Одно исследование показало, что приём пищи на 75 г углеводов, 17 г жира и 27 г белка выпускал аминокислоты, глюкозу и жирные кислоты в кровоток на протяжении пяти часов.
Выходит, что даже умеренная по размеру порция еды поддерживает анаболическое состояние в организме не менее пяти часов. Очень медленно усваивающиеся белки могут выпускать аминокислоты до 7-8 часов после приема пищи.
На скорость усвоения белка влияет и еда с предыдущего приема пищи. В течение дня человек никогда не находится в действительно голодном с физиологической точки зрения состоянии, даже если он чувствует пустой желудок. Если мы едим 3-5 раз в день, мы не обнуляемся к следующему приему пищи. Еда с прошлого раза может усваиваться несколько часов, в зависимости от количества и состава. Так что питательные вещества из еды встречаются в кровотоке. Даже если спортсмен думает, что он голодает во время трехчасового перерыва между порциями белка, и мышцы его горят, на самом деле это не так.
Таким образом, безопасный с точки зрения анаболизма перерыв между приемами пищи — около 5 часов.
Частота приемов пищи
Если спортсмен получает достаточно калорий и белка в течение дня, разбиение их на многие приемы пищи не влияет на синтез и распад мышц. Принимать решение о том, сколько раз есть в день, стоит только из соображений удобства и практичности.
При высокой калорийности питания приходится есть чаще, чтобы порции не были слишком большими. Спортсмены с меньшей калорийностью рациона часто обнаруживают, что более редкое питание и большой размер порций насыщают лучше, чем дробное питание. Люди, которые заняты на работе и не могут есть каждые 2-3 часа, не должны волноваться о потере мышц.
Кстати, некоторые исследования показывают, что слишком частое питание может плохо влиять на рост мышц, так как их клетки становится нечувствительными к стимулированию аминокислотами, и они просто окисляются в печени. При более редком питании с большим скачком аминокислот в крови мышцы остаются к ним более чувствительными.
С этой точки зрения оптимальный перерыв между едой — 3-5 часов. Питание твёрдой пищей с качественным белком, углеводами, клетчаткой и небольшим количеством жиров будет поддерживать анаболическое состояние организма до 5 часов, не вызывая проблем, связанных со слишком частым или слишком редким питанием.
Алгоритм метаболизма

Решение организационных вопросов питания у лиц старших возрастов, разработка и назначение индивидуализированных рационов рационального, профилактического и лечебного питания в существенной степени зависит от правильной оценки врачом нутриционного статуса пожилого человека, особенностей состояния обменных процессов. Именно поэтому профессионально грамотный клиницист, участвующий в решении проблем лечебно-профилактического питания у лиц пожилого и старческого возраста, должен быть достаточно хорошо ориентирован в области основ клинической биохимии и физиологии питания стареющего организма.
Белковый обмен
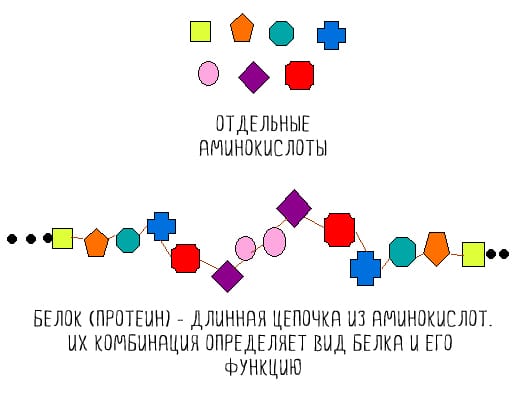
Белки — сложные азотсодержащие биополимеры, мономерами которых служат аминокислоты (органические соединения, содержащие карбоксильные и аминные группы). Их биологическая роль многообразна. Белки выполняют в организме пластические, каталитические, гормональные, транспортные и другие функции, а также обеспечивают специфичность. Значение белкового компонента питания заключается прежде всего в том, что он служит источником аминокислот.
Аминокислоты делятся на эссенциальные и неэссенциальные в зависимости от того, возможно ли их образование в организме из предшественников. К незаменимым аминокислотам относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, триптофан и валин, а также цистеин и тирозин, синтезируемые соответственно из метионина и фенилаланина. Девять заменимых аминокислот (аланин, аргинин, аспарагиновая и глутамовая кислоты, глутамин, глицин, пролин и серин) могут отсутствовать в рационе, так как способны образовываться из других веществ. В организме также существуют аминокислоты, которые продуцируются путем модификации боковых цепей вышеперечисленных (например, компонент коллагена — гидроксипролин — и сократительных белков мышц — 3-метилгистидин).
Большинство аминокислот имеют изомеры (D- и L-формы), из которых только L-формы входят в состав белков человеческого организма. D-формы могут участвовать в метаболизме, превращаясь в L-формы, однако утилизируются гораздо менее эффективно.
Взаимоотношение аминокислот
По химическому строению аминокислоты делятся на двухосновные, двухкислотные и нейтральные с алифатическими и ароматическими боковыми цепями, что имеет большое значение для их транспорта, поскольку каждый класс аминокислот обладает специфическими переносчиками. Аминокислоты с аналогичным строением обычно вступают в сложные, часто конкурентные взаимоотношения.
Так, ароматические аминокислоты (фенилаланин, тирозин и триптофан) близкородственны между собой. Хотя фенилаланин является незаменимой, а тирозин — синтезируемой из него заменимой аминокислотой, наличие тирозина в рационе как будто бы «сберегает» фенилаланин. Если фенилаланина недостаточно или его метаболизм нарушен (например, при дефиците витамина С) — тирозин становится незаменимой аминокислотой. Подобные взаимоотношения характерны и для серосодержащих аминокислот: незаменимой — метионина — и образующегося из него цистеина.
Триптофан в ходе превращений, для которых необходим витамин В 6 (пиридоксин), включается в структуру НАД и НАДФ, то есть дублирует роль ниацина. Приблизительно половина обычной потребности в ниацине удовлетворяется за счет триптофана: 1 мг ниацина пищи эквивалентен 60 мг триптофана. Поэтому состояние пеллагры может развиваться не только при недостатке витамина РР в рационе, но и при нехватке триптофана или нарушении его обмена, в том числе вследствие дефицита пиридоксина.
Аминокислоты также делятся на глюкогенные и кетогенные, в зависимости от того, могут ли они при определенных условиях становиться предшественниками глюкозы или кетоновых тел (см. табл. 1).
Таблица 1. Классификация аминокислот
| Виды | Эссенциальные аминокислоты | Неэссенциальные аминокислоты |
| Алифатические | Валин (Г), лейцин (К), изолейцин (Г, К) | Глицин (Г), аланин (Г) |
| Двухосновные | Лизин (К), гистидин (Г, К)* | Аргинин (Г)* |
| Ароматические | Фенилаланин (Г, К), триптофан (Г, К) | Тирозин (Г, К)** |
| Оксиаминокислоты | Треонин (Г, К) | Серин (Г) |
| Серосодержащие | Метионин (Г, К) | Цистеин (Г)** |
| Дикарбоновые и их амиды | Глутамовая кислота (Г), глутамин (Г), аспарагиновая кислота (Г), аспарагин (Г) | |
| Иминокислоты | Пролин (Г) |
Обозначения: Г — глюкогенные, К — кетогенные аминокислоты; * — гистидин незаменим у детей до года; ** — условно-незаменимые аминокислоты (могут синтезироваться из фенилаланина и метионина).
Необходимые азотсодержащие соединения
Поступление азотсодержащих веществ с пищей происходит в основном за счет белка и в менее значимых количествах — свободных аминокислот и других соединений. В животной пище основное количество азота содержится в виде белка. В продуктах растительного происхождения большая часть азота представлена небелковыми соединениями, также в них содержится множество аминокислот, которые не встречаются в организме человека и зачастую не могут метаболизироваться им.
Синтез пуриновых оснований
Человек не нуждается в поступлении с пищей нуклеиновых кислот. Пуриновые и пиримидиновые основания синтезируются в печени из аминокислот, а избыток этих оснований, поступивших с пищей, выводится в виде мочевой кислоты.
Прием белка
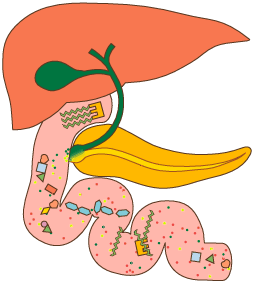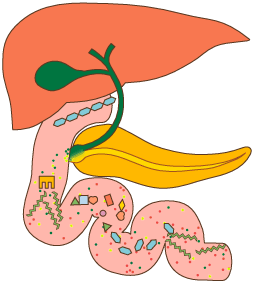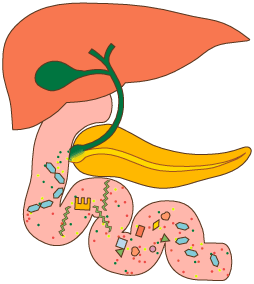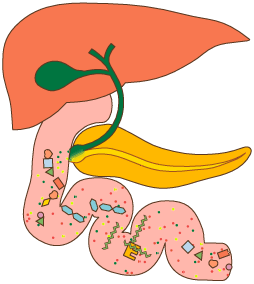
Обычный (но не оптимальный) ежедневный прием белка у среднестатистического человека составляет приблизительно 100 г. К ним присоединяется примерно 70 г белка, секретируемого в полость желудочно-кишечного тракта. Из этого количества абсорбируется около 160 г. Самим организмом в сутки синтезируется в среднем 240–250 г белка. Такая разница между поступлением и эндогенным преобразованием свидетельствует об активности процессов обратного восстановления исходного сложного химического соединения из «осколков», образовавшихся при его метаболизме (ресинтеза белков из аминокислот, а аминокислот из аммиака и «углеродных скелетов» аминокислот).
Азотное равновесие
Для здорового человека характерно состояние азотного равновесия, когда потери белка (с мочой, калом, эпидермисом и т. п.) соответствуют его количеству, поступившему с пищей. При преобладании катаболических процессов возникает отрицательный азотный баланс, который характерен для низкого потребления азотсодержащих веществ (низкобелковых рационов, голодания, нарушения абсорбции белка) и многих патологических процессов, вызывающих интенсификацию распада (опухолей, ожоговой болезни и т. п.). При доминировании синтетических процессов количество вводимого азота преобладает над его выведением, и возникает положительный азотный баланс, характерный для детей, беременных женщин и реконвалесцентов после тяжелых заболеваний.
После прохождения энтерального барьера белки поступают в кровь в виде свободных аминокислот. Следует отметить, что клетки слизистой оболочки желудочно-кишечного тракта могут метаболизировать некоторые аминокислоты (в том числе глутамовую кислоту и аспарагиновую кислоту в аланин). Способность энтероцитов видоизменять эти аминокислоты, возможно, позволяет избежать токсического эффекта при их избыточном введении.
Аминокислоты, как поступившие в кровь при переваривании белка, так и синтезированные в клетках, в крови образуют постоянно обновляющийся свободный пул аминокислот, который составляет около 100 г.
Путь белка
75 % аминокислот, находящихся в системной циркуляции, представлены аминокислотами с ветвящимися цепями (лейцином, изолейцином и валином). Из мышечной ткани в кровоток выделяются аланин, который является основным предшественником синтеза глюкозы, и глутамин. Многие свободные аминокислоты подвергаются трансформации в печени. Часть свободного пула инкорпорируется в белки организма и при их катаболизме вновь поступает в кровоток. Другие непосредственно подвергаются катаболическим реакциям. Некоторые свободные аминокислоты используются для синтеза новых азотсодержащих соединений (пурина, креатинина, адреналина) и в дальнейшем деградируют, не возвращаясь в свободный пул, в специфичные продукты распада.
Роль печени
Постоянство содержания различных аминокислот в крови обеспечивает печень. Она утилизирует примерно ⅓ всех аминокислот, поступающих в организм, что позволяет предотвратить скачки в их концентрации в зависимости от питания.
Первостепенная роль печени в азотном и других видах обмена обеспечивается ее анатомическим расположением — продукты переваривания попадают по воротной вене непосредственно в этот орган. Кроме того, печень непосредственно связана с экскреторной системой — билиарным трактом, что позволяет выводить некоторые соединения в составе желчи. Гепатоциты — единственные клетки, обладающие полным набором ферментов, участвующих в аминокислотном обмене. Здесь выполняются все основные процессы азотного метаболизма: распад аминокислот для выработки энергии и обеспечения глюконеогенеза, образование заменимых аминокислот и нуклеиновых кислот, обезвреживание аммиака и других конечных продуктов. Печень является основным местом деградации большинства незаменимых аминокислот (за исключением аминокислот с ветвящимися цепями).
Инсулиновый ответ
Синтез азотсодержащих соединений (белка и нуклеиновых кислот) в печени весьма чувствителен к поступлению их предшественников из пищи. После каждого приема пищи наступает период повышенного внутрипеченочного синтеза белков, в том числе альбумина. Аналогичное усиление синтетических процессов происходит и в мышцах. Эти реакции связаны прежде всего с действием инсулина, который секретируется в ответ на введение аминокислот и/или глюкозы.
Некоторые аминокислоты (аргинин и аминокислоты с ветвящимися цепями) усиливают продукцию инсулина в большей степени, чем остальные. Другие (аспарагин, глицин, серин, цистеин) стимулируют секрецию глюкагона, который усиливает утилизацию аминокислот печенью и воздействует на ферменты глюконеогенеза и аминокислотного катаболизма. Благодаря этим механизмам происходит снижение уровня аминокислот в крови после поступления их с пищей. Действие инсулина наиболее выражено для аминокислот, содержащихся в кровотоке в свободном виде (аминокислот с ветвящимися цепями), и малозначимо для тех, которые транспортируются в связанном виде (триптофана). Обратное инсулину влияние на белковый метаболизм оказывают глюкокортикостероиды.
Аминокислоты на «экспорт»
Печень обладает повышенной скоростью синтеза и распада белков по сравнению с другими тканями организма (кроме поджелудочной железы). Это позволяет ей синтезировать «на экспорт», а также быстро обеспечивать лабильный резерв аминокислот в период недостаточного питания за счет распада собственных белков.
Особенность внутрипеченочного белкового синтеза заключается в том, что он усиливается под действием гормонов, которые в других тканях производят катаболический эффект. Так, при голодании белки мышц, для обеспечения организма энергией, подвергаются распаду, а в печени одновременно усиливается синтез белков, являющихся ферментами глюконеогенеза и мочевинообразования.
Избыток белка и голодание
Прием пищи, содержащей избыток белка, приводит к интенсификации синтеза в печени и в мышцах, образованию избыточных количеств альбумина и деградации излишка аминокислот до предшественников глюкозы и липидов. Глюкоза и триглицериды утилизируются как горючее или депонируются, а альбумин становится временным хранилищем аминокислот и средством их транспортировки в периферические ткани.
При голодании уровень альбумина прогрессивно снижается, а при последующей нормализации поступления белка медленно восстанавливается. Поэтому хотя альбумин и является показателем белковой недостаточности, он низкочувствителен и не реагирует оперативно на изменения в питании.
7 из 10 эссенциальных аминокислот деградируют в печени — либо образуя мочевину, либо впоследствии используясь в глюконеогенезе. Мочевина преимущественно выделяется с мочой, но часть ее поступает в просвет кишечника, где подвергается уреазному воздействию микрофлоры. Аминокислоты с ветвящимися цепями катаболизируются в основном в почках, мышцах и головном мозге.
Роль мышц
Мышцы синтезируют ежедневно 75 г белка. У среднего человека они содержат 40 % от всего белка организма. Хотя белковый метаболизм происходит здесь несколько медленнее, чем в других тканях, мышечный белок представляет собой самый большой эндогенный аминокислотный резерв, который при голодании может использоваться для глюконеогенеза.
Мышцы являются основной мишенью воздействия инсулина: здесь под его влиянием усиливается поступление аминокислот, увеличивается синтез мышечного белка и снижается распад.
В процессе превращений в мышцах образуются аланин и глутамин, их условно можно считать транспортными формами азота. Аланин непосредственно из мышц попадает в печень, а глутамин вначале поступает в кишечник, где частично превращается в аланин. Поскольку в печени из аланина происходит синтез глюкозы, частично обеспечивающий мышцу энергией, получающийся круго- оборот получил название глюкозо- аланинового цикла.
К азотсодержащим веществам мышц также относятся высокоэнергетичный креатин-фосфат и продукт его деградации креатинин. Экскреция креатинина обычно рассматривается как мера мышечной массы. Однако это соединение может поступать в организм с высокобелковой пищей и влиять на результаты исследования содержания его в моче. Продукт распада миофибриллярных белков — 3-метилгистидин — экскретируется с мочой в течение короткого времени и является достаточно точным показателем скорости распада в мышцах — при мышечном истощении скорость его выхода пропорционально снижается.
Механизм голодания
В отсутствие пищи синтез альбумина и мышечного белка замедляется, но продолжается деградация аминокислот. Поэтому на начальном этапе голодания мышцы теряют аминокислоты, которые идут на энергетические нужды. В дальнейшем организм адаптируется к отсутствию новых поступлений аминокислот (снижается потребность в зависящем от белка глюконеогенезе за счет использования энергетического потенциала кетоновых тел) и потеря белка мускулатуры уменьшается.
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!
Роль почек
Почки не только выводят конечные продукты азотного распада (мочевину, креатинин и др.), но и являются дополнительным местом ресинтеза глюкозы из аминокислот, а также регулируют образование аммиака, компенсируя избыток ионов водорода в крови.
Глюконеогенез и функционирование кислотно-щелочной регуляции тесно скоординированы, поскольку субстраты этих процессов появляются при дезаминировании аминокислот: углерод для синтеза глюкозы и азот — для аммиака. Существует даже мнение, что именно производство глюкозы является основной реакцией почек на ацидоз, а образование аммиака происходит вторично.
Белок в нервной ткани
Для нервной ткани характерны более высокие концентрации аминокислот, чем в плазме. Это позволяет обеспечить мозг достаточным количеством ароматических аминокислот, являющихся предшественниками нейромедиаторов.
Некоторые заменимые аминокислоты, такие как глутамат (из которого при участии пиридоксина образуется гамма-аминомасляная кислота) и аспартат, также обладают влиянием на возбудимость нервной ткани. Их концентрация здесь высока, при этом заменимые аминокислоты способны синтезироваться и на месте.
Сон после еды
Специфическую роль играет триптофан, являющийся предшественником серотонина. Именно с повышением концентрации триптофана (а следовательно, и серотонина) связана сонливость после еды. Такой эффект особенно выражен при приеме больших количеств триптофана совместно с углеводистой пищей. Повышенная секреция инсулина снижает уровень в крови аминокислот с ветвящимися цепями, которые при преодолении барьера «кровь — мозг» обладают конкурентными взаимоотношениями с ароматическими аминокислотами, но в то же время не оказывает влияния на концентрацию связанного с альбумином триптофана. Благодаря подобным эффектам препараты триптофана могут использоваться в психиатрической практике.
При заболеваниях печени
Ограничение ароматических аминокислот в рационе, в связи с их влиянием на центральную нервную систему, имеет профилактическое значение при ведении пациентов с печеночной энцефалопатией. Элементные аминокислотные диеты с преимущественным содержанием лейцина, изолейцина, валина и аргинина помогают избежать развития белковой недостаточности у гепатологических больных и в то же время не приводят к возникновению печеночной комы.
Основные пластические функции протеиногенных аминокислот перечислены в таблице 2.
Таблица 2. Основные функции аминокислот
| Аланин | Предшественник глюконеогенеза, переносчик азота из периферических тканей в печень |
| Аргинин | Непосредственный предшественник мочевины |
| Аспарагиновая кислота | Предшественник глюконеогенеза, предшественник пиримидина, используется для синтеза мочевины |
| Глутаминовая кислота | Донор аминогрупп для многих реакций, переносчик азота (проникает через мембраны легче, чем глутамин), источник аммиака, предшественник ГАМК |
| Глицин | Предшественник пуринов, глютатиона и креатинина, входит в состав гемоглобина и цитохромов, нейротрансмиттер |
| Гистидин | Предшественник гистамина, донор углерода |
| Лизин | Предшественник карнитина (транспорт жирных кислот), составляющая коллагена |
| Метионин | Донор метальных групп для многих синтетических процессов (в т. ч. холина, пиримидинов), предшественник цистеина, участвует в метаболизме никотиновой кислоты и гистамина |
| Фенилаланин | Предшественник тирозина |
| Серин | Составляющая фосфолипидов, предшественник сфинголипидов, предшественник этаноламина и холина, участвует в синтезе пуринов и пиримидинов |
| Триптофан | Предшественник серотонина и никотинамида |
| Тирозин | Предшественник катехоламинов, допамина, меланина, тироксина |
| Цистеин | Предшественник таурина (желчные кислоты), входит в состав глютатиона (антиоксидантная система) |
Нормы потребления белка
Современные рекомендации по обеспечению пожилых людей и стариков основными питательными веществами, в первую очередь белками, свидетельствуют о целесообразном некотором снижении суточного количества белковых продуктов в пищевом рационе до 0,75–0,8 г/кг веса. Это связано с тем, что интенсивность основных физиологических функций с каждым десятилетием жизни человека после 50 лет снижается почти на 10 % (Rogers J., Jensen G., 2004), потребность белка уменьшается за счет инволюции синтетических и пластических процессов и ферментообразования, продукции гормонов, ряда биологически активных веществ, обеспечения мышечной деятельности и т. д.
Рекомендуемые нормы потребления для белка с учетом приведенных выше показателей составляют 55–62 г/сут (для мужчины весом 77 кг в возрасте 60–70 лет) и 45–52 г/сут (для женщины весом 65 кг в возрасте 60–70 лет) по выводам IV Американского национального исследования по оценке здоровья и питания (2006).
Вместе с тем установлено, что при сохранении физической активности пожилых людей (профессиональной физической нагрузки, занятий физкультурой, работы на дачном участке и т. п.) для поддержания азотного равновесия организма требуется повышение белкового обеспечения пожилого человека в количестве 1–1,25 г/кг в день. Эта же квота пищевого белка полностью обеспечит потребности пожилого человека, находящегося в состоянии стресса, болезни или ранения (Lowenthal D. T., 1990).
Рис. 1. Влияние пищевых веществ на развитие болезней избыточного питания (по А. А. Покровскому)
Дефицит белка = старение
Важно отметить, что организм пожилого человека очень чувствителен как к дефициту экзогенно поступающих белков, так и к их избытку. В условиях белкового дефицита прогрессирующе развиваются процессы дистрофии и атрофии клеточных структур, в первую очередь мышечной ткани, слизистых оболочек (желудочно-кишечного тракта, дыхательной системы и др.), паренхиматозных органов (поджелудочной железы, печени, эндокринных желез и др.), структур иммунной системы. Белковый дефицит питания активизирует процессы старения организма.
Механизмы патологического действия на организм пожилого и старого человека пищевой белковой перегрузки связаны в первую очередь с белковой «агрессией» печени и связанной с этим несостоятельностью ферментных систем, неполной деполимеризацией всех фракций белка, накоплением в крови токсических продуктов незавершенных окислительно-восстановительных реакций и т. д.
Белковая перегрузка
Интоксикационный процесс метаболического генеза при избыточном белковом питании пожилых и старых людей многократно усиливается по причине развития процессов гнилостной кишечной диспепсии в условиях относительной ферментной недостаточности желудка, поджелудочной железы, тонкой кишки и развития синдромов мальдигестии и мальабсорбции, а также кишечного дисбиоза (Барановский А. Ю., Кондрашина Э. А., 2008).
Белковая пищевая перегрузка в рамках интоксикационного синдрома способствует перевозбуждению центральной нервной системы, иногда — состояниям, близким к неврозам. При этом наблюдается повышенный расход витаминов в организме с формированием витаминной недостаточности.
При длительном высокобелковом питании вначале наблюдается компенсаторное усиление, а затем угнетение секреторной функции желудка и поджелудочной железы, повышается риск развития таких заболеваний, как подагра, мочекаменная болезнь.
В следующем выпуске журнала «Практическая диетология» мы продолжим рассказ о геронтологических особенностях основных видов обмена веществ пациентов пожилого и старческого возраста — углеводном и жировом обмене.
// ПД
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!