через какое время действует азитромицин при хламидиозе
Применение азитромицина (Сумамеда) для лечения хламидийной инфекции в гинекологической практике
Вопросы гинекологии, акушерства и перинатологии, 2003, т. 2, №3, с. 81—84
Одной из актуальнейших проблем современной клинической медицины являются инфекции с внутриклеточной персистенцией возбудителя. Несмотря на широкое изучение хламидийной инфекции, высокая частота осложнений, рецидивирования и неэффективности терапии, диктует необходимость разработки новых подходов к лечению данной патологии.
Как и для N. gonorrhoeae для С. trachomatis характерен тропизм к цилиндрическому эпителию.
Элементарные тельца (ЭТ) хламидии имеют овальную форму при размерах 250-500 нм. Они обладают инфекционными, антигенными свойствами, способны проникать в чувствительную клетку. Уникальный цикл развития хламидии происходит только внутри связанных с мембраной клетки вакуолей цитоплазмы, где элементарные тельца превращаются в более крупные ретикулярные тельца, претерпевающие деление.
Ретикулярные тельца (РТ) обладают полиморфизмом (округлой, овальной, полулунной, коккобациллярной формы), не имеют постоянного размера и структуры, а величина их колеблется от 300 до 1000 нм. Ретикулярные тельца не обладают инфекционными свойствами, не имеют нуклеотида, относятся к вегетативным («незрелым») формам возбудителя.
Затем происходит внедрение хламидии в клетку путем инвагинации участков плазмалеммы и образования фагоцитарных вакуолей (эндоцитоз). Данный этап продолжается от 7 до 10 ч.
Процесс трансформации РТ в ЭТ занимает 36-42 ч. На данном этапе обнаруживаются переходные (промежуточные) тельца хламидий.
Заканчивается жизненный цикл хламидий выходом ЭТ из эндосомы и разрушением инфицированной клетки. Однако возможно сохранение жизнеспособности инфицированной клетки при выходе ЭТ путем экзоцитоза. Это наблюдается при бессимптомном течении хламидийной инфекции. Через 48-72 ч освободившиеся ЭТ проникают в новые клетки-мишени.
Наиболее важным моментом является то, что при первичной инвазии возбудителя полный цикл развития хламидий занимает около 100 ч (4 сут). Однако при возникновении неблагоприятных биохимических условий(например, в условиях проводимой антибиотикотерапии) продолжительность жизненного цикла развития хламидий может значительно увеличиваться, достигая нескольких недель. При этом существует форма латентной инфекции с периодическим реци-дивированием и хронический хламидиоз.
Вторым важным аспектом патогенеза хламидийной инфекции является влияние хламидий на процессы иммунитета. Ведущая роль в защите от хламидийной инфекции принадлежит Т-хелперам, активирующих фагоцитарную активность макрофагов. В то же время поликлональная активация В-лимфоцитов приводит к повышению выработки иммуноглобулинов классов М, А и G.
Поглощение хламидий моноцитами периферической крови ведет к их диссеминации по всему организму. Моноциты, оседая в тканях суставов, сосудов, сердца, превращаются в тканевые макрофаги, которые сохраняют жизнеспособность в течение нескольких месяцев. Локальная антигенная стимуляция приводит к формированию фиброзных гранулем в здоровой ткани. Высвобождение хламидий приводит к образованию специфических антител, даже при отсутствии хламидийного антигена в области входных ворот инфекции.
При урогенитальном хламидиозе отсутствуют патогномоничные клинические проявления и выраженная симптоматика заболевания. У 50-70% женщин инфекция протекает бессимптомно. Отсутствие клинических симптомов заболевания лишь указывает на временное равновесие между паразитом и хозяином в условиях ограничивающих, но не препятствующих размножению патогенного внутриклеточного микроорганизма. Хламидийная инфекция с клинически бессимптомным течением является не менее опасной, чем ее манифестные формы, требует проведения лечебных и профилактических мероприятий, воздействующих на возбудитель и повышающих защитные силы организма.
По клиническому течению выделяют свежий урогенитальный хламидиоз (давность заболевания менее 2 мес) и хронический (более 2 мес). Свежий урогенитальный хламидиоз подразделяется на острую, подострую и торпидную стадии.
Первичное инфицирование Chlamydia trachomatis выявить практически не удается. В связи с этим деление хламидийной инфекции на острую, хроническую и торпидную формы весьма условно.
Клиническая манифестация заболевания, как правило, имеется при наличии смешанной инфекции или на фоне снижения местной или общей реактивности организма. При этом именно ассоциированные возбудители обусловливают клинические проявления заболевания.
Формирование клинического диагноза может основываться только на результатах комплексного клинического и лабораторного обследования. Обязательным является выделение возбудителей (этиология), определение топики поражения и ассоциированных осложнений.
Таким образом, особенности инфекционного процесса, малосимптомность клинических проявлений, возможность персистенции хламидий в жизнеспособных клетках, сложности контроля за излеченностью инфекции, диктуют необходимость подбора схем этиотропного лечения заболевания, обладающих высокой микробиологической эффективностью, удовлетворительным комплаенсом и высокой биодоступностью.
Одним из препаратов выбора для лечения хламидийной урогенитальной инфекции у женщин является азитромицин (Сумамед). В то же время, возникающие на фоне хламидиоза дефекты иммунного ответа, требуют комбинации антибиотика с иммунокорригирующими препаратами.
Имеющиеся в настоящее время иммунокорректоры не обладают специфическим действием на активацию локального иммунитета. Их необоснованное применение (отсутствие клинических признаков иммунодефицита, персистенции инфекции) может спровоцировать гипериммунную реакцию, что приведет к углублению уже имеющихся нарушений, так как сосудистое русло и ткани органов репродукции обладают повышенной чувствительностью к иммунным комплексам, продуктам воспаления.
Избыточная стимуляция T-лимфоцитов провоцирует аутоиммунные процессы. Гиперактивация В-лимфоцитов стимулирует повышенную выработку иммуноглобулинов, повышение концентрации комплексов антиген-антитело, что приводит к блокированию фагоцитов, повреждению микрокапилляров. Чрезмерная стимуляция макрофагов и нейтрофилов может реализоваться в повышении выделения интерлейкинов, моноаминов, фактора некроза опухоли, что инициирует повреждение клеток и снижает возможности фагоцитов в инактивации иммунных комплексов.
В этом случае активированное состояние иммунной системы может быть опасным для организма, а применение высокоактивных иммуномодулирующих препаратов нанесет вред.
Таким образом, активная иммуностимулирующая терапия показана только больным с клиническими проявлениями иммунодефицита и длительно персистирующей генитальной инфекцией.
Вместе с тем в последние годы широко применяются препараты рекомбинантного интерферона а-2b (виферон, кипферон, реальдирон, интрон-А). Следует отметить, что отечественный препарат Виферон предназначен для ректального введения (или местного использования). Интерфероны обладают неспецифическим действием, препятствующим внутриклеточной сборке чужеродных белков.
В настоящем исследовании принимали участие 143 женщины со свежим неосложненным хламидиозом и 189 пациенток с давностью заболевания более 4 мес. У всех женщин были исключены другие инфекции, передаваемые половым путем.
Применение азитромицина (Сумамеда) для лечения хламидийной инфекции в гинекологической практике
Обнаружение абсолютно патогенных микроорганизмов хламидий во всех случаях требует проведения специфической терапии. В связи с этим, даже при так называемой персистенции инфекции и отсутствии клинических проявлений заболевания, лечение необходимо. Каждая группа обследованных была разделена на две подгруппы в зависимости от варианта проводимого лечения.
При свежем неосложненном урогенитальном хламидиозе 92 женщины получали 1,0 г азитромицина (Сумамеда) перорально однократно (2 табл по 500 мг). 51 пациентке назначали Сумамед по 500 мг (1 табл) в день на протяжении 3 дней. Одновременно с антибиотикотерапией проводили интерферонотерапию в виде ректальных свечей, содержащих 150 000 ME интерферона-a по 3 раза в течение суток на протяжении 10 дней.
Аналогичное лечение проводилось половым партнерам женщин, входивших в исследование.
Ни один из современных методов диагностики хламидиоза не обеспечивает 100% надежности. Поэтому лабораторная диагностика должна основываться на сочетании минимум двух методов, одним из которых должен являться культуральный. Диагностику хламидийной инфекции проводили с помощью выделения возбудителя на культуре клеток McCoy, амплификации гомологичных участков ДНК с помощью полимеразной цепной реакции на аппарате «Терцик», для реакции прямой иммунофлюоресценции применяли набор ХлаМоноСкрин (Ниармедик, Россия).
Полимеразная цепная реакция (ПЦР) обладает преимуществами по сравнению с иммунологическими методами:
Таким образом, в данной работе было принято, что наиболее достоверным методом диагностики хламидиоза является сочетание культурального исследования и полимеразной цепной реакции. Материалом для исследования служили отделяемое цервикального канала, моча, содержимое брюшной полости и полостей внутренних половых органов.
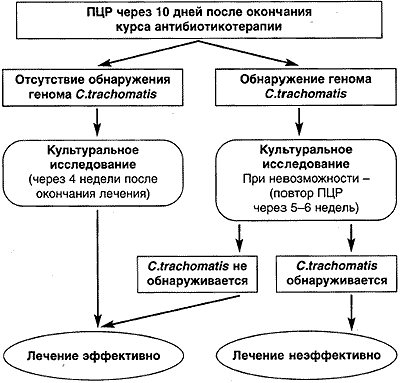
Рис. 1.
Схема проведения контроля за эффективностью терапии урогенитального хламидиоза.
Топическую диагностику различных форм хламидиоза осуществляли на основании клинического обследования, расширенной кольпоскопии, ультразвукового исследования, лапароскопии.
С целью контроля за эффективностью терапии применяли следующую схему (рис. 1).
После получения данных о микробиологической эффективности проведенного лечения (71,1%) 236 всех пациенток остались под нашим наблюдением в течение 18 мес. Им с интервалом в 6 мес проводилось контрольное лабораторное обследование, включавшее сочетание культурального метода идентификации хламидий и полимеразной цепной реакции.
В результате проведенного исследования было установлено, что в группе женщин с неосложненным свежим хламидиозом максимальная эффективность терапии достигала 93%. При этом показатели микробиологической и клинической эффективности проведенной терапии достоверно не отличались на протяжении всего времени наблюдения (18 мес).
Отмечено, что из 92 пациенток, первой подгруппы только одна не выполнила условий приема Сумамеда, приняв препарат во время еды. Среди 56,9% женщин второй подгруппы, получавших антибиотик в течение 3 дней, наблюдались колебания между временем приема препарата до 3,2 ± 0,6 часа. Не выполнили условий применения антибиотика, самостоятельно прекратив прием сумамеда 8 больных (15,7%).
Эрадикация возбудителя наблюдалась у 81,1% больных к моменту первого лабораторного контроля после лечения, а исчезновение клинической симптоматики у 85,3% женщин было достигнуто к 14 дню после окончания терапии.
Среди побочных эффектов на фоне приема Сумамеда у одной женщины возникла аллергическая реакция по типу крапивницы (в группе с однократным приемом антибиотика), а у 4 (7,8%) больных из 51, принимавших Сумамед на протяжении 3 дней, в течение недели была отмечена диарея.
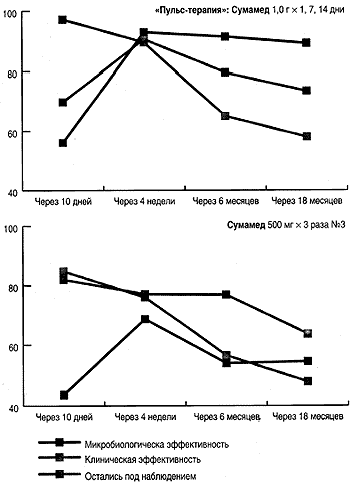
Рис. 2.
Клиническая и микробиологическая эффективность Су-мамеда для лечения урогенитального хламидиоза.
Наиболее существенные различия в эффективности терапии и соблюдении пациентами правил, режима и длительности приема препаратов были отмечены при лечении пер-систирующей хламидийной инфекции.
Так, микробиологическая и клиническая эффективность различных вариантов терапии урогенитального хламидиоза представлена на рис. 2.
Как видно на рис. 2, показатели микробиологической и клинической эффективности лечения персистирующего хламидиоза достигали максимальных значений к 4 неделям после окончания лечения. Только при проведении первого контроля клиническая эффективность превалировала над микробиологической. За 1,5 года показатели эффективности терапии урогенитальной хламидийной инфекции после использования «пульс-терапии» Сумамедом снижаются незначительно.
В то же время, при применении других схем приема антибиотика частота элиминации возбудителя встречается реже, чем клиническое излечение, а эффективность терапии не превышает 82%.
На фоне пролонгированных схем приема Сумамеда общая частота побочных явлений не превышала 3,7%, при этом до 3/4 из них отмечены среди женщин, использовавших непрерывный режим приема препарата.
Таким образом, азитромицин (Сумамед) обладает высокой эффективностью для лечения свежего неосложненного хламидиоза вне зависимости от схемы приема. Схему с однократным приемом препарата характеризует высокий комплаенс, низкая частота побочных реакций.
При лечении персистирующей хламидийной инфекции наибольшей клинической и микробиологической эффективности, удлинения времени безрецидивного промежутка, позволяет добиться «пульс-терапия» азитромицином (Сумамедом), включающая прием 1,0 г препарата на 1-7-14-й дни лечения. Создание терапевтических концентраций азитромицина (Сумамеда) в инфицированных тканях в течение 5-7 дней после однократного перорального его приема позволяет добиться эрадикации возбудителя и длительного сохранения антибактериального эффекта. При необходимости длительного приема препарата подобные его свойства определяют возможность дискретного назначения Сумамеда, что приводит к уменьшению побочных эффектов и повышению комплаентности проводимого лечения.
Лечение хламидийных уретритов у мужчин – почему азитромицин?
В течение последних лет в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем (ИППП), и уступает по частоте только трихомониазу. Такая же картина в ст
В течение последних лет в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем (ИППП), и уступает по частоте только трихомониазу. Такая же картина в странах Северной Америки и Европы, где урогенитальный хламидиоз уже много лет является самым распространенным бактериальным ИППП. Хотя доля Clamidia trachomatis (C. trachomatis) как этиологического агента в общей структуре уретритов у мужчин не превышает 50%, именно этот возбудитель остается главной причиной таких уретритов.
Классификация хламидийных инфекций. В принятой в большинстве стран мира международной классификации болезней Х пересмотра (МКБ-Х) урогенитальные хламидийные инфекции подразделяются:
1. На хламидийную инфекцию нижних отделов (неосложненную):
2. Инфекцию верхних отделов мочеполового тракта (осложненную):
Кроме этого, в МКБ-Х выделяют хламидийную инфекцию аноректальной области, хламидийные фарингиты, а также хламидийную инфекцию других локализаций.
Эта классификация более удобна для статистических отчетов, где требуется четкая рубрификация всех болезней. Специалисты нередко в клинической практике видоизменяют МКБ с целью большей адаптации ее для своей работы. Так, для назначения адекватной терапии хламидийных инфекций важно понять, какая из 3 форм урогенитального хламидиоза имеется у больного:
Клинические проявления хламидийной инфекции. Чаще всего у мужчин на практике встречается хламидийная инфекция нижних отделов урогенитального тракта — уретриты.
Уретриты, вызванные С. trachomatis, проявляются обычно скудной клинической симптоматикой, хотя могут сопровождаться и признаками острого воспаления, сходными с гонореей. Нередко инфицирование нижних отделов урогенитального тракта у мужчин хламидиями может протекать без какой-либо клинической симптоматики.
Наиболее частые проявления хламидийной инфекции нижних отделов урогенитального тракта у мужчин — это наличие слизисто-гнойных или слизистых необильных выделений из уретры, дизурии (зуда, жжения, болезненности при мочеиспускании), дискомфорт, зуд, жжение в области уретры. При клиническом обследовании у таких пациентов можно выявить гиперемию и отечность слизистой оболочки наружного отверстия мочеиспускательного канала, инфильтрацию стенок уретры, повышенный лейкоцитоз в материале из уретры.
Успешное излечение хламидийной инфекции во многом зависит от выбора правильной тактики терапии, поскольку ошибки на самом начальном этапе болезни, будь то диагностические ошибки или неадекватный выбор антибиотиков, могут привести к тому, что от инфекции избавиться не удастся, что грозит больному серьезными осложнениями.
К наиболее тяжелым осложнениям хламидийной инфекции относят: эпидидимиты, воспалительные заболевания органов малого таза (ВЗОМТ), бесплодие у лиц обоего пола, болезнь Рейтера, перигепатит, пельвиоперитонит, патологию плода и послеродовую патологию у матери, а также некоторые другие состояния. Их развитие может быть связано не только с хламидиями, но и с другими возбудителями, однако хламидии остаются наиболее частой причиной указанных осложнений.
Основным препаратом для лечения различных форм урогенитальной хламидийной инфекции вот уже более 10 лет является азитромицин. Все основные российские и зарубежные руководства — «Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем» (2005), «Дерматовенерология 2007» (клинические рекомендации Российского общества дерматовенерологов), клинические рекомендации CDC (Centers for Disease Control) (2006), Европейского Руководства по лечению инфекций, передаваемых половым путем (2001), — именно азитромицин относят к препаратам выбора для лечения урогенитального хламидиоза.
Азитромицин был синтезирован в 1983 г. в научно-исследовательском институте «Плива» (Хорватия). Тогда это был абсолютно новый антибиотик, созданный на основе эритромицина, и полученное в результате этого вещество с уникальной химической структурой и исключительными фармакокинетическими свойствами превзошло все показатели своего предшественника. Этот препарат стал первым представителем новой группы антибиотиков — азалидов.
Уникальность азитромицина базируется на его исключительной фармакокинетике. Азитромицин устойчив в кислой среде, благодаря чему хорошо всасывается после приема внутрь (Feise EF et al, 1990). Одновременный прием с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 ч до или через 2 ч после еды. Этого недостатка лишена таблетированная форма препарата, которая может приниматься независимо от приема пищи.
После приема внутрь 500 мг азитромицина биодоступность препарата составляет 37%, а максимальная концентрация в плазме (0,4 мг/л) достигается через 2–3 часа, затем она плавно снижается к 24 ч, в последующие сроки препарат в крови не определяется (Комаров Р.В. с соавт, 2001). Этого недостаточно для достижения терапевтического эффекта при лечении инфекций, сопровождающихся бактериемией. Однако липофильность молекулы азитромицина обеспечивает, помимо высокого уровня всасывания в кишечнике, еще и отличное проникновение препарата в ткани. Быстрое проникновение азитромицина из крови в ткани обеспечивается также низким уровнем связывания азитромицина с белками крови, что дает возможность достигнуть быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани (Foulds G et al, 1990).
Эффективность антибиотиков обычно оценивается путем сравнения активности в условиях in vitro (это показатель минимальной подавляемой концентрации (МПК) и концентрации препарата в сыворотке крови. Эти сравнения могут приводить к ошибочным представлениям о реальной эффективности антибиотика. Для ее оценки необходимо принимать во внимание еще и концентрацию препарата в тканях и месте воспаления. Именно эти показатели азитромицина обеспечивают ему превосходство. В различных тканях концентрации азитромицина в десятки раз превышают концентрации в сыворотке крови (рис. 1).
В эксперименте и исследованиях на животных было показано, что клинический и бактериологический эффекты макролидных антибиотков прямо зависят от времени превышения их концентраций над значениями МПК90 возбудителей, причем условием положительного эффекта является превышение концентрациями МПК в течение как минимум 40% интервала дозирования. Учитывая, что, по данным Комарова Р.В. и соавт. (2001), через 3 дня после приема концентрации азитромицина в секрете/ткани предстательной железы в 16,8 раза превышали значения МПК и, принимая это значение времени за 40%, можно прогнозировать сохранение эффекта азитромицина в течение как минимум 7 дней после однократного приема.
Для антибактериальных препаратов важен не только уровень накопления в тканях, но и соотношение тканевых концентраций и значений МПК для возбудителей инфекций. Так, концентрации азитромицина в секрете и ткани предстательной железы, представленные выше (рис. 1), превышали МПК90 для хламидий во все сроки наблюдения, вплоть до 2-х недель (в исследовании LeBell M. et al (1996)).
Полученные данные подтверждают возможность однократного применения азитромицина при неосложненной хламидийной инфекции, когда необходимо 7-дневное воздействие на микроорганизм, перекрывающее 2 жизненных цикла хламидий, а также его назначения короткими курсами с длительными интервалами между ними при осложненном и персистирующем хламидиозе.
Накопление препарата в макрофагах и полиморфноядерных лейкоцитах и транспортировка его с ними к месту воспаления дополняют нацеленное действие азитромицина в очаге инфекции. Показано, что концентрация препарата в месте воспаления в значительной степени превышает его концентрацию в здоровой ткани (Pukander J, 1990).
Способность азитромицина к проникновению внутрь клеток обеспечивает активное воздействие на внутриклеточные микроорганизмы, к которым относится С. trachomatis. При заболеваниях, вызываемых внутриклеточными патогенами, эффект лечения и скорость элиминации возбудителя из организма зависят от уровня концентраций антибиотика внутри клеток (полиморфноядерные лейкоциты, макрофаги, клетки эпителия). Среди всех антибиотиков макролиды характеризуются наибольшей способностью концентрироваться внутри клетки. Азитромицин при этом особенно привлекателен, поскольку соотношение концентраций антибиотика внутри клетки и в экстрацеллюлярном пространстве составляет для него 40 и более. По этому показателю азитромицин превосходит не только эритромицин, но и другие полусинтетические макролиды (Фомина И.П. с соавт., 1996).
В эксперименте установлено, что азитромицин накапливается в лейкоцитах с последующим медленным высвобождением. При этом соотношение внутри-/внеклеточных концентраций в полиморфноядерных лейкоцитах и макрофагах in vitro после 2 ч инкубации с антибиотиком составляет 79, превышая соответствующие показатели для эритромицина в 4–5 раз. Внутриклеточная концентрация азитромицина обнаруживается в течение 24 ч и более. Установлено также, что предварительная обработка клеток азитромицином не влияет на захватывающую, переваривающую и киллерную функции фагоцитов (McDonald P. J. et al, 1991). К дополнительным важным свойствам азитромицина, способствующим быстрой реализации терапевтического эффекта, даже при коротких схемах применения относится концентрация антибиотика в фибробластах, превращающихся в своеобразный резервуар, из которого препарат высвобождается в очаге инфекции (Glodue R. P. et al, 1990).
Еще одна важная особенность азитромицина — продолжительный период полувыведения — 68 ч, который приводит к тому, что высокие уровни концентрации в месте инфекции, сохраняющиеся в течение продолжительного периода времени (до 10 дней), обеспечивают постоянное активное воздействие на патогенные микроорганизмы (Andriole V. T., 1990, Retsema J., et al, 1990). Сокращение времени приема антибиотика при сохранении терапевтической эффективности очень важный принцип при амбулаторном лечении пациента. По данным различных авторов, только 65% больных полностью выполняют предписания врача. Почти половина лиц, получающих лечение как половые партнеры инфицированных пациентов, полноценно не выполняют режим терапии. По данным Grob P. R., 1992, в течение первых 3–5 дней лечения неисполнительность отмечается приблизительно в половине случаев, на 6–7 день ее уровень возрастает до 71–81%. По этим причинам предпочтение отдается сегодня схемам лечения, предусматривающим однократный или по крайней мере не очень частый прием лекарств. Длительный период полувыведения азитромицина из организма, сохранение эффективных концентраций в очаге инфекции в течение 4–5 дней после прекращения лечения позволяют проводить укороченные курсы терапии, которые соответствуют по эффективности 10-дневным курсам лечения традиционными антибиотиками (Фомина И.П. с соавт., 1996). Азитромицин остается единственным на сегодня антибиотиком однократного приема для лечения неосложненной хламидийной инфекции. Еще в 1993 г. Lister P. J. et al показали, что однократный прием 1,0 грамма азитромицина не уступает по эффективности 7-дневному курсу доксициклина. Большое удобство применения азитромицина для больных и возможность контроля за приемом однократной дозы со стороны медицинского персонала позволяют обеспечить практически 100%-ное соблюдение режима лечения (Petitta ABS et al, 1999).
Азитромицин метаболизируется в печени, причем 50% выделяется с желчью в неизмененном виде, около 6% выводится с мочой.
При приеме азитромицина могут наблюдаться побочные эффекты со стороны желудочно-кишечного тракта (тошнота, рвота, диарея) и печени (повышение активности трансаминаз, холестаз, желтуха), а также аллергические реакции.
Механизм действия азитромицина, как и других макролидов, обусловлен влиянием на функцию бактериальных рибосом. Препарат связывается с 50S субъединицей рибосом рибосомы и таким образом подавляет биосинтез белков микроорганизма, оказывая бактериостатическое действие. Бактерицидное действие препарата начинается в концентрациях, превышающих МПК в несколько раз.
Несмотря на представленные обширные данные, касающиеся фармакокинетики азитромицина, многие принципиальные аспекты взаимодействия хламидий и антибиотиков in vitro и in vivo остаются неясными. Поскольку хламидии являются внутриклеточными паразитами, оценка их антибиотикочувствительности возможна только на культуре клеток. Такие трудоемкие и уникальные тесты доступны далеко не во всех лабораториях. Например, в Москве эти исследования выполняются в медико-биологическом центре «Пастер». Лаборатория использует стандартизованную и хорошо изученную методику выявления хламидий в культуре клеток, включая труднокультивируемые персистирующие формы хламидий, а также обладает референсным штаммом хламидий, необходимым для контроля качества исследований. Однако четкой корреляции между результатами исследования чувствительности хламидий в культуре клеток и эффективностью лечения пока не установлено, что может быть связано со сложным жизненным циклом хламидий.
Азитромицин при уретритах нехламидийной этиологии. Азитромицин проявляет высокую активность не только в отношении хламидии, но и других инфекций, которые могут передаваться при сексуальных контактах: Ureaplasma urealyticum, Mycoplasma genitalium, Neisseria gonorrhoeae и Haemophilus ducreyi. Mycoplasma hominis в большинстве случаев резистентна к азитромицину.
Азитромицин активен также и в отношении грамположительной (St. aureus, St. epidermidis, включая штаммы, продуцирующие бета-лактамазы, различных видов стрептококков, за исключением штаммов, резистентных к макролидам, и энтерококков) и грамотрицательной флоры (Haemophilus influenzae, Moraxella catarrhallis и др). Эти микроорганизмы также могут быть обнаружены в мочеполовых путях, но их роль в возникновении уретрита не доказана.
Рекомендации по применению азитромицина при хламидийной инфекции. Для лечения больных хламидийной инфекцией нижних отделов урогенитального тракта все вышеназванные руководства в качестве метода выбора рекомендуют однократный прием азитромицина в дозе 1,0 грамм, за 1 ч до еды или через 2 ч после, если препарат используется в капсулах, или независимо от приема пищи при приеме таблеток. Другим препаратом выбора является доксициклин, который назначают по 100 мг 2 раза в сутки в течение 7 дней. К недостаткам азитромицина в сравнении с доксициклином можно было бы отнести более высокую стоимость азитромицина. Однако согласно результатам фармакоэкономических исследований, проведенных CDC, более высокая стоимость азитромицина в сравнении с доксициклином компенсируется снижением затрат, связанных с лечением ВЗОМТ, эктопической беременности и бесплодия, возникающими из-за неадекватной терапии, связанной с несоблюдением назначенной схемы лечения, что значительно чаще встречается при назначении доксициклина.
К преимуществам азитромицина перед доксициклином, помимо более высокой комплаентности лечения, относятся лучшая переносимость, а также возможность применения у подростков.
Многие годы достоверных данных о выделении штаммов C. trachomatis, устойчивых к макролидам, не было. Первое достоверное сообщение о выделении от 3 пациентов штаммов C. trachomatis, в отношении которых МПК азитромицина была выше 4,0 мкг/л было опубликовано в 2000 г. (Somani J. et al, 2000). Кроме устойчивости к азитромицину, у выделенных штаммов была выявлена также устойчивость к доксициклину и офлоксацину. Механизмы устойчивости С. trachomatis к макролидам пока не изучены, а ее выявление связано со значительными методическими трудностями. Механизм резистентности к азитромицину может быть генетически обусловлен метилированием рибосом бактерий, что препятствует связыванию азитромицина с субъединицами рибосом. При этом может наблюдаться перекрестная устойчивость к другим макролидам. Пока редкие сообщения об антибиотикорезистентности хламидий к азитромицину клинического значения не имеют и не привели к изменению существующих рекомендаций по лечению этим антибиотиком хламидийной инфекции.
Заключение. Таким образом, уникальные фармакокинетические характеристики азитромицина — продолжительный период полувыведения, высокий уровень всасывания и устойчивость в кислой среде, способность этого антибиотика транспортироваться лейкоцитами к месту воспаления, высокая и продолжительная концентрация в тканях, возможность проникновения внутрь клетки, а также простые схемы применения, высокая клиническая эффективность и комплаентность лечения, низкая токсичность сохраняют позицию азитромицина как основного препарата при лечении хламидийных уретритов у мужчин и другой патологии, связанной с хламидийной инфекцией.
Гомберг М. А., доктор медицинских наук
Соловьев А. М., кандидат медицинских наук
МГМСУ, Москва