четвертичная структура белка характерна для каких белков
Параграф 59. Четвертичная структура белков
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 59:
«ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ».
(См. сначала п.57 и 58, затем п.6)
Содержание параграфа 59:
59. 1. Четвертичная структура белков.
Глобулы (см. п.58) и фибриллы, имеющие третичную структуру,
могут соединяться (нековалентно обычно),
образуя комплексы.
Это и есть четвертичная структура белка.
Определение:
Четвертичная структура белка –
это соединение (комплекс)
из нескольких отдельных полипептидных цепей (ППЦ),
у каждой из которых обычно есть третичная структура.
Кратко: четвертичная структура – это комплекс глобул. Или нитей-фибрилл.
Термины:
При наличии у белка четвертичной структуры
(а она не у всех белков есть, характерна для регулируемых белков)
отдельную ППЦ (глобулу, например) называют СУБЪЕДИНИЦЕЙ
или протомером, или мономером
(но не путайте эти мономеры
с мономерами типа аминокислот в ППЦ или глюкозы в гликогене).
Комплекс субъединиц называют ОЛИГОМЕРОМ
(олиго- означает несколько).
Олигомеры из двух субъединиц называют димерами,
из четырёх – ТЕТРАМЕРАМИ,
из шести – гексамерами,
из восьми – октамерами.
Пример октамера – октамер гистонов,
на который «наматывается» дуплекс ДНК – п.73 и 74.
Примеры тетрамеров –
гемоглобин и протеинкиназа А
(в ассоциированном виде – п.6).
59. 2. Связи в четвертичной структуре.
Какие связи удерживают субъединицы в комплексе
и тем самым стабилизируют четвертичную структуру (олигомер)? –
Те же самые, что и третичную,
кроме дисудьфидных –
ковалентные связи не характерны для четвертичной структуры,
поскольку важно, чтобы субъединицы могли соединяться и разъединяться.
Те же самые – то есть ионные, водородные и т.д.
59. 2. Положительная и отрицательная кооперативность в олигомерах.
Субъединицы могут влиять на конформацию других субъединиц олигомеров
и за счёт этого –
менять активность субъединиц –
активировать или инактивировать их.
Это влияние одних субъединиц на активность других субъединиц олигомера
называется КООПЕРАТИВНОСТЬЮ.
Активация субъединицы другой субъединицей (при связывании с ней)
называется ПОЛОЖИТЕЛЬНОЙ кооперативностью,
а инактивация субъединицы другой субъединицей
называется ОТРИЦАТЕЛЬНОЙ кооперативностью.
Примеры. –
59. 2. 1. Пример положительной кооперативности.
Молекула гемоглобина состоит из четырёх субъединиц,
то является тетрамером.
Субъединицы гемоглобина активируют друг друга
(то есть в тетрамере гемоглобина наблюдается положительная кооперативность)
– благодаря этому активность тетрамера в 400 раз выше,
чем активность отдельной субъединицы
или чем активность молекулы миоглобина, у которой есть только одна субъединица.
(Миоглобин – это белок мышц.
Он тоже связывает кислород, как и гемоглобин,
но глобулы миоглобина не образуют олигомеры).
Есть группа ферментов, которые катализируют фосфорилирование белков
и называются протеинкиназами.
Одна из них называется протеинкиназой А (ПК А).
Молекула протеинкиназы А (см. п.6 и 95) тоже является тетрамером,
то есть состоит из четырёх субъединиц, как и гемоглобин.
Две субъединицы ПК А
способны катализировать реакцию
(фосфорилировать белки)
и поэтому называются КАТАЛИТИЧЕСКИМИ.
А две другие субъединицы протеинкиназы А
не катализируют реакции,
их функция – регулировать активность каталитических,
поэтому они эти субъединицы называются РЕГУЛЯТОРНЫМИ.
Когда регуляторные субъединицы связаны с каталитическими,
то каталитические не могут работать –
так как регуляторные их инактивируют
(то есть регуляторные являются ингибиторами каталитических),
поэтому тетрамер протеинкиназы не активен.
Кооперативность в протеинкиназе А отрицательная.
Каталитические субъединицы могут работать только тогда,
когда регуляторные отсоединяются от них.
Отсоединение регуляторных от каталитических
(и в итоге активация протеинкиназы А)
происходит тогда,
когда с регуляторными субъединицами связывается цАМФ.
Поэтому цАМФ считается активатором протеинкиназы А.
Таким образом, при положительной кооперативности олигомеры активнее субъединиц,
а при отрицательной кооперативности олигомеры не активны.
59. 3. Олигомерные белки
и полибелковые комплексы (полиферментные комплексы).
Олигомерные белки – это белки, которые образуют олигомеры.
О них выше.
Некоторые белки образуют комплексы из множества ППЦ (обычно глобул).
Это и есть полибелковые комплексы.
Если это комплекс ферментов, то он называется полиферментным комплексом.
Пример такого комплекса – пируват/дегидрогеназный комплекс (ПДГ),
катализирующий превращение пирувата в ацетилКоА (п.32, 20).
В этом комплексе объединены ферменты,
которые катализируют последовательность реакций.
Что даёт объединение белков в комплекс? – повышение эффективности работы.
Глобулы отдельных ферментов передают друг другу метаболиты, работая как конвейер.
Четвертичная структура белка характерна для каких белков
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помоши водородных и ионных связей.
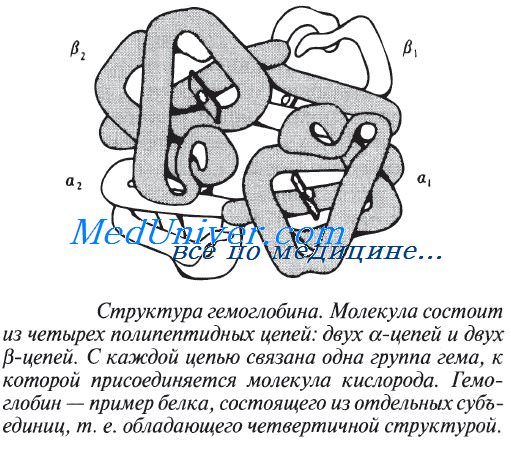
Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Четвертичная структура имеется, например, у гемоглобина — содержащегося в эритроцих позвоночных красного пигмента, связывающего и переносящего кислород.
Молекула гемоглобина состоит из четырех отдельных полипептидных цепей двух разных типов: из двух а-цепей и двух бета-цепей. Цепи эти по своему строению напоминают полипептидную цепь миоглобина. Две отцепи содержат по 141 аминокислотному остатку, а две (3-цепи — по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц.
Как и у других глобулярных белков, гидрофобные боковые цепи гемоглобина скрыты внутри молекулы, а гидрофильные выставлены наружу, что делает гемоглобин растворимым в воде. Мутация, вызывающая замену одной из гидрофильных аминокислот на гидрофобную и тем самым снижающая растворимость гемоглобина, служит причиной болезни, известной как серповидноклеточная анемия.
Некоторые вирусы, например вирус табачной мозаики, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом.
– Вернуться в оглавление раздела “Биология.”
Четвертичная структура белка: ее характеристика, особенности и функционирование, специфика олигомерных белков
Четвертичная структура белка
Особенности четвертичной структуры
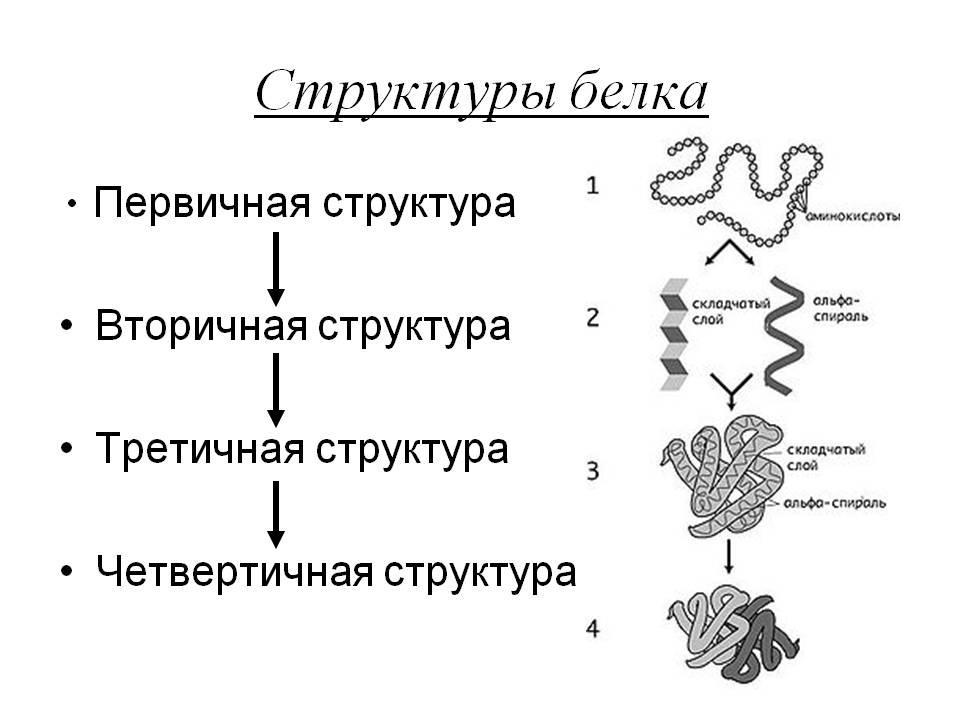
Четвертичная структура белка — это вариант того, как в пространстве укладываются отдельные полипептидные цепи, обладающие разной (может быть, одинаковой) первичной, вторичной и третичной структурой.
Вторичная структура белка представляет собой складчатый слой (альфа-спираль).
Почти все белковые молекулы могут сохранять свою биоактивность. Это значит, что они выполняют свойственные им функции исключительно в узком температурном диапазоне и в узком диапазоне кислотности среды.
В случаях, когда температура повышается или кислотность изменяется до экстремальных показателей, при добавлении гидрофобных агентов, к примеру, органических растворителей, увеличении концентрации солей, происходит изменения в структуре белков. Эти изменения становятся причиной денатурации — белок теряет свою естественную пространственную структуру.
При этом, разрушения первичной структуры белка не происходит.
Если исходить из структуры, то четвертичная структура белка — макромолекула. Множество функциональных белков состоит из полипептидных цепей, соединенных друг с другом несколькими главновалентными цепями. При этом ковалентные связи не наблюдаются.
Отдельную полипептидную цепь называют протомером, мономером или субъединицей, которая не отличается высокой функциональной активностью.
Эта способность появляется у белка при определенном варианте пространственного объединения мономеров. В результате возникает новое качество, не характерное для мономерного белка. Образующаяся в итоге молекула называется олигомером.
Специфика олигомерных белков
У олигомерных белков отмечаются следующие свойства:
К примеру, молекула гемоглобина включает две альфа- и две бета-полипептидные цепи. У этой молекулы форма тетрамера: это значит, что в ее состав входят 4 полипептидные цепи, регулярно взаимодействующие.
Каждая из этих цепей окружает специализированную группу гема-пигмента, которые отвечает за окрашивание крови в красный цвет. Молекула гемоглобина может подвергаться обратной диссоциации при определенных условиях. Формирование такого процесса происходит в результате влияния разрыва водородных связей. В случае, если мочевина и соли удаляются, исходная молекула гемоглобина подвергается автоматической ассоциации.
Стандартный пример олигомерной молекулы — вирус табачной мозаики, отличающийся гигантской молекулой. Длина этого вируса достигает 300 нм. Белковые частицы со спиралеобразной структурой (в ней содержится свыше 130 витков) нанизываются вокруг молекулы РНК.
У вируса есть невероятная способность: полная регенерация или восстановление четвертичной структуры. При этом наблюдается восстановление всех ее физических параметров и биологических функций.
Особенности функционирования четвертичной структуры
Внутри последовательности аминокислот есть информация, реализуемая на всех уровнях организации структуры молекулы белка.
У многих ферментов отмечается четвертичная структура. К примеру, фосфорилаза состоит из двух идентичных субъединиц, которые, в свою очередь, состоят из двух пептидных цепей. Из этого следует, что молекула — тетрамер. У отдельных субъединиц не наблюдается особенная каталитическая активность.
У любого регуляторного фермента — четвертичная структура и высокая скорость требуемых химических реакций в клетке.
Четвертичная структура белка довольно стабильна, хотя в отдельных случаях подвергается денатурации и последующему восстановлению (если выполняются некоторые условия вроде температуры, наличия катализаторов и др).
Характеристики четвертичной структуры белка
Для нескольких сотен белков четвертичная структура полностью расшифрована, хотя остается еще много белков с нерасшифрованной структурой. У этой структуры есть определенные характеристики:
Все вышеописанное позволяет говорить о существовании четвертичной структуры белка низшего порядка. У каждого белка — собственная уникальная структура и специализированные функции. Если человек постигнет структуру всех белков, то это даст возможность понять, как функционируют живые организмы. В результате такого научного поиска:
Некоторые ученые считают, что существует пятый уровень организации структуры белка. Имеются в виду полифункциональные макромолекулярные комплексы.
Ассоциат представляет собой макромолекулярный белковый комплекс.
В этом случае ферменты — метаболоны и олигомеры. Они отвечают за катализацию всего пути превращений субстрата в синтетазы высших кислот, дыхательную цепь и пируватдегидрогеназный комплекс.
Говоря о структуре белка кратко, на основе описанного выше, можно утверждать, что взаимодействие между отдельными молекулами внутри четвертичной структуры белка открывает возможности для изменений ее пространственной структуры.
Конформация — расположение атомов и групп молекул органического вещества, которое обусловлено возможностями вращения этих молекул вокруг ковалентных связей.
Эти изменения — основа биологической активности белковых полимеров.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Третичная и четвертичная структура белка
Содержание
Третичная структура белка [ править | править код ]
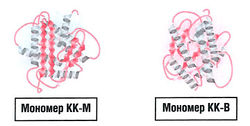
Третичная структура белка — это взаимное расположение в пространстве β-цепей, β-складчатых слоев и а-спиралей. Примеры различных способов укладки — мономеры креатинкиназы КК-М и КК-В (рис. 8.1).
Четвертичная структура белка [ править | править код ]
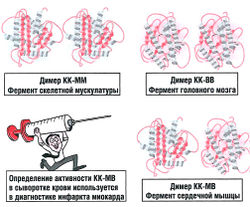
Многие белки состоят из нескольких полипептидных цепей, которые связаны нековалентными связями. Мономером называется один отдельный белок, состоящий из одной полипептидной цепи. Когда мы говорим о четвертичной структуре белка, это означает, что в его состав входят несколько мономеров: 2 мономера образуют димер (рис. 8.2), три — тример, четыре — тетрамер и т.д. Олигомеры состоят из большого числа мономеров.
Коллаген [ править | править код ]
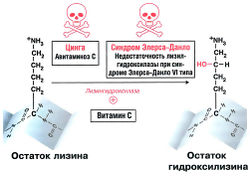
При кипячении соединительная ткань превращается в желатин, который можно использовать как клей. Отсюда и возникло название «коллаген» (по-гречески «kola» значит «клей»). На настоящий момент известно 19 разных типов коллагена. Коллагены — структурные белки соединительной ткани, самые многочисленные белки человеческого организма. Коллагены по-разному распределены в организме: так, коллаген I типа содержится главным образом в связках, сухожилиях и коже, а коллаген II типа — в хрящевой ткани. Структурные единицы коллагена — а-спирали, которые скручиваются в тройную спираль. В первичной последовательности коллагена повторяется мотив -Гли-X-Y-. В этой последовательности X обычно представлен пролином. На месте Y чаще всего находится остаток пролина, гидроксилированный в витамин С-зависимой реакции: таким образом, Y представляет собой остаток гидроксипролина. В других случаях Y может быть представлен остатком гидроксилизина (рис 8.3). Глицин — необходимый компонент коллагена. Это самая маленькая аминокислота: ее радикал R представлен лишь одним атомом водорода. Пространство в тройной спирали ограничено, и другие, более крупные, молекулы аминокислот просто не могли бы там поместиться.
Биосинтез коллагена [ править | править код ]
Коллаген — нерастворимый гликопротеин внеклеточного матрикса. Каким же образом фибробласты — клетки, синтезирующие коллаген, образуют нерастворимый внеклеточный белок? Все дело в том, что синтез коллагена осуществляется в 2 стадии: внутриклеточной и внеклеточной (рис. 8.4).
На внутриклеточной стадии происходит синтез проколлагена
Сначала внутриклеточный белковый аппарат синтезирует полипептидные а-спирали (длиной примерно в 1000 аминокислот). Некоторые из остатков пролина и лизина гидроксилируются в ходе реакций, для которых необходим витамин С. Некоторые остатки гидроксилизина гликозилируются. Потом а-спирали объединяются, сплетаясь друг с другом, и образуют тройную спираль проколлагена, который является растворимым белком.
На внеклеточной стадии формируются коллагеновые волокна
Проколлаген секретируется клеткой во внеклеточную жидкость. Фермент проколлагенпептидаза удаляет глобулярные пропептиды с N- и С-концевых участков молекул проколлагена, и образуется нерастворимый тропколлаген. Молекулы тропоколлагена объединяются в микрофибриллы, причем они располагаются в шахматном порядке так, что каждая молекула тропоколлагена перекрывается с соседними на четверть своей длины. Наконец, в присутствии лизиноксидазы остатки лизина и гидроксилизина реагируют друг с другом, формируя поперечные связи, что придает микрофибрилле прочность на растяжение, и микрофибриллы объединяются в одно полимерное коллагеновое волокно.