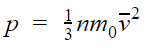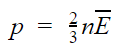что такое газ и какими свойствами обладает
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
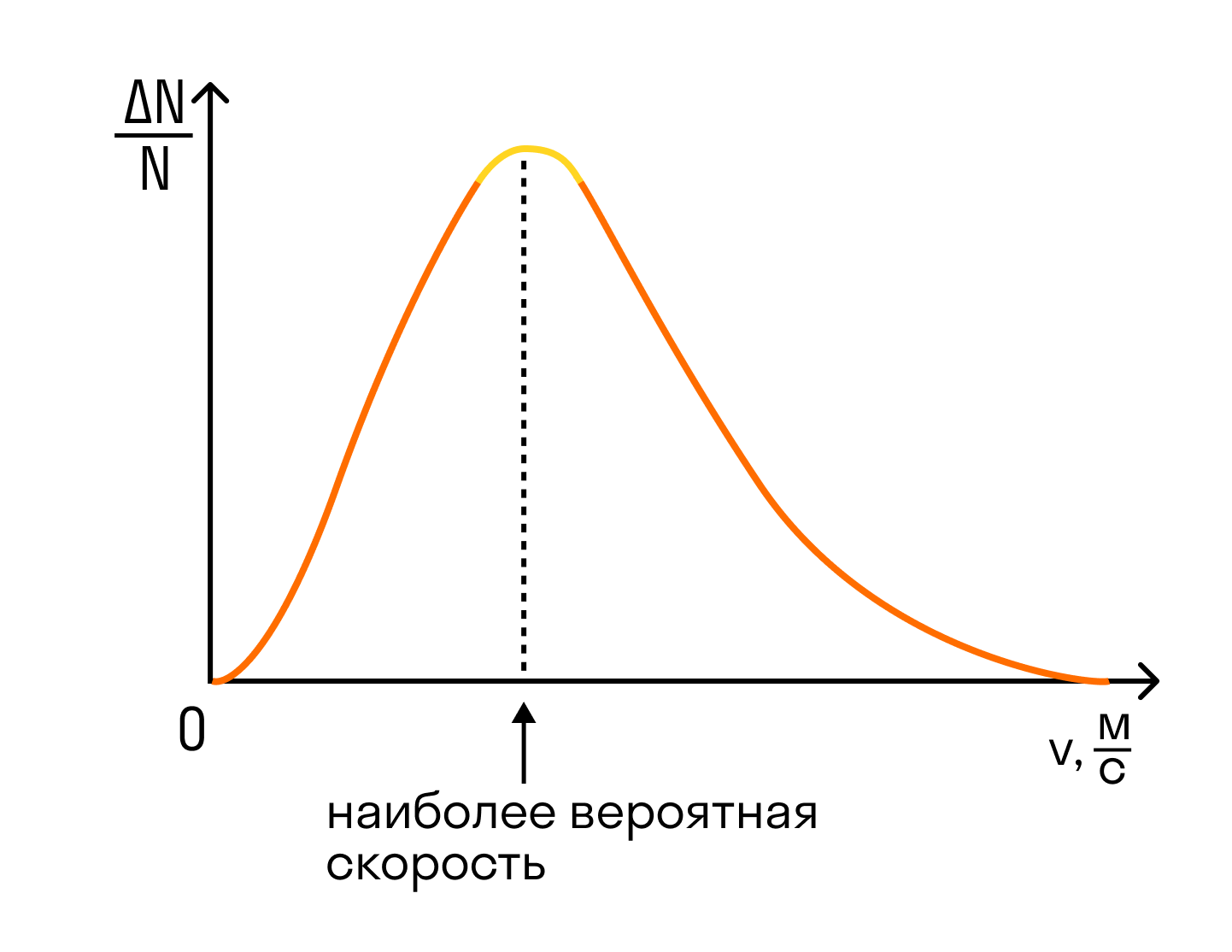
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
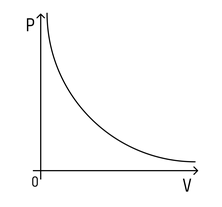
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
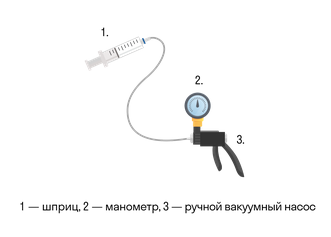
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
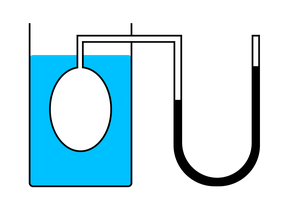
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
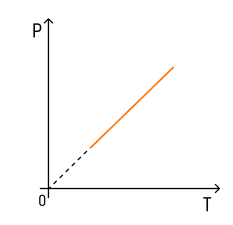
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Бесплатный марафон: как самому создавать игры, а не только играть в них (◕ᴗ◕)
Записаться на марафон
Бесплатный марафон: как самому создавать игры, а не только играть в них (◕ᴗ◕)
ГАЗ (состояние вещества)
Полезное
Смотреть что такое “ГАЗ (состояние вещества)” в других словарях:
ЭКСТРЕМАЛЬНОЕ СОСТОЯНИЕ ВЕЩЕСТВА — состояние с аномально высокой концентрацией энергии, возникающее под воздействием высоких давлений и (или) температур. Физика Э. с. в. (физика высоких плотностей энергии) охватывает физику давлений высоких и физику плазмы, составляя важную часть… … Физическая энциклопедия
Газы (агрегатное состояние вещества) — Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им… … Большая советская энциклопедия
ГАЗ — (фр. gaze). Легкая прозрачная ткань из шелка или льна; название свое получила от сирийского гор. Gaza, где впервые была приготовлена. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГАЗ (франц. gaz, от нем. gaschen … Словарь иностранных слов русского языка
газ — 1. ГАЗ, а ( у), предл. на газе; (разг.) на газу; м. [франц. gaz] 1. Физическое состояние вещества, при котором его частицы (атомы и молекулы) движутся свободно и обладают способностью распространяться и заполнять доступное пространство; вещество … Энциклопедический словарь
газ — сущ., м., употр. сравн. часто Морфология: (нет) чего? газа и газу, чему? газу, (вижу) что? газ, чем? газом, о чём? о газе и на газу; мн. что? газы, (нет) чего? газов, чему? газам, (вижу) что? газы, чем? газами, о чём? о газах 1. Газ это… … Толковый словарь Дмитриева
Газ (значения) — Газ: Газ агрегатное состояние вещества. Газ просторечное обозначение природного газа и систем его подачи. Газ лёгкая прозрачная ткань. ГАЗ аббревиатура от Горьковский автомобильный завод. «Группа ГАЗ» российская… … Википедия
ГАЗ — ГАЗ, состояние (ФАЗА) ВЕЩЕСТВА, при котором молекулы свободно движутся в любых направлениях; газ всегда распространяется (путем ДИФФУЗИИ) по резервуару любого размера, стремясь заполнить его полностью. В силу низкой плотности, основная масса… … Научно-технический энциклопедический словарь
ГАЗ — (французское gaz, от греческого chaos хаос), агрегатное состояние вещества, в котором энергия движения его частиц (атомов, молекул) значительно превышает энергию их взаимодействий. Таким образом, частицы газа движутся свободно (между… … Современная энциклопедия
Газ — (французское gaz, от греческого chaos хаос), агрегатное состояние вещества, в котором энергия движения его частиц (атомов, молекул) значительно превышает энергию их взаимодействий. Таким образом, частицы газа движутся свободно (между… … Иллюстрированный энциклопедический словарь
ГАЗ — (франц. gaz от греч. chaos хаос), агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы… … Большой Энциклопедический словарь
Что такое газ и какими свойствами обладает
ГАЗЫ (франц. gaz; назв. предложено голл. учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в к-ром его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Г. образуют атмосферу Земли, в значит, количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из Г.- нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях Г. представляют собой, как правило, смеси химически индивидуальных Г.
Физические свойства газов
Углекислый газ СО2
Плотность при 0°С и 1 am* (кг/м 3 )
Теплоёмкость при постоянном объёме Сv и 0°С (кдж/моль*град)
Скорость звука при 0°С (м/сек)
Вязкость л при 0 0 С (n* 10 6 н*сек/м 2 )
Теплопроводность ламбда при 0°С (лямбда*10 2 дж/м*сек* град)
Диэлектрич. проницаемость эпсилон при 0°С и 1 am*
Удельная магнитная восприимчивость х при 20°С (капа*10 6 на 1 г)
При темп-рах ниже Ткможно сконденсировать Г.- перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение Г. в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (напр., плотности, энтальпии, теплоёмкости и др.). Процессы конденсации Г., особенно сжижение газов, имеют важное техническое значение.
При Т>ТК граница газообразной области условна, поскольку при этих темп-рах фазовые превращения не происходят. В ряде случаев за условную границу между Г. и жидкостью при сверхкритич. темп-pax и давлениях принимают критич. изохору вещества (кривую постоянной плотности или удельного объёма, см, рис. 1), в непосредств. близости от к-рой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
С другой стороны, при высоких давлениях вещество, к-рое при сверхкритич. темп-pax можно считать Г., обладает огромной плотностью (напр., в центре нек-рых звёзд
10 9 г/см 3 ). В зависимости от условий в широких пределах изменяются и др. свойства Г.- теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория Г. Молекулярно-кинетическая теория рассматривает Г. как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетич. теории удаётся объяснить осн. физич. свойства Г., особенно полно – свойства разреженных Г.
У достаточно разреженных Г. средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, напр., при нормальных условиях в 1 см 3 Г. находится
10 19 молекул и среднее расстояние между ними составляет
100А, тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5-10А. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10-20 раз меньше среднего расстояния между молекулами, так что общий объём, в к-ром эти силы могут сказываться (как бы “собственный объём” всех молекул), составляет 10
4 от полного объёма Г. Это позволяет считать собств. объём молекул Г. в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы к-рого рассматриваются как не взаимодействующие друг с другом материальные точки, наз. идеальным. При тепловом равновесии
идеального Г. все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведён график этого распределения для азота при темп-рах 20 и 500°С. Из графика видно, что подавляющее большинство
молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной темп-ре), но существует также изностная часть молекул с малыми и очень большими скоростями. При помощи максвеллов-ского распределения может быть определена т. н. средняя квадратичная скорость молекул связанная с темп-рой Т газа соотношением
Поскольку молекулы идеального Г. обладают лишь кинетич. энергией, внутренняя энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля).
Молекулярно-кинетич. теория рассматривает давление Г. на стенки сосуда, в к-ром он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
Ур-ние (4), записанное для 1 моля Г., содержащего N = 6,023*10 23 молекул (см. Авогадро число), называют Клапейрона уравнением:
В условиях теплового равновесия темп-pa и давление Г. по всему его объёму одинаковы, молекулы движутся хаотично, в Г. нет упорядоченных потоков. Возникновение в Г. перепадов (градиентов) темп-ры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физич. величин.
К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критич. точки, относится вириалъное уравнение состояния:
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэфф. являются функциями только темп-ры.
В Г. малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэфф. В. В соответствии с температурным изменением В, при т. н. темп-ре Бойля ТВ (см. Бойля точка) В обращается в нуль, и умеренно плотный Г. ведёт себя как идеальный, т. е. подчиняется ур-нию (5). Физически это означает, что при ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г. Внутр. энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
Внутреннее строение молекул Г. слабо влияет на их термич. свойства (давление, темп-ру, плотность и связь между ними). Для этих сврйств в первом приближении
существенна только молекулярная масса Г. Напротив, калорич. свойства Г. (теплоёмкость, энтропия и др.), а также его электрич. и магнитные свойства существенно зависят от внутр. строения молекул. Напр., для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме cv необходимо знать число внутр. степеней свободы молекулы (т. е. число возможных внутр. движений) iвн. В соответствии с равнораспределения законом классич. статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная 1/2*kT. Отсюда теплоёмкость 1 моля
Для точного расчёта калорич. свойств Г. необходимо знать уровни энергии молекулы, сведения о к-рых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорич. свойства вычислены с высокой точностью и их значения представлены в виде таблиц до темп-р 10-22 тыс. градусов.
Электрич. свойства Г. связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Г. электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается. Зависимость электропроводности Г. от различных физич. факторов рассмотрена в ст. Электрический разряд в газах.
При темп-pax начиная с неск. тыс. градусов всякий Г. частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного Г.
По магнитным свойствам Г. делятся на диамагнитные (к ним относятся, напр., инертные газы, Н2, N2, CO2, Н2О) и парамагнитные (напр., О2). Диамагнитны те Г., молекулы к-рых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля (см. Диамагнетизм). Те же Г., у к-рых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. Парамагнетизм).
Учёт межмолекулярного взаимодействия и внутр. строения молекул необходим при решении многих проблем физики Г., напр, при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см. Газовая динамика, Аэродинамика разреженных газов).
Лит.: Кириллин В. А., Сычёв В. В. и Ш ейндлин А. Е., Техническая термодинамика, М., 1969; Кикоин И. К. н Кикоин А. К., Молекулярная физика, М., 1963; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов н жидкостей, пер. с англ., М., 1961; Термодинамические свойства индивидуальных веществ. Справочник, под ред. В. П. Глушко, 2 изд., т. 1-2, М., 1962.
Смотреть что такое ГАЗЫ в других словарях:
— тела, характеризующиеся стремлением наполнять любое пространство и лишенные собственной формы. Учение о Г. представляет блестящую страницу современного естествознания. Казавшаяся некогда неуловимой форма тела, по понятиям древних занимавшего среднее место между веществом и духом, оказалась подчиняющейся наиболее простым законам и послужила к установке основных законов вещества. Убеждение в вещественности Г. открывает новую, современную эру естествознания. Оно явилось прежде всего по отношению к воздуху, когда было доказано, что воздух имеет вес, т. е. обладает основным признаком вещества. Лишь в половине XVII века опытами Торичелли и Паскаля было доказано, что поднятие жидкостей в пустоте обуславливается не “боязнью пустоты”, а весом воздуха. Эти опыты положили начало исследованиям газов. Вскоре за тем последовали наблюдения Бойля, показавшие, что объем воздуха находится в весьма простой зависимости от давления, производимого им на оболочку. В то же время появились первые указания на то, что воздух не есть единственный представитель Г., обнаруживающий различия в своих свойствах, лишь вследствие “порчи”. Голландец ван Гельмонт в том же XVII веке впервые констатировал различия воздухообразных веществ и ввел слово газ. Но систематическое изучение Г. начинается лишь с половины XVIII века исследованиями Блека над углекислотой, положившего начала “пневматической химии”, т. е. химии Г. Работы Кавендиша и Пристлея в значительной степени обогатили эту область открытиями новых Г. и усовершенствованием приемов исследования Г.; но истинная роль Г. в химических превращениях веществ была разгадана лишь Лавуазье. Ему удалось с очевидностью доказать, что видимые нарушения закона сохраняемости вещества происходят лишь оттого, что мы не видим Г., принимающих участие в химических превращениях. Истина, столь простая теперь и выражавшаяся не раз в древности, стала законом только тогда, когда было доказано, что ему подчиняются все формы вещества.Без тех опытных доказательств, которые даны были Лавуазье исследованием участия газа в химических явлениях и особенно в явлениях горения, закон сохраняемости вещества не мог бы проникнуть в общее сознание, так как именно в явлениях горения мы видим поразительнейшие образчики кажущегося исчезания веществ. Для Лавуазье уже было ясно, что Г. представляют лишь временную форму, или состояние, вещества. Он предполагал, что при достаточном охлаждении все Г. должны обращаться в жидкое и даже твердое состояние. Этому предположению Лавуазье суждено было осуществиться окончательно лишь в недавнее время. В 1878 г. двум ученым, Пикте и Кальете, почти одновременно, удалось сгустить самые “постоянные” из газов — водород, кислород и азот. Учение о Г., как о состоянии, или временной, форме вещества, было, таким образом, фактически закончено, а пройденный в их изучении путь оказался в высшей степени плодотворным для всего учения о веществе. Задачи физики и химии на этом поприще сошлись и привели к одному общему приему выражения свойств вещества. Путем совокупного изучения физики и химии Г. обоснована современная атомическая теория. Атомическая теория древних, бывшая лишь фигуральным представлением вещества, обратилась в настоящую теорию благодаря, главным образом, изучению Г. Как состав химических соединений, так и основные свойства Г. удалось простым образом выразить, исходя из одного и того же представления о неделимой массе, о неизменном весе. Атом, не будучи и теперь обязательным как представление, стал обязательным как величина, определяющая свойства тел. Изучение законов Г. дало возможность определить эти величины, устранив произвол, и сверх того, привело к необходимости принять две категории атомов: атомы и частицы. Каждая из этих величин является неизменной и постоянной в определенном классе явлений, и обе связаны между собой законом кратности. Сущность современной атомической теории выразилась не в неделимости атомов, а в неизменной их величине, характеризующей определенный класс явлений. В дальнейшем мы опишем свойства Г. и изложим основания теории Г., имея в виду, главным образом, связь между свойством Г. и величиною атомов и частиц.
(или вес единицы объема Г.) может быть определена лишь условно, ибо зависит от давления, под которым находится Г., и при нулевом давлении предполагается равной нулю. По закону Бойля-Мариотта, объем, занимаемый газом, обратно пропорционален давлению, т. е.
или vp = v 1 p 1 = постоянной величине.
Следовательно, плотность d газа прямо пропорциональна давлению, т. е.
Принято называть удельным весом газа вес единицы объема Г. при 0° и при “нормальном давлении”. Нормальное давление соответствует давлению столба ртути в 760 мм высоты. Так как это давление меняется с переменой напряжения силы тяжести, то нормальная высота столба ртути будет различна в разных широтах а на различной высоте над уровнем моря, что должно быть принято во внимание при сличении наблюдений разных мест. При указанных нормальных условиях плотность Г. очень мала сравнительно с плотностью твердых и жидких тел. Так, удельный вес воздуха (вес куб. см) равен 0,0012932 г. Чаще всего плотность газов выражают относительно, причем за единицу сравнения принимают уд. вес воздуха при одинаковых условиях.
Г. имеет в виду прежде всего объяснить безграничную (по-видимому) способность Г. к расширению и происходящее оттого давление на стенки оболочки. Это основное свойство Г. объясняли первоначально присущей частицам Г. отталкивательной силой. Такое объяснение противоречит, однако, закону сохранения энергии. В опытах расширения Г., не сопровождающегося внешней работой (см. рубрику теплоемкость Г.), не только не наблюдается выделение тепла, как необходимый эквивалент работы отталкивательных сил, но происходит поглощение тепла (незначительное), указывающее на притягательные силы. Давление Г. на стенки сосуда можно объяснить, и самый закон Бойля-Мариотта легко предвидеть, если предположить, что газ состоит из упругих “частиц”, свободно движущихся в пространстве. По совокупности современных сведений мы должны принять внутреннее движение вещества, свободное же движение отдельных масс вещества, частиц, можно допустить при малой плотности вещества. Взаимное притяжение весомых масс уменьшается с расстоянием. При весьма большом расстоянии между этими массами, т. е. при малой плотности тела, действие притягательных сил становится ничтожным, и движение частицы становится свободным, т. е. прямолинейным и с постоянной скоростью. Предполагая, что Г. находятся в таких условиях, нетрудно видеть, что давление, произведенное ударами его частиц, должно быть пропорционально числу частиц, находящихся в данном объеме, т. е. пропорционально плотности. Это давление зависит, таким образом, от скорости частиц и от общей массы частиц, то есть от плотности газа. Поэтому, не зная массы отдельной частицы, но зная плотность газа, можно все же вычислить, какою скоростью должны обладать частицы, чтобы производить на стенки сосуда наблюдаемое давление. Вычисление дает следующую формулу для скорости:
где р — давление Г., d — плотность его, отвечающая данному давлению, и С — скорость поступательного движения частиц. Если р — нормальное давление, то d — удельный вес газа, поэтому для двух газов:
т. е. скорости обратно пропорциональны корням квадратным из плотностей. Наибольшая скорость должна, следовательно, принадлежать частицам легчайшего Г. — водорода. Вычисление дает для скорости движения частиц водорода при 0° громадную величину — 1843 метра в секунду. Скорость движения частиц кислорода в 4 раза меньше, чем водорода, ибо плотность кислорода в 16 раз больше плотности водорода и т. п.
По закону Грема (Graham), при равных давлениях скорости истечения Г. обратно пропорциональны корням квадратным их плотностей. Следовательно, по предыдущему, скорости истечения Г. пропорциональны скоростям движения частиц. Закон Грема приложим только к случаям истечения газа через отверстия в тонкой стенке, в противном случай к явлению примешивается трение, о котором речь будет впереди.
имеющих одну и ту же температуру, происходит без заметного изменения температуры, а давление смеси равно сумме давлений каждого из газов. Каждый Г. производит давление такое же, как если бы он один наполнял пространство, занимаемое смесью. Г. относятся друг к другу, как к пустоте. Это свойство Г. вполне согласуется с допущением свободного движения их частиц.
связана с весьма простыми изменениями объема и давления. По закону Гей-Люссака, все Г. при постоянном давлении обнаруживают одинаковое изменение объема при одинаковом изменении температуры. Эта зависимость выражается при постоянном давлении таким образом:
где V объем — газа при температуре t, V 0 — объем его при 0° и α коэффициент расширения, или при постоянном объеме
Число частиц в единице объема.
где αе — прирост энергии (в тепловых единицах) поступательного движения частиц, выражающейся в давлении Г., а r — внешняя работа расширения Г. (в тепловых единицах). При указанном допущении легко вывести, что отношение теплоемкостей
должно равняться 1,66 (5/3).
Неполнота теории. Диффузия, теплопроводность и трение Г. —
В изложенных выше положениях теории шла речь исключительно о скорости поступательного движения частиц и их относительном весе. Величины скоростей оказались громадными. Многие явления, свойственные Г. при таких величинах скоростей, не могут быть объяснены, ограничиваясь только установленными выше положениями. Таковы явления диффузии и теплопроводности Г. Смешение Г., или диффузия их друг в друга, совершается весьма медленно, а между тем при громадной скорости движения частиц, казалось бы, что проникание Г. друг в друга должно происходит почти мгновенно. То же можно сказать и о теплопроводности Г. Передача тепла от нагретой части Г. соседним должна была бы совершаться также почти мгновенно, ибо частицы газа с повышенной энергией должны бы весьма скоро рассеяться во всей массе Г. На деле же такая передача совершается весьма медленно. Необходимо, следовательно, допустить какое-то препятствие свободному движению частиц газа в пространстве. Это препятствиe могут представлять взаимные столкновения частиц. Столкновения должны были бы происходить, однако, чрезвычайно редко, если бы частицы были бесконечно малы, т. е. являлись бы точками. Медленность диффузии и малая теплопроводность Г. показывают, что столкновения должно признать чрезвычайно частыми, а, следовательно, отождествлениe частиц с материальными точками не отвечает действительности. Необходимо допустить, что масса вещества, представляющая частицу, владеет известным объемом, в который не проникает никакая другая частица при их взаимных столкновениях. Движениe частиц Г. является, следовательно, не свободным, а ограничивается определенной длиной пути, проходимой частицей без столкновения с другой. Изложенные соображения не только заставляют признать за частицами известный объем, но могут служить основанием для вычисления и средней длины пути. Опираясь на эти соображения, можно предвидеть связь между явлениями диффузии и теплопроводностью Г. и, сверх того, еще более отдаленную связь между явлениями диффузии и внутренним трением Г. Внутреннее трение (см. Вязкость) газов незначительно, и подвижность их весьма велика. Легко заставить слои Г. “скользить”, заставить Г. “течь”. Вызвать некоторую разность скоростей в двух соседних плоскостях газа было бы, однако, чрезвычайно трудно, если бы частицы мгновенно проникали бы из одного слоя в другой. При таком условии движение, сообщенное части Г., весьма быстро должно было бы передаваться всей массе, ибо частицы движущейся массы Г. при громадной скорости их движения должны были бы почти мгновенно развиваться по массе покоящегося Г. и заменяться частицами покоящегося Г. Таким образом, движущийся слой газа встречал бы громадное сопротивление самостоятельному движению вследствие быстроты передачи этого движения соседним слоям, и вязкость Г. была бы весьма велика. В действительности же наблюдается противоположное. И здесь мы должны допустить то же препятствие к свободному движению частиц: их взаимные столкновения, замедляющие передачу движения от слоя к слою. Чем свободнее движение частиц, чем больше путь, проходимый частицами без столкновения, тем больше внутреннее трение Г. Расчет дает для постоянной вязкости (см. это слово) следующую формулу:
А/ A 1 = (па)/(па 1 ) = a/a 1.
Опыт показывает, что в действительности это не так. Для каждого простого тела число п, т. е. отношение между частичным и атомным весами, должно быть определено особо. Из приведенных примеров видно, что для водорода, кислорода и азота п не менее двух. Величина п должна, сверх того, удовлетворять еще одному условию: она должна представлять наибольшее отношение между объемом соединения (в газ. сост.) и объемом простого тела во всем ряду соединений, заключающих данный элемент. Это условие вытекает из самого определения атомного веса, как наименьшей весовой величины, входящей в состав соединения. Наименьшая же величина отвечает наибольшему отношению между объемом соединений и объемом простого тела. Для определения атомного веса необходимо поэтому знать отношения объемов соединения и простого тела для всего ряда соединений, заключающих данный элемент. Фактически, такая задача никогда не может быть решена, ибо число возможных соединений для каждого элемента безгранично. Однако, при большом числе уже известных теперь соединений найденные этим путем атомные веса элементов представляют большую вероятность. Прием этот вводит во всяком случае рациональные основания в определении атомных весов. С тех пор, как следуя мысли Жерара, в основу определения атомных весов положены объемные отношения в газообразном состоянии, величины атомных весов перестали быть условными и привели к целому раду соотношений, подтверждающих правильность найденных величин (см. Вес атомов).
Частицы простых тел в газообразном состоянии являются вообще сложными, и сложность их у разных простых тел различна, но всегда выражается простыми числами. Для большинства простых тел отношение между частичным весом (в газообр. сост.) и атомным весом выражается числом 2. Для фосфора и мышьяка это отношение равно 4. У некоторых простых тел отношение между частичным весом и атомным весом является переменным. Так, для кислорода в его обычном состоянии это отношение равно 2, в форме озона равно 3. Для серы отношение п является постоянным и равным 2 лишь при температурах выше 800°. При низших температурах отношение п быстро возрастает с понижением температуры (вследствие резкого возрастания плотности пара серы) и приближается к 6.
C p /C v = (ае + r 1 + r)/(ae + r 1 )
т.е. должно быть во всяком случае меньше 1,66, и тем меньше, чем больше r 1 и т. е. работа внутри частицы.
Изложенные данные показывают, что только для таких Г., как ртутный, теплоемкость отвечает требованиям теории Г. Для всех других Г. и величина теплоемкости неодинакова, и самое постоянство теплоемкости при разных температур необязательно. Так как в величину теплоемкости Г. входит работа внутри частицы, то никаких определенных заключений как о величине теплоемкости, так и об изменении ее с температурой мы сделать не можем, ибо о работе теплоты внутри частицы мы не имеем определенного представления. Опытные исследования теплоемкости Г. обещают и в этом отношении дать важные результаты. Имеющиеся наблюдения позволяют выразить частичную теплоемкость (т. е. теплоемкость, умноженную на частичный вес) для всех газов, заключающих в частице несколько атомов, формулой:
где с — частичная теплоемкость, t — температура по Цельсию, b — постоянная (температурный коэффициент теплоемкости), зависящая от природы Г. Постоянная b — тем больше, чем сложнее газ, для “постоянных” Г. она близка к нулю. Эта формула показывает, что при понижении температуры различия в теплоемкости газов со сложной частицей сглаживаются и при температуре абсолютного нуля (— 273) совершенно исчезают. Частичная теплоемкость всех Г. со сложною частицею выразится тогда величиной 6,8. Величина эта близка к атомной теплоемкости в твердом состоянии (см. Дюлонга закон). Величина частичной теплоемкости слагается из работы расширения, составляющей 2 cal, прироста энергии поступательного движения, составляющая на 1 ° 3 кал., и внутренней работы частицы, которая находится из разности
Теплоемкость Г., заключающих в частице только один химический атом, выразится суммой только двух первых величин и, следовательно, будет равна 2 + 3 = 5 кал.
Вероятные уклонения от средней скорости.
Говоря о скорости движения частиц, мы имели в виду среднюю скорость, ибо необходимо допустить, что при случайностях столкновения частиц скорости их станут неравными. Расчет по теории вероятностей показывает, что при различии скоростей, в массе частиц Г. преобладает некоторая вероятнейшая скорость, весьма близкая к средней. Значительные уклонения от этой вероятнейшей скорости встречаются редко. Так, вероятность скорости, уклоняющейся на 0,1 от вероятнейшей, составляет всего 0,16, т. е. из 100 частиц Г. только у 16 частиц скорость отличается на 10% от вероятнейшей. Вероятность же скоростей втрое или вчетверо больших, чем вероятнейшая, крайне ничтожна. Движение частиц Г. близко к тому, как если бы они двигались с одинаковой скоростью. Прямых опытных доказательств существования предполагаемых различий в скоростях частиц мы не имеем. Косвенным указанием на то, что подобные различия существуют, могут служить наблюдения над химическими превращениями Г. Химическое превращение Г. совершается не при определенной температуре, а в некотором промежутке температур и весьма часто ограничены пределом. Эти факты легко объяснить, допустив, что при данной температуре не все частицы Г. находятся в одинаковых условиях, т. е. обладают неоодинаковым запасом энергии, следовательно, неодинаковой скоростью движения.
Уклонения от законов Бойля-Мариотта и Гей-Люссака.
Состояние Г. согласно этим законам выражается формулой
В высшей степени замечательны уклонения от закона Б.-М. при малых давлениях, обнаруженные исследованиями Д. И. Менделеева. При весьма малых давлениях уклонения газов от закона Б.-М. положительны, т. е. при возрастали давления произв. pv. Г. возрастает, газ, следовательно, менее сжимаем, чем по закону Б.-М. Сжимаемость разреженного Г. уменьшается с разрежением. Газ весьма разреженный, будучи весьма мало сжимаем, по своим свойствам приближается к твердому телу.
газы мн. Газообразные выделения, образующиеся в кишечнике.
ГАЗЫ в технике, применяются гл. обр. в качестве топлива; сырья для химич. пром-сти; химич. агентов при сварке, газовой химико-термич. обработке метал. смотреть
ГАЗЫ в металлах. Г. попадают в твёрдые и жидкие металлы при их выплавке и электролитич. получении, при взаимодействии металлич. изделий с атмосферой. смотреть
ГАЗЫ ГОРЮЧИЕ, газообразные вещества, способные гореть. В широком смысле слова к Г. г. относятся водород, окись углерода, сероводород, газообразные у. смотреть
в-ва в агрегатном состоянии, характеризующемся слабым взаимод. составляющих в-во частиц (по сравнению с их средней кинетич. энергией), в результате че. смотреть