что такое регенерация какие клетки участвуют в этом процессе
Перспективы регенерации мышечной ткани с помощью клеточной терапии
Клеточная терапия с использованием мезенхимных стромальных клеток (МСК) является перспективным подходом к восстановлению скелетных мышц после травм и заболеваний. МСК, исходно присутствующие в мышце или приходящие в нее из костного мозга в ответ на повреждение, вырабатывают различные регуляторные молекулы, которые благотворно влияют на выживание, размножение и дифференцировку клеток, усиливают рост кровеносных сосудов, оказывают противовоспалительное и антифибротическое действие. Способность к продукции разнообразных факторов, воздействующих на все стадии репаративного процесса, позволяет использовать МСК для ускорения регенерации, что было неоднократно показано на различных экспериментальных моделях повреждения мышц. Эффект МСК может быть усилен путем совершенствования способов доставки клеток в ткань и улучшения их выживаемости; кроме того, секреторный профиль клеток может быть изменен в необходимом направлении путем воздействия различных физических или химических стимулов либо с помощью генетической модификации. Новым направлением регенеративной медицины становится использование продуцируемых МСК внеклеточных везикул и содержащихся в них регуляторных молекул, прежде всего микроРНК. Активацию регенеративного потенциала МСК можно рассматривать как инструмент тканевой инженерии in vivo, стимулирующий восстановление тканей за счет внутренних резервов.
Повреждение скелетных мышц такими воздействиями, как сдавливание, порезы, проколы, отморожения, истощающие физические нагрузки, может приводить к образованию рубцов и значительно ухудшать сократительную способность. Существуют разные подходы к восстановлению мышц после травм и заболеваний, и один из наиболее перспективных связан с использованием мезенхимных стромальных клеток (МСК) (Заглавная иллюстрация). МСК привлекательны для клеточной терапии своей доступностью, легкостью культивирования, несклонностью к образованию опухолей и способностью не отторгаться иммунной системой. Они способны давать начало различным типам зрелых клеток и выделять множество регуляторных молекул, оказывающих благотворное влияние на ткань. В скелетных мышцах, как и во многих других тканях и органах, присутствуют клетки со свойствами МСК, которые в случае травмы размножаются и участвуют в регенерации. Строго говоря, главная роль в восстановлении мышц принадлежит не им, а миосателлитам – незрелым предшественникам, способным дифференцироваться в клетки, сливающиеся затем в мышечные волокна. Однако вклад МСК и близких к ним клеточных популяций, содержащихся в мышцах, также не стоит недооценивать: они создают временную нишу для мышечных предшественников, секретируя молекулы, способствующие их делению и дифференцировке. Кроме того, при травме мышцы в нее приходят МСК из костного мозга. Их привлекают вещества, так называемые хемоаттрактанты, выделяемые тканью в условиях нехватки кислорода из-за повреждения. Эти пришлые клетки тоже участвуют в восстановительном процессе наряду с местными МСК мышц.
Каковы же механизмы участия МСК в регенерации мышечной ткани? Эксперименты на клеточных культурах и на животных с поврежденными мышцами показали, что МСК способны непосредственно давать начало мышечным клеткам или сливаться с ними. Однако такие события происходят редко, и их вклад в регенерации едва ли может быть существенным. Гораздо более важную роль в ней играет способность МСК секретировать биологически активные вещества, способствующие улучшению состояния поврежденной ткани. Эти вещества предотвращают гибель мышечных клеток, стимулируют их размножение и слияние, уменьшают воспаление, усиливают рост сосудов, а значит, и кровоснабжение регенерирующей мышцы. По некоторым данным, они также препятствуют образованию рубца на месте травмы. Таким образом, выделяемые МСК факторы воздействуют на все стадии восстановительного процесса. А значит, дополнительное введение МСК в поврежденную мышцу можно рассматривать как способ комплексной доставки в нее биоактивных молекул для ускорения регенерации.
Этот подход показал свою эффективность в многочисленных опытах на животных. Мышцы мышей или крыс травмировали сдавливанием или надрезанием, разрушали инъекциями токсинов, вызывали мышечную атрофию с помощью высокожировой диеты или длительной иммобилизации конечности, нарушали кровоток в мышцах, перевязывая бедренную артерию, использовали мутантных животных с генетически обусловленной миодистрофией. И во всех этих случаях введение МСК приводило к улучшению структуры поврежденных мышц и их функционального состояния.
Таким образом, результаты использования МСК для регенерации мышц выглядят весьма обнадеживающими. Но эффективность их применения можно сделать еще более высокой, если усовершенствовать доставку клеток в поврежденную ткань, улучшить их выживаемость в организме реципиента или усилить продукцию ими биоактивных молекул. В частности, высокой концентрации МСК в месте повреждения можно достичь, трансплантируя их на искусственных носителях. Разрабатывается и другой подход: на мышцу воздействуют импульсами фокусированного ультразвука, что способствует усиленной миграции в нее МСК. Известна также магнитная система доставки МСК, когда вводимые клетки метят наночастицами оксида железа, а к поврежденной области прикладывают внешнее магнитное поле. В этом случае содержание донорских клеток в травмированной мышце оказывается выше, а ее восстановление эффективнее, чем после трансплантации МСК обычным образом. Еще один путь к повышению регенеративного потенциала МСК состоит в воздействии на них различными физическими или химическими факторами (сниженным содержанием кислорода, механическим натяжением, гормонами, фармакологическими агентами и т.п.), стимулирующими их секреторную активность. Таким образом можно добиться усиленного выделения клетками тех молекул, которые необходимы для регенерации. С той же целью можно подвергнуть МСК генетической модификации, введя в них гены, обеспечивающие синтез необходимых веществ. Наконец, вводить в поврежденную ткань можно не сами МСК, а их внеклеточные везикулы – мембранные пузырьки, заключающие в себе различные регуляторные молекулы. Эти везикулы могут стимулировать клетку-мишень через мембранные рецепторы или, сливаясь с ней, доставлять свое содержимое в цитоплазму.
В последние годы получение МСК с заданными свойствами, необходимыми для полноценного восстановления тканей, становится одной из активно разрабатываемых областей регенеративной медицины. В перспективе знание биологии этих клеток позволит управлять их миграцией к месту повреждения и влиять на их секреторный профиль, что обеспечит эффективную тканевую регенерацию за счет внутренних резервов.
ГДЗ биология 7 класс Пасечник, Суматохин, Калинова Просвещение 2019-2020 Задание: 7 Тип Кишечнополостные
Стр. 36. Вспомните
№ 1. Чем различаются одноклеточные и многоклеточные животные?
Одноклеточные и многоклеточные животные являются единицами биосферы, которые населяют нашу планету. Между собой они имеют такие отличия:
Одноклеточные состоят только из одной клетки; многоклеточные – из множества клеток;
У одноклеточных организмов есть оболочка, которая удерживает внутреннее содержимое клетки. У ядерных организмов присутствует четко оформленное ядро, которое защищено ядерной оболочкой. У безъядерных молекула ДНК крупная и содержит в себе ценную генетическую информацию.
У всех одноклеточных для передвижения служат жгутики, реснички, ложноножки, газовые вакуоли. У многоклеточных организмов для передвижения предназначены специальные органы, строение которых отличается у разных животных и зависит как от типа их локомоции, так и от условий окружающей среды (почвенная, наземно-воздушная, водная, организменная).
Размножение у одноклеточных организмов происходит методом деления, либо в процессе обмена фрагментами своего генетического багажа, при котором число особей не увеличивается. У многоклеточных организмов размножение возможно бесполым и половым путем. Новая жизнь у них начинается с одной клетки – зиготы. Это является главным подтверждением того, что многоклеточные организмы произошли уже после одноклеточных, которые стали базовым организмом.
№ 2. Что такое размножение?
Размножение – это свойство всех живых организмов к воспроизведению себе подобных особей. Может происходить как половым, так и бесполым способом.
Стр. 39. Лабораторная работа. Изучение пресноводной гидры
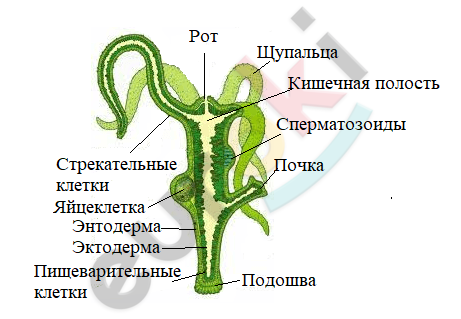
При помощи лупы рассматриваем внешнее строение пресноводной гидры. Обращаем внимание на форму тела и размеры животного. Зарисовываем гидру и указываем части ее тела. Пресноводная гидра прозрачная. Тело вытянутое, длиной около 7 мм. На одном конце тела гидры находятся щупальца.
Рассматриваем на препарате поперечный и продольный срезы тела гидры при малом увеличении микроскопа.
Рассматриваем среды тела гидры при большом увеличении микроскопа. Находим разные виды клеток наружного и внутреннего слоев тела.
Зарисовываем увиденное и подписываем:
Вывод:
Тело гидры цилиндрической формы, длина – около 7 мм. С одной стороны тела располагается ротовое отверстие, которое окружено щупальцами. С другой стороны находится подошва, при помощи которых гидра крепится к разным поверхностям. Жизненная форма гидры – одиночный полип. Размножается бесполым способом – почкованием.
Стр. 39. Вопросы после параграфа
№ 1. Какие признаки характерны для кишечнополостных животных?
У всех представителей кишечнополостных животных тело симметрично относительно нескольких плоскостей, которые проходят через его центральную ось. Само тело состоит из эктодермы и энтодермы, а по внешнему виду напоминает двуслойный мешок, который на одном конце открыт. Это отверстие окружено венчиком щупалец и служит ведущим в замкнутую кишечную полость ртом. Между эктодермой и энтодермой располагается студенистое вещество – мезоглея.
Для всех кишечнополостных животных характерными являются две формы жизни – полип и медуза, которые приспособлены к разным образам жизни. Например, полипы из-за своей малоподвижности крепятся ко дну водоема – прикрепленный образ жизни, и образуют целые колонии. Медузы же благодаря строению своего тела и наличию щупалец по его краям приспособлены к плавающему образу жизни.
Пищеварительная система замкнутого типа, представлена ртом, через который происходит как заглатывание пищи, так и удаление ее непереваренных остатков. Сама же пища переваривается не только внутри кишечной полости, но и внутри клеток, которые ее выстилают. Так как все кишечнополостные – хищники, то для охоты у них предназначены стрекательные клетки.
Нервная система примитивного типа и образована нервными клетками, которые соприкасаются друг с другом отростками и таким образом образуют нервное сплетение (сетчатая или диффузная нервная система).
№ 2. Как происходит половое размножение гидры?
Половое размножение гидры возможно при наступлении неблагоприятных условий окружающей среды, например, со снижением температуры. На первом этапе происходит образование на поверхности ее тела небольших выпячиваний. У одних особей в этих бугорках развиваются мужские половые клетки или сперматозоиды. У других особей бугорки чуть больше, в них развиваются женские половые клетки или яйцеклетки.
Сперматозоиды из бугорков первых особей подплывают к гидре с яйцеклетками и проникают в них. Так происходит процесс оплодотворения и образования яйца, из которого уже к весне разовьется молодая гидра.
№ 3. Что такое регенерация? Какие клетки участвуют в этом процессе?
Регенерация – это способность организма к восстановлению повреждённых, либо утраченных частей своего тела. Участвуют в этом процессе промежуточные клетки, которые содержатся в эктодерме (у гидры).
№ 4. Что такое рефлекс? Из каких этапов он состоит?
Рефлекс – это стереотипная реакция живого организма на раздражитель из окружающей среды, которая происходит с непосредственным участием нервной системы. Он является основной формой деятельности нервной системы.
Рефлекс состоит из трех основных этапов:
Восприятие раздражения из окружающей среды;
Передача возбуждения по нервным клеткам;
Ответная реакция организмом в виде какого-либо действия.
Стр. 39. Подумайте
Почему нервная система у подвижных кишечнополостных более развита, чем у прикрепленных форм?
В целом у всех кишечнополостных нервная система примитивна и образована нервными клетками, которые, соприкасаясь отростками, образуют нервное сплетение – диффузную или сетчатую нервную систему.
Более развитой нервная система является у подвижных кишечнополостных – медуз, которые могут плавать. Двигаются они путем реактивных толчков – зонтик резко сокращается и выталкивает воду наружу. Для таких движений обязательна работа более развитых нервов.
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
NAME] => URL исходной статьи [
Ссылка на публикацию: Cbio
Код вставки на сайт
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
Что такое регенерация какие клетки участвуют в этом процессе
До недавнего времени считалось, что возможность репаративной регенерации организма, происходящей после повреждения или утраты какой-либо части тела, была утеряна практически всеми живыми организмами в процессе эволюции и, как следствие, усложнения строения организма, кроме некоторых существ, включая амфибий. Одним из открытий, сильно поколебавшим этот догмат, стало обнаружение гена р21 и его специфических свойств: блокирование регенеративных возможностей организма, группой исследователей из Вистарского Института, штат Филадельфия, США (The Wistar Institute, Philadelphia).
По словам ученых, при отсутствии гена р21 клетки грызунов ведут себя как регенерирующие эмбриональные стволовые клетки. А не как зрелые клетки млекопитающих. То есть, они скорее выращивают новую ткань, чем восстанавливают поврежденную. Здесь будет уместно вспомнить, что такая же схема регенерации присутствует и у саламандр, обладающих возможностью отращивать заново не только хвост, но и утерянные конечности, или у планарий, ресничных червей, которых можно разрезать на несколько частей, и из каждого кусочка вырастет новая планария.
По осторожным замечаниям самих исследователей, следует вывод, что теоретически, отключение гена р21 может запускать аналогичный процесс и в человеческом организме. Безусловно, стоит отметить и тот факт, что ген р21 тесно связан с другим геном, р53. который контролирует деление клеток и препятствует образованию опухолей. В обычных взрослых клетках организма р21 блокирует деление клеток в случае повреждения ДНК, поэтому у мышей, у которых он был отключен, больше риск возникновения рака.
Но хотя исследователи действительно обнаружили большие повреждения ДНК в ходе эксперимента, они не нашли следов рака: напротив, у мышей усилился механизм апоптоза, программируемого «суицида» клеток, который также защищает от возникновения опухолей. Такая комбинация может позволять клеткам делиться быстрее, не превращаясь в «раковые».
Избегая далеко идущих выводов, все же отметим, что сами исследователи говорят лишь о временном отключении этого гена с целью ускорения регенерации: «While we are just beginning to understand the repercussions of these findings, perhaps, one day we´ll be able to accelerate healing in humans by temporarily inactivating the p21 gene». Перевод: «В данный момент мы только начинаем понимать все последствия наших открытий, и возможно, когда-нибудь мы сможем ускорять исцеление людей, временно инактивируя ген р21» [1].
1. ЭСК экспрессируют такие факторы, связанные с плюрипотентными клетками, как Oct4, Sox2, Tert, Utfl и Rex1 (Carpenter and Bhatia 2004).
3. ЭСК могут самообновляться путем многократных делений.
Отдельно остановимся на механизмах работы и регуляции стволовых клеток. Особые характеристики стволовых клеток определяются не одним геном, но целым их набором. Возможность идентификации этих генов непосредственно связана с разработкой метода культивирования эмбриональных стволовых клеток in vitro, а также с возможностью использования современных методов молекулярной биологии (в частности, использование фактора ингибирования лейкемии LIF).
В результате совместных исследований компаний Geron Corporation и Celera Genomics были созданы библиотеки кДНК недифференцированных ЭСК и частично дифференцированных клеток (кДНК получают путем синтеза на основе молекулы иРНК, комплиментарной молекулы ДНК при помощи фермента обратной транскриптазы). При анализе данных по секвенированию нуклеотидных последовательностей и экспрессии генов было выявлено более 600 генов, включение или выключение которых отличает недифференцированные клетки, и составлена картина молекулярных путей, по которым идет дифференцировка этих клеток.
В настоящее время принято отличать стволовые клетки по их поведению в культуре и по химическим маркерам на клеточной поверхности. Однако, гены, ответственные за проявление этих особенностей, в большинстве случаев остаются неизвестными. Тем не менее, проведенные исследования позволили выделить две группы генов, придающих стволовым клеткам их замечательные свойства. С одной стороны, свойства стволовых клеток проявляются в определенном микроокружении, известном как ниша стволовых клеток. При изучении этих клеток, которые окружают, питают и поддерживают стволовые клетки в недифференцированном состоянии, было обнаружено около 4000 генов. При этом указанные гены были активны в клетках микроокружения, и неактивны во всех других
клетках [3, 4].
Следует отметить, что база данных по генам, определяющим свойства стволовых клеток, постоянно пополняется. Полный каталог генов стволовых клеток может улучшит процесс их идентификации, а также прояснить механизмы функционирования этих клеток, что обеспечит получение дифференцированных клеток, необходимых для терапевтического применения, а также позволит получить новые возможности для разработки лекарств. Значение этих генов велико, так как они обеспечивают организму возможность сохранять себя и регенерировать ткани.
Здесь у читателя может возникнуть вопрос: «А насколько далеко продвинулись ученые в практическом применении этих знаний?». Используются ли они в медицине? Имеются ли перспективы дальнейшего развития у этих направлений? Чтобы ответить на эти вопросы, проведем небольшой обзор по научным разработкам в данном русле, как старым, чему не нужно удивляться, ведь исследования в области регенеративной медицины ведутся давно, минимум с начала 20 века, так и совсем новым, подчас весьма необычным и экзотическим.
Для начала отметим, что еще в 80-е годы 20 века в СССР в Институте эволюционной экологии и морфологии животных им. Северцева АН СССР, в лаборатории А.Н. Студицкого проводились эксперименты: измельченное мышечное волокно пересаживалось в поврежденный участок, которое впоследствии восстанавливаясь, заставляло регенерировать нервные ткани. Были сделаны сотни успешных операций на человеке.
Отдельно отметим, что еще в середине 20 века группой советских ученых, под руководством Л.В. Полежаева проводились исследования, с успешным практическим применением их результатов по регенерации костей свода черепа у животных и человека; область дефекта достигала до 20 квадратных сантиметров. Края пробоины засыпались измельченной костной тканью, что вызывало процесс регенерации, в ходе которого происходило восстановление поврежденных участков.
Так же, хотелось бы заострить внимание на таком повседневном и привычном объекте, как соль (NaCl). Широко известны лечебные свойства морского климата, мест, с высоким содержанием соли в воде и в воздухе, наподобие Мертвого моря в Израиле или Соль-Илецка в России, соляных шахт, широко применяемых в стационарах, санаториях и курортах по всему миру. Спортсмены и люди, ведущие активный образ жизни, хорошо знакомы и с соляными ванночками, применяемыми при лечении травм опорно-двигательного аппарата. В чем же секрет этих удивительных свойств обычной соли? Как обнаружили ученые из университета Тафтса (США), для процесса восстановления отрезанного или откушенного хвоста головастикам необходима поваренная соль. Если посыпать ею ранку, хвост отрастает быстрее даже в том случае, если уже успела образоваться рубцовая ткань (шрам). При наличии соли ампутированный хвост отрастает, а отсутствие ионов натрия блокирует этот процесс. Безусловно, следует порекомендовать воздержаться от безудержного потребления соли, в надежде ускорить процесс исцеления. Многочисленные исследования наглядно демонстрируют тот вред, который наносит организму чрезмерное употребление соли в пищу. По всей видимости, для запуска и ускорения процесса регенерации, ионы натрия должны поступать к поврежденным участкам иными путями [6].
В дальнейшем был разработан специальный пластик, разлагаемый микроорганизмами. Из него был изготовлен имплантант на спине мыши: пластиковый каркас, отлитый в форме человеческого уха, покрытый живыми клетками. Клетки в процессе роста прилипают к волокнам и принимают необходимую форму. Со временем клетки начинают доминировать и формировать новую ткань (например, хрящ ушной раковины). Другой вариант данного метода: имплантант на спине пациента, представляющий собой каркас необходимы формы, засеивается стволовыми клетками определенной ткани. Через некоторое время этот фрагмент удаляется со спины и имплантируется на место.
Тот же пластик, о котором упоминалось чуть выше, был использован для восстановления поврежденного спинного мозга у лабораторных мышей. Принцип здесь был тот же: волокна пластика сворачивали в жгут и высеивали на него эмбриональные нервные клетки. В результате разрыв закрывался новой тканью, и происходило полное восстановление всех моторных функций. Достаточно полный обзор приводится в документальном фильме ВВС «Сверхчеловек. Самоисцеление».
. А чего нельзя? Нельзя ставить крест на больном лишь потому, что в учебники еще не вошло все, что могут сегодня специалисты. Те же врачи, которые принимали больного и все видели, удивлялись: «Ну, помилуйте, товарищи ученые, конечно, у вас там наука, но ведь полный перерыв спинного мозга, о чем можно говорить?!» Вот так. Видели и не видели. Есть научный фильм, все заснято.
Чем раньше после поражения мозга начинается стимуляция, тем более вероятен эффект. Однако даже в случаях давних травм многое удается и узнать, и сделать.
В этом же направлении имеются и более экзотичные пути, наподобие трехмерного биопринтера, созданного в Австралии, который уже печатает кожу, и в ближайшем будущем, по заверениям разработчиков, сможет печатать и целые органы. В основу его работы заложен тот же принцип, что и в описанном случае создания мочевого пузыря: высеивание живых клеток слой за слоем [1].
Второе направление регенеративной медицины можно условно обозначить одной фразой: «Зачем выращивать новое, если можно починить старое?». Главной задачей приверженцы данного направления считают восстановление поврежденных участков силами самого организма, используя его резервы, скрытые возможности (стоит вспомнить начало данной статьи) и определенные вмешательства извне, в основном в виде поставки дополнительных ресурсов и строительного материала для репарации.
Возможных вариантов здесь также большое количество. Для начала, следует отметить, что по некоторым оценкам, в каждом органе от рождения есть запас резервных стволовых клеток примерно в 30 %, которые расходуются в процессе жизни. В соответствии с этим, по мнению некоторых геронтологов, видовой предел жизни человека составляет 110-120 лет. Следовательно, биологический резерв жизни человека 30-40 лет, а учитывая российские реалии эти цифры можно увеличить до 50-60 лет. Другой вопрос, что современные условия жизни не способствуют этому: крайне плачевное, и с каждым годом все более ухудшающееся состояние экологии; сильные, и что еще более важно постоянные стрессы; огромные психические, интеллектуальные и физические нагрузки; удручающее на местах состояние медицины, в частности российской; направленность фармацевтики не на помощь людям, а на получение сверхприбыли и многое другое, полностью изнашивают человеческий организм к тому моменту, когда по идее должен наступать самый расцвет наших сил и возможностей. Тем не менее, данный резерв может сильно помочь при восстановлении после травм и лечении серьезных заболеваний, особенно в младенческом и детском возрасте [7].
Отдельно выделим создание гемобанков по сбору пуповинной крови новорожденных, являющейся одним из наиболее перспективных источников стволовых клеток. Известно, что пуповинная кровь богата гемопоэтическими стволовыми клетками (ГСК). Характерной особенностью полученных из пуповинной крови СК является их значительно большее, чем у взрослых СК сходство с клетками из эмбриональных тканей по таким параметрам, как биологический возраст и способность к размножению. Пуповинная кровь, полученная из плаценты сразу после рождения ребенка, богата СК с большими пролиферативными возможностями, чем у клеток, полученных из костного мозга или периферической крови. Подобно любому продукту крови, СК пуповинной крови нуждаются в инфраструктуре для их сбора, хранения и установления пригодности для трансплантации. Пуповина пережимается через 30 секунд после рождения ребенка, плацента и пуповина отделяются, и пуповинную кровь собирают в специальный пакет. В образце должно быть не менее 40 мл, чтобы его можно было использовать. Кровь типируется по HLA и культивируется. Незрелые клетки человеческой пуповинной крови с высокой способностью к пролиферации, размножению вне организма и выживанию после трансплантации могут храниться замороженными более 45 лет, затем после оттаивания они с большой вероятностью сохраняют эффективность при клинической трансплантации. Банки пуповинной крови существуют по всему миру, только в США их более 30 и еще много частных банков. Национальные институты здоровья США спонсируют программу изучения трансплантации пуповинной крови. В Нью-Йоркском центре крови есть программа плацентарной крови, и своя программа исследований есть у Национального регистра доноров костного мозга [2].
Другой важной областью исследований является изучение способности СК пуповинной крови к дифференцировке в клетки различных тканей, помимо гемопоэтической, и установление соответствующих линий СК. Исследователи из университета Южной Флориды (University of South Florida (USF, Tampa,FL)) использовали ретиноевую кислоту, чтобы заставить СК пуповинной крови дифференцироваться в нервные клетки, что было продемонстрировано на генетическом уровне анализом строения ДНК. Эти результаты показали возможность использования этих клеток для лечения нейродегенеративных болезней. Пуповинная кровь для этой работы была предоставлена родителями ребенка; она была обработана в оснащенной на современном уровне лаборатории CRYO-CELL и фракционированные замороженные клетки были переданы ученым USF. Пуповинная кровь оказалась источником гораздо более разнообразных клеток-предшественников, чем считалось раньше. Она может быть использована для лечения нейродегенеративных болезней, в том числе в сочетании с генотерапией, травм и генетических болезней. В ближайшем будущем станет возможным при рождении детей с генетическими дефектами собирать их пуповинную кровь, методами генной инженерии исправлять дефект и возвращать эту кровь ребенку.
1) не травмировать ткани механически;
2) не поражать здоровые клетки;
3) не вызывать побочных эффектов;
4) лекарства должны самостоятельно:
Наиболее экзотическим вариантом являются так называемые нанороботы. Среди проектов будущих медицинских нанороботов уже существует внутренняя классификация на макрофагоциты, респироциты, клоттоциты, васкулоиды и другие. Все они являются по сути искусственными клетками, в основном иммунитета или крови человека. Соответственно, их функциональное предназначение напрямую зависит от того, какие клетки они замещают. Помимо медицинских нанороботов, существующих пока только в головах ученых и отдельных проектов, в мире уже созданы ряд технологий для наномедицинской отрасли. К ним относятся: адресная доставка лекарств к больным клеткам, диагностика заболеваний с помощью квантовых точек, лаборатории на чипе, новые бактерицидные средства [10].
И ученым это удалось: они синтезировали искусственный аналог активного сайта белка MMPS9: ион цинка, скоординированный тремя гистидиновыми остатками. Его инъекция лабораторным мышам приводила к выработке антител, действующих ровно в той же манере, в какой работают белки TIMPS: блокируя вход в активный сайт [1].
В России Министерство образования и науки создало Межведомственный научно-технический совет по проблеме нанотехнологий и наноматериалов, деятельность которого направлена на сохранение технологического паритета в будущем мире. Для развития нанотехнологий в целом и наномедицины в частности. Готовится принятие федеральной целевой программы по их развитию. Данная программа будет включать подготовку целого ряда специалистов в длительной перспективе.
Достижения наномедицины станут доступны по разным оценкам только через 40-50 лет. Сам Эрик Дрекслер называет цифру в 20-30 лет. Но учитывая масштаб работы в данной области и количество вкладываемых в нее денег, все больше аналитиков сдвигают первоначальные оценки на 10-15 лет в сторону уменьшения [10].