Импакция кости что это
Импактные и ретинированные зубы
Зубы в норме начинают процесс прорезывания, когда уже сформировано три четвертых длины корневой части. Если прорезывания нет, ситуация называется задержкой, причины которой самые разные. В зависимости от того, что вызвало подобную ситуацию, выбирается схема и методы лечения. В зависимости от особенностей развития такой патологии различают ретинированные и импактные зубы. Каждая из патологий имеет собственный классификационный код – К01.0 и К01.1 соответственно.
Особенности
Импактные зубы – это состояние, при которое единицы во время прорезывания сталкиваются. Ретинирование – причина развития ряда, при которой препятствием становится не другой зуб, а иное воздействие. Обычно это недостаточность свободного места, сверхкомплектность. К основным типам препятствий относятся:
Симптомы и клинические признаки
Основными проявлениями патологии выступают:
В некоторых случаях наблюдаются такие симптомы, как перикоронарит, то есть развитие воспалительных процессов со стороны нарушения. Они сопровождаются покраснением, сильной отечностью, болезненностью. При запушенной ситуации боли становятся сильными, в месте воспаления появляются гнойные выделения. У больного поднимается температура, состояние ухудшается.
Диагностика, особенности лечения
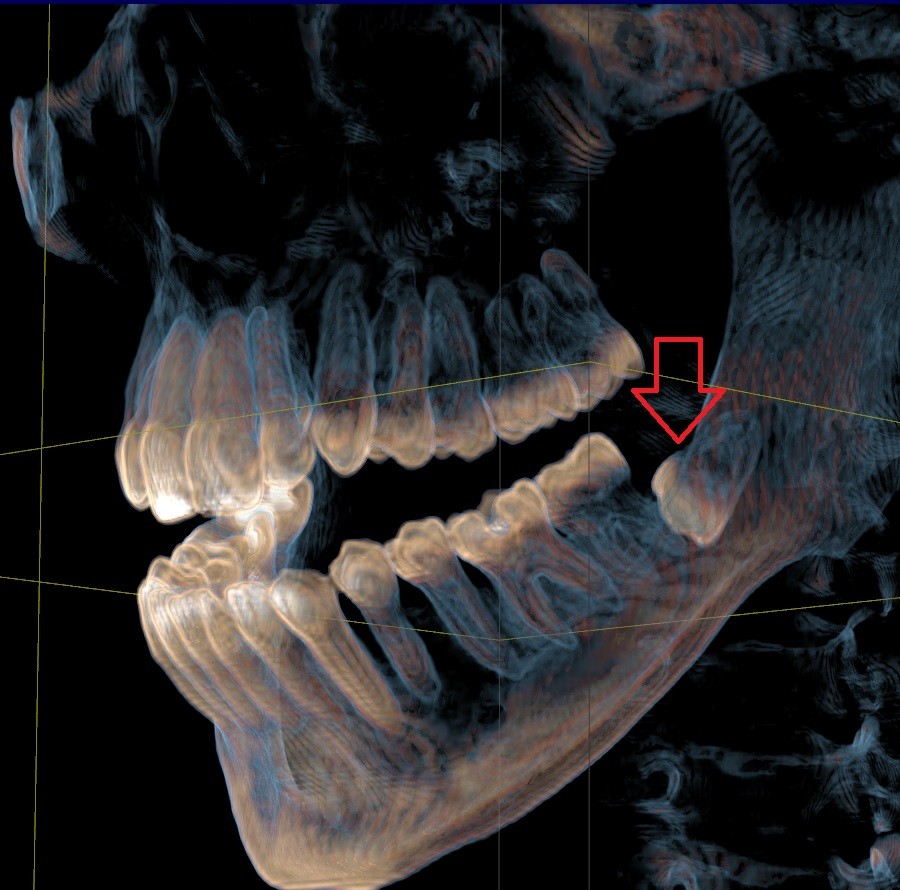
Для выявления патологии используется дифференциальная диагностика, позволяющая различить адентию от ретинироваггого зуба. Для этого врач проводит наружный осмотр, пальпирует десну, назначает рентгенографию. Это позволяет не только определить проблему, но и выявить причину, которая вызвала нарушения прорезывания. Например, при ретинированных зубах причиной выступает анкилоз, на рентгеновских снимках он проявляется в виде периодонтальной щели. Кроме того, могут быть назначены следующие методы диагностики – конусно-лучевая томография, ортопантомография.
Лечение патологии проводится комплексное или только в виде какой-либо одной тактики – хирургического, эндодонтического, ортодонтического вмешательства. Результативным выступает ортодонтическое лечение, а также экстракция. Второй случай применим, если удаление зуба необходимо для обеспечения нормального прорезывания скрытой единицы. Показаниями к удалению выступает ситуация, при которой зуб не может прорезаться, что вызывает развитие дальнейших аномалий. В таком случае врач проводит диагностику и определяет, что эффективнее – полностью удалить мешающую единицу или совместить лечение с ортодонтическими мерами, переместив неправильно растущий зуб в сторону.
При наличии незначительного повреждения тканей коронки кариесом предварительно проводится лечение. Но оно нецелесообразно, если зуб сильно разрушен. В этом случае его удаляют.
Перикоронит, то есть вскрытие десны, выполняется для правильного формирования прохода. Если при обследовании выявлены радикулярные, пародонтальные кистообразные включения, следует их устранить.
Цели ортодонтического лечения:
Профилактика
Для предупреждения развития аномалии необходимы определенные превентивные меры. Начинать надо с младшего возраста, отучая малыша от вредных привычек. К ним относятся сосание щек и языка, неправильное положение сна, постоянное подпирание подбородка кулаком во время сна.
На одно из первых мест выводится своевременный перевод от грудного вскармливания к нормальной пище. Ребенок должен своевременно начать получать твердую пищу, что стимулирует правильное развитие челюстного аппарата. Такие простые меры в будущем позволяют избежать многих проблем, включая неправильное положение зубов, проблемы с прикусом.
К профилактическим методам также относятся регулярные посещения врача. Это позволяет вовремя заметить отклонения в развитии зубного ряда, начать лечение в раннем возрасте, когда оно приносит максимальный результат. Импактные и ретинированные зубы обычно наблюдаются при нарушении превентивных мероприятий, когда родители малыша не уделяют должного внимания развитию ребенка, его зубов, правильному питанию и личной гигиене ротовой полости.
Чем отличается импактный зуб от ретинированного, и как избежать развития аномалии
Прорезывание зуба – это перемещение его из нефункционального поддесневого положения в функциональное наддесневое, обеспечивающее полноценное пережевывание пищи.
Задержка прорезывания (ЗПЗ) – очень распространенная аномалия, которая по данным статистики в той или иной степени затрагивает около 50% людей планеты.
ЗПЗ происходит по разным причинам, связанным как с местными, внутриротовыми факторами, так и внешними системными.
Содержание статьи:
Расшифровка определения
Импактными (англ. Impact— столкновение) называются зубы, которые не смогли прорезаться в положенное им время в нужном месте из-за препятствия со стороны соседних единиц.
В МКБ 10 они обозначаются кодом K01.1 и определяются как единицы, «изменившие свое положение при прорезывании из-за препятствия со стороны соседних зубов».
Импактные единицы следует отличать от ретинированных (лат. «Retentio» означает «сдерживание»), имеющих обозначение К01.0 и определяемых как «изменившие свое положение при прорезывании без препятствия со стороны соседних зубов».
Воздействие соседних единиц, становящееся причиной появления импактных зубов, может определяться разными факторами с различной выраженностью. Чаще всего причиной импакции становятся следующие случаи:
Чаще всего импактными становятся 3-и моляры НЧ и верхние клыки.
Клинические проявления
Основным проявлением импактного зуба является его отсутствие на своем месте – то есть дефект в ряду. Косвенно о наличии скрытой в десне импактной единицы, может говорить ширина дефекта – если она меньше, чем ширина одноименного зуба с другой стороны ряда.
Однако наличие дефекта еще не говорит о том, что в десне точно скрывается импактный зуб. Это может быть ретинированная единица или адентия (отсутствие зародыша). Чтобы диагностировать импакцию, нужно убедиться, что непрорезывание произошло из-за соседних зубов, а не по каким-то иным местным или системным причинам.
Другими признаками являются:
Кроме отсутствия в положенном месте зуба об импакции может говорить выпячивание области десны в зоне дефекта, боль, покраснение, отек, наличие гнойного образования или кисты. Некоторые из этих проявлений могут быть симптомам перикоронарита — воспаления мягких тканей, которые окружают коронку непрорезавшейся единицы.
Если перикоронарит имеет выраженный характер, он может сопровождаться дискомфортом при приеме пищи, ухудшением общего состояния из-за воспалительного процесса, повышенной температурой, головной болью. Область десны, под которой находится импактный зуб, может подвергаться частому травмированию.

Заходите сюда, чтобы узнать, насколько часто встречаются молочные зубы у взрослых.
Дифференциальная диагностика
Диагностирование проводится по традиционной в стоматологии технологии, состоит из опроса пациента на жалобы и дискомфорт, клинического и рентгенографического обследования ротовой полости.
Визуально устанавливается отсутствие единицы в положенном месте, наличие или отсутствие воспаления в области дефекта, пальпацией и визуально оценивается состояние мягких тканей.
С помощью рентгенографии (ортопантомографии, прицельных снимков, телерентгенографии), спиральной или конусно-лучевой томографии определяется наличие зубов или их зародышей в десне, их состояние, причина, по которой импактная единица не смогла прорезаться.
В частности, если определенная по рентгенограмме ширина непрорезавшегося зуба превышает расстояние между соседними единицами, это говорит о том, что импакция произошла из-за нехватки места в ряду.
Дефект дифференцируют от ретинированных единиц и адентии (отсутствие зародыша). Рентгенограмма ясно показывает, есть ли фолликул, в каком состоянии находится непрорезавшийся зуб, имеются ли препятствия прорезыванию со стороны соседних единиц.
Наиболее информативными методами лучевого обследования при всех видах ЗПЗ является ортопантомография и конусно-лучевая компьютерная томография.
Тактика лечения
В зависимости от вида, выраженности, наличия или отсутствия осложнений импакция зубов лечится хирургическим, эндодонтическим и ортодонтическим способами или их сочетанием.
Хирургическое вмешательство
Хирургическое лечение чаще всего представляет собой экстракцию проблемного элемента или его соседей. Показания к удалению следующие:
Нередко удалению подвергаются единицы, являющиеся препятствием для правильного прорезывания импактного зуба. Чаще всего такой участи подвергаются «молочники».
В других случаях, при которых дефект не вызывает патологических процессов в окружающих мягких и костных тканях, рекомендуется ортодонтическое, эндодонтическое, ортопедическое или терапевтическое лечение.
Ортодонтическое лечение
Ортодонтическая коррекция преследует следующие цели:
Если при вытяжении на коронке невозможно закрепить кнопку или брекет, в качестве подготовительной операции может применяться хирургическое вмешательство, обеспечивающее возможность прикрепления ортодонтического элемента.
Эндодонтическое лечение
Осуществляется при воспалении пульпы. Состоит в трепанации коронки и обтурации каналов.
Терапевтическое лечение
Проводится при воспалительных процессах в пульпе или пародонтальных тканях в области импактного зуба. Наиболее частой патологией, требующей терапевтического лечения, является перикоронит (перикоронарит) – воспаление десневых мягких тканей, окружающих непрорезавшуюся единицу.
Нередко терапевтическому лечению перикоронарита предшествует первичное хирургическое вмешательство для обработки и удаления гнойного очага, а также перикоронаротомия (обнажение поверхности зуба рассечением слизистой оболочки над ним) и перикоронарэктомия — полное ее удаление, обнажающее не только окллюзионную, но и боковые поверхности коронки.
Противовоспалительная терапия острого и хронического перикоронарита после хирургического вмешательства предусматривает антисептирование раны марлевым тампоном с антисептиком, и отвод экссудата.
Проводится также антибиотикотерапия – прием внутрь антибактериальных препаратов: амоксициллина, клиндамицина, метронидазола, цефалоспоринов и др. Назначаются НПВП, антигистаминные препараты, делаются ванночки с антисептиком.
Протетическое лечение
К ортопедическим способам лечения импакции относится лечебно-профилактическая процедура, состоящая во временном замещении непрорезавшейся единицы протезом, препятствующим смещению соседних с дефектом зубов.

В этой публикации читайте об исправлении орального положения зубов.
Превентивные меры
Меры профилактики не позволят застраховаться от возникновения дефекта, но сократят в разы возможности развития любого рода аномалий. К ним относятся:
Крайне важная профилактическая мера в отношении всех аномалий – регулярное посещение с ребенком стоматолога. По крайней мере, раз в полгода нужно посещать врача, чтобы он посмотрел, как прорезываются и растут зубки малыша.
Отзывы
Задержка прорезывания зубов – очень многообразная аномалия, как по своему виду, так и по причинам. И импакция – далеко не самая сложная из них, устраняется сравнительно легко.
Главное, вовремя начать лечение и сохранить зуб. Если вам пришлось лечить импакцию у своего ребенка, поделитесь личным опытом. Что вызвало задержку прорезывания, как удалось решить проблему? Комментарий можно оставить внизу этой страницы.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Метаболизм костной ткани и остеопороз
Рассмотрены подходы к выбору средств для профилактики и лечения потерь костной ткани, восстановления ее структуры и качества. Применяемый препарат должен способствовать синтезу коллагена, формированию костного матрикса, его минерализации и, соответственно
Approaches to selecting the methods of prevention and treatment of bone tissue losses, restoration of its structure and quality, were considered. The used preparation must contribute to collagen synthesis, formation of bone matrix, its mineralization, and, respectively, increase of the bone density and strength.
Остеопороз (ОП) — прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники (качества) костной ткани, что приводит к хрупкости костей и повышению риска переломов. ОП — самое распространенное заболевание костной ткани: остеопоротические переломы отмечается у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [1]. Очевидно, что рано начатые активные профилактические мероприятия у значительной части населения могут существенно повлиять на распространенность, прогрессирование и исходы заболевания, а также снизить риск переломов. В связи с этим изучение различных лекарственных препаратов и методов, применяемых для профилактики ОП, приобретает особый смысл.
Кость — специализированная разновидность соединительной ткани, состоящая из клеток и межклеточного вещества. В течение всей жизни основные функции костной ткани, такие как жесткость и гибкость, снижаются, поскольку с возрастом наблюдаются повреждение матрикса и потеря минералов. В противовес указанным проявлениям, в кости осуществляется ремоделирование — процесс, направленный на самостоятельное обновление и сохранение скелета как структурного и функционального органа.
Основными клетками костной ткани, функциями которой регулируется гомеостаз кости, являются остеобласты, остеокласты и остеоциты. Основной функцией остеобластов является создание органического межклеточного матрикса кости, остеоида. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Наряду с этим остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, способствующих связыванию Ca 2+ и участвующих в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca 2+ и цАМФ. Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей.
В ходе формирования кости некоторые остеобласты оказываются замурованными в толщу матрикса и становятся остеоцитами. Остеоциты контактируют друг с другом через отростки, являются основными компонентами в сформировавшейся костной ткани. Основная функция остеоцитов — поддержание нормального состояния костного матрикса и баланса кальция и фосфора в организме.
Остеокласты — клетки, выполняющие функцию разрушения кости; развиваются из стволовой кроветворной клетки и являются специализированными макрофагами. В процессе ремоделирования кости резорбтивный стимул запускает процесс привлечения остеокластов к участку кости. Прикрепившись к кости, остеокласты продуцируют множество протеолитических ферментов и формируют полость в кальцинированном матриксе. Таким образом, они осуществляют непрерывный процесс резорбции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость.
Важнейшим компонентом костной ткани является межклеточное вещество — уникальный комплекс органических и неорганических компонентов, заполняющих пространство между клетками. Минерализованный матрикс костной ткани поддерживает структуру скелета и под координирующим влиянием остеобластов и остеокластов обеспечивает резервуар как ионов, так и факторов роста, которые высвобождаются в процессе метаболизма.
Органический межклеточный матрикс костной ткани представлен семейством коллагеновых белков. Состав кости необычен тем, что фактически в ней представлен только коллаген I типа (90%), хотя наряду с коллагеном I типа в кости все же присутствуют следы других типов коллагена, таких как V, XI, XII. Скорее всего, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща. Коллагеновые фибриллы в кости строго ориентированы в соответствии с распределенной функциональной нагрузкой на кость, что обеспечивает упругость и эластичность кости. Веретенообразные и пластинчатые кристаллы гидроксиапатита находятся на коллагеновых волокнах, в их пределах и в окружающем пространстве. Как правило, они ориентированы в том же направлении, что и коллагеновые волокна.
Неколлагеновая часть матрикса (10%) представлена основным веществом (витамин К-зависимыми глютамилпротеинами (остеокальцином), матричными протеинами, остеопонтином, остеонектином, фибронектином, фосфопротеидами, сиалопротеидами, а также протеогликанами).
Важно подчеркнуть, что ОП является результатом уменьшения органического матрикса кости, а вовсе не плохой кальцификацией костной ткани. При ОП существенно снижается скорость образования остеоида, необходимого для формирования кости. Поэтому при планировании профилактических мероприятий чрезвычайно важно учитывать потенциальную возможность препаратов, наряду с адекватной минерализацией, оказывать влияние на синтез органического матрикса.
Разумеется, качественная структура и прочность кости, ее эффективное функционирование и своевременное самообновление возможны лишь при адекватной обеспеченности макро- и микроэлементами, которые, подобно кальцию и витамину D, принимают непосредственное участие в биохимических процессах костной ткани [2–5]. Магний, медь, цинк, марганец, бор, являясь кофакторами ферментов, регулируют синтез костного матрикса, его минерализацию, а также равномерный рост, гибкость и прочность костной ткани. Известно, что дефицит этих веществ замедляет формирование костной массы в детстве и подростковом возрасте, способствует ее ускоренной потере в пожилом возрасте. Соответственно, дефицит любого из известных минеральных веществ в организме препятствует успешной терапии и профилактике нарушений структуры кости [6, 7].
Одним из основных минералов, играющих важную роль в формировании и поддержании структуры костной ткани, является кальций. Поскольку кальций не производится в организме, то для поддержания оптимальной концентрации он должен регулярно поступать извне. Причем желательно, чтобы его поступление в организм обеспечивалось за счет натуральных молочных продуктов, молока и его производных (кефира, простокваши, ряженки, йогурта, творога, сыра). Вместе с тем биодоступность кальция из пищи составляет порядка 30%, причем с высокой индивидуальной вариабельностью. Более того, у лиц пожилого возраста нередко имеет место непереносимость молочных продуктов, связанная со снижением концентрации лактазы в желудочном соке, что приводит к низкому потреблению кальция.
Согласно эпидемиологическим исследованиям, среди женщин в возрасте старше 45 лет, проживающих в мегаполисах, непереносимость молока встречается с частотой 25,0–34,0%. При этом достаточное потребление кальция с продуктами питания имеет место менее чем у 5% женщин [8]. Фактически содержание кальция в пищевом рационе постменопаузальных женщин не соответствует рекомендованным нормам. Очевидно, что обеспечение должного уровня потребления кальция возможно лишь при условии дополнительного регулярного назначения медикаментозных препаратов.
Витамин D — основной регулятор активной абсорбции кальция в организме. Витамин D относят к группе жирорастворимых витаминов. Хотя в отличие от всех других витаминов он биологически не активен. В активную, гормональную, форму он превращается за счет двухступенчатой метаболизации в организме и оказывает многообразные биологические эффекты за счет взаимодействия со специфическими рецепторами, локализованными в ядрах клеток тканей и органов. Другое дело — активный метаболит витамина D. Он действует как истинный гормон, хотя в научной литературе его традиционно называют витамином D [9, 10].
Природная форма витамина D — витамин D2 (эргокальциферол) поступает в организм человека в относительно небольших количествах — не более 20–30% от потребности. В основном из злаковых растений, рыбьего жира, сливочного масла, маргарина, молока, яичного желтка и др. В организме витамин D2 метаболизируется с образованием производных, обладающих сходным с метаболитами витамина D3 действием.
Еще одна природная форма витамина D — витамин D3, или холекальциферол, является ближайшим аналогом витамина D2, но его синтез мало зависит от поступления извне. Холекальциферол образуется в организме позвоночных животных, в том числе амфибий, рептилий, птиц и млекопитающих, в связи с чем играет значительно бóльшую роль в процессах жизнедеятельности человека, чем поступающий в небольших количествах с пищей витамин D2. В организме витамин D3 образуется из находящегося в дермальном слое кожи предшественника (7-дегидрохолестерина) под влиянием коротковолнового ультрафиолетового облучения спектра В (УФ–В/солнечного света, длина волны 290–315 нм) при температуре тела в результате фотохимической реакции раскрытия В-кольца стероидного ядра и термоизомеризации, характерной для секостероидов [9, 10].
В последующем поступивший с пищей и/или образовавшийся в организме в процессе эндогенного синтеза витамин D подвергается реакции 25-гидроксилирования в печени. Важно, что гидроксилирование витамина D3 в печени представляет собой полностью субстратзависимый процесс, который протекает весьма быстро и ведет к повышению уровня 25(ОН)D в сыворотке крови. Уровень этого вещества отражает как образование витамина D в коже, так и его поступление с пищей, в связи с чем может использоваться как маркер статуса витамина D [9, 10].
Вторая реакция гидроксилирования 25(ОН)D, с образованием наиболее важной, качественно и количественно значимой активной гормональной формы — 1a,25-дигидроксивитамина D3 (1α,25(ОН)2D3), называемой также D-гормоном, кальцитриолом, протекает уже в основном в почках, в клетках проксимальных отделов канальцев коры почек при участии фермента 1α-гидроксилазы (CYP27В1). Этот процесс строго регулируется рядом эндогенных и экзогенных факторов. Во-первых, регуляция синтеза 1a,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ), на концентрацию которого в крови, в свою очередь, по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация кальция и фосфора в плазме крови. Во-вторых, активация синтеза 1a-гидроксилазы и реакции 1a-гидроксилирования зависит от половых гормонов (эстрогенов и андрогенов), кальцитонина, пролактина, гормона роста (через ИПФР-1) и др. В-третьих, ингибирующее влияние на активность 1a-гидроксилазы оказывают глюкокортикостероидные гормоны, 1α,25(ОН)2D3 и ряд его синтетических аналогов. Фактор роста из фибробластов (FGF23), секретируемый в клетках кости, вызывает образование натрий-фосфат-котранспортера, который действует в клетках почек и тонкого кишечника, оказывает тормозящее влияние на синтез 1,25-дигидроксивитамина D3. На метаболизм витамина D оказывают влияние и некоторые лекарственные средства, например, противоэпилептические препараты.
Основными реакциями, в которых участвует D-гормон, являются абсорбция кальция в желудочно-кишечном тракте и его реабсорбция в почках. D-гормон усиливает кишечную абсорбцию кальция в тонком кишечнике за счет взаимодействия со специфическими РВD. Об эффективности данного механизма свидетельствует тот факт, что без участия витамина D лишь 10–15% пищевого кальция и 60% фосфора абсорбируются в кишечнике. Взаимодействие между 1a,25-дигидроксивитамином D3 и РВD повышает эффективность кишечной абсорбции Са 2+ до 30–40%, т. е. в 2–4 раза, а фосфора — до 80%. Сходные механизмы действия D-гормона лежат в основе осуществляемой под его влиянием реабсорбции Са 2+ в почках.
В костях 1α,25(ОН)2D3 связывается с рецепторами на кость-формирующих клетках — остеобластах, вызывая повышение экспрессии ими лиганда рецептора активатора ядерного фактора кВ (RANKL). Рецептор-активатор ядерного фактора кВ (RANK), являющийся рецептором для RANKL, локализованным на преостеокластах, связывает RANKL, что вызывает быстрое созревание преостеокластов и их превращение в зрелые остеокласты. В процессах костного ремоделирования зрелые остеокласты резорбируют кость, что сопровождается выделением кальция и фосфора из минерального компонента (гидроксиапатита) и обеспечивает поддержание уровня кальция и фосфора в крови. В свою очередь, адекватный уровень кальция (Са 2+ ) и фосфора необходим для нормальной минерализации скелета [11–13].
Многочисленные исследования показали, что назначение препаратов кальция и/или витамина D способствует уменьшению потери костной ткани [14–19]. У женщин в поздней постменопаузе с низким употреблением пищевого кальция прием кальция предотвращает потерю костной ткани в позвоночнике [20, 21]. В свою очередь, назначение добавок кальция лицам старше 60 лет приводит к снижению потери костной массы в области бедра среди белых мужчин и женщин в возрасте моложе 72 лет [22]. Эффект назначения цитрата кальция на минеральную плотность кости (МПК) у женщин в раннем (до 5 лет) и среднем (от 5 до 10 лет) постменопаузальном периоде в течение двух лет проявлялся в виде прироста МПК в поясничном отделе на 1%, наряду со значимым снижением МПК на 2,4% в группе, получавшей плацебо [23]. Метаанализ 9 рандомизированных клинических исследований с общей выборкой более 50 тыс. человек, в 6 из которых сравнивалось комбинированное лечение витамином D (400 или 700–800 МЕ/сут) и кальцием с группами плацебо или без лечения, продемонстрировал достоверное снижение риска перелома бедра на 18% (RR 0,82 [95% ДИ 0,71–0,94], р = 0,0005) и риска внепозвоночных переломов на 12% (RR 0,88 [95% ДИ 0,78–0,99], р = 0,036) в группах, получавших комбинированную терапию, по сравнению с группами без добавок [24]. В исследованиях, где применялся витамин D в дозе 700–800 МЕ/сут, эффект на риск перелома бедра был выше, чем при приеме 400 МЕ (21% и 18% соответственно). Соответственно, в исследованиях, в которых пациенты получали только витамин D или плацебо (4 РКИ с общей численностью 9083 пациента), не было получено снижения риска внепозвоночных переломов как при применении дозы 400 МЕ (RR 1,14 [95% ДИ 0,87–1,49]), так при использовании 700–800 МЕ (RR 1,04 [95% ДИ 0,75–1,46]), что подтверждает ранее представленные данные о том, что витамин D без добавления кальция не снижает риск переломов [24].
Магний
Известно, что 60–65% магния находится именно в скелете и от обеспеченности костей магнием зависит обмен кальция и витамина D. Являясь структурным компонентом значительного числа ферментов, магний образует кристаллы с фосфатами, принимает участие в росте и стабилизации кристалла гидроксиапатита — структурной единицы минерального компонента костной ткани [25, 26]. Магний регулирует секрецию паратгормона (ПГ), повышает чувствительность клеток-мишеней к ПГ и витамину D, стимулирует действие кальцитонина. Длительное во времени нарушение соотношения Mg/Ca в сторону дефицита магния сопровождается замедлением обменных процессов в кости. Специальные магний-дефицитные диеты, сопровождающиеся уменьшением сывороточной концентрации магния, способствуют системной потере костной массы, снижению толщины надкостницы, характерным изменениям провоспалительных маркеров и маркеров резорбции кости. Уже по истечении достаточно короткого срока (4 недели), магний-дефицитная диета приводит к значимому снижению содержания минеральных веществ кости (р
ГБОУ ВПО ОмГМУ МЗ РФ, Омск