Имплантация микробиома что это
Трансплантация фекальной микробиоты и иммунотерапия онкологических заболеваний
Меланома – злокачественная опухоль из пигментных клеток кожи. Заболеваемость меланомой в последние годы неуклонно растет, при этом прогноз пациентов с метастатической формой заболевания остается крайне неблагоприятным. Появление нового класса иммунопрепаратов – блокаторов рецептора PD-1, – позволило достичь определенных успехов в лечении метастатической формы меланомы. Препараты данного класса ( пембролизумаб, ниволумаб) блокируют рецептор программируемой гибели клеток PD-1 (programmed cell death-1) на поверхности T-лимфоцитов, тем самым активируя противоопухолевый иммунитет.
В 2018 году опубликован ряд исследований на мышиных моделях, в ходе которых установлено, что эффективность блокаторов рецептора PD-1 тесно связана с составом кишечной микробиоты. При этом авторы не пришли к единому мнению относительно вида микроорганизмов, которые могли бы послужить предикторами ответа на иммунотерапию. Попытки применения полученных данных в клинической практике до настоящего времени не предпринимались.
Однако, в феврале 2021 года в журнале Science опубликованы результаты исследований, в которых изучалась эффективность и безопасность трансплантации фекальной микробиоты у пациентов с метастатической меланомой, рефрактерной к терапии блокаторами PD-1.
Так, Baruch и соавт. провели пересадку микробиоты от двух пациентов, ответивших на терапию блокаторами PD-1, десяти пациентам, у которых применение данной группы препаратов оказалось безуспешным. Реципиентам первоначально проводилась антибактериальная терапия с целью уменьшить количество бактерий в кишечнике, затем – трансплантация кала совместно с повторным индукционным курсом ниволумаба. Уменьшение размеров опухоли было отмечено у трех пациентов, при этом у одного из них наблюдался полный ответ на лечение (исчезновение всех опухолевых очагов). Следует отметить, что у всех трех пациентов, ответивших на терапию после трансплантации микробиоты, в собственной пластинке слизистой оболочки кишечника и опухолевой ткани наблюдалось увеличение количества иммунных клеток, а также повышение экспрессии генов, регулирующих иммунный ответ.
В исследование Davar и соавт. было включено 16 пациентов с прогрессирующей меланомой, не ответивших на терапию блокаторами PD-1. Реципиентам проводилась трансплантация микробиоты от семи доноров с частичным либо полным ответом на лечение препаратами данного класса наряду с повторной терапией пембролизумабом. В ходе исследования у шести пациентов был достигнут ответ на терапию. Кроме того, авторы отметили повышение содержания бактериальных таксонов, которые, согласно проведенным ранее исследованиям, связаны с активацией CD8+ T-лимфоцитов и уменьшением количества миелоидных клеток.
Авторы пришли к выводу, что проведение трансплантации фекальной микробиоты совместно с повторным курсом блокаторов PD-1 приводит к изменениям в иммунной системе, которые способствуют преодолению резистентности к иммунотерапии. Так как данный класс препаратов применяется не только при меланоме, но и при опухолях других локализаций (рак легкого, почек), дальнейшие исследования в данной области позволят определить роль трансплантации микробиоты в иммунотерапии рака.
Специфика костного материала bio oss
Атрофия костной ткани – это уменьшение объема челюстной кости, которая развивается на фоне отсутствия моляров и премоляров в течение продолжительного периода времени. Обнаружить его удается только при посещении стоматологического кабинета. Это связано с тем, что визуально человеку может быть незаметна атрофия.
Чаще всего с целью восстановления костной ткани прибегают к помощи биоматериала Bio-Oss. Он пользуется особым спросом, за годы применения был накоплен большой опыт по его использованию. Он имеет природное происхождение, за счет чего химически и структурно совместим с минерализованной костью человека. В ходе ряда клинических исследований была подтверждена безопасность и надежность материалов. Рассмотрим подробнее, какими преимуществами он обладает, и в каких ситуациях применяют.
Причины потери костной ткани
Убыль костной ткани способна развиться на фоне одного или нескольких факторов. Основная причина появления недуга – утрата зубов. Спустя 4-6 месяцев после их удаления, челюстная кость начинает существенно сокращаться в объеме, а через 12 месяцев доходит до своего минимума. Среди других факторов, провоцирующих атрофию костной ткани, отмечают:
Когда необходимо восстанавливать кость?
Восстановление необходимо при пародонтите, чтобы сохранить здоровые зубы, которые потеряли связь с костью. Часто врачи проводят увеличение объема костной ткани, если ее недостаточно для осуществления надежной имплантации. Во время осуществления операции синус-лифтинг восстановление требуется для замещения недостающей кости в верхнечелюстных пазухах. Во время цистэктомии восстановление необходимо для замещения приобретенного дефекта.
Характеристики костного биоматериала Bio-Oss
Костнозамещающий материал bio oss производит ведущая компания Geistlich Pharma. Она признана одним из крупнейших производителей биоматериалов для регенерации костной и мягких тканей. Страна-производитель: Швейцария. В процессе производства предусмотрена высокая степень очистки с соблюдением строгих правил техники безопасности. Производство включает стерилизацию одних продуктов сухим жаром, а других – облучением γ-лучами.
Bio-Oss состоит из крупного рогатого скота – бычьей кости. По своей структуре бычья кость является практически идентичной структуре человеческой кости. Это гарантирует быструю адгезию клеток: обеспечивается их ускоренное сцепление и регенерация тканей. Кроме того предоставляется костная матрица для прорастания новой ткани.
Благодаря высокопористой микроструктуре, натуральный костный материал способен обеспечивать беспрепятственный ангиогенез и остеогенез, сохраняя при этом объем на протяжении длительного периода времени. Bio-Oss характеризуется шероховатой поверхностью, способствующей прикреплению и размножению костных клеток.
Средство отличается широким ассортиментом. Для удобства его выпускают в разных формах – в виде блока, гранул, коллагеновой мембраны или матрицы. Принцип действия Био-Осс состоит в том, что материал заполняет образовавшиеся пустоты в костной ткани, создавая некий каркас и естественную среду для восстановления кровеносных сосудов в поврежденной области кости.
Существует и другой достойный материал – Био-Гайд (Gide) с натуральной белковой структурой. Он представляет собой резорбируемую мембрану, которая не дает врастись мягкой ткани в область дефекта, гарантируя быстрое заживление раны. Ее применение способствует достойному результату процедур по восстановлению костной ткани и имплантации моляров и премоляров.
Основные преимущества
Костный материал bio oss успешно применяют ведущие врачи-стоматологи уже долгие годы, в частности, специалисты клиники «А-Медик». К его достоинствам относятся:
Основные показания и противопоказания к применению
Био осс (костный материал) характеризуется широким спектром показаний для применения в различных сферах, в частности, челюстно-лицевой хирургии, хирургической стоматологии и имплантологии. Его используют для заполнения лунки зуба после удаления, чтобы сохранить объем кости для дальнейшей имплантации. Зачастую к помощи bio oss прибегают при выполнении операции синус-лифтинга. При выполнении одномоментной имплантации проводят заполнение зазоров после установки имплантата.
Также, материал необходим для оптимальной стабильности объема в области выраженных дефектов и проведении операции вертикальной и горизонтальной аугментации (заполнения зазоров после фиксации блока и нанесение прослойки гранул, чтобы значительно улучшить контур аугментата). Иногда требуе6тся заполнение дефектов кости после проведения цистэктомии (хирургической операции по удалению кисты зуба вместе с поврежденной частью корня).
Гранулы выпускают разных размеров, что определяет их основное назначение. Гранулы размера «S» требуются для заполнения небольших костных дефектов, зазоров между блоком и костью, поскольку они лучше адаптируются к поверхности. Гранулы размера «L» требуются для проведения операций синус-лифтинга и серьезных дефектов.
Однако, несмотря на ряд преимуществ и широкого спектра показаний, к применению материала bio oss существует ряд противопоказаний. К ним относятся:
Особенности оперативного вмешательства
Как правило, восстановление кости и установку имплантата осуществляют одновременно. Для формирования новой кости дефект заполняют биоматериалом Био-Осс, а для направленной регенерации на рану накладывают мембрану Био-Гайд.
После проведения оперативного вмешательства возможно появление небольшой припухлости и отечности, которые можно устранить с помощью холодного компресса. Первые 10-14 дней во время чистки зубов следует избегать травм оперированного участка, пользоваться антибактериальным ополаскивателем. При появлении сильных болезненных ощущениях врач может назначить обезболивающее средство. При этом важно регулярно показываться врачу-стоматологу даже в том случае, если ничего не беспокоит и заживление протекает благополучно.
Костный материал bio oss: отзывы
Александр, 30 лет. Потерял два зуба несколько лет назад, долго не ходил к врачам и никак не решал эту проблему. Недавно понадобилась помощь стоматолога, записался на прием в клинику «А-Медик». Очень понравилось чуткое отношение врача! Провел диагностику и посоветовал провести имплантацию. Во время нее специалист использовал материал Био-Осс, чтобы восстановить утраченную костную ткань. Процедура прошла хорошо, побочная реакция на материал не возникла.
Оксана, 43 года. В прошлом месяце в клинике «А-Медик» мне проводили синус-лифтинг с применением швейцарского материала Bio-Oss. Заранее прочитал о нем отзывы в интернете, все писали, что материал достойный. Теперь я полностью с ними согласен!
Не все йогурты одинаковые — полезные статьи Активиа
Микробиота кишечника: что это такое и в чём её роль в организме человека
В нашем организме около 30 триллионов клеток и почти столько же бактерий.
Что такое микробиота?
По нашему телу микроорганизмы распределены неравномерно, и в местах обитания бактерий – нишах – формируется свое особенное микробное сообщество: на коже, в полости рта, дыхательных путях и кишечнике.
***Разная микробиота: собственные наборы бактерий для кожи, полости рта, лёгких, влагалища, кишечника.
Человек не приходит в этот мир с уже сформировавшейся микробиотой — она развивается и до, и после рождения.
Примерно к трем годам у ребенка полностью формируется микробиота [2]. В течение всей жизни она будет меняться незначительно [3], а в пожилом возрасте ее состав станет менее разнообразным из-за процессов старения и влияния привычной пищи [4].
Микробиом, микробиота, микрофлора — в чем разница?
Термины «микробиом» и «микробиота» часто используются как синонимы, но различия между ними все-таки есть.
Микробиота — это совокупность микроорганизмов определенной экосистемы (наше тело — тоже своего рода макроэкосистема для различных микроорганизмов). Ее составляют не только бактерии — она включает еще и дрожжи, вирусы, археи и другие виды микроорганизмов.
Микробиом — это совокупность генов микробиоты, ее коллективный геном.
Кто населяет наш кишечник?
Условно-патогенные (оппортунистические) бактерии для здорового человека обычно безвредны. Но они резко размножаются при негативном воздействии на организм. Если человек получил травму, произошел сбой в иммунной системе или нарушился баланс в составе микробиоты, нейтральные микробы могут стать патогенными. Например, из-за стресса на фоне приема антибиотиков растет число оппортунистических бактерий [8,9].
Функции кишечной микробиоты
Работа, которую выполняют бактерии кишечника, трудна и незаметна — по крайней мере, на первый взгляд. Однако именно микробиота нужна для выполнения нескольких важных функций организма [10]:
• Поддержка иммунитета. Микробиота нужна для эффективной работы иммунной системы: бактерии кишечника выступают в роли своеобразного «тренажера». А главное, обитатели микробиома постоянно конкурируют между собой, занимая свободное пространство, и места для патогенных микробов уже не остается.
• Синтез витаминов (К, группы В и других), которые всасываются в кишечнике вместе с пищей.
Этим перечнем функции микробиоты не исчерпываются. Исследования показывают [11], что бактерии в ее составе влияют на настроение, на работу нейромедиаторов и на уровень главного гормона стресса — кортизола.
Все эти функции — пищеварение, помощь иммунной системе, синтез витаминов — выполняют далеко не все бактерии. Микробиота — это целая экосистема, где каждая часть микроорганизмов отвечает за свою задачу. Фактически, это орган в органе со своими особенностями и функциями. Мы получаем его при рождении и растем вместе с ним, формируя свой собственный, уникальный профиль микробиома.
Что может влиять на микробиоту
Что же влияет на микробиоту?
Как улучшить микробиом кишечника
Вопросы и ответы о микробиоте
Различается ли микробиота толстого и тонкого кишечника?
Да, различается — и по составу (количественному и качественному), и по функциям. Микробиота тонкого кишечника отвечает за защиту слизистой оболочки, принимает активное участие в усвоении питательных веществ, участвует в иммунной защите нашего организма.
Микробиом толстого кишечника — это настоящий центральный реактор всего ЖКТ. От него зависит наше самочувствие. К тому же, в толстом кишечнике микробиоты в разы больше, чем в тонком. Поэтому мы чаще говорим о микробиоте толстого кишечника.
Как узнать состояние своей микробиоты?
Если исследование нужно для лечения, назначить его и интерпретировать полученные результаты должен только лечащий врач.
Связаны ли микробиоты разных органов?
Тем не менее, микробиоты могут влиять друг на друга. Например, продолжительный прием определенных лекарств может привести к тому, что микробы желудка будут попадать в кишечник и там размножаться, приводя к дисбиозу.
Что такое “пересадка микробиоты”?
Это еще один способ восстановить баланс микроорганизмов, когда бактерии доставляются не стандартным способом, через весь ЖКТ, а сразу в нужную часть кишечника. Так микробы оказываются на нужном месте быстрее, но пересадка весьма трудоемка, и используют ее редко, только при очень тяжелых заболеваниях. Чаще всего достаточно классических методов лечения.
Физические упражнения – новый подход к коррекции микробиома

С появлением возможности изучения микробиома кишечника, влияние на его таксономический состав и метаболизм с помощью упражнений служит предметом широкого научного интереса
Микробиом человека – важная составляющая здоровья
С развитием в конце ХХ века методов, позволяющих оценить состав и функции микроорганизмов, а именно секвенирования генома, появилась возможность изучить разнообразие микробных сообществ. Для качественной и количественной оценки бактериального разнообразия в образцах широко применяется секвенирование 16S рибосомальной РНК микроорганизмов, все более доступными становятся методы метагеномного анализа, позволяющие провести оценку метаболизма и функций того или иного вида бактерий. (3)
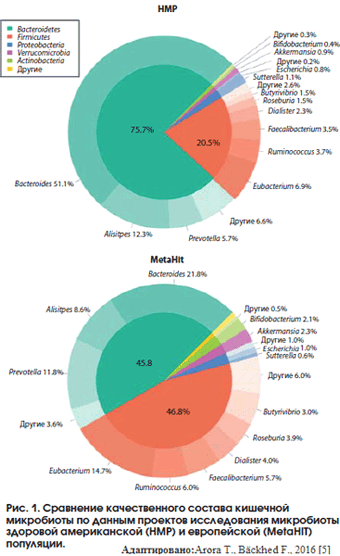
Наибольшее количество бактерий находится в толстой кишке, среди которых в норме преобладают два типа, Bacteroidetes и Firmicutes (∼90%). Тип Firmicutes состоит из более чем 250 родов бактерий, среди которых Lactobacillus и Clostridium, в то время как тип Bacteroidetes включает 20 родов, с преобладанием Bacteroides. Такие типы как Actinobacteria, Proteobacteria и Verrucomicrobia обнаруживаются в составе нормальной микрофлоры, но в гораздо меньших количествах. (1,4) Кроме того, среди здоровой микробиоты толстой кишки могут встречаться метанопродуцирующие археи, которые, в отличии от других живых организмов, не содержат пептидогликан в клеточной стенке и имеют особые рибосомы и рибосомные РНК, а также эукариоты (дрожжи) и вирусы.
Понятие “нормы” в отношении кишечного микробиома относительно, его состав может изменять множество различных факторов, воздействующих на кишечник и организм человека в целом. В настоящее время важным для поддержания равновесия между непатогенными и условно-патогенными бактериями считается отношение численности Bacteroidetes к Firmicutes (так называемый градиент Firmicutes/Bacteroidetes). (5)
Заселение кишечника микроорганизмами начинается с рождения, и состав микробиома определяется в значительной степени способом родоразрешения. В последующем микрофлора кишечника изменяется в зависимости от пищевых привычек, адаптируясь к новым продуктам в рационе человека. (6, 7) Вакцинация, различные заболевания, прием лекарственных препаратов, курение и другие факторы также влияют на композицию кишечного микробиома и его метаболизм. (8, 9) В то же время имеет место двустороннее взаимодействие между микро- и макроорганизмом. Очевидной демонстрацией этому служит важная роль кишечной микробиоты в формировании гипоталамо-гипофизарно-надпочечниковой оси, которая участвует в регуляции иммуномодуляции, обмена липидов, энергетического баланса и электрофизиологической активности энтеральной нервной системы. (11)
Влияние физических упражнений на изменение кишечного микробиома
Регулярные физические упражнения рекомендованы Всемирной организацией здравоохранения для укрепления здоровья и снижения риска развития многих заболеваний, в том числе психических, а также для увеличения продолжительности жизни. (12) Эти рекомендации основаны на данных множества исследований, демонстрирующих разнообразие патогенетических путей, посредством которых улучшается здоровье на фоне физической нагрузки. (13) С появлением возможности изучения микробиома кишечника, влияние на его таксономический состав и метаболизм с помощью упражнений служит предметом научного интереса.
Изучение микробного состава животных при физических упражнениях демонстрирует противоречивые результаты. Например, в некоторых исследованиях обнаружено увеличение градиента Firmicutes/Bacteroidetes, в то время как другие свидетельствуют о его снижении или отсутствии изменений. (Таблица 1)
Вероятно, это связано с отсутствием стандартизации вида физических упражнений, породы и возраста животных, их диеты.
Таблица 1. Влияние физических упражнений на кишечный микробиом животных
Имплантация микробиома что это
1 ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России;
2 ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России;
3 ФГБОУ ВО «Первый СПбГМУ им. акад. И.П. Павлова» Минздрава России,
Санкт-Петербург
Современная концепция симбиотических взаимоотношений между макроорганизмом и микробиотой кишечника не вызывает сомнений. На состав микробиоты прежде всего влияют факторы окружающей среды, генетические и иммунные факторы организма хозяина. Дисбиоз кишечника может привести к доминированию некоторых видов бактерий, способствующих активации механизмов канцерогенеза и развитию злокачественных опухолей толстой кишки за счет хронического воспаления или местной иммуносупрессии. В эру иммуноонкологии роль кишечной микробиоты в формировании ответа на иммунотерапию злокачественных новообразований представляет большой интерес для медицинского сообщества. Учитывая, что состав кишечной микробиоты является индивидуальным для каждого человека, ее исследование как нельзя лучше вписывается в набирающую силу концепцию персонализированного медицинского подхода.
Ключевые слова: кишечная микробиота, иммунотерапия, checkpoint-ингибиторы, антибиотикотерапия.
Роль кишечной микробиоты в различных аспектах лечения онкологических заболеваний с каждым годом становится все более значимой темой для медицинского сообщества. Это имеет свое отражение в количестве научных публикаций: при поиске работ, содержащих указание на связь состава микробиома с онкологическими заболеваниями, представлено более 1500 статей. Разрабатываются новые методы использования микроорганизмов в диагностике, лечении и прогнозировании отдельных злокачественных новообразований. Изучением роли количественного и качественного состава микрофлоры в формировании ответа на различные терапевтические агенты в настоящее время занимаются исследователи во многих странах мира. Большой интерес представляют научные работы, посвященные области иммунотерапии онкологических заболеваний. Также определение состава кишечной микробиоты является одной из перспективных задач, которая в будущем позволит оценивать клинический ответ на применение таргетных препаратов.
МАКРООРГАНИЗМА И МИКРОБИОТЫ КИШЕЧНИКА
Колонизация желудочно-кишечного тракта микроорганизмами начинается сразу же после рождения, а точнее уже при прохождении плода через родовые пути матери 7. На разнообразие микробиома оказывает влияние большое количество факторов, таких как диета, половая и этническая принадлежность 13. Способ родоразрешения при этом оказывается очень важным фактором, который обусловливает получение новорожденным первичной микробиоты. В нескольких зарубежных исследованиях доказана корреляция между кесаревым сечением и становлением иммунной системы 16. Это означает, что состав комменсальной микрофлоры может играть роль в иммунном ответе и, таким образом, возможно, определяет уровень восприимчивости организма к различным заболеваниям [8, 19]. Дисбиоз кишечника, как проявление нарушения равновесия в бактериальной экосистеме, приводит к превалированию количества некоторых видов бактерий над другими. Это может с большой степенью вероятности способствовать активации механизмов канцерогенеза и, как следствие, возникновению злокачественных новообразований 22.
Следует учитывать, что кишечный микробиом – модифицируемая единица, что может быть залогом хороших результатов восстановления благоприятного микробиоценоза у онкологических больных. С началом развития методов иммунотерапии в последние годы стала рассматриваться также тема роли кишечной микробиоты в формировании ответа на воздействие различных классов противоопухолевых препаратов. Результаты достаточно большого количества исследований показывают, что при внесении бактериальных образцов от доноров в организм пациентов, страдающих от онкологических заболеваний, стимулируется рост собственной микробиоты у реципиентов, увеличение ее разнообразности, что в свою очередь повышает способность организма осуществлять контроль над механизмами канцерогенеза 27. Это дает основание дальнейшему исследованию корреляции между использованием иммунотерапевтических методов лечения злокачественных новообразований и значением состава микрофлоры кишечника. Некоторые исследователи говорят о том, что микробиота кишечника оказывает влияние на распространенность опухоли и, следовательно, продолжительность жизни пациентов путем воздействия на процессы молекулярного окислительного стресса 32 и системную генотоксичность периферических лейкоцитов [31], что приводит к снижению активности процессов системного воспаления, играющего основную роль в развитии злокачественных новообразований.
Учитывая, что состав кишечной микробиоты индивидуален для каждого отдельного человека, можно говорить о том, что необходимость его изучения соответствует принципам персонализированной медицины.
КИШЕЧНАЯ МИКРОБИОТА КАК МОДУЛЯТОР ОТВЕТА
НА ИММУНОТЕРАПИЮ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Большинство работ, посвященных определению ключевой роли микробиома кишечника, были выполнены на мышиных моделях. В подавляющем большинстве исследований было показано, что ответ опухоли на терапию химиопрепаратами и check-point ингибиторами (ингибиторами иммунных «точек контроля») [25, 34-38] был обусловлен накоплением опухолеспецифических Т-клеток CD8+ [37, 39-41]. Также в некоторых исследованиях было освещено участие дендритных клеток в активации данных механизмов, при этом установлено увеличение накопления и прайминга CD8+ Т-лимфоцитов в микроокружении опухоли [37, 42].
Мнение о том, бактерии каких преимущественно типов могут опосредовать наилучший ответ на противоопухолевую иммунотерапию, до сих пор не стало единым. Имеются данные о том, что наиболее выраженную эффективность показывают анти-PD-1-препараты, применяющиеся для пациентов, у которых обнаруживается преобладание бактерий рода Ruminococcaceae в фекальных образцах [43]. Однако исследователи других крупных лабораторий сообщают о том, что относительное превалирование Clostridiales [38] связано с более высокой эффективностью проводимой терапии, а также есть сведения, говорящие, что у когорт пациентов с преобладанием Faecalibacterium значительно повышает показатель выживаемости без прогрессирования (PFS) [44]. При этом пациенты, в образцах которых отмечалось повышенное содержание Bacteroidales, имели меньшую PFS по сравнению с группой пациентов со сниженным количеством этих бактерий в образцах.
В противоположность вышеупомянутым результатам имеется мнение, что эффективность анти-CTLA-4-терапии взаимосвязано с наличием в составе кишечной нормобиоты различных представителей рода Bacteroidales. На базе мышиных моделей, для того чтобы убедиться в связи доминирования Bacteroidales spp. с противоопухолевым эффектом анти-CTLA-4-препаратов, были выполнены повторные колонизации желудочно-кишечного тракта фекальными образцами, полученными от доноров и содержащими изоляты представителей рода Bacteroidales. На основании полученных данных было установлено, что заселение кишечника сочетанием B. fragilis и Burkholderia cepacia было связано с более выраженной эффективностью анти-CTLA-4-препаратов, в отличие от всех других использованных изолятов [38]. По мнению авторов, формирование ответа на иммунотерапию могло быть обусловлено Akkermansia muciniphila, так как эти бактерии являются комменсалами, и их присутствие в фекальных образцах было чаще связано с наилучшим клиническим исходом заболевания [38].
В нескольких научных исследованиях было установлено, что повышение количества бактерий рода Bifidobacterium в составе кишечного микробиома формирует Т-клеточный противоопухолевый ответ [37, 39-40]. Также было показано, что обладание комменсальной флорой с превалированием рода Bifidobacterium может обусловливать повышение активности противоопухолевого иммунитета, что тем самым улучшает эффект анти-PD-L1-терапии [37].
И, конечно же, оценка взаимосвязи ответа на анти-CTLA-4-препараты с количественным и качественным составом микробиома кишечника в настоящее время также имеет большую ценность. Анализ ряда зарубежных исследований показал, что имеются веские доказательства наличия изменений на уровне рода микроорганизмов сразу же после инициации лечения злокачественных новообразований с применением CTLA-4-ингибиторов. Так, было зафиксировано быстрое уменьшение представительства как Bacteroidales, так и Burkholderiales, с относительным преобладанием содержания Clostridiales при использовании ипилимумаба [38, 46].
Из всего вышеизложенного можно сделать заключение, что CTLA-4-ингибиторы могут влиять на количественный состав рода Bacteroides spp. в кишечнике, обладающего иммуногенными свойствами, что, в свою очередь, влияет на эффективность препаратов данной группы.
Эффективность иммунотерапии онкологических заболеваний
в условиях предшествующей антибиотикотерапии
Из проанализированных данных следует, что наиболее выраженный эффект иммунотерапии злокачественных опухолей возможно ожидать у пациентов, имеющих более широкое представительство микроогранизмов в составе микробиома кишечника. Следовательно, встает вопрос о пользе изучения влияния антибиотиков, которое они оказывают на эффективность применения методов иммунотерапии онкологических заболеваний, например, checkpoint-ингибиторов. Тот факт, что использование антибактериальных препаратов влечет за собой резкое изменение количественного и качественного состава микробиоты, как патогенной, так и комменсальной, на настоящее время доказан во множестве исследований 49. Антибиотики, независимо от пути введения их в организм, изменяют гомеостатическое равновесие бактериальной флоры кишечника 50, что существенно влияет на метаболизм всей совокупности микроорганизмов. В недавнем времени было установлено, что бактерии имеют значительное влияние на дифференцировку стволовых клеток. В свою очередь антимикробные препараты, изменяя состав микробиоценоза кишечника, приводят к различным модификациям путей развития клеток и, как следствие, к нарушениям физиологии на всех уровнях жизнедеятельности макроорганизма [52].
Кишечная микробиота играет важную роль в формировании иммунного ответа хозяина, поэтому необходимо учитывать то, что изменения ее состава могут приводить к негативным последствиям для макроорганизма [53]. Это было показано в ряде исследований, результаты которых говорят о том, что имеется определенная связь между составом микробиома и риском развития некоторых аутоиммунных заболеваний 53. Согласно имеющимся данным нескольких доклинических исследований, микробиота влияет на активность ингибиторов иммунных контрольных точек, а применение антибактериальных препаратов широкого спектра действия приводит к снижению эффекта от их применения 57. Существует мнение, что отрицательный эффект антибиотикотерапии на фоне использования checkpoint-ингибиторов связан исключительно с элиминацией комменсальной флоры.
На ежегодном международном урологическом симпозиуме (Орландо, Флорида), который был проведен в феврале 2017 года, были представлены результаты ретроспективного анализа данных 80 пациентов (Lisa Derosa et al., 2017) [56], установившие отчетливое снижение эффективности применения checkpoint-ингибиторов у больных почечно-клеточным раком, подвергшихся эмпирической или этиологической антибактериальной терапии за месяц до начала специального лечения.
Больным с диагнозом «метастатический почечно-клеточный рак» проводилась иммунотерапия ингибиторами иммунных «точек контроля»: монотерапия PD-1 или PD-L1 ингибиторами (n=67); комбинированная терапия PD-1 и CTLA-4 ингибиторами (n=10); комбинация PD-L1-ингибиторов и бевацизумаба (n=3). Из 80 пациентов почечно-клеточным раком (65% из которых являлись мужчинами) за месяц до начала иммунотерапии 16 больных (20%) получали антибактериальную терапию в основном антибиотиками широкого спектра действия (бета-лактамные антибиотики и фторхинолоны). Большинству больных ПКР (80%) была ранее выполнена нефрэктомия. В исследовании показано, что более агрессивное течение почечно-клеточного рака после лечения ингибиторами точек иммунного контроля наблюдается у больных, подвергшихся антибактериальной терапии, в сравнении с пациентами, не получавшими антибактериальные препараты (медиана времени до прогрессирования составила 2,3 и 8,1 месяца соответственно, p


