Индекс свободных андрогенов у женщин понижен что это значит
ПРОФИЛЬ «Индекс свободных андрогенов» в Москве
Срок исполнения:
Подготовка к исследованию
Описание
В состав профиля входят:
Тестостерон;
ГСПГ;
Индекс свободных андрогенов.
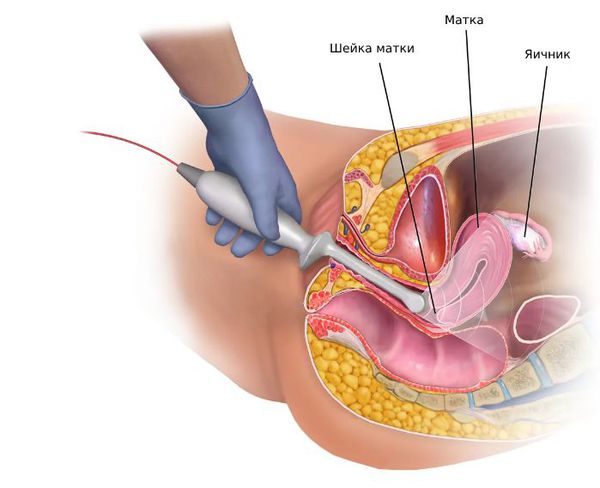
Тестостерон — главный мужской половой гормон. Поддерживает сперматогенез, обеспечивает плотность костей и мышечной ткани, влияет на психо-эмоциональное состояние. Выработку тестостерона контролирует лютеинизирующий гормон (ЛГ). Уровень тестостерона увеличивается после физической нагрузки и достигает максимальных цифр в утренние часы.При патологических состояниях тестостерон повышается при опухолях коры надпочечников, эктрагонадных опухолях.
Глобулин, связывающий половые гормоны (ГСПГ) – белок, контролирующий уровень свободного тестостерона в крови; также может связывать и транспортировать эстрадиол, гормоны щитовидной железы. В случае нарушения синтеза ГСПГ происходит нарушение доставки гормонов к органам мишеням и выполнению их физиологических функций. Низкий уровень ГСПГ у мужчин может быть связан с развитием нефротического синдрома, недостатком гормонов щитовидной железы, ожирением и инсулинорезистентностью, заболеваниями печени, циррозом, синдромом Кушинга.
Индекс свободных андрогенов. В случае, когда пациенту назначают определение в крови концентрации тестостерона и ГСПГ, то рассчитывают косвенный показатель уровня свободного тестостерона — индекс свободного тестостерона. Он является отношением концентрации тестостерона к концентрации ГСПГ в процентном выражении. Понижение свободного расчетного тестостерона может указывать на снижение свободного тестостерона.
На данное исследование скидки не предоставляются (см. Положение о скидках)
Индекс свободных андрогенов у женщин понижен что это значит
Получить результаты
Компания «Новые Медицинские Технологии»
Индекс свободных андрогенов
Группа исследований: Эндокринология
Сроки исполнения: 1 рабочий день*.
Биоматериал: кровь.
Справка: Индекс свободных андрогенов (ИСА) – соотношение общего тестостерона к глобулину, связывающему половые гормоны (ГСПГ), выраженное в процентах. Данное исследование применяется для диагностики патологических состояний, имеющих клинику нарушения продукции андрогенов, но сопровождающихся нормальным уровнем общего тестостерона в крови.
Для проведения данного теста необходимо определить уровень общего тестостерона, который в организме представлен двумя фракциями: свободным, который оказывает биологическое воздействие на клетки организма, и вторая фракция – связанная с транспортными белками крови (с альбумином и с ГСПГ). В клетки-мишени может проникать только свободный тестостерон и тестостерон, связанный с альбумином, они составляют биодоступный тестостерон.
Продукция общего тестостерона контролируется гипоталамо-гипофизарно-яичковой вертикалью. Лютеинизирующий гормон (ЛГ) стимулирует производство общего тестостерона клетками Лейдига и способствует развитию яичек, а фолликулостимулирующий гормон (ФСГ) совместно с общим тестостероном регулирует сперматогенез и созревание сперматозоидов. Общий тестостерон регулирует выделение ЛГ и ФСГ посредством отрицательной обратной связи гипоталамуса и гипофиза. Таким образом, содержание фракций тестостерона зависит как от уровня тестостерона, так и от содержания белков. Уровень синтеза ГСПГ в печени прямо пропорционально зависит от концентрации половых гормонов в организме: эстрогены увеличивают, а андрогены снижают его продукцию. Поэтому, содержание ГСПГ у женщин почти вдвое выше, чем у мужчин. При снижении продукции андрогенов увеличение синтеза ГСПГ обуславливает поддержание на постоянном уровне общего тестостерона, хотя концентрация свободного гормона снижается. Именно поэтому для оценки уровня биодоступного тестостерона и используют показатель – индекс свободных андрогенов (ИСА).
Показания к назначению: Адреногенитальный синдром, гирсутизм, ановуляция, аменорея, синдром поликистозных яичников, заболевания щитовидной железы у женщин; прогнозирование развития гестоза, прием оральных контрацептивов. Мужской климакс, хронический простатит; нарушение потенции и снижение либидо у мужчин. Облысение, угревая сыпь, жирная себорея, выявление маркеров инсулинорезистентности, клинические признаки увеличения или снижения уровня андрогенов при нормальном уровне тестостерона у мужчин и женщин.
Нормальные показатели::
| показатель | норма (%) |
| мужчины | 14,8 – 95 |
| женщины | |
| фолликулярная фаза | 0,8 – 9,3 |
| овуляция | 1,3 – 17 |
| лютеиновая фаза | 0,8 – 11 |
| менопауза | до 6,6 |
Увеличение ИСА имеет клиническое значение только для женщин, поскольку в значительном большинстве случаев у пациенток, страдающих бесплодием и имеющих признаки гирсутизма, определяется содержание тестостерона по верхней границе референсных значений, что затрудняет диагностику. Как правило, в таких случаях повышение ИСА позволяет выполнить точные диагностические мероприятия и провести лечение.
Снижение ИСА, напротив, имеет значение только в андрологической клинике для диагностики различных нарушений половой сферы, связанных с тестикулярной недостаточностью.
Что такое гиперандрогения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
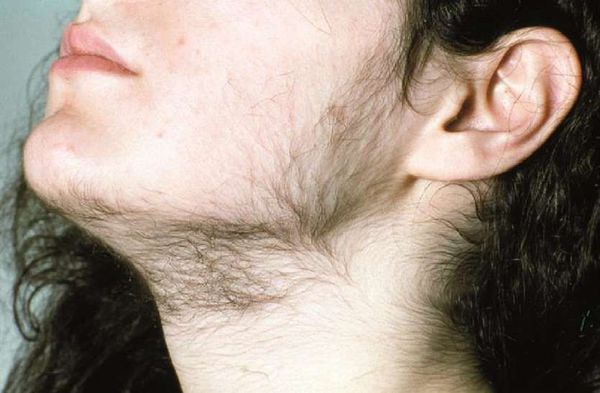
Гиперандрогения — это состояние, при котором у женщины в крови значительно повышен уровень мужских половых гормонов (андрогенов): тестостерона, дигидротестостерона, андростендиона и других.
Распространённость
Причины
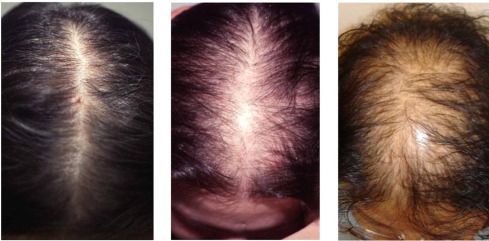
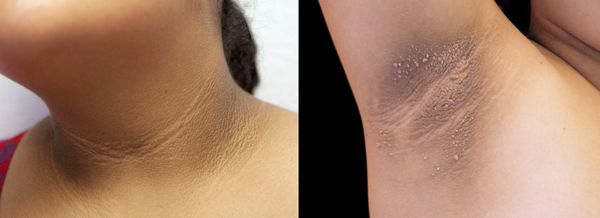
Симптомы гиперандрогении
Патогенез гиперандрогении
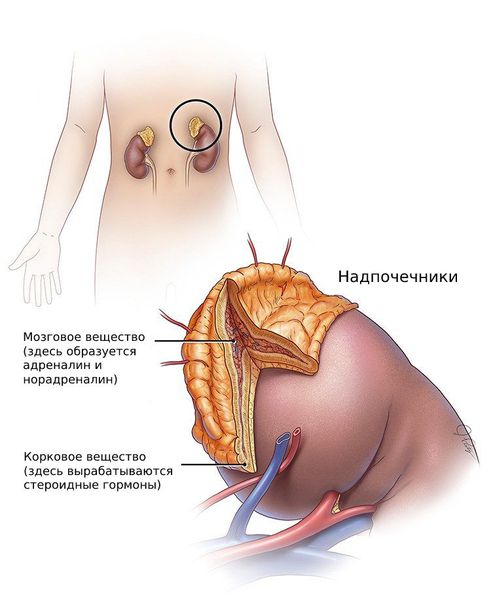
Андрогены — стероидные половые гормоны, которые вырабатываются из холестерина в коре надпочечников, а также в клетках фолликулов и соединительной ткани яичников.
К андрогенам относятся:
Роль андрогенов
В женском организме андрогены поддерживают гормональный баланс и после начала полового созревания инициируют рост волос на лобке и в подмышечных впадинах. Также они необходимы для выработки эстрогена и возникновения полового влечения.
Андрогены замедляют потерю кальция в костях и регулируют работу внутренних органов и систем: репродуктивной, почечной, мышечной и сердечной.
Гормональная регуляция происходит почти мгновенно с малым количеством активного вещества — гормона. Другая её особенность заключается в дистанцировании: гормон может вырабатываться в одной железе, а попадать в орган-мишень, находящийся в другой части организма.
В плазме крови андрогены взаимодействуют с глобулином, связывающим половые гормоны (ГСПГ). Он выполняет транспортную роль: вместе с ним андрогены доставляются с кровью в клетки органов-мишеней.
Избыток андрогенов
К избытку андрогенов могут приводить различные патологические механизмы:
Повышать уровень андрогенов могут и другие внешние факторы, например приём стероидов и гормональных препаратов. Интересно, что при всех гиперандрогенных состояниях, андрогены происходят более чем из одного источника. Так, при поликистозе яичников увеличен синтез тестостерона, но большая часть этого гормона образуется вне яичников — в надпочечниках.
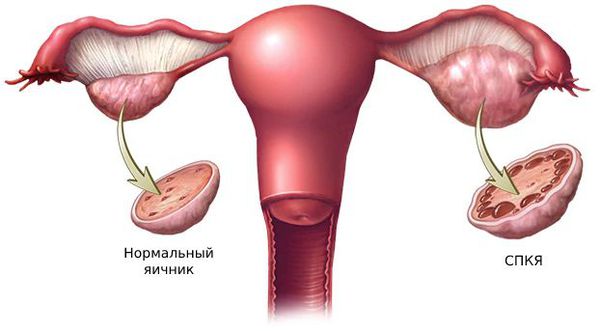
Большую роль в развитии первичной гиперандрогении играют генетические факторы. Одной из причин синдрома поликистозных яичников (СПКЯ) является генетически предопределённый избыток лютеинизирующего гормона (ЛГ). ЛГ стимулирует образование мужских половых гормонов: тестостерона и андростендиона. Их чрезмерная выработка нарушает процесс развития фолликулов: они преждевременно перерождаются в жёлтое тело и в этой области образуются фолликулярные кисты.
Другая причина развития СПКЯ — генетически обусловленное нарушение выработки инсулина и развитие инсулинорезистентности, то есть недостаточный ответ тканей на его действие.
К гиперандрогении, как было сказано выше, может приводить врождённая гиперплазия коры надпочечников. Причина её развития — мутации генов, которые отвечают за синтез ферментов или транспортных белков, участвующих в выработке кортизола.
Классификация и стадии развития гиперандрогении
Согласно Международной классификации болезней (МКБ-10), гиперандрогения кодируется как Е.28.1 Избыток андрогенов. Выделяют истинную гиперандрогению и другие её формы.
Истинная гиперандрогения
Истинная гиперандрогения бывает яичниковой и надпочечниковой
Яичниковая гиперандрогения:
1. Синдром поликистозных яичников. Первичный СПКЯ (синдром Штейна — Левенталя) возникает при нарушении в системе гипоталамус-гипофиз-яичники. Вторичный СПКЯ развивается при эндокринной патологии, например на фоне сахарного диабета, заболеваний щитовидной железы или под воздействием внешних факторов: интоксикации, стресса, травмы и инфекции.
2. Стромальный текоматоз яичников (синдром Френкеля) — тяжёлая форма овариальной неопухолевой гиперандрогении. При заболевании разрастается соединительная ткань и возникает синдром HAIR-AN (высокий уровень андрогенов, инсулинорезистентности, ожирение и чёрный акантоз). Это редкая патология выявляется преимущественно в постменопаузе.
3. Андроген-продуцирующая опухоль яичников:
Надпочечниковая гиперандрогения:
Другие формы гиперадрогении
Осложнения гиперандрогении
Наиболее частые осложнения гиперандрогении: бесплодие, инсулинорезистентность и ожирение. Нарушение обмена липидов, сахарный диабет, сердечно-сосудистая патология возникают как следствие этих процессов.
Механизмы развития гиперандрогении и гиперинсулинемии до конца не изучены. Теоретически возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении и есть третий фактор, ответственный за оба феномена.
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах:
О том, что гиперинсулинемия вызывает гиперандрогению, свидетельствует следующее: инсулинорезистентность сохраняется у пациенток с удалёнными яичниками и при длительном приёме препаратов, подавляющих выработку андрогенов.
Диагностика гиперандрогении
Диагностика проводится эндокринологом или гинекологом-эндокринологом.
Этапы:
1. Опрос (сбор анамнеза). Врач беседует с пациенткой и выясняет следующие факты:
2. Осмотр. Доктор обращает внимание на следующие симптомы:
3. Лабораторные исследования:
Направление на анализы выписывает врач, так как часть из них нужно проводить в определённые дни менструального цикла.
4. Инструментальная диагностика:
Лечение гиперандрогении
Заболевание лечит врач-эндокринолог или гинеколог-эндокринолог.
Лечение поможет устранить симптомы и достичь основных целей:
Нормализация менструального цикла уменьшает риск гиперплазии эндометрия и рака тела матки, маточных кровотечений и постгеморрагической анемии.
В редких случаях выполняют операции на яичниках.
Комбинированные оральные контрацептивы (КОК) снижают уровень гонадотропинов, а значит и концентрацию андрогенов, которые производятся в яичниках. Содержащиеся в КОК эстрогены увеличивают синтез глобулина, связывающего половые гормоны и, следовательно, снижают уровень свободного тестостерона. Кроме того, прогестагены в составе КОК уменьшают синтез андрогенов в надпочечниках, подавляют фермент 5-альфа-редуктазу и блокируют связывание андрогенов с рецепторами.
Оптимальными будут КОК, содержащие прогестаген с антиандрогенным действием: ципротерон, хлормадинон, диеногест и дроспиренон. Также предпочтительны оральные контрацептивы с этинилэстрадиолом.
Наиболее известные КОК, применяемые для лечения гиперандрогении:
Прогестагены нормализуют менструальный цикл при циклическом или постоянном приёме. Однако есть гипотезы, что прогестерон сам обладает андрогеноподобным действием. Его, как правило, не назначают для лечения гиперандрогении, но применяют для нормализации второй фазы менструального цикла.
Блокаторы андрогенных рецепторов из–за выраженной тератогенности (влияния на внутриутробную закладку органов будущего ребёнка) беременным принимать запрещено.
Основные препараты из группы блокаторов андрогенных рецепторов:
Дозировку и режим приёма препаратов врач назначает индивидуально.
Способы удаления волос при гирсутизме
Существуют три вида электроэпиляции:
Побочные эффекты электроэпиляции: ожоги, раздражение кожи, редко — образование рубцов.
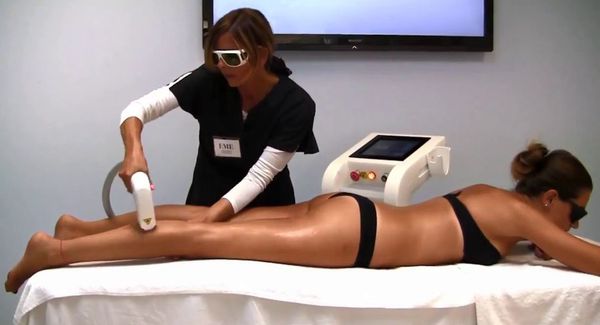
Лазерная эпиляция позволяет повредить волосяной фолликул, не разрушив окружающие его ткани. Процедуры нужно проводить многократно, но полностью избавиться от волос удаётся редко. В зависимости от источника светового излечения лазеры для удаления волос делятся на три группы:
Прогноз. Профилактика
Если своевременно обратиться к врачу и правильно подобрать лечение, то можно уменьшить неприятные симптомы и избежать серьёзных осложнений.
Результаты терапии следует оценивать через 3–6 месяцев, потому что антиандрогенные препараты действуют медленно: они постепенно накапливаются в организме и встраиваются в обмен веществ. Их приём требует адекватного дозирования, а также регулярной оценки результатов и возможных побочных действий.
Лечение позволяет избавиться от симптомов, поэтому для грамотной коррекции терапии пациентке необходимо регулярно посещать врача-эндокринолога
Профилактика:
Андрогены, гиперандрогения, гирсутизм
Гиперандрогения? Гирсутизм? Повышенное содержание «мужских» половых гормонов? Бесплодие? Ановуляция? Синдром поликистозных яичников?
В нашей лаборатории проводится расширенное обследование на андрогены.
ДВА БЛОКА АНАЛИЗОВ
Индекс свободных андрогенов. Расчет свободного и биодоступного тестостерона: скрининговое обследование на андрогены в общем гормональном обследовании.
Андрогенный профиль: полное обследование на андрогены при наличии гиперандрогении, гирсутизме, бесплодии, ановуляции, СПКЯ, нарушениях менструального цикла.
Кроме основных показателей, выполняемых внутри блока, в результате указывается несколько расчетных показателей, в том числе, свободный и биодоступный тестостерон.
О составе блоков, стоимости, условиях сдачи, сроках готовности читайте здесь:
Содержание раздела
Почему не достаточно анализа на общий тестостерон?
Обычно для оценки андрогенного статуса используется определение общего тестостерона.
Общий тестостерон представлен двумя фракциями:
Небольшая часть тестостерона циркулирует в крови в свободном состоянии (не связана с какими-либо белками). Этот тестостерон называют свободным. Он может оказывать биологическое воздействие на клетки организма.
Другая часть тестостерона связана с белками:
Таким образом, в клетки-мишени может проникать свободный тестостерон и тестостерон, связанный с альбумином, они составляют биодоступный тестостерон.
Биодоступный тестостерон = свободный тестостерон + тестостерон, связанный с альбумином
Таким образом, содержание фракций тестостерона зависит как от уровня тестостерона, так и от содержания белков. Мы видим, что обычный анализ на общий тестостерон не отражает истинное влияние гормона на клетки-мишени. Только анализ с определением индексов может дать наиболее точную информацию.
В нашей лаборатории исследование уровня отдельных показателей проводится на современном автоматическом оборудовании, а расчет проводится с помощью специального компьютерного обеспечения.
Когда нужно сдавать тесты:
Андрогенный статус оценивается на 7-10 день менструального цикла
Комплексное обследование при синдроме поликистозных яичников, гиперандрогении, гирсутизме, нарушениях цикла
Вопрос: У меня нарушения цикла, иногда бывают задержки менструации, идет усиление роста волос на теле. Насколько это серьезно и что с этим можно сделать?
Те признаки, которые Вас беспокоят, могут быть следствием имеющихся особенностей гормональной регуляции организма, и могут быть связаны с изменением соотношения между различными гормонами яичников, а также с наличием изменения уровня гормонов надпочечников.
Это может быть причиной как избыточного роста волос, так и нарушений менструального цикла. Во многих случаях за этими с виду безобидными нарушениями могут скрываться тенденции, которые могут влиять на здоровье в целом.
Нарушение овуляции может часть происходить на фоне, предрасполагающем к развитию метаболических нарушений (избыточный вес, увеличение риска сахарного диабета), а также гиперпластических процессов слизистой оболочки матки – эндометрия, заболевания молочных желез, что увеличение риска онкологической патологии с стороны эндометрия и молочных желез.
Поэтому эти нарушения могут сопровождаться увеличением риска как для здоровья в целом, так и приводить к уменьшению продолжительности жизни. Эти изменения могут накапливаться в течение многих лет и даже десятилетий в организме женщины, поэтому важна своевременная, правильная и качественная диагностика таких состояний.
Нарушение менструального цикла и избыточный рост волос на теле могут быть следствием так называемых гиперандрогенных состояний, то есть таких состояний, которые сопровождаются повышением уровня гормонов, традиционно называемых мужскими. Это понятие не совсем правильное, поскольку эти гормоны всегда присутствуют в организме женщины и выполняют очень важные функции. Проблемы возникают тогда, когда появляется ненормальное соотношение между этими гормонами и теми, которые яичник должен производить в большом количестве (эстрогены в первую фазу цикла, эстрогены и прогестерон во вторую, после овуляции).
Для того, чтобы правильно поставить диагноз возможных нарушений, необходима правильная и комплексная диагностика, назначенная врачом-специалистом, которая включает в себя гормональные, биохимические анализы, ультразвуковую и функциональную диагностику.
В раннюю фолликулярную фазу (до селекции доминатного фолликула) определяется уровень гормонов, управляющих работой яичников (ЛГ, ФСГ, пролактин).
После 5 дня цикла у большинства женщин происходит выделение так называемого доминантного фолликула, то есть такого образования внутри яичника, которое обладает мощной секрецией. Внутри него созревает яйцеклетка, которая сможет участствовать в оплодотворении. Функция доминантного фолликула определяется с помощью специальных тестов, где первое место отводится гормональному обследованию. При этом измеряется уровень главного женского гормона – эстрадиола, а также проводится комплексное определение уровня «мужских» гормонов, их транспортрных белков с расчетом целого ряда показателей. В ООО «Лаборатории ЦИР» это обследование называется «Андрогенный профиль». В отличие от обычного определения уровня общего тестостерона, андрогенный профиль включает в себя определение таких показателей, как андростендион, андростандиол-глюкуронид, которые позволяют с большей степенью точности определить степень наршений и риски осложнений. При гиперандрогенных состояниях может нарушаться овуляция, что опасно по развитию гиперпластических процессов. Для определения овуляции проводится определение уровня гормонов желтого тела (эстрадиол, прогестерон).
При увеличении уровня андрогенов в организме женщины достаточно часто задействована эндокринная функция поджелудочной железы. Состояние, которое называется инсулинорезистентностью, сопровождается прямой стимуляцией выработки тестостерона под действием избыточного количества инсулина (гормона поджелудочной железы), что дальше приводит у нарушению овуляции и к развитию метаболических расстройств. Для выяснения метаболического статуса и возможной роли инсулинорезистентности проводится комплексный анализ, который в ООО «Лаборатории ЦИР» называется «Метаболический блок». При этом определяется несколько биохимических показателей натощак, а также показатели через 1 и 2 часа после сахарной нагрузки.
Во многих случаях показано специальное молекулярно-генетическое исследование, которое позволяет выявить скрытые наследственные риски гиперандрогении и метаболических нарушений. Такое комплексное обследование позволяет поставить диагноз и назначить оптимальное лечение. Эти состояния поддаются коррекции с помощью лекарственных препаратов, рекомендаций по питанию, режиму и спорту.
Словарик
Индекс свободных андрогенов как определяющий фактор артериальной жесткости
Free androgen index as a determinant of arterial stiffness in menopause
Накопленные к настоящему времени доказательства позволяют предположить, что эндогенные андрогены могут способствовать появлению или активизации механизмов, способствующих развитию сердечно-сосудистых заболеваний (CСЗ) у женщин по окончанию переходного периода [Vitale C, et al. Fundam Clin Pharmacol 2010; 24:675-685; Lambrinoudaki I, et al. Eur J Endocrinol 2006;154:907-916]. Характерную для женщин в постменопаузе гормональную среду скорее нужно считать андрогенной, чем эстроген-дефицитной, если принять во внимание гормональные сдвиги, происходящие в течение переходного периода в результате изменения соотношения уровней циркулирующих в крови эстрогенов к андрогенам [Davison SL, et al. J Clin Endocrinol Metab 2005;90:3847-3853]. Эндогенные андрогены оказывают множественные эффекты на сердечно-сосудистый гомеостаз [Mesch VR, et al. Climacteric 2008;11:509-517], определяющие неблагоприятный кардиометаболический профиль женщин в постменопаузе, но данные относительно динамики изменений и значимости гормональных взаимосвязей остаются противоречивыми [Golden SH, et al. Am J Epidemiol 2002;155:437-445; Karim R, et al. J Clin Endocrinol Metab 2008;93:131-138; Wildman RP, et al. Menopause 2008;15:414-421; Liu PY, et al. Endocr Rev 2003;24:313-340].
Кроме того, потенциальные причинные связи между гиперандрогенемией (повышением уровня андрогенов в крови) и сосудистым старением в постменопаузе недостаточно освещены в литературе. В предыдущих работах авторы сосредоточились на изучении воздействия андрогенов на сосудистые структурные маркеры или взаимосвязи между андрогенами и артериальной жесткостью в ходе исследований с поперечным дизайном, не позволяющим выявить причинные связи. Женщины в постменопаузе с нормальным уровнем артериального давления (АД) и сниженными концентрациями глобулина, связывающего половые стероиды (ГСПС) и/или с повышенными уровнями эндогенного тестостерона демонстрировали повышение частоты выявления гипертензии и более высокие уровни АД в лонгитюдинальном исследовании Multi-Ethnic Study of Atherosclerosis [Wang L, et al. Atherosclerosis 2012;224:228-234].
В нескольких исследованиях было показано, что индекс свободных андрогенов (ИСА) является более точным маркером гиперандрогенемии по сравнению с показателем общего тестостерона, поскольку была продемонстрирована его корреляция с артериальной жесткостью у женщин в постменопаузе [Creatsa M, et al. Metabolism 2012;61:193-20; Georgiopoulos GA, et al. Atherosclerosis 2016;247:177-183]. В недавнем проспективном исследовании авторов данной статьи показатель ИСА служил независимым прогностическим фактором развития артериальной жесткости, новых случаев гипертензии и перехода женщин в категорию с более высоким уровнем АД в течение 29 месяцев наблюдения [Georgiopoulos GA, et al. Atherosclerosis 2016;247:177-18]. Авторы пришли к заключению, что у практически здоровых женщин в постменопаузе ИСА мог бы служить новым биомаркером, превышающим по своей значимости общий тестостерон в отношении ускоренного сосудистого старения и статуса гипертензии.
В вышеприведенных исследованиях не был сделан статистический анализ, который позволил бы получить выводы, касающиеся направленности выявленных изменений [Creatsa M, et al. Metabolism 2012;61:193-201; Armeni E, et al. J Hypertens 2013;31:1998-2004], при том, что не проводились интервенционные исследования с введением экзогенных андрогенов, предоставляющие механистические данные. Таким образом, по данным текущей литературы невозможно сделать заключение о последовательности событий в клинических ситуациях. С одной стороны, вызванное андрогенами повышение артериальной жесткости может привести к развитию новых случаев артериальной гипертензии, а, с другой стороны, ускорение процессов формирования артериальной жесткости может быть следствием вызванной влиянием андрогенов гипертензии [Georgiopoulos GA, et al. Hypertension 2009;54:98-105; Mancia G, et al. J Hypertens 2013;31:1281-1357], Кроме того, эндотелиальная дисфункция вовлечена, как в формирование артериальной жесткости, так и в развитие артериальной гипертензии вследствие неблагоприятного ремоделирования сосудистой стенки, приводящего к повышению пульсового давления и индексов АД [Georgiopoulos GA, et al. Atherosclerosis 2016;247:177-183; Brandes RP. Hypertension 2014;64:924-928; Yannoutsos A, et al. J Hypertens 2014;32:216-224].
Потенциальные прямые корреляции между эндогенными андрогенами и характеристиками артериальных стенок могли объяснить оставшийся необъясненным сердечно-сосудистый риск у женщин в постменопаузе, упущенный при подсчете общепринятых показателей сердечно-сосудистого риска [Ajani UA, Ford ES. Am Coll Cardiol 2006;48:1177-1182; Lambrinoudaki I, et al. Int J Cardiol 2013;164:70-76]. В ходе оценки направленности взаимосвязей между эндогенными андрогенами, уровнем АД и артериальной жесткостью в менопаузе мог бы быть применен более эффективный скрининг у женщин в постменопаузе с субклиническим поражением органов-мишеней, подверженных большему риску развития новых случаев артериальной гипертензии. Кроме того, эпидемиологические доказательства направленности таких ассоциаций могли бы обеспечить, предварительные данные, которые послужили бы толчком к проведению будущих рандомизированных плацебо-контролируемых клинических исследований.
Таким образом, основываясь на текущих клинических доказательствах наличия взаимосвязи между уровнями андрогенов, артериальной гипертензией и повышением артериальной жесткости у женщин в менопаузе, авторы стремились исследовать направленность взаимосвязей между этими параметрами при помощи современного статистического метода ─ моделирования структурными уравнениями (structural equation modeling (SEM)), позволяющего оценить линейные взаимосвязи (направленные и ненаправленные) среди других измеренных и скрытых переменных величин [Gunzler D, et al. Shanghai Arch Psychiatry 2013; 25:390-394; Wardlaw JM, et al. Neurology 2014;82:1331-1338], чтобы улучшить понимание лежащих в их основе патофизиологических механизмов. Направленные (directional) взаимосвязи подразумевают направленное влияние одной переменной величины на другую, а ненаправленные (nondirectional) взаимосвязи подразумевают только корреляционные соотношения и не подразумевает направленного влияния.
С целью изучения направленных взаимосвязей между уровнями эндогенных андрогенов и показателями АД и жесткости артериальной стенки авторы включили в исследование 411 последовательно набранных практически здоровых женщин в постменопаузе, у которых были применены не инвазивные методы оценки сосудистой функции, включавшие: анализ пульсовой волны (pulse wave analysis) с помощью измерения внутриаортального давления и индекса аугментации (показатель, который, в первую очередь, характеризует выраженность отраженной волны и ее вклад в увеличение пульсового АД), измерение жесткости стенки аорты (aortic stiffness ) с помощью оценки скорости распространения пульсовой волны (PWV), индекса жесткости (stiffness index (SI)) и поток-опосредованного расширения (FMD). Измерялся также кумулятивный маркер, объединяющий показатели PWV и SI и позволяющий оценить локальную артериальную и аортальную жесткость (combined local and aortic arterial stiffness (CAS)). ИСА подсчитывается с использованием показателей общего тестостерона и ГСПС (ИСА = общий тестостерон (нг/мл) х 347/ГСПС (нмоль/л)). Оценивалась также инулинорезистентность с помощью Homoeostasis model assessment insulin resistance (HOMA-IR).