Инфильтрация параректальной клетчатки что такое
Что такое парапроктит острый? Причины возникновения, диагностику и методы лечения разберем в статье доктора Соловьев Д. П., проктолога со стажем в 18 лет.
Определение болезни. Причины заболевания
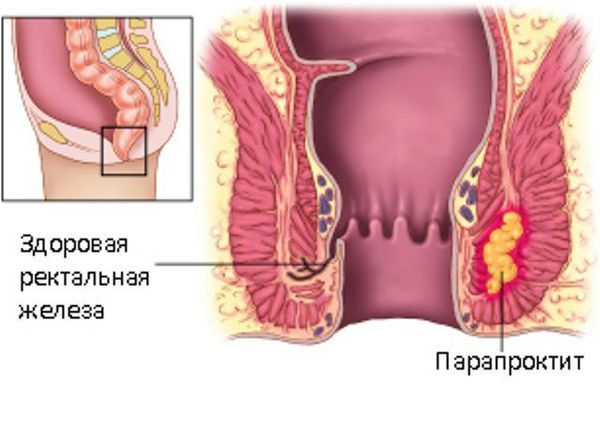
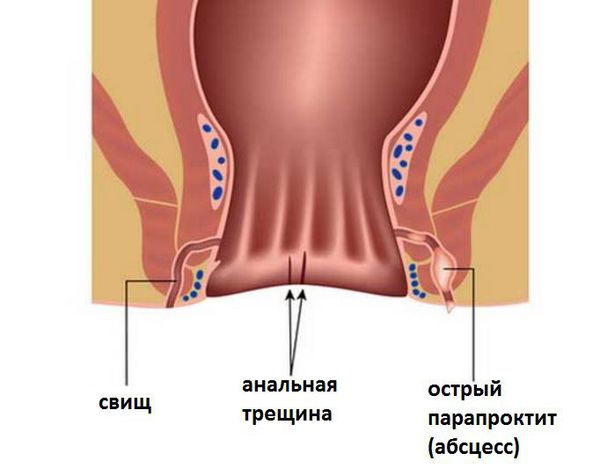
Острый парапроктит — острое воспаление околопрямокишечной клетчатки, обусловленное распространением воспалительного процесса из анальных крипт и анальных желез.
Около 30% пациентов с аноректальными абсцессами сообщают о возникновении подобных абсцессов ранее, которые либо разрешались спонтанно, либо требовали хирургического вмешательства.
Частота образования абсцессов выше весной и летом. В разных странах и регионах мира нет четкой статистики.
Ранее высказывалось предположение, что существует прямая связь между образованием аноректальных абсцессов и привычками кишечника, частой диареей и плохой личной гигиеной, однако эта связь остается недоказанной.
Пиковая частота аноректальных абсцессов приходится на 30-40 лет. Мужчины страдают в 2-3 раза чаще, чем женщины.
К образованию абсцессов могут приводить аэробные и анаэробные бактерии. Наиболее часто встречающиеся анаэробы: Bacteroides fragilis, Peptostreptococcus, Prevotella, Fusobacterium, Porphyromonas и Clostridium. Наиболее часто встречающиеся аэробы: Staphylococcus aureus, Streptococcus и Escherichia coli.
В более поздних исследованиях был выявлен метициллин-устойчивый S. aureus (MRSA) как микроорганизм, приводящий к образованию абсцессов. [8] [9]
Приблизительно 10% аноректальных абсцессов могут быть вызваны причинами, не связанными с анальными железами, это:
Симптомы острого парапроктита
Классические положения аноректальных абсцессов следующие:
Клиническая картина коррелирует с анатомическим расположением абсцесса (хотя следует иметь в виду, что подкожный абсцесс иногда не является изолированным поверхностным поражением, а представляет собой внешнее проявление более глубокого абсцесса).
Почти все параректальные абсцессы проявляются болью в области промежности и прямой кишки. Пациенты с подкожным абсцессом обычно жалуются на перианальный дискомфорт и зуд. Боль часто вызывается движением и повышением давления на промежность от сидения или дефекации. При ишиоректальных парапроктитах возникает лихорадка, озноб, выраженная боль в промежности, появление инфильтрата.
До 50% пациентов с парапроктитами могут иметь отек вокруг прямой кишки, а у 25% выделения: кровянистые, гнойные или слизистые. [2] [4] Эти пациенты могут также жаловаться на запор, скорее всего, из-за боли при дефекации, но отсутствие запора или даже диарея не исключают диагноза. Большинство пациентов не сообщают об истории лихорадки или озноба.
Патогенез острого парапроктита
Аноректальный абсцесс — заболевание, возникающее преимущественно (
90% случаев) из-за обструкции анальных крипт, [4] возможно при повышении тонуса сфинктера. [6] Инфицирование секрета желез приводит к нагноению и образованию абсцесса в анальной железе. Как правило, абсцесс формируется изначально в межсфинктерном пространстве, а затем распространяется вдоль соседних клетчаточных пространств.
Классификация и стадии развития острого парапроктита
Разнообразие анатомических локализаций первичной инфекции выражается в разных клинических проявлениях. Относительно простой перианальный абсцесс следует отличать от более сложных периректальных абсцессов.
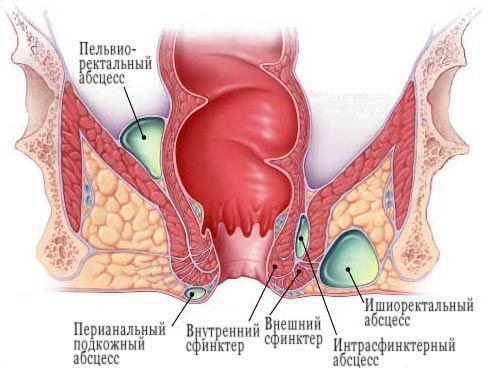
Аноректальные абсцессы классифицируются в соответствии с их анатомическим расположением:
Перианальные (подкожные) абсцессы представляют собой наиболее распространенный тип, на которые приходится примерно 60% зарегистрированных случаев. [1] [2] [3] [4]
Это поверхностное скопление гноя расположено в подкожной клетчатке и не пересекает наружный сфинктер.
Ишиоректальные абсцессы образуются, когда гнойник через наружный сфинктер распространяется в ишиоректальное клетчаточное пространство. Ишиоректальный абсцесс может распространяться через позадианальное пространство в контралатеральную сторону, образуя так называемый подковообразный абсцесс.
Интерсфинктерные абсцессы, третий наиболее распространенный тип, являются результатом нагноения, возникающего между внутренним и внешним анальным сфинктером. Они могут локализоваться полностью в анальном канале, что приводит к сильной боли и может быть обнаружено только путем ректального обследования или аноскопии.
Супралеваторные (тазово-прямокишечные) абсцессы, наименее распространенные из четырех основных типов, могут образовываться из-за проксимального распространения межсфинктерного абсцесса над мышцей, поднимающей задний проход. Эти абсцессы могут быть диагностированы с помощью компьютерной томографии (КТ) и вызывают тазовые и ректальные боли.
Осложнения острого парапроктита
Диагностика острого парапроктита
При оценке жизненно важных систем отклонений, как правило, не находят.
При осмотре промежности отмечается четко выраженный болезненный инфильтрат и гиперемированная кожа, пальпаторно можно определить зону флюктуации (размягчения). [2]
Пациенты с интерсфинктерным абсцессом при пальцевом ректальном осмотре жалуются на локальную болезненность, но иногда осмотр не позволяет идентифицировать межсфинктерный абсцесс.
Редкие супралеваторные (тазово-прямокишечные) абсцессы представляют собой сложную диагностическую проблему. В результате клинического подозрения на интерсфинктерный или супралеваторный абсцесс может потребоваться подтверждение с помощью компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) или анальной ультрасонографии.
Пальцевой осмотр с анестезией может быть полезен в некоторых случаях, поскольку дискомфорт пациента может значительно ограничить оценку локального статуса.
Дифференциальный диагноз:
Лабораторная диагностика
Лабораторная диагностика не является ведущей в постановке диагноза. В общем анализе крови может выявляться, иногда со сдвигом лейкоцитарной формулы влево. 23% пациентов с перианальными абсцессами имеют нормальную температуру и нормальное количество лейкоцитов. [2]
Несмотря на то, что назначение антибиотиков не требуется при вскрытии неосложненных перианальных абсцессов, [21] [22] посев раневого отделяемого, с выделением культуры микроорганизмов, должен проводиться у всех пациентов, с целью выявление новых штаммов бактерий (например, резистентный к метициллину S. aureus ). [1] [2] [8] [9]
Инструментальные методы (КТ, УЗИ и МРТ)
Вспомогательные инструментальные методы требуются при подозрении на абсцесс интерсфинктерный или супралеваторный. [23] [24]
Как правило, использование анальной ультрасонографии ограничивается подтверждением наличия межсфинктерного абсцесса, также может использоваться внутриоперационно, чтобы помочь определить сложный абсцесс или свищ.
КТ обычно используется для диагностики абсцессов супралеваторных. Чувствительность метода 77%. [25]
Трансперинеальная ультрасонография показала хорошие результаты для обнаружения свищей и сбора жидкости в предоперационном планировании с чувствительностью от 85% [26] [27] [28] до 100% [29] или обнаружения хирургически значимого заболевания.
Чувствительность МРТ составляет 91%, что делает его полезным при предоперационном планировании, [30] однако использование МРТ ограничено.
Эндоскопия
Использование эндоскопической визуализации (трансректальной и трансанальной) является отличным способом оценки сложных случаев перианального абсцесса и свища (фистулы). С помощью эндоскопической техники можно четко визуализировать степень и конфигурацию абсцесса и свищей. Эндоскопическая визуализация столь же эффективна, как и фистулография.
Лечение острого парапроктита
Наличие абсцесса является показанием для вскрытия и дренирования. Введение антибиотиков является недостаточным. Задержка хирургического вмешательства приводит к хроническому разрушению тканей, фиброзу и образованию стриктур и может ухудшить анальное удержание.
Адекватный дренаж абсцесса является самым важным фактором в борьбе с прогрессирующей перианальной инфекцией.
Фармакологическая терапия
Рутинное назначение антибиотиков у пациентов с аноректальными абсцессами не требуется, так как нет доказательств ускорения времени заживления или уменьшения частоты рецидивов. Назначение антибиотиков оправдано пациентам с: [1]
Хирургическое вмешательство
Подготовка к оперативному вмешательству не требуется. Оно проводится под спинномозговой анестезией или наркозом.
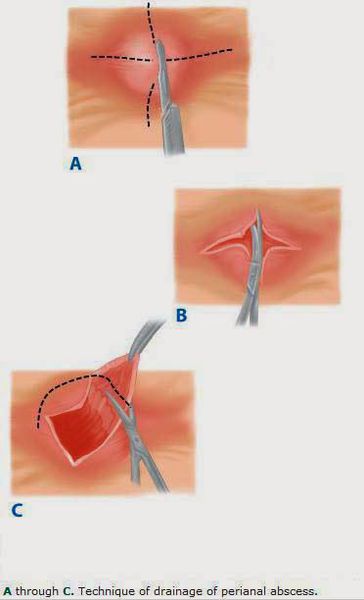
Хирургическое дренирование гнойной полости:
Разрез должен быть сделан как можно ближе к анусу. [1] Гной эвакуируется, а рана заполняется салфеткой с йодопироном. Дренаж устанавливают только для лечения сложных или двусторонних абсцессов. Через 24 часа салфетку удаляют, и пациенту дается указание принимать сидячие ванны три раза в день и после дефекации. Послеоперационные анальгетики и размягчители стула назначают для облегчения боли и предотвращения запора.
Дренирование межсфинктерного абсцесса: в анальном канале делается поперечный разрез ниже зубчатой линии сзади. Выделяется интерсфинктерное пространство и открывается плоскость между внутренним и внешним сфинктерами. Абсцесс вскрывается, оставляется небольшой дренаж, для преждевременного закрытия раны.
Техника дренирования супралеваторных абсцессов определяется положением и этиологией поражения. Оценка с помощью магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ) может исключать внутрибрюшную или тазовую патологию как возможные источники.
Если супралеваторный абсцесс развивается из ишиоректального абсцесса, то дренирование проводится через ишиоректальную ямку. Если абсцесс был вызван продолжением межсфинктерного парапроктита, то дренирование проводится через слизистую.
Если клиническое состояние пациента не улучшится в течение следующих 24-48 часов, необходима переоценка состояния с помощью КТ или повторной операции. Некоторым пациентам с рецидивирующими, тяжелыми абсцессами может потребоваться формирование колостомы.
Прогноз. Профилактика
Общая смертность от аноректальных абсцессов низкая. [2]
Ранние данные указывали на то, что образование абсцесса повторяется примерно у 10% пациентов, причем свищ формируется почти у 50% пациентов. [1] [2] [12]
Более позднее исследование показало, что у 37% пациентов сформировался свищ или возникал рецидив парапроктита (абсцесса). [6]
Парапроктит
Наши специалисты свяжутся с вами в ближайшее время
Парапроктит — воспаление тканей около прямой кишки (параректальной клетчатки) из-за проникновения в них инфекции. Часто формируется абсцесс (ограниченное пространство с гнойным содержимым), это называется острый парапроктит. Абсцесс параректальной клетчатки может самостоятельно прорваться, но при этом процесс часто переходит в хроническую форму, формируя свищи прямой кишки (хронический парапроктит).
Причины развития
Факторов, которые могут способствовать развитию патологии, множество. Среди них:
Совокупность причин определяет основную категорию пациентов врача-проктолога – чаще всего с парапроктитом обращаются к врачу мужчины в возрасте 25-50 лет.
Диагностика парапроктита:
Врач-колопроктолог проводит ректальное исследование для обнаружения внутреннего отверстия абсцесса.
Симптомы острого парапроктита:
Симптомы острого парапроктита зависят от расположения очага воспаления и других факторов. Наиболее характерные симптомы:
При остром парапроктите симптомы могут нарастать (усиливается боль, продолжает ухудшаться общее самочувствие). В некоторых случаях состояние резко улучшается, при этом в кале появляются гной и кровь. Это значит, что гнойник прорвался в прямую кишку. При прорыве или неправильном лечении острого парапроктита высок риск перехода заболевания в хроническую форму. Кроме того, парапроктит опасен распространением гнойного воспаления на органы малого таза, брюшной полости, и другими серьезными осложнениями.
Хронический парапроктит (свищи прямой кишки)
При неправильном лечении острого парапроктита, самостоятельном прорыве гнойника или под воздействием других факторов внутреннее отверстие абсцесса образует свищ. Свищ перианальной области – это тонкий канал, соединяющий задний проход с отверстием на коже около заднепроходного отверстия. Для хронического парапроктита характерны стадии ремиссии и обострения.
В просвете свища может скапливаться гной, вызывающий опухание и болевые ощущения. Свищ может самостоятельно дренироваться (прорваться), в таком случае симптомы на время исчезают, и возвращаются, когда просвет свища снова забивается. Периодические обострения происходят из-за постоянного инфицирования свища патогенной флорой прямой кишки.
Симптомы свищей прямой кишки (проявляются преимущественно в фазу обострения)
Лечение парапроктита
Самый эффективный метод лечения и острого парапроктита, и свища прямой кишки – хирургический.
Операция проводится под наркозом. Местная анестезия в этом случае не применяется, так как крайне важным является полное обезболивание операционного поля и расслабление мышц. В ходе операции гнойник вскрывается, пациенту выполняется дренирование гноя. Однако на этом хирургическое лечение не заканчивается, если речь идет о хронической форме заболевания – важно устранить не только гнойник, но и сам свищ. Не всегда это можно сделать в момент активного воспаления. Поэтому в некоторых случаях проводят две операции – одну по вскрытию абсцесса, вторую – по иссечению свища. Иногда в рамках предоперационной подготовки пациенту назначают курс противовоспалительной и антибактериальной терапии, также хорошо себя зарекомендовали физиотерапевтические методы.
В Лечебно-диагностическом центре ЦКБ РАН операции по поводу острого парапроктита и иссечение свища проводятся в условиях операционного блока дневного стационара. Использование современных анестетиков сводит на нет неприятные ощущения во время операции. После вмешательства человек несколько часов находится под наблюдением врача, после чего может самостоятельно идти домой, получив необходимые рекомендации по послеоперационному лечению.
Консультация проктолога
Любые подозрения на парапроктит являются поводом для незамедлительного обращения к проктологу и безотлагательного проведения операции в случае подтверждения диагноза. Если же лечение не провести или не избавиться от источника инфекции, парапроктит переходит в хроническую форму, с течением времени формируется свищевой ход. На консультации проктолог проведет диагностику посредством пальпации и визуального осмотра. Определит тяжесть состояния и порекомендует наиболее эффективный способ борьбы с заболеванием.
Инфильтрация параректальной клетчатки что такое
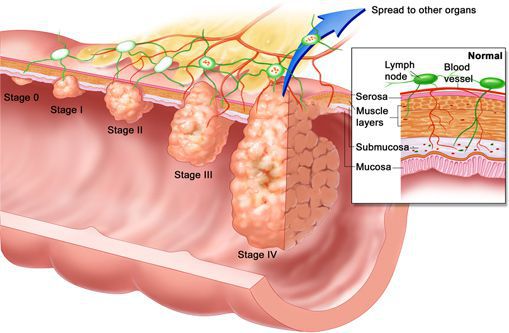
Предложено большое количество классификаций колоректального рака.
Следует подчеркнуть, что в зарубежной научной литературе для стадирования опухолевого процесса и определения клинического прогноза широко используется классификация C.E.Dukes (1958), разработанная для рака прямой кишки. Согласно последней учитываются два основных патоморфологических признака, а именно – глубина прорастания опухоли в кишечную стенку и наличие метастазов в регионарных лимфатических узлах. Так, стадия А- соответствует случаям, в которых рост опухоли ограничен стенкой прямой кишки; стадия В – опухоль распространяется на окружающие ткани, но метастазы в лимфатических узлах отсутствуют; стадия С – опухоль с любой степенью местного распространения с наличием метастазов в регионарных лимфатических узлах.
В настоящее время среди зарубежных хирургов широко используется классификация Dukes в модификации Aster et Coller (1953), которая предполагает выделение 6 стадий рака прямой кишки:
А – опухоль не выходит за пределы слизистой оболочки;
В 1 – опухоль прорастает мышечную оболочку, но не серозу, и нет регионарных метастазов;
В 2 – прорастание всех слоев стенки кишки, но без регионарных метастазов;
B 3 – прорастание в соседние органы и ткани, но без регионарных метастазов;
С 1 – поражение регионарных лимфатических узлов без прорастания стенки кишки;
С 2 – прорастание серозной оболочки и наличие регионарных метастазов;
D – наличие отдаленных метастазов.
Среди отечественных хирургов используется классификация рака прямой кишки, предложенная еще в 1956 году, с разделением на 4 стадии опухолевого процесса. С учетом ряда конкретных уточнений, в отделении проктологии РОНЦ РАМН данная классификация используется в следующем виде:
I стадия – подвижная опухоль или язва до 2 см в диаметре, растущая в пределах слизистого и подслизистого слоя прямой кишки. Регионарных метастазов нет.
При этом: IIа стадия – без регионарных метастазов, IIб стадия – с наличием регионарных метастазов.
При этом: IIIа стадия – без регионарных метастазов, IIIб стадия – с наличием регионарных метастазов.
IV стадия – обширная, неподвижная опухоль, прорастающая окружающие органы и ткани или опухоль любых размеров при наличии отдаленных метастазов.
При этом: IVа стадия – без отдаленных метастазов,
IVб стадия – опухоль любых размеров при наличии отдаленных метастазов.
Широкое распространение получила и Международная классификация рака прямой кишки, предложенная Международным Противораковым Союзом в 1989 году с использованием символов TNM (Tumor, Nodulus, Metastases).
Символ Т содержит следующие градации:
Т Х – недостаточно данных для оценки первичной опухоли;
Т is – преинвазивная карцинома;
Т 1 – опухоль инфильтрирует слизистую оболочку и подслизистый слой прямой кишки;
Т 2 – опухоль инфильтрирует мышечный слой, без ограничения подвижности стенки стенки кишки;
Т 3 – опухоль, прорастающая все слои стенки кишки с инфильтрацией или без инфильтрации параректальной клетчатки, но не распространяющаяся на соседние органы и ткани.
Для опухолей, расположенных в верхнеампулярном и ректосигмоидном отделах прямой кишки (покрытых брюшиной), последние распространяются до субсерозы (не прорастают серозу).
Символ N указывает на наличие или отсутствие регионарных метастазов.
N Х – недостаточно данных для оценки регионарных лимфоузлов
N 0 – поражения регионарных лимфатических узлов нет
N 1 – метастазы в 1-3 регионарных лимфатических узлах
N 2 – метастазы в 4 и более регионарных лимфатических узлах
Символ М указывает на наличие или отсутствие отдаленных метастазов.
М 0 – без отдаленных метастазов
М 1 – с наличием отдаленных метастазов.
Естественно, что окончательно стадия рака прямой кишки выставляется после патоморфологического исследования удаленного во время хирургического вмешательства операционного материала.
— к.м.н. Тамразов Р.И.
Пресс-центр
Роль магнитно-резонансной томографии в оценке местной распространенности рака прямой кишки
Балясникова С.С., Сураева Ю.Э., Долгушин Б.И., Барсуков Ю.А, Мамедли З.З., Полыновский А.В., Кузьмичев Д.В.
ФГБУ «РОНЦ им.Н.Н. Блохина», РАМН, г. Москва (директор – академик РАМН и РАН, профессор М.И. Давыдов
ВВЕДЕНИЕ
Совершенствование хирургической техники и современные данные о результатах лечения рака прямой кишки (MERCURY Study Group) диктуют необходимость персонализированного подхода в назначении неоадьювантной химиолучевой терапии с учетом критериев риска рецидивирования рака в зависимости от местного распространения опухоли. В связи с этим, роль специалистов лучевой диагностики в планировании предстоящего лечения и оценки его эффективности стала критически значимой. Информация, получаемая при интерпретации изображений (с высоким разрешением) органов малого таза, дает детализированное представление о местной распространенности опухолевого процесса, что позволяет более грамотно определять тактику лечения больных и улучшать, тем самым, отдаленные результаты.
Магнитно-резонансная томография (МРТ) на сегодня является методом выбора для оценки местной распространённости рака прямой кишки 4. Обладая высоким мягкотканным контрастом, МРТ дает возможность визуализировать эндофитное и экстрамуральное распространение опухоли, в частности, определять нарушение зональной структуры кишечной стенки, распространение опухоли в мезоректальную клетчатку и вовлечение в опухолевой процесс мезоректальной фасции, а также органов малого таза, костных и мышечных структур; изменения в лимфатических узлах (ЛУ), расположенных как экстрафасциально так и в параректальной клетчатке.
Было доказано, что использование контрастных препаратов, как внутривенных, так и трансректальных, не улучшает диагностическую точность 11. Введение внутривенных МР-контрастных препаратов не дает клинически значимой дополнительной информации. Для опухолей прямой кишки характерно интенсивное накопление контрастного препарата (за исключением муцинозных опухолей – где кистозный компонент преобладает над солидным). Однако, столь же интенсивное накопление контрастного препарата может наблюдаться в отечной окружающей клетчатке при развитии десмопластической реакции (состояния, при котором отмечается разрастание соединительной ткани без элементов опухолевого роста) и неправильная интерпретация результатов в этом случае, будет приводит к завышению стадии экстрамуральной распространенности [4, 11-13]. По данным работ ряда авторов, динамическое МР-контрастирование может быть использовано в качестве метода, позволяющего оценить эффективность предстоящего неоадъювантного лечения. Получаемые в ходе этого вида исследования данные (такие показатели, как степень и интенсивность накопления контрастного препарата) отображают ангиогенез опухоли, ключевой фактор опухолевого роста и диссеминации, и дают возможность рассчитывать эффективность использования препаратов ингибиторов ангиогенеза в будущем [14].
В начале своей работы некоторым больным (у которых отсутствовали противопоказания) мы выполняли исследования с трансректальным введением ультразвукового геля. Следует отметить, что растяжение кишечной стенки при введении геля трансректально позволяло легко определять внутрипростветное распространение опухоли, но не увеличило точность оценки внутристеночной или трансмуральной глубины инвазии. Наоборот, перерастяжение кишечной стенки приводило к сокращению истинного пространства мезоректальной клетчатки и не позволяло определять фактическое расстояние от латерального края опухоли до мезоректальной фасции 14.
В исследовании MERCURY было доказано, что на Т2-изображениях можно визуализировать глубину инвазии мезоректальной клетчатки с точностью до 0,5 мм [15]. Но, несмотря на столь высокие показатели, стандартные режимы МРТ имеют свои диагностические ограничения в определении изменений лимфатических узлов, оценке эффективности проводимой терапии и диагностике локорегионарных рецидивов 15. В литературе существует ряд работ, оправдывающих использование диффузионно-взвешенного режима с целью улучшения диагностических возможностей МРТ в оценке местной распространенности рака прямой кишки и его рецидивов.
Давно известный в нейрорадиологии, но сравнительно недавно применяемый в онкодиагностике метод диффузионно-взвешенной МРТ (ДВ-МРТ) позволяет быстро и более точно проводить первичное стадирование опухолей и оценивать эффективность предоперационного лечения [11, 15-17].
Методика ДВ-МРТ основана на оценке степени подвижности молекул воды в исследуемых тканях. Неопластический процесс приводит к увеличению количества клеток и соответствующему уменьшению межклеточных пространств, что отображается на ДВ-изображениях с высоким b-value, в виде зон гиперинтенсивного сигнала в участках самой опухоли и пораженных Л/У. С физической точки зрения в диффузионно-взвешенном режиме изображения получают, благодаря применению двух равных по силе и длительности диффузионных градиентов, используемых перед (дефазирующий градиент) и после (рефазирующий градиент) 180 ° радиочастотного импульса в последовательности spin-echo T2. Таким образом, если молекулы воды в той или иной мере статичны, то действие на них дефазирующего градиента будет минимизировано за счет применения рефазирующего градиента, и такие молекулы будут иметь яркий сигнал на изображениях. И наоборот, если молекулы воды подвижны, то на них не сможет подействовать рефазирующий градиент, направленный в ту же точку пространства, что и дефазирующий и, следовательно, такие молекулы не будут в фазе, и это приведет к снижению сигнала на Т2-изображениях.
В-фактор (b value) отображает силу, продолжительность и время между используемыми диффузионными градиентами. В большинстве онкологических протоколов используются 2 и более b-факторов, один низкий b-value, равный 0 с/мм2, один – средний, порядка 50/100 с/мм2, и один или несколько высоких b-value 500/800/1000 с/мм2, в зависимости от зоны исследования. В процессе постобработки “сырых” данных возможно получение карт истинного коэффициента диффузии (ИКД (ADC) карт), на которых могут быть посчитаны значения ADC (apparent diffusion coefficient).
С целью определения роли магнитно-резонансной томографии в оценке местной распространенности рака прямой кишки были изучены результаты МР исследований, проведенных 110 пациентам (60 мужчин, 50 женщин), получавшим лечение в хирургическом отделении колопроктологии ФГБУ РОНЦ им Н.Н. Блохина, с 2011 по 2014 гг. Восемнадцать больных (19,8%) не получали неоадъюватной терапии, а только хирургическое лечение, и поэтому МР исследование им было проведено один раз с целью__местного стадирования опухоли. Остальным 92 больным (80,2%) исследование проводилось дважды: с целью первичного стадирования опухоли и повторно, для оценки эффективности проводимого лечения.
Рисунок 1. T2 cor. Красными линиями обозначено поле исследования и угол наклона сагиттальных срезов