Инфильтрация стромы что это
Хронический эндометрит
Хронический эндометрит (ХЭ) – воспалительное заболевание слизистой оболочки матки (эндометрия).
Заболевание встречается преимущественно у женщин репродуктивного возраста (26-35 лет), ведет к нарушению менструальной и генеративной функции, служит причиной бесплодия, невынашивания беременности. У женщин с бесплодием частота встречаемости ХЭ составляет от 12 до 68%, а у пациенток с привычным невынашиванием беременности – более 70%. У больных с неудачной попыткой ЭКО и ПЭ хронический эндометрит встречается в 60% случаях.
ХЭ чаще всего развивается после аборта или родов, в результате осложнений внутриматочных манипуляций, таких как выскабливание полости матки, биопсия эндометрия, гистероскопия, гистеросальпингография, использование ВМС. Развитию ХЭ также предшествуют воспалительные заболевания органов малого таза, инфекции влагалища и шейки матки, деформация полости матки с нарушением отторжения эндометрия во время менструации, перенесенные ИППП (инфекции, передающиеся половым путем).
Чаще всего возбудителями ХЭ в современных условиях являются микст – инфекции (сочетание вирусно-бактериальной и условно-патогенной флоры). Особое место занимает герпетическое поражение эндометрия, которое чаще всего бывает у женщин, страдающих различным формами генитального герпеса.
Длительное присутствие инфекционных агентов в эндометрии приводит к выраженным изменениям его структуры и свойств, что вызывает нарушение нормальной имплантации эмбриона и формирования плаценты. Морфологические изменения структуры эндометрия сопровождаются выраженной воспалительной реакцией, в результате которой нарушается местная микроциркуляция.
Клинически ХЭ проявляется циклическими маточными кровотечениями, перименструальными кровянистыми выделениями, болевым синдромом, выделениями из половых путей (гноевидные и серозные бели), бесплодием и невынашиванием беременности. У 9-38% пациенток с ХЭ могут отсутствовать какие-либо симптомы, и заболевание протекает субклинически и бессимптомно.
Диагностика ХЭ
Обязательным этапом диагностики данного заболевания является морфологическое исследование материала, которое проводят в среднюю и позднюю фазу пролиферации эндометрия – на 7-10 день менструального цикла.
Морфологические критерии диагностики ХЭ:
Важным методом диагностики ХЭ является ультразвуковое исследование органов малого таза, которое должно предшествовать морфологическому методу.
Исследование проводят дважды: в первые 1-3 дня после менструации и за 2-3 дня до начала месячных.
Наиболее частые эхографические признаки хронического эндометрита это:
Гистероскопия является инвазивным и окончательным методом при установлении диагноза и состоит из визуализации полости матки и биопсии эндометрия с последующим микробиологическим и морфологическим исследованием ткани.
Наиболее характерные гистероскопические признаки ХЭ:
Лечение ХЭ
На первом этапе необходимо удалить повреждающий агент. С этой целью используют антимикробные и противовирусные лекарственные препараты, обеспечивающие элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы и стрептококк. Оправдано назначение нескольких курсов этиотропного лечения со сменой групп препаратов.
Одновременно проводится коррекция иммунных нарушений.
Второй этап лечения направлен на коррекцию метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. С этой целью применяются физические факторы (электроимпульсная терапия, переменное магнитное поле низкой частоты и т.д.). Физиотерапию проводят с 5-7-го дня менструального цикла ежедневно. С целью метаболической терапии используются метаболические препараты не менее 3-4 недель.
Контроль эффективности терапевтических мероприятий проводится через 2 месяца после окончания лечения путем применения аспирационной биопсии эндометрия.
Необходимо помнить, что хороший эндометрий – одно из главных условий успешного прикрепления плодного яйца.
Источники: «Бесплодный брак» под редакцией, В.И.Кулакова, «Хронический эндометрит», Г.Т.Сухих, А.В.Шуршалина, «Женское бесплодие», В.А.Кулавский, «Патология полости матки», В.Н.Демидов, А.И.Гус.
Инфильтрация стромы что это
Комплексное иммуногистохимическое исследование экспрессии специфических иммунологических маркеров хронического эндометрита (натуральных киллеров CD56 и CD16, B-клеток (CD20), плазматических клеток (CD138) и активированных лимфоцитов (HLA-DR), позволяющее провести более точную диагностику и спрогнозировать течение процесса, оценить эффективность проводимой терапии и провести ее коррекцию.
Иммуногистохимическое исследование биоптата эндометрия.
Синонимы английские
Immunohistochemical analysis of endometrial biopsies.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Иммуногистохимия – это метод исследования тканей и клеток, основанный на обнаружении специфических антигенов с помощью присоединения к ним антител, меченных флюорохромом или ферментом. Антигены – молекулы белков или углеводов, имеющие уникальную трёхмерную структуру, способные индуцировать образование антител. Антитела – это иммуноглобулины, распознающие антигены и присоединяющиеся к ним во время реакции “антиген-антитело”. Антигены и антитела – это молекулы, неразличимые при исследовании методом световой и электронной микроскопии. Для обнаружения специфических антигенов к образцу ткани или клеток добавляют реагент, содержащий меченные флюорохромом или ферментом антитела, в результате чего образуется иммунный комплекс “антиген-антитело”. Комплексы формируют специфическое окрашивание тканей и клеток, обеспечивая детекцию патологических изменений на молекулярном уровне. Иммуногистохимическое исследование позволяет верифицировать онкологические заболевания, метастатические поражения, определить их гистологический подтип, экспрессию биомаркеров, определяющих прогноз заболевания и схему лечения.
Эндометрий – это слизистая оболочка, выстилающая полость матки изнутри, необходимая для имплантации оплодотворенной яйцеклетки и развития плаценты во время беременности. Он подвергается динамическим структурным и функциональным изменениям во время менструального цикла под действием женских половых гормонов. Для исследования эндометрия в фазе пролиферации материал для исследования забирается с 5 до 14 день менструального цикла. Пролиферативная фаза прекращается в момент овуляции, когда зрелая яйцеклетка выходит из фолликула яичника в маточную трубу. Под действием гормона желтого тела яичника – прогестерона приостанавливается рост желез эндометрия и стромы, начинается секреторная фаза, характеризующаяся образованием вакуолей секретом в клетках желез (15-18 день). Позже секрет выделяется в просвет желез, формируется гипертрофия стромальных клеток, появляются видимые спиральные артериолы. Морфологические изменения сопровождаются небольшой нейтрофильной и лимфоцитарной инфильтрацией.
Ряд патологических состояний нарушает нормальное циклическое функционирование эндометрия у женщин репродуктивного возраста. Наиболее распространенными причинами считаются хронический эндометрит, полипы эндометрия, ановуляция и миома матки.
Хронический эндометрит – это воспалительное заболевание эндометрия, чаще поражающее женщин репродуктивного возраста, но встречающееся и в постменопаузе. Факторами риска являются воспалительные заболевания органов малого таза, внутриматочные контрацептивы (спирали), хирургические манипуляции в полости матки (выскабливание), недавняя беременность. Возбудителями заболевания чаще всего являются Chlamydia trachomatis, Neisseria gonorrhoeae, Streptococcus agalactiae, Mycoplasma hominis и различные вирусы. Наиболее распространенный симптом – маточные кровотечения, не связанные с менструацией. Кроме того, хронический эндометрит может быть причиной бесплодия и самопроизвольного прерывания беременности.
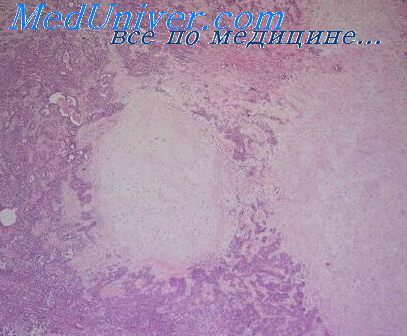
Золотым стандартом диагностики хронического эндометрита является гистологическое исследование биоптата эндометрия. Главным маркером является инфильтрация стромы эндометрия плазматические клетками (CD138). Также часто обнаруживаются и другие воспалительные элементы: нейтрофилы (обычно в поверхностном эпителии и железах), субэпителиальные лимфоцитарные инфильтраты, гистиоциты с гемосидерином и редкие эозинофилы.
Поскольку эпизодические плазматические клетки обнаруживаются и в поздней секреторной фазе, и в строме полипов эндометрия, их присутствие не всегда означает инфекционную этиологию. В очень редких случаях обнаружение плазматических клеток в биоптате эндометрия может свидетельствовать о лимфопролиферативном заболевании.
Для дифференциальной диагностики используется метод иммуногистохимии, позволяющий определить маркеры хронического эндометрита на молекулярном уровне и идентифицировать воспалительные клетки (плазматические клетки CD138), натуральные киллеры CD56 и CD16, B-клетки (CD20) и активированные лимфоциты (HLA-DR).
При верификации диагноза назначается специфическая антибактериальная терапия. По результатам исследования можно оценить эффективность проводимой терапии, определить показания к ее коррекции.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Исследование назначается при наличии клинико-анамнестических данных и по результатам предварительно проведенного гистологического исследования.
Структуры эндометрия, соответствующие фазе пролиферации, наблюдаемые в физиологических условиях в первую половину 2-фазного менструального цикла могут отражать гормональные нарушения, если их обнаруживают во второй половине цикла (это может указывать на ановуляторный, однофазный цикл или на ненормальную, удлиненную фазу пролиферации с запоздавшей овуляцией при двухфазном цикле), при железистой гиперплазии эндометрия в различных участках гиперплазированной слизистой оболочки матки и при дисфункциональных маточных кровотечениях у женщин в любом возрасте.
Обнаружение специфических маркеров (натуральных киллеров CD56 и CD16, B-клеток CD20), плазматических клеток (CD138) и активированных лимфоцитов (HLA-DR) в биоптате эндометрия в пролиферативную фазу свидетельствует о хроническом эндометрите.
Кто назначает исследование?
1) Techniques of immunohistochemistry: principles, pitfalls, and standardization. Richard W. Cartun, Clive R. Taylor and David J. Dabbs. Diagnostic Immunohistochemistry, Chapter 1, 1-46.
2) Benign Endometrium. David W Kindelberger and Marisa R Nucci. Gynecologic Pathology: A Volume in the Series: Foundations in Diagnostic Pathology, Chapter 6, 197-232.
3) The Female Genital Tract. Lora Hedrick Ellenson and Edyta C. Pirog. Robbins and Cotran Pathologic Basis of Disease, Chapter 22, 991-1042.
4) Immunohistochemical analysis of CD56-positive natural killer cells in the human endometrium. Maja Weber, Bettina Toth, Isabel Santillan, Christin Bär, Ekkehard Schleußner and Udo R. Markert. Journal of Reproductive Immunology, 2016-06-01, Volume 115, Pages 79-80.
5) Genital Tract Infections: Vulva, Vagina, Cervix, Toxic Shock Syndrome, Endometritis, and Salpingitis. Carolyn Gardella, Linda O. Eckert and Gretchen M. Lentz Comprehensive Gynecology, 23, 524-565.
Инфильтрация стромы что это
Под влиянием лечебных процедур изменяются и многие другие свойства опухолевых клеток и происходящие в них процессы, которые здесь не рассмотрены. Клеточные реакции при патологии, как известно, многообразны и сводятся к нескольким типам. Все они наблюдаются в той или иной мере при патоморфозе. Однако уже давно показано, что, помимо прямого действия на паренхиму, лечебные факторы оказывают влияние на опухоль и опосредованно через изменения стромы и окружающих тканей Н А. Краевский (1976) в связи с этим подчеркивал, что «успехи в лечении опухолей нельзя сводить к простому прямому уничтожению клеток, их образующих.
По-видимому, нет оснований надеяться на «нормализацию» клеток новообразования. Успех скорее может быть связан с невозможностью дальнейшего существования клеток опухоли н появлением иовых, с иными биологическими свойствами клеточвых генераций в зоне исчезнувших опухолевых.
Анализ литературы показывает, что изменениям стромы опухолей при патоморфозе посвящено значительно меньше работ, чем превращениям паренхимы. Это связано, очевидно, не с одним, а с рядом обстоятельств, в частности, с относительно меньшей диагностической значимостью стромалькых изменений, с опосредованным характером стромальных механизмов патоморфоза, с недооценкой прогностической значимости сдвигов со стороны клеточных и особенно иеклеточных компонентов стромы и т. д. Между тем, даже относи тельно скромные данные указывают на многообразие состояний стромы эпителиальных опухолей при патоморфозе. В предыдущие десятилетия полнее всего были изучены повреждения кровеносных сосудов опухоли и неклеточиых компонентов соединительной ткаин, нарушения кровообращения.
В последнее время предпочтение отдается исследованию клеточных элементов соединительной ткани местного н гематогенного происхождения в соответствии с учением о воспалении и иммунитете.
В процессе лекарственной и особенно радикальной лучевой терапии в соединительной ткани опухоли определяют по существу все известные из общей патологии процессы дистрофию н иекроз, нарушения крово- и лимфообращения, воспалительные и иммунопатологические реакции. При эффективном лечении на месте бывшей опухоли разрастается соединительная ткань разной степени зрелости. Совокупность признаков лучевого патоморфоза злокачественных опухолей мягких тканей изменяется в зависимости от длительности интервала между завершением облучения и операцией.
Для опухолей, удаленных в 1-ю неделю, более характерно нарастание коллагенообразования, отек, миксоматоз, кровоизлияния. По мере удлинения предоперационного интервала нарастают фиброзные изменения в внде очагового и диффузного разрастания соединительной ткани с образованием очагов гиалиноза с четким отграничением опухолевого узла фиброзной капсулой.
Кровеносные сосуды опухоли — артерии, вены, синусоиды, капилляры — подвергаются самым разнообразным изменениям, начиная от новообразования капилляров и кончая облитерацией просвета и гиалинозом артерий. Нарушения кровообращения представлены также всем спектром патологии. Изучение меланомы, рака молочной железы и злокачественных опухолей мягких тканей после комплексного лечения (СВЧ-гипертермия+ луче вая терапия, гипергликемия +химиотерапия+обшая гипертермия+лучевая терапия) показало, что необратимые повреждения развиваются главным образом в центрально расположенных отделах опухолей, имеют распространенный характер н сопровождаются резко выраженными расстройствами кровообращения.
Применение электронной микроскопии помогло установить особенности внутриопухолевой пролиферации сосудов и ее взаимом ношение с пролифера тивной активностью эпителия. Показано, что регенерация поврежденное сосудистого русла опухолей может осуществляться за счет как существующих, так и новообразуюших капилляров. Кровеносные и лимфатические капилляры опухоли реагируют на терапевтические воздействия, в частности, на раннее облучение и всеми элементами. Реакция эндотелиальных клеток на облучение имеет сходные черты с реакцией паренхимы опухши.
Физиологический аспект проблемы микроциркуляции в опухоли прежде всего связан с вопросами тканевой проницаемости и с процессами поступления кислорода и субстратов обмена веществ лекарственных средств, выделением продуктов метаболизма, миграцией клеток гематогенном) происхождения и др. Современные исследования подтверждают уже давно установленную закономерность о нарушении проницаемости сосудистых стенок и соединительной ткани при лучевом воздействии. Значительно меньшая скорость кровотока в опухолях но сравнению с нормальными тканями является дополнительным фактором, препятствующим эффективному лечению.
Характер и выраженность клеточных реакций стромы в опухоли и в окружающих ее тканях разнообразны и это разнообразие зависит от вида опухоли, условий ее возникновения и роста, от длительности болезни и от особенностей тканей, в которые опухоль прорастает. Считают, что эти реакции возникают в ответ на изменения антигенных свойств эпителия при малигнизации. Поскольку полиморфноядерные лейкоциты, макрофаги, лимфоциты и другие клетки составляют основу воспалительных инфильтратов, было выдвинуто предположение о их защитной рати при росте опухоли. Результаты многих исследований показали, что образование в строме опухолей и особенно в зонах их роста лимфоидно-плазмоцитарной инфильтрации, а также гиперплазия лимфатических фолликулов регионарных лимфатических узлов представляют собой проявление иммунной реакции. Важнейшим условием роста опухолей является иммунологическая недостаточность организма.
Вместе с тем известна усиливающая канцерогенез роль лимфоцитов. Вопрос о механизмах участия клеточных факторов в феномене усиления требует более глубокого изучения. Рассмотрение этих вопросов выходит за пределы данного раздела. Однако участие клеточных элементов стромы в механизмах лечебного патоморфоза необходимо разобрать
Лимфоцитарная инфильтрация Джесснера-Канофа
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
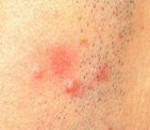
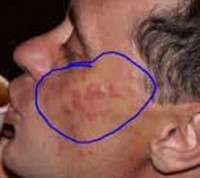
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Инфильтрат
Инфильтрат — это скопление в тканях организма клеточных элементов, несвойственных для этой области, а также крови и лимфы. Его формирование сопровождается увеличением ткани в объеме, она уплотняется, меняет цвет, в очаге ощущается болезненность.
Лечение и прогноз этого состояния зависят от вида и причины его возникновения:
В медицине выделяется еще несколько разновидностей этого состояния.
Представляет собой скопление различных клеток в легочной ткани. При этом ткань уплотняется, увеличивается в объеме, а работа органов дыхания затрудняется. Причина образования инфильтрата легкого — проникновение инфекции и паразитов (аскаридоз), развитие опухоли, аллергический процесс.
Для определения патологии решающую роль играет рентгенологическое обследование. Также назначаются анализы крови для определения природы болезни и возможных возбудителей.
Лечение зависит от причины патологии. Терапию назначает врач-пульмонолог.
Инфильтрат после операции — это осложнение, возникшее в результате хирургического вмешательства. Причина развития патологии — инфицирование и травматизация тканей.
Также возникновению инфильтратов способствует нарушение кровообращения в области вмешательства и сниженная сопротивляемость инфекциям в послеоперационном периоде.
Патология развивается постепенно. Она обнаруживается на первой или второй неделе после операции. У человека поднимается температура, появляются боли в области брюшной полости, возникает задержка стула. В области вмешательства врач определяет болезненное уплотнение.
Инфильтрат опасен остановкой затягивания послеоперационной раны и ее нагноением, поэтому сразу при его обнаружении хирург назначает антибиотикотерапию.
Патология развивается на месте подкожных или внутримышечных уколов. Чаще всего инфильтрат возникает после инъекций в ягодичную мышцу: появляется болезненность, при пальпации обнаруживается уплотнение. Кожа краснеет, температура поднимается до субфебрильных цифр.
Причиной развития становится нарушение правил постановки уколов (тупые иглы, быстрое введение препарата, частые инъекции в одну и ту же область, несоблюдение правил асептики).
Для лечения инфильтрата используются местные средства (йодная сетка), методы физиотерапии (электрофорез), УВЧ и антибиотикотерапия.
Это осложнение острого аппендицита, которое проявляется в виде спаянных между собой тканей аппендикса с органами, расположенными поблизости (слепая кишка, тонкая кишка, сальник).
Образование формируется на 2–5 день от начала болезни. После формирования инфильтрата острую боль в правой подвздошной области сменяет тупая и ноющая. В крови также определяется воспаление (повышенное СОЭ, лейкоцитоз). Температура поднимается до субфебрильных цифр. Со временем уплотнение может нагноиться или рассосаться. Образование лечится консервативным путем: врач назначает антибиотики, физиотерапевтические процедуры. Через 2 месяца проводится плановая аппендэктомия.