Ингаляция оксидом азота для чего
Применение ингаляций оксида азота при первичной легочной гипертензии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
НИИ Пульмонологии МЗ РФ, Москва
Больная С., 43 лет, поступила в октябре 2000 г. в НИИ пульмонологии МЗ РФ с жалобами на одышку при умеренной физической нагрузке (ходьба до 200 м), сердцебиение, повышенную утомляемость, слабость.
Из анамнеза известно, что впервые небольшая одышка при физической нагрузке появилась в 1974 г., а с 1996 г. изредка стали возникать эпизоды синкопе. За медицинской помощью больная не обращалась, не обследовалась. С 1998 г. стали беспокоить приступы учащенного сердцебиения, сопровождающиеся давящей болью за грудиной, усилилось диспное, резко снизилась толерантность к физической нагрузке.
При осмотре: состояние тяжелое, цианоз губ, пастозность стоп. Границы легких перкуторно не изменены, при аускультации дыхание везикулярное, хрипы не выслушиваются, ЧДД 16 в минуту. Границы сердечной тупости несколько расширены влево (на 1,5 см), при аускультации выслушивается систолический шум вдоль левого края грудины, акцент II тона над точкой легочной артерии, ЧСС 86 в минуту, тоны ритмичные, АД 130/80 мм рт.ст. Живот мягкий, безболезненный при пальпации, печень не пальпируется.
Рентгенография органов грудной клетки: легочные поля прозрачные, легочный рисунок обеднен по периферии легочных полей, корни легких расширены, в прямой проекции по левому контуру выбухает II дуга, увеличение тени сердца за счет правого желудочка.
ЭКГ: синусовый ритм, резкое отклонение электрической оси сердца вправо, признаки перегрузки правого предсердия и гипертрофии правого желудочка.
ФВД: нормальная бронхиальная проходимость, небольшое снижение воздушного потока по мелким бронхам (MСВ25-75 = 66% от должного).
Исследование вентиляционно-перфузионного дисбаланса: P(A-a)O2 – 36 мм рт. ст., истинный шунт QS/QT (на фоне дыхания 100% О2) – 7%.
Допплерэхокардиография: систолическая регургитация в полость правого предсердия III cтепени; систолическое давление в легочной артерии повышено (расчет по скорости трикуспидальной регургитации) – 75 мм рт.ст.
Учитывая практически нормальные показатели ФВД при наличии клинических и инструментальных признаков высокой легочной гипертензии и при умеренных нарушениях газообмена, решено было применить более инвазивные методы диагностики для исключения пороков сердца и тромбоэмболической формы легочной гипертензии.
Ангиопульмонография: значительное расширение основного ствола легочной артерии и ее крупных ветвей, резкое сужение периферических ветвей легочных артерий с обеих сторон по типу синдрома “обгоревшего дерева”; данных за эмболию и пороки сердца не получено.
Катетеризация правых отделов сердца (Swan Ganz катетер): давление в легочной артерии 89/35 мм рт. ст. (в норме до 30/12 мм рт.ст.); среднее давление в легочной артерии 56 мм рт. ст. (в норме до 16 мм рт.ст.), давление в правом предсердии 4 мм рт.ст. (в норме 4-5 мм рт.ст.); давление заклинивания в легочной артерии 9 мм рт.ст. (в норме до 12 мм рт.ст.); сердечный индекс 4,2 л/мин (в норме 4-7 л/мин); легочное сосудистое сопротивление 895 дин/с/см5 (в норме 50-120 дин/с/см5), индекс ударной работы правого желудочка 24,9 г.м/м2 (в норме до 10 г.м/м2).
Гистологическое исследование ткани легких (торакоскопическая видеосопровождаемая биопсия): гипертрофия медии, пролиферация и фиброз интимы вплоть до полного сужения сосудов – признаки плексогенной легочной артериопатии (рис. 1).
Рис. 1. Гистологическая картина ткани легких
Учитывая данные проведенных исследований, был поставлен диагноз: Первичная легочная гипертензия, плексиформная артериопатия, НК II.
Для оценки ответа на терапию вазодилататорами был проведен тест с ингаляционным NO. Последовательно назначались дозы NO 5, 10, 20 и 40 ppm. Эффект терапии оценивался по динамике показателей систолического давления в легочной артерии и сердечного выброса, измеряемых при помощи эхокардиографического метода, показателей системного артериального давления и газового состава артериальной крови. Максимальный эффект от терапии NO был получен при использовании концентраций 10 и 20 ppm: снижение легочного систолического давления более 30%, повышение PaO2, при умеренном снижении сердечного выброса и неизменных значениях системного артериального давления (рис. 2).
Рис. 2. Применение NO при первичной легочной гипертензии
В дальнейшем больной в ходе стационарного лечения (14 дней) проводилась терапия оксидом азота через носовые канюли в дозе 20 ppm. Эффективность оказалась довольно высокой: значительно уменьшилась одышка, выросла толерантность к физическим нагрузкам, снизилось давление в легочной артерии (в конце курса терапии систолическое легочное АД 61 мм рт.ст.), повысилась оксигенация артериальной крови (перед выпиской 78 мм рт.ст.).
ПЛГ является редким заболеванием (заболеваемость 1 случай на 2 млн в год), которым чаще страдают женщины молодого возраста, хотя оно может наблюдаться у мужчин, детей и у пожилых. Причиной повышенного давления в легочной артерии становятся изменения мелких сосудов легких, что приводит к повышению сопротивления кровотоку в этих сосудах [8]. Повышенное легочное сопротивление, в свою очередь, ведет к повышению нагрузки на правый желудочек, с его последующей гипертрофией, дилатацией, и в конечном итоге, развитию сердечной недостаточности.
При первичной легочной гипертензии описано несколько гистологических типов сосудистых изменений: гипертрофия медии, фиброз интимы, плексиформные, тромботические и вено-окклюзионные изменения. Данная патология не специфична для ПЛГ, так как может наблюдаться и при многих формах вторичной легочной гипертензии [4]. Часто перечисленным изменениям сопутствуют гипертрофия и гиперплазия гладких мышц легочных артерий, что также вносит существенный вклад в повышение легочного сосудистого сопротивления.
ПЛГ является очень сложным заболеванием как с точки зрения диагностики, так и лечения, что отражает недостаточно изученные механизмы заболевания. Кроме того, данное заболевание ассоциировано с крайне плохим прогнозом: средняя выживаемость больных через 5 лет от момента диагностики ПЛГ составляет около 21% [4].
К основным клиническим симптомам заболевания относятся прогрессирующая одышка при физическом напряжении, загрудинные ангинозноподобные боли, также чаще всего связанные с физической нагрузкой, изредка – кровохарканье. Появление синкопальных состояний считается неблагоприятным прогностическим признаком, свидетельствующем о снижении церебрального кровотока.
Следует подчеркнуть, что для постановки диагноза ПЛГ необходимо исключить вторичные причины легочной гипертензии, такие как тромбоэмболическая болезнь, врожденные пороки сердца, паренхиматозные заболевания легких, синдромы нарушения дыхания во время сна, системные заболевания соединительной ткани, легочные васкулиты, применение различных препаратов и субстанций (анорексигенные препараты, L-триптофан, токсическое рапсовое масло, кокаин), ВИЧ-инфекция, портальная гипертензия [10].
Выбор лекарственных препаратов, доступных для терапии ПЛГ, в настоящее время довольно ограничен. Системные вазодилататоры, такие как антагонисты кальция (АК), могут приводить к снижению артериального давления в легочной артерии и улучшению функции правого желудочка. У больных, “отвечающих” на прием антагонистов кальция снижением легочного давления, прогноз значительно лучше, чем у больных, не реагирующих на данный класс препаратов [4]. При ПЛГ используются очень высокие дозы АК: 40-180 мг нифедипина или 120-360 мг дилтиазема [1]. К сожалению, лишь 20-30% больных имеют положительный ответ на вазодилататоры. Серьезным препятствием для подбора эффективной дозы АК при ПЛГ является развитие значительных побочных эффектов: системной гипотензии и тахикардии. Для неотвечающих больных необходим подбор других препаратов.
Одним из наиболее мощных и эффективных препаратов для терапии больных ПЛГ является простациклин (PGI2), который назначается в виде длительной (годами!) внутривенной инфузии. Кроме снижения давления в системе легочной артерии, препарат обладает также антипролиферативным и антиагрегантным эффектами, что препятствует развитию ремоделирования сосудистой стенки. Длительная терапия простациклином приводит к улучшению клинических симптомов, увеличению толерантности к физическим нагрузкам, повышению качества жизни и выживаемости больных [2]. Однако простациклин обладает большим количеством побочных эффектов (диарея, головокружение, сыпь, боли в конечностях, гипотензия). Внутривенный путь введения препарата также существенно затрудняет его широкое использование: наличие центрального катетера часто ведет к развитию таких осложнений, как инфекции и тромбозы. Еще одним недостатком препарата является его высокая стоимость: годовой курс терапии простациклином стоит около 25 тыс долларов США.
В связи с перечисленными недостатками простациклина все большее значение придается альтернативным методам терапии легочной гипертензии, к числу которых относится и оксид азота.
Мощный вазодилатирующий эффект и возможность обеспечения селективного действия на сосуды малого круга при ингаляционном пути введения NO очень быстро привлекли внимание исследователей к данной молекуле. В настоящее время как селективный вазодилататор NO активно используется при таких состояниях, как острый респираторный дисстресс-синдром, легочная гипертензия новорожденных, легочная гипертензия после операций на сердце, эмболия легочной артерии, первичные и вторичные формы легочной гипертензии.
Изначально при ПЛГ NO отводилась роль агента, позволяющего оценить реактивность сосудов легких, т.е. выявить больных, положительно отвечающих на вазодилататоры, что, как уже подчеркивалось, имеет важное прогностическое значение. Снижение тонуса сосудов легких может наблюдаться через несколько секунд от начала ингаляции NO. В нескольких исследованиях было показано, что острые тесты с ингаляционным NO позволяют выявить больных, которые реагируют на пероральные антагонисты кальция с точностью до 90% [9]. В то же время тест с NO более безопасен по сравнению с нифедипином или дилтиаземом (частота развития побочных эффектов при остром тесте с АК достигает 38%: системная гипотензия, шок и даже летальные исходы!). Кроме того, острый тест с NO занимает гораздо меньше времени (10-40 мин) по сравнению с пробой с АК ( до 6-8 часов). При проведении теста с NO обычно используют возрастающие концентрации 5, 10, 20, 40 ppm, время ингаляции во время каждого этапа не превышает 10 минут [8]. В нашем случае максимальный эффект наблюдался при концентрации NO 20 ppm, по данным ранее проведенных исследований чаще всего используются дозы от 10 до 40 ppm.
Другим перспективным направлением использования ингаляционного NO при ПЛГ является длительное назначение данного газа с лечебной целью. Число таких исследований пока очень мало. В нашем случае ингаляционная терапия NO в течение 14 дней привела к выраженному положительному клиническому эффекту, что позволяет в перспективе рекомендовать данный вид терапии больным с ПЛГ в условиях стационара. Техника назначения NO довольна проста, возможно назначение газа через носовые канюли, либо через лицевую маску, однако для точного титрования дозы необходимо использование мониторинга вдыхаемой смеси при помощи анализаторов NO/NO2. Необходимо также обратить внимание на такие технические детали, как использование регуляторов давления из нержавеющей стали и калибровка флоуметра для NO, а также на меры безопасности при терапии NO: контроль метгемоглобина крови пациента в первые дни лечения и контроль в контуре системы и в окружающем воздухе концентрации NO2 (токсичного метаболита реакции взаимодействия NO и O2), которая не должна превышать 2 ppm.
Имеются сообщения о длительном амбулаторном назначении NO больным ПЛГ: описано двое пациентов, получавших данный вид терапии в течение 9 месяцев и 1,5 лет. В обоих случаях ингаляция NO оказалась безопасным и высокоэффективным методом терапии больных ПЛГ [3, 6]. В настоящее время в нескольких центрах США и Европы планируется проведение долгосрочных исследований эффективности длительной терапии NO.
Литература:
1. Чазова И.Е. Современные подходы к лечению легочного сердца. //Рус Мед Журн, 2000; 8(2): 83-6.
2. Barst RJ, Rubin LJ, McGoon MD, et al. Survival in primary pulmonary hypertension with long-term continuous intravenous prostacyclin. //Ann Intern Med 1994; 121:409-15
3. Channick RN, Newhart JW, Johnson FW, et al. Pulsed delivery of inhaled nitric oxide to patients with primary pulmonary hypertension. An ambulatory delivery system and initial clinical tests. //Chest, 1996; 109: 1545-9.
4. Groechenig E. Cor pulmonale. Treatment of pulmonary hypertension. Blackwell Science, Berlin- Vienna, 1999; 146.
5. Ignarro LJ. Biological actions and properties of endothelium-derived nitric oxide formed and released from artery and vein. //Circ Res, 1989; 65: 1-21
6. Koh E, Niimura J, Nakamura T, et al. Long-term inhalation of nitric oxide for a patient with primary pulmonary hypertension. //Jpn.Circ.J., 1998; 62: 940-2.
7. Rubin LJ. ACCP Consensus Statement: primiry pulmonary hypertension. //Chest, 1993; 104: 236-50.
8. Sitbon O, Brenot F, Denjean A, et al. Inhaled nitric oxide as a screening vasodilator agent in primary pulmonary hypertension. //Am J Respir Crit Care Med, 1995; 151: 384-9
9. Sitbon O, Humbert M, Jagot J, et al. Inhaled nitric oxide as a screening agent for safely identifying responders to oral calcium-channel blockers in primary pulmonary hypertension. //Eur Respir J, 1998; 12: 265-70.
10. Voelkel NF, Tuder RM. Severe pulmonary hypertensive diseases: a perspective. //Eur Respir J, 1999; 14: 1246-50.
Ингаляция от коронавируса: пульмонолог — о лечении COVID-19 оксидом азота и гелием
Ингаляции гелия и оксида азота могут применяться для лечения коронавирусной инфекции нового типа у тяжелобольных пациентов, однако этот метод технологически сложен и имеет противопоказания. Об этом в интервью RT заявил заслуженный врач России, профессор РНИМУ им. Пирогова, врач-пульмонолог Александр Карабиненко.
Также академик Чучалин рассказал, что в НИИ им. Склифосовского уже получены положительные результаты лечения пациентов такой смесью — оксид азота улучшает микроциркуляцию крови и предотвращает тромбообразование, а нагретый гелий убивает вирусы.
Для использования газовых смесей разработан российский аппарат «Тианокс», который, по информации специалиста, начнут выпускать серийно по госзаказу.
По словам Александра Карабиненко, лечение газовыми смесями действительно может быть весьма эффективным для тяжелобольных коронавирусной инфекцией, особенно вместе с применением аппаратов искусственной вентиляции лёгких (ИВЛ).
«Оба метода, как ИВЛ, так и лечение гелиевыми смесями с оксидом азота, эффективны при тяжёлой дыхательной недостаточности»,— подтвердил профессор Карабиненко.
Однако, по мнению специалиста, предложенная методика имеет ряд ограничений. «Этот метод лечения известен давно, его активно применяют последние 20 лет. Однако получение таких газовых смесей — дело непростое. Их заказывают заранее, изготавливают на специальных предприятиях», — отметил собеседник RT.
«Нужна особая аппаратура и специалисты, обученные методике. К тому же есть противопоказания. Нельзя просто так дать дышать человеку инертным газом», — объяснил Карабиненко.
Специалист добавил, что быстро обеспечить всю страну оборудованием для таких ингаляций непросто — даже в обычных столичных стационарах его пока нет. По словам пульмонолога, система здравоохранения испытывает повышенную нагрузку, в связи с этим специалист отметил, что обеспечение больниц приборами для ингаляций будет «материально накладно для медицины».
Ингаляция оксида азота
Специалисты санаторно-курортной отрасли при разработке программы реабилитации после COVID-19 были озадачены поиском подходящей эффективной и безвредной методики. И такой метод был найден. Это ингаляции оксида азота, NO-терапия. Метод уже давно применяется в кардиологии и реанимации, неонатологии, хирургии, является проверенным многолетней практикой врачей стационаров. По рекомендации ведущего Российского пульмонолога академика Александра Григорьевича Чучалина теперь он стал применяться и в санатории «Виктория» в Кисловодске в программах лечения последствий коронавирусной инфекции, а также в лечении хронических заболеваний бронхолегочной и сердечно-сосудистой систем.
Суть метода
Оксид азота во время ингаляций расширяет легочные сосуды, что обеспечивает снижение легочного сопротивления, то есть. При этом он не оказывает патологического действия на сосуды большого круга кровообращения и не раздражает ткани легких и бронхов. В результате улучшается микроциркуляция крови, уменьшается процесс тромбообразования, снижается нагрузка на сердце, улучшается кровоснабжение всех внутренних органов.
Лечебные свойства оксида азота:
Процедура проводится с помощью специального аппарата «Тианокс», который обеспечивает определенную концентрацию подаваемого оксида азота. Курс состоит из 8-15 процедур. Методика весьма эффективно сочетается с большинством других процедур санатория. Аппарат «Тианокс» осуществляет синтез оксида азота непосредственно во время процедуры, что сделало процедуру доступной для пациентов санатория.
Аппарат для реабилитационных целей с успехом применяется в ведущих российских медицинских центрах, в которых проводится лечение больных с коронавирусной инфекцией и кардиопациентов: НИИ скорой помощи им. Склифосовского, РНИМУ им. Н.И.Пирогова, ФГБУ «НМИЦ им В.А.Алмазова» и других. Проведенные научные исследования убедительно доказали, что NO- терапия позволяет снизить легочное сосудистое сопротивление на 35%, что существенно ускоряет восстановление пациентов после перенесённой инфекции.
Ожидаемый эффект
Показания
Показания к применению ингаляция оксида азота в санаторно-курортном лечении:
У NO-терапии есть и существенные ограничения. Применяться он должен только под наблюдением лечащего врача.
Противопоказания
Имеется ещё ряд других противопоказаний. Ингаляции оксида азота проводятся в санатории исключительно по назначению лечащего врача. Их применение в комплексном санаторно-курортном лечении позволяет добиваться высокой эффективности при реабилитации после коронавирусной инфекции, хронических заболеваниях бронхолегочной и сердечно-сосудистой систем.
Министр туризма и оздоровительных курортов Ставропольского края Реут Кирилл Владимирович вручил награды отличившимся сотрудникам санатория. Все они – призеры краевого конкурса «Туристское Ставрополье».
О новых видах анализов – цитологические исследования шейки матки и спермограмма, рассказывает врач лабораторной диагностики Айбазова Мариям Алиевна.
Дорогие гости, просим обратить внимание на ИЗМЕНЕНИЯ перечня документов, необходимых при заезде в санаторий.
Россия,
Ставропольский край,
г. Кисловодск, ул. Кирова, д. 12
+7 (495) 959-22-78
Москва
+7 (87937) 9-43-33
Кисловодск
Ингаляция оксидом азота для чего
Молекула оксида азота (NO) представляет собой один из важнейших факторов противоинфекционной резистентности иммунной системы организма. эндогенный NO участвует в реакциях пролиферации, апоптозе лимфоцитов и моноцитов, фагоцитозе, активации системы комплемента, изменяет плазменную концентрацию провоспалительных, ростовых, пролиферативных цитокинов.
Материалы и методы исследования эффективности ингаляционного оксида азота в профилактике бактериальных осложнений у новорожденных
Целью исследования, проведенного неонатологами НИИ Акушерства неонатологии и педиатрии Ростовского медицинского университета, стала оценка эффективности ингаляций оксида азота (iNO) в составе традиционной интенсивной терапии в профилактике бактериальных осложнений у новорожденных с респираторной патологией, находящихся на искусственной вентиляции легких ИВЛ).
Было обследовано 97 доношенных новорожденных с респираторной патологией, поступивших на ИВЛ из родильных домов города и области, рандомизированных на две группы: основную (n = 44) и контрольную (n = 53). Пациенты обеих групп получали традиционную интенсивную терапию. Помимо традиционной интенсивной терапии пациенты основной группы получали iNO в концентрации 10 ppm в течение 48 ч; с последующим поэтапным снижением дозы до 5 ppm за 5 ч с шагом в 1 ррm; в дозе 1 ppm iNO подавали в течение 1 ч с последующей отменой при динамическом контроле витальных функций и содержания метгемоглобина в крови.
Основными конечными точками исследования считали частоту развития бактериальных осложнений и неблагоприятного исхода заболевания; продолжительность искусственной вентиляции легких и госпитализации в реанимации.
Результаты исследования эффективности ингаляционного оксида азота в профилактике бактериальных осложнений у новорожденных
Согласно результатам исследования, развитие сепсиса зафиксировано у 4 пациентов в основной группе и у 13 детей – в контрольной группе (р1 = 0,04; р2 = 0,005). В основной группе умерло 6 пациентов (исходы не были связаны с проведением ингаляций), в контрольной умерло 10 новорожденных (р1 = 0,37; р2 = 0,59). Медиана длительности искусственной вентиляции легких достоверно различалась между группами: в основной группе — 5 сут, в контрольной — 10 сут (р = 0,00007). При сравнении длительности пребывания в отделении реанимации и интенсивной терапии в основной группе составила 11 сут, в контрольной — 15 суток (р = 0,026).
Медицинские интернет-конференции
Языки
Биологические эффекты оксида азота в развитии кардиоваскулярной патологии как основа применения терагерцовой терапии
Паршина С.С., Афанасьева Т.Н., Тупикин В.Д.*
Резюме
Ключевые слова
Обзор
В 2001 г. группой саратовских авторов впервые было предложено использовать электромагнитные колебания миллиметрового диапазона с частотами, соответствующими вращательным молекулярным спектрам важнейших клеточных метаболитов (NO, CO, O2, CO2, OH и др.) [1]. Поскольку молекулярные спектры излучения и поглощения клеточных метаболитов находятся в коротковолновой части субмиллиметрового (терагерцового) диапазона [2], который располагается на шкале электромагнитных волн между КВЧ и оптическим инфракрасным диапазонами [3], новое направление получило название «терагерцовой терапии» (ТГЧ-терапии) [4].
Известно, что именно молекулы-метаболиты являются фундаментальной основой функционирования сложных биологических систем, поэтому чрезвычайно большой интерес представляет возможность управления их реакционной способностью, что может быть использовано для регуляции процессов метаболизма.
Для реализации новых научных задач в ОАО ЦНИИИА (г.Саратов) был создан панорамно-спектрометрический измерительный комплекс с квазиоптическим рефлектометром, работающем в частотном диапазоне 118-600 ГГц [1], так как именно указанный диапазон включает спектры резонансного поглощения и излучения молекул вышеупомянутых клеточных метаболитов [2], в том числе и молекулярный спектр излучения и поглощения оксида азота (150,176…150,644 ГГц).
Молекулярный спектр излучения и поглощения оксида азота (NO) привлек внимание исследователей в первую очередь, поскольку уже более 20 лет проблема оксида азота является одной из ключевых в современной биологии и медицине.
В 1987 г. была открыта реакция образования NO внутри клеток макроорганизма [5], после чего стали интенсивно изучаться способы ускорения и замедления этой реакции, взаимодействие NO с нервной, эндокринной и иммунной системами организма, цитотоксичность NO в отношении макроорганизма и микробов. Открытие внутриклеточного синтеза NO привело к открытию ранее неизвестной регуляторной системы организма человека и млекопитающих животных – системы окиси азота [5]. В биологии возникло новое направление – биология NO [6], дающее новые фундаментальные сведения, которые могут быть использованы в медицине. Ряд авторов считают, что анализ циклических превращений NO будет не менее плодотворным для медиков и биологов ХХI века, чем изучение цикла трикарбоновых кислот в середине ХХ века [7].
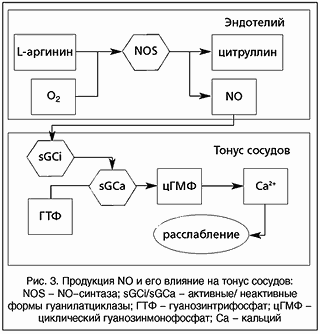
Внутри клетки NO активирует одни энзимы и ингибирует другие. Основными физиологическими мишенями для NO считают растворимую гуанилатциклазу и ADP-риббозилтрансферазу [7, 14]. Активация растворимой гуанилатциклазы вызывает повышение cGMP, что в свою очередь, приводит к снижению внутриклеточного содержания Ca 2+ [7]. По мнению многих авторов, способность регулировать внутриклеточную концентрацию ионов Ca 2+ является одним из важнейших свойств NO [15].
Эндогенный оксид азота существует и непрерывно синтезируется в органах, тканях и клетках ферментативным путем при участии NO-синтаз (NOS) – ферментов, использующих в качестве единственного субстрата аминокислоту L-аргинин [6].
Изучены 3 изоформы NOS: эндотелиальная, нейрональная и макрофагальная [1,16]. Эндотелиальная NOS обнаруживается в клетках эндотелия сосудов, тромбоцитах, миокарде и эндокарде. Эндотелиальный механизм образования NO из L-аргинина активируется при нарушениях кровотока и при воздействии ацетилхолина, брадикинина, гистамина и фактора агрегации тромбоцитов [1, 8, 16]. Нейрональную NOS обнаруживают в нейроцитах ЦНС и периферических сплетений вегетативной нервной системы (ВНС). В ЦНС и ВНС имеются нитрергические (нитринергические) синапсы [1, 8]. Их медиатором является NO. По эфферентным нитрергическим нервам NO распространяется в органы дыхательной системы, желудочно-кишечного тракта, мочеполовой системы, в матку [5, 16].
Помимо конститутивной NOS выделяют также «индуцибельную» или «кальций-независимую» NOS. Ее обнаруживают в макрофагах (поэтому она носит ещё название «макрофагальной»), гепатоцитах, фибробластах, гладкомышечных клетках сосудов, желудочно-кишечного тракта и мочеполовой системы, мышечных клетках сердца и матки [5, 16-18]. Индуцибельная NOS появляется в клетках только после индукции их бактериальными токсинами и некоторыми медиаторами воспаления, например, провоспалительными цитокинами [5, 16, 17]. В клетках, находящихся в покое, она не определяется. Индуцибельная NOS синтезирует NO в непрерывном режиме, причем независимо от содержания кальция в NO-синтезирующих клетках и в количествах, в сотни тысяч раз превышающих концентрации NO, вырабатываемые конститутивной NOS [16]. Продуцируемый индуцибельной NOS NO прежде всего предназначен для защиты организма хозяина, способствует снижению активности пограничных воспалительных клеток, гибели микроорганизмов и внутриклеточных паразитов, тормозя агрегацию тромбоцитов и улучшая местное кровообращение [12].
Система гипоталамус – гипофиз – кора надпочечников может предотвратить активацию еще не активированной индуцибельной NOS, но не может остановить секрецию NO, начавшуюся под влиянием уже активированной индуцибельной NOS [5]. Косвенно подсчитано, что скорость синтеза NO в макроорганизме может изменяться в миллионы раз [5].
В условиях гипоксии стабильность NO повышается, что усиливает его биологическое действие [7].
Выработка NO может замедляться или прекращаться под влиянием этанола, глюкокортикостероидов, индометацина [7, 19].
Инактивация NO осуществляется гемоглобином крови с образованием нитрозогемоглобина, который распадается до метгемоглобина [5]. Избыток NO может связываться при взаимодействии его с супероксидными радикалами, тиолами и металлами (особенно с Fe 2+ ) [20].
У оксида азота описаны и нежелательные эффекты. Согласно современным представлениям, они обусловлены образованием сильнейшего окислительного агента – пероксинитрита, возникающего в реакции NO с анионом супероксида. Пероксинитрит выступает в качестве интегрального звена, объединяющего две системы активных низкомолекулярных агентов, возникающих в клетках и тканях – NO и активных форм кислорода [16].
Высокие концентрации NO оказывают цитотоксическое или цитостатическое действие на любую клетку, не дифференцируя, является ли она нормальной клеткой хозяина, опухолевой клеткой или макрофагом [5, 7]. Период полураспада молекулы NO исчисляется секундами, поэтому ее действие распространяется только на близлежащие клетки [5]. Установлено, что хронический избыток NO в организме приводит к аутоиммунным заболеваниям [5].
Коссвенно подсчитано, что скорость синтеза NO в макрооргнизме может изменяться в миллионы раз. Резкая гиперпродукция NO – частый спутник тяжелого течения острых терапевтических, хирургических и инфекционных заболеваний [5]. В то же время сам NO, избыточно накапливаясь в клетке, может вызвать повреждение ДНК и давать провоспалительный эффект при эндотоксемии, септическом шоке, воспалительных заболеваниях легких [12].
Следует особо подчеркнуть, что в настоящее время все шире стали говорить о полифункциональности действия NO, которое порой носит противоположный характер. Так, стало известно, что NO может как усиливать процессы ПОЛ в мембранах клеток, так и ингибировать их, вызывать как расширение сосудов, так и вазоконстрикцию, индуцировать апоптозную гибель клеток и оказывать защитный эффект в отношении апоптоза, индуцированного другими агентами [7, 21]. Для NO характерна как антиканцерогенная активность, так и мутагенное действие [19].
Существует мнение, что различные эффекты NO определяются разнообразными сигнальными путями NO (которые зависят от относительной скорости формирования NO, окислительно-восстановительных реакций, а также комбинаций кислорода, супероксидного радикала и других биологических молекул) и чувствительностью клеточных систем к тому или иному сигнальному пути [21]. Итоговый эффект NO в сосудах может зависеть от места его генерации, локальной концентрации и взаимодействия с другими компонентами ткани [20].
Особый интерес биологические эффекты NO вызывают у кардиологов, поскольку NO является нейромедиатором, мощным фактором гемостаза, антиагрегантом, эндогенным вазодилататором [14, 16, 22-27], обладает стресс-лимитирующим эффектом [28], принимает непосредственное участие в механизмах модуляции иммунного ответа [18], является универсальным регулятором центральной и периферической нервных систем [7, 13]. Описаны нитринергические синапсы в ЦНС и вегетативной нервной системе, нитринергические нервы в сердце, желудочно-кишечном тракте, дыхательных путях и мочеполовой системе [5, 12], что позволяет предположить существование третьего (наряду с холин- и норадренэргическим) типа нервной системы [12].
Однако основной механизм сосудорасширяющего действия NO непосредственно связан с функционированием гуанилатциклазы, причем только растворимой ее формы, и опосредуется через активацию растворимой гуанилатциклазы с накоплением циклического 3’, 5’-гуанозинмонофосфата (сGMP), что в дальнейшем приводит к выходу Ca 2+ из мышечных клеток и в конечном итоге – к вазодилатации [17]. Доказано, что NO участвует в расслаблении гладких мышц сосудов [7, 29, 30-34].
Более того, установлено, что многие физиологические вазодилататоры оказывают свое сосудорасширяющее действие именно через активацию синтеза NO. Лечебный эффект наиболее известных нитровазодилататоров – нитроглицерина, нитросорбида, нитропруссида натрия и др. – также связан с взаимодействием NO, образующегося в результате их биотрансформации, с гемом гуанилатциклазы, активацией фермента и накоплением сGMP.
Цитопротекторное действие NO обусловлено его способностью предотвращать не только агрегацию, но и адгезию тромбоцитов [16, 19].
Известно, что оксид азота способствует нормализации функционального состояния клеточной стенки, а также коагуляционного потенциала крови и микроциркуляции [17, 34, 37].
Кроме того, под влиянием оксида азота происходит снижение агрегационной способности эритроцитов как в условиях in vitro, так и in vivo [38], изменение геометрии сосудов вследствие их дилатации [23, 27, 39], то есть эндогенный оксид азота во многом определяет реологические свойства крови, которые, в первую очередь, зависят от качественного и количественного состава эритроцитов.
Большое значение имеет обнаруженное антистрессорное действие NO, которое связывают с активацией им стресс-лимитирующих механизмов [28]. Известно, что при этом в крови уменьшается содержание фибриногена, влияющего как на агрегацию тромбоцитов, так и на реологические свойства крови 41.
При длительном стрессорном воздействии происходят снижение продукции эндогенного оксида азота и уменьшение его регуляторных функций [28].
Установлено, что оксид азота принимает участие в регуляции ПОЛ: в физиологических концентрациях NO выступает как антиоксидант, который тормозит развитие радикальных окислительных реакций, связываясь со свободными и входящими в состав гема ионами Fe 2+ и ингибируя разложение перекисей [7].
Таким образом, регуляторная система оксида азота оказывает влияние на основные патогенетические механизмы развития сердечно-сосудистой патологии: тромбоцитарный гемостаз, гемокоагуляцию, реологические свойства крови, функциональное состояние эндотелиального и гладкомышечного компонентов сосудистой стенки, стресс-лимитирующие факторы, перекисное окисление липидов.
Заболевания сердечно-сосудистой системы могут развиваться как вследствие снижения, так и в результате неконтролируемого повышения концентрации NO в организме.
Понижение секреции NO приводит к развитию артериальной гипертензии и патологии коронарных сосудов. Так, результаты экспериментов на подопытных животных выявили существование причинной связи между понижением секреции NO и возникновением артериальной гипертензии [43, 44].
Механизм этого действия объясняется, во-первых, тем, что NO является (наряду с простациклином и др.), активатором гуанилатциклазы [17] и вызывает расслабление гладкой мускулатуры сосудов. Во-вторых, NO оказывает на артериальное давление и центральное депрессивное действие, вероятно, за счет влияния на паравентрикулярные ядра гипоталамуса и ядро одиночного пути [17, 45]. Установлено, что повышенная концентрация эндогенных блокаторов NOS является одной из причин почечной гипертензии [46].
Исследования с донаторами и ингибиторами NO показали, что их внутрикоронарное введение оказывает непосредственное влияние на тонус венечных артерий у больных с атеросклерозом либо с гиперхолестеринемией. Так, у больных с атеросклерозом венечных артерий внутрикоронарное вливание ингибитора NO ацетилхолина приводит к парадоксальной реакции – уменьшению диаметра субэндокардиальных артерий, тогда как у здоровых подобная процедура вызывает их увеличение [47]. Опыты с донатором NO L-аргинином показали, что при его внутрикоронарном введении у больных с гиперхолестеринемией значительно увеличивался венечный кровоток, что подтверждает роль NO в регуляции тонуса коронарного русла [48]. При этом отмечено, что дисфункция сосудистого эндотелия проявляется, по-видимому, задолго до развития клинически значимого атеросклероза [48].
Известно также обязательное участие оксида азота, выделяющегося в синоатриальном узле, в автономном контроле сердцебиения [7]. NO может также принимать участие в процессах ремоделирования сосудов [20].
Доказана роль NO в регуляции сосудистого тонуса легких в условиях гипоксии: острая блокада синтеза NO приводила к усилению гипоксической вазоконстрикции [12]. Недостаточное образование и выделение NO является преимущественным механизмом развития гипертонии малого круга и потери легочными сосудами способности отвечать вазодилятацией на эндотелийзависимые субстанции при хронической гипоксии [12]. Во многих случаях ингаляции NO устраняют легочную вазоконстрикцию, связанную с гипоксией, первичной легочной гипертензией, сердечными пороками, респираторным дистресс-синдромом взрослых [12].
Увеличение концентрации NO является одним из патогенетических звеньев различного вида шоков [5]. Доказано, что прогрессивное снижение артериального давления в случаях затяжного инфекционно-токсического шока, обусловлено повышенной секрецией окиси азота в результате экспрессии индуцибельной NOS под влиянием воспалительных стимулов [20, 49]. При этом отмечается рефрактерность даже к большим дозам вазоконстрикторов, однако доказано, что сразу же после внутривенного назначения ингибиторов NO артериальное давление у таких больных повышается [49]. Аналогичная ситуация отмечается и при геморрагическом шоке [50].
Концентрация NO в крови увеличивается не только при шоке, но и при многих других болезнях [11, 51]. Для большинства из них характерна склонность к гипотонии и понижению резерва сократительной функции сердца.
Отрицательное инотропное действие провоспалительных цитокинов на изолированную папиллярную мышцу опосредуется NO, который является эффективной молекулой цитокинов [52]. Развитие недостаточности кровообращения при системных воспалительных реакциях также связано с гиперпродукцией NO в сосудах под действием воспалительных стимулов [20].
В кардиомиоцитах больных дилятационной кардиомиопатией была обнаружена индуцибельная NOS, которая в здоровых кардиомиоцитах не встречается [53]. В экспериментальных исследованиях выявлено отрицательное хронотропное действие NO на миокард [54]. Повышенное содержание NO в крови является, по-видимому, одной из причин нарушения сократительной функции сердца при дилатациоонной кардиомиопатии, миокардите и инфаркте миокарда [55, 56].
Известно, что местные сосудистые реакции, вызванные атеросклерозом и разрушением эндотелия, также приводят к гиперпродукции оксида азота в результате экспрессии индуцибельной NOS [20].
Представленные данные свидетельствуют, что как дефицит, так и избыток оксида азота способствуют возникновению самой разнообразной патологии сердечно-сосудистой системы.
Понижение секреции NO приводит к развитию артериальной гипертензии, патологии коронарных сосудов, прогрессированию предтромботических и тромботических состояний, нарушению микроциркуляции, усилению гипоксической вазоконстрикции легочных сосудов. Оксид азота играет ключевую защитную роль в ишемическом поражении миокарда, принимает участие в патогенезе ишемического инфаркта мозга, процессах ремоделирования сосудов, активации стресс-лимитирующих факторов, в механизмах модуляции иммунного ответа.
Чрезмерное повышение концентрации NO в крови приводит к гипотонии и понижению резерва сократительной функции сердца, является одним из патогенетических звеньев различного вида шоков.
Таким образом, для кардиологов вопросы поддержания физиологического уровня концентрации и функционального состояния эндогенного NO в организме человека представляются чрезвычайно актуальными как в научном, так и в практическом отношении.
Особое значение имеет тот факт, что эффективность работы цикла оксида азота резко повышается при функциональных нагрузках, связанных с усиленной утилизацией кислорода, при ишемиях мозга и миокарда, при многочисленных патологических процессах, протекающих в условиях гипоксии. Лишь в тех случаях, когда использование кислорода будет полностью компенсироваться его поступлением, роль цикла окиси азота может оставаться такой же, какую он выполняет в обычных физиологических условиях [57]. Следовательно, роль цикла окиси азота резко возрастает при таких заболеваниях, как ишемическая болезнь сердца и мозга, артериальная гипертензия, врожденные и приобретенные пороки сердца, миокардиодистрофии.
В настоящее время ведутся интенсивные поиски методов по созданию фармакологических активаторов гуанилатциклазы на основе химических структур (доноров), обеспечивающих возможность образования в организме эндогенного оксида азота, регуляцию его концентрации и реакционной способности [6, 14].
К сожалению, пока препараты на основе описанных соединений не внедрены в клиническую практику. Кроме того, фармакологическая коррекция содержания NO может сопровождаться возникновением нежелательных побочных эффектов, поскольку в настоящее время в клинике отсутствуют доступные методы определения концентрации оксида азота в кровотоке.
В связи с вышеизложенным представляет интерес использование в качестве потенциального регулятора цикла оксида азота электромагнитного излучения миллиметрового диапазона (ЭМИ ММД) или излучение в диапазоне крайне высоких частот (КВЧ-излучение), которое включает электромагнитные колебания частотой от 3 ´ 10 10 до 3 ´ 10 11 Гц, что соответствует длинам волн от 1 до 10 мм [59]. Одним из основных свойств ЭМИ ММД является зависимость результатов воздействия ЭМИ ММД от фазы биологического развития и от исходного состояния объекта: на нормальное функционирование здорового организма ЭМИ ММД практически не влияет [59, 60, 61], а при возникновении патологии может отрегулировать его функционирование в пределах, присущих данному биологическому виду [62].
По мнению ряда современных авторов, при облучении ЭМИ терагерцового диапазона на частотах молекулярного спектра оксида азота (ЭМИ ТГЧ-NO) может не только возрастать синтез эндогенного оксида азота и повышаться его реакционная способность, но и увеличиваться продолжительность существования оксида азота в клетках [63].
В настоящее время выявлено положительное влияние ЭМИ ТГЧ-NO на функциональные свойства тромбоцитов и реологические параметры при облучении крови больных стенокардией в условиях in vitro [64, 65], а также восстановление исходно нарушенных реологических показателей и функциональной активности тромбоцитов при облучении ЭМИ ТГЧ-NO белых крыс, находящихся в состоянии иммобилизационного стресса [66].
С 2004 г., после изучения воздействия ЭМИ на частотах молекулярного спектра оксида азота у здоровых добровольцев, на кафедре терапии ФПК и ППС Саратовского медицинского университета впервые были начаты исследования по изучению влияния ТГЧ-терапии-NO у больных кардиологического профиля [67]. Первые результаты подтвердили предполагаемые вазоактивный, антиангинальный и гипокоагуляционный эффекты ТГЧ-излучения-NO [67], что позволяет рассматривать ЭМИ ТГЧ-NO в качестве нового перспективного направления в терапии кардиоваскулярной патологии, требующего серьезного изучения.
В дальнейшем было установлено, что ТГЧ-терапия-NO способствует усилению антиангинального и гипотензивного действия медикаментозного лечения у больных как стабильной, так и нестабильной стенокардией, улучшает отдаленные результаты лечения данных категорий пациентов, благоприятно влияет на реологические свойства крови, что чрезвычайно важно для оптимизации процессов микроциркуляции, а также оказывает выраженный положительный эффект на течение хронического ДВС-синдрома у пациентов со стабильной стенокардией высоких функциональных классов [68, 69].
В то же время, при изучении влияния ЭМИ ТГЧ-NO у больных стенокардией среднего и пожилого возраста получены результаты, которые свидетельствуют об относительно независимой динамике показателей гемокоагуляционного потенциала и антиангинального эффекта ТГЧ-терапия-NO [70]. Купирование приступов стенокардии происходило в равной степени у пациентов среднего и пожилого возраста, в то время как изменение параметров тромбогенного потенциала крови существенно различалось.
У больных среднего возраста улучшение гемокоагуляционных показателей происходило за счет увеличения активности естественного антикоагулянта антитромбина-III вплоть до его полной нормализации, при этом воздействия на прокоагулянтный потенциал не отмечено. В группе пациентов пожилого возраста, напротив, влияние ТГЧ-терапии-NO реализовывалось через положительную динамику уровня естественных прокоагулянтов, причем воздействие осуществлялось как на начальные, так и на конечные этапы свертывания крови, что проявлялось в снижении уровня фибриногена в сочетании с удлинением АВР. При этом отсутствовала динамика активности антитромбина-III [70]
В последних работах установлено, что эффективность ТГЧ-терапии-NO зависит от тяжести исходного состояния больных стенокардией III-IV ф.к. [71]
У пациентов с исходно менее частыми приступами стенокардии (1-3 в сутки) почти в 90% (89,5%) удается добиться полного исчезновения приступов стенокардии к моменту выписки из стационара. При этом максимальное антиангинальное действие ЭМИ ТГЧ-NO выявлено к окончанию курса лечения – к 7-му сеансу.
У больных стенокардией III-IV ф.к.с более частыми приступами (более 3-х в сутки) полного купирования приступов стенокардии удалось добиться только в 51,4% случаев, что существенно ниже, чем у пациентов с более легким течением стенокардии, но максимальный антиангинальный эффект был достигнут раньше, к 6-му сеансу [71]
Таким образом, у более тяжелых пациентов, вероятно, целесообразно ограничиваться укороченным курсом ТГЧ-терапии-NO. Полученные сведения соответствуют одному из основных положений о взаимодействии волн миллиметрового диапазона с живыми объектами: при более тяжелом исходном состоянии для нормализации гомеостаза требуется менее активное воздействие 61.
Чрезвычайно интересным представляется тот факт, что влияние ЭМИ ТГЧ-NO на показатели гемокоагуляции и реологии крови принципиально отличается в двух обследованных группах: при менее частых приступах стенокардии выявлено только снижение прокоагулянтного потенциала, тогда как в группе с более частыми болевыми приступами увеличивается и восстанавливается активность антикоагулянтного звена, а также повышается деформируемость эритроцитов [71]. Объяснить механизм подобных различий с учетом имеющихся сведений пока не представляется возможным.
Вместе с тем данные результаты могут быть связаны с активацией различных компонентов цикла оксида азота в отдельных группах больных стенокардией, поскольку известно, что многочисленные, зачастую противоположные эффекты оксида азота связаны с разнообразными сигнальными путями NO (которые зависят от относительной скорости формирования NO, окислительно-восстановительных реакций, а также комбинаций кислорода, супероксидного радикала и других биологических молекул) и чувствительностью клеточных систем к тому или иному сигнальному пути [12]. Итоговый эффект NO может зависеть от места его генерации, локальной концентрации и взаимодействия с другими компонентами тканей [11].
Полученные результаты свидетельствуют, что ЭМИ ТГЧ-NO является перспективным методом, оказывающим влияние на патогенетические механизмы развития сердечно-сосудистой патологии (тромбогенный потенциал, гемореологические показатели), повышающим антиангинальное и антигипертензивное воздействие медикаментозжных препаратов.
Вместе с тем выявленные различия эффектов ТГЧ-терапии-NO в отдельных группах больных стенокардией требуют дальнейших исследований для разработки индивидуального подхода при использовании волн терагерцового диапазона в клинической практике.
Литература
1. Майбородин А.В., Креницкий А.П., Тупикин В.Д., Киричук В.Ф., Авдеенко В.С.
3. Мериакри В.В. Состояние и перспективы развития линий передачи субмиллиметрового диапазона волн и устройств на их основе // Успехи современной радиоэлектроники, 2002, № 12.
5. Виноградов Н.А. Антимикробные свойства окиси азота и регуляция ее биосинтеза в макроорганизме// Антибиотики и химиотерапия –1998 – №43; 2 – C.24-29.
6. Ванин А.Ф. Оксид азота и его обнаружение в биосистемах методом электронного парамагнитного резонанса // Успехи физических наук. – 2000.- Том 170. – N 4. – С. 455-458.
8. Ванин А.Ф. Нобелевская премия 1998 г. по физиологии и медицине // Природа. – 1999. – N 1. – С. 1-7. или http://badis.narod.ru/home/histor/his_nobel.html
12. Невзорова В.А., Зуга М.В., Гельцер Б.И. Роль окиси азота в регуляции легочных функций // Терапевтический архив – 1997. – N 3. – С. 68-73.
13. Башкатова В.Г., Раевский К.С. Оксид азота в механизмах повреждения мозга, обусловленных нейротоксическим действием глутамата // Биохимия. – 1998. – Т. 63. – Вып. 7. – С. 1020-1028.
16. Ванин А.Ф. Оксид азота в биологии: история, состояние и перспективы исследований // Биохимия. – 1998. – Т. 63. – Вып. 7. – С. 867-869.
17. Журавлева И.А., Мелентьев И.А., Виноградов Н.А. Роль окиси азота в кардиологии и гастроэнтерологии // Клиническая медицина – 1997. – N 4. – С. 18-21.
18. Хаценко О. Взаимодействие оксида азота и цитохрома Р-450 в печени // Биохимия. – 1998. – Т. 63. – Вып. 7. – С. 984-991.
19. Тэйлор Б.С., Аларсон Л.Х., Биллиар Т.Р. Индуцибельная синтаза оксида азота в печени: регуляция и функции // Биохимия. – 1998. – Т. 63. – Вып. 7. – С. 905-923.
21. Брюне Б., Сандау К., фон Кнетен А. Апоптотическая гибель клеток и оксид азота: механизмы активации и антагонистические сигнальные пути // Биохимия. – 1998. – Т. 63. – Вып. 7. – С. 966-975.
22. Matsuoka I., Suzuki T. Mepacrine-induced elevation of cyclic GMP levels and acceleration of reversal of ADP-induced aggregation in washed rabbit platelets // J. Cyclyc Nucleotide Protein Phosphor. Res. – 1983 – N 9. – P. 5341-5353.
23. Ignarro L.G., Buga G.M., Wood K.S. et al. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide // Proc. Nat. Acad. Shi. USA. – 1987. – N 84. – P. 9265-9269.
24. Palmer R.M., Ferrige A.G., Moncada S. Nitric oxide release account for the biological activity of endothelium-derived relaxing factor // Nature. – 1987. – N 327. – P. 524-526.
25. Palmer R.M., Ashton D.S., Moncada S. Vascular endothelial cells synthesize nitric oxide from L-arginine // Nature. – 1988. – N 333. – P. 6174-6646.
26. Knowles R.G., Palacios M., Palmer R.M. et al. Formation of nitric oxide from L-arginine in the central nerves system: a transduction mechanism for stimulation of the soluble quanylate cyclase // Proc. Nat. Acad. Shi. USA. – 1989. – N 86. – P. 5159-5162.
27. Furchgott R.F., Jothianandan D. Endothelium-dependent and independent vasodilation involving cyclic GMP: relaxation induced by nitric oxide, carbon monoxide and light // Blood Vessels. – 1991. – N 28. – P. 52-61.
29. Северина И.С. Гуанилатциклаза – функция в норме и при патологии // Вестн. АМН СССР. – 1987. – N7. – С.41.
33. Крыжановский Г.Н. Патология регуляторных механизмов // Патол. физиология и эксперим. терапия. – 1990. – N 2. – С.3.
36. Чирков Ю.Ю., Тыщук И.А., Северина И.С., Старосельцева Л.К. Гуанилатциклаза тромбоцитов человека при сахарном диабете // Бюл. эксперим. биологии и медицины. – 1989. – Т. 107. – N 3. – С. 300.
37. Лобанок Л.М., Лукша Л.С.Функциональная роль эндотелия сосудов: патофизиологические и клинические аспекты // Медицинские новости. – 1999. – N 4. – С. 21-29.
38. Starzik P. Effect of nitric oxide and prostacycline on deformability and aggregability of red blood celles of rats in vivo and in vitro // J. Phisiol. Pharmacol. – 1999. – N 50. – P. 629-637.
39. Ignarro L.G. Вiosynthesis and metabolism of endothelium-derived nitric oxide // Annu. Rev. Pharmacol. Toxicol. – 1990. – no.30. – P. 535-560.
44. Baylis C., Mitruka B., Deng A. Chronic blocade of nitric oxide synthesis in the rat produces systemic hypertension and glomerular damag// J. clin. Invest. – 1992. – Vol. 90. – P. 278-281.
46. Vallance P., Leone A., Calver A. et al. Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure// Lancet. – 1992. – Vol. 339. – P. 572-575.
51. Nakaki T. Physiological and clinical significance of NO (nitric oxide) – a review// Keio J. Med. – 1994. – Vol.43. – P.15-26.
57. Реутов В.П., Каюшин Л.П., Сорокина Е.Г. Физиологическая роль цикла окиси азота в организме человека и животных // Физиология человека. – 1994. – Том 20. – N 3. – С. 165-174.
58. Клещев А.Л., Мордвинцев П.И., Ванин А.Ф., Седов К.Р. Создание физиологически активного депо окиси азота в организме животных // Бюллетень Сиб. отд. АМН СССР. – 1989. – N 2. – С. 41-44.
59. Бецкий О.В., Голант М.Б., Девятков Н.Д. Миллиметровые волны в биологии. – М.: Знание, 1988. – 64 с.
60. Голант М.Б. О проблеме резонансного действия когерентных электромагнитных излучений миллиметрового диапазона на живые организмы // Биофизика. – 1989. – Вып. 2. – С. 339-348.
61. Голант М.Б. Резонансное действие когерентных электромагнитных излучений миллиметрового диапазона волн на живые организмы // Биофизика. – 1989. – Вып. 6. – С. 1004-1014.
62. Голант М.Б. Биологические и физические факторы, обусловливающие влияние монохроматических электромагнитных излучений миллиметрового диапазона малой мощности на жизнедеятельность // Применение миллиметрового излучения низкой интенсивности в биологии и медицине. – М., 1985. – С. 21-36.
64. Киричук В.Ф., Волин М.В., Креницкий А.П., Майбородин А.В., Тупикин В.Д.
69. Водолагин А.В. Особенности течения ДВС-синдрома у больных стенокардией напряжения высоких функциональных классов и пути оптимизации его лечения // Автореф. дисс. канд. мед. наук – Саратов, 2008. – 30 с.