Ингибирование секреции соляной кислоты что это
Ингибирование секреции соляной кислоты что это
Несмотря на частое назначение ингибиторов протонной помпы при заболеваниях ЖКТ, многие пациенты не знают, что такое ИПП в гастроэнтерологии: что это за препараты, для чего он нужен и как действует на организм. Данная статья поможет ознакомиться со следующими вопросами:
Полный текст статьи:
Что это?
ИПП — это антисекреторные средство, активно назначаемое при кислотозависимых болезнях желудка, двенадцатиперстной кишки и пищевода. Все представители этой категории лекарств являются производными бензимидазола и обладают достаточно похожей химической структурой, а также единый принцип действия. Отличает их структура радикалов на пиридиновом и бензимидазольном кольце. В гастроэнтерологии они активно применяются для борьбы с кислотозависимыми заболеваниями. Лекарственные средства этой группы хорошо переносятся, практически не имеют побочных эффектов. Самый распространенный и известный — это Омепразол.
Механизм действия
После прохождения лекарства через желудок, препарат проникают в тонкую кишку, где разрушается, всасывается в системный кровоток, а затем направляется в печень. После этого, минуя мембрану, оно отправляется в париетальные клетки слизистой оболочки желудка, где накапливается в секреторных канальцах. В желудке, вследствие высокой кислотности, происходит активация и трансформация препарата в тетрациклический сульфамид, не проникающий через мембранный барьер и, соответственно, не покидающий кислой среды. В новой форме лекарственное средство блокирует конформационный переход протонной помпы, поэтому она выключается из системы образования HCl.
Показания и противопоказания
Рекомендуется назначать при ГЭРБе, язве желудка и двенадцатиперстной кишки, симптоматической язве (синдром Золлингера-Эллисона и т.п.), функциональной диспепсии и инфекции H.pylori. Несмотря на минимальный риск развития побочных реакций, назначение лекарственных препаратов из этой группы противопоказано беременным и кормящим грудью женщинам, детям до 14 лет и лицам с повышенной чувствительностью к отдельным компонентам медикамента.
Вывод:
ИПП — это обязательная составляющая успешной терапии при кислотозависимых заболевания желудочно-кишечного тракта. Без их применения не удается подавить выработку соляной кислоты, что чревато значительным повреждением слизистой оболочки.
Технологии медикаментозного подавления желудочной секреции
Исторически М-холинолитики являются одними из первых препаратов, применявшихся для лечения пациентов с язвенной болезнью. «Прародителями» данной группы лекарственных средств были экстракт белладонны и атропин, на протяжении целых десятилетий служившие базисом противоязвенной терапии. Тем не менее, колоссальное количество серьезных побочных эффектов, непосредственно и закономерно связанных с влиянием препаратов на сердце, бронхи, сосуды, рецепторы головного мозга, заставляло вести поиск новых лекарственных средств. Так появились платифиллин и метацин, обладающие менее выраженными побочными эффектами, но принципиально уступающие атропину по выраженности антисекреторного эффекта. Как и атропин, платифиллин и метацин являются неселективными М-холинолитиками, то есть оказывают блокирующее действие на М1-, М2- и М3-холинорецепторы. Избирательное действие на М1-холинорецепторы оказывает пирензепин, избирательно ингибируя секрецию кислоты и пепсина, находящуюся под контролем блуждающего нерва, подавляя желудочную секрецию, вызванную условно-рефлекторной стимуляцией, растяжением дна желудка и аминокислотами, без влияния на моторно-эвакуаторную функцию желудка. Угнетение секреции соляной кислоты пирензепином является опосредованным. Пирензепин блокирует М1-холинорецепторы, находящиеся на мембране ECL-клеток, и тем самым ингибирует выделение гистамина, стимулирующего секрецию HCl париетальными клетками. Следует иметь в виду, что пирензепин непосредственно на париетальные клетки не действует, поскольку на их мембране находятся только М3-холинорецепторы, и отсутствуют М1-холинорецепторы. По строению пирензепин представляет собой трициклическое соединение бензодиазепина. От типичных трициклических бензодиазепинов с нейротропной активностью препарат отличается высокой гидрофильностью, что обусловливает, с одной стороны, незначительное проникновение через гематоэнцефалический барьер, слабо выраженные межиндивидуальные колебания показателей абсорбции, распределения и элиминации препарата, но с другой стороны – низкую биодоступность. Пирензепин гораздо слабее, чем атропин, подавляет секрецию соляной кислоты, не оказывая при этом влияния на количественную продукцию защитной желудочной слизи. Изучение характера подавления желудочной секреции пирензепином показало снижение секреции натощак как у пациентов с язвенной болезнью желудка, так и у больных с язвенной болезнью ДПК. При этом базальная секреция снижалась у 62,9% больных с язвой желудка и у 64,3% – с язвенной болезнью ДПК; стимулированная – соответственно у 51,8 и 71,4% пациентов. При приеме 2 раза в сутки гастроцепин в равной степени снижает и дневную и ночную секрецию. Следует отметить, что если атропин у пациентов с язвенной болезнью вызывает заметное повышение концентрации гастрина в крови, то пирензепин достоверно ее снижает во время гастральной фазы пищеварения, индуцированной растяжением дна желудка или аминокислотами. Было отмечено, что пирензепин усиливает защитные свойства слизи только в межпищеварительную фазу функционирования желудка: в порции желудочного содержимого, взятой натощак и отражающей межпищеварительные процессы, отмечено увеличение содержания в слизи фукозы и N-ацетилнейраминовой кислоты, в то время как в базальных порциях (механическая стимуляция секреции) увеличение продукции указанных компонентов слизи было менее выраженным, а в стимулированных – продукция слизи не менялась вообще. Важным свойством пирензепина является способность к увеличению объемной скорости кровотока в слизисто-подслизистом слое гастродуоденального комплекса. Пирензепин увеличивает кровоток в зависимости от дозы препарата, что можно объяснить участием мускариновых рецепторов как в вазоконстрикции, так и в вазодилятации. Предполагается, что препарат избирательно тормозит функцию М1-рецепторов, принимающих участие в вазоконстрикции. Информация о влиянии пирензепина на тонус нижнего пищеводного сфинктера и тонус привратника весьма противоречива. Приводятся данные о том, что при внутривенном введении препарата пациентам с кардиоспазмом в дозе 10 мг через 4 мин. наблюдается достоверное уменьшение давления в нижнем пищеводном сфинктере в течение примерно 50 мин. При пероральном назначении препарата такого эффекта не наблюдалось. Однако, по другим данным, гастроцепин снижает давление в нижнем пищеводном сфинктере, замедляет глотательные движения пищевода, эвакуацию из желудка и моторику двенадцатиперстной кишки. Пирензепин снижает объем базальной секреции поджелудочной железы и содержание химотрипсина, не влияя на концентрацию бикарбонатных ионов. Последнее обстоятельство можно считать очень важным для лечения как заболеваний ДПК, так и поджелудочной железы. Необходимо помнить о возможности образования антител к препарату со снижением эффективности при длительном его применении. Таким образом, М1-холинолитики могут использоваться при повышенной желудочной секреции, особенно в случае доказанной ваготонии. Следует отметить, что для препарата, сходного по своей структуре с трициклическими антидепрессантами, совершенно закономерной являются возможность возникновения побочных эффектов в виде сухости во рту, вестибулярных расстройств, нарушения аккомодации, сонливости.
Несмотря на то, что антисекреторная активность М1-холинолитиков во многом уступает активности Н2-блокаторов и ингибиторов протонной помпы, пирензепин, тем не менее, весьма длительное время использовался в практике неотложной хирургии именно благодаря существованию лекарственной формы для парентерального введения. Исторически путь фармацевтического воздействия на мускариновые рецепторы оказался наиболее ранним. Но в настоящее время, как справедливо подчеркивает Н.А. Яицкий (2002), неселективные и селективные М-холиноблокаторы фактически утратили свое первоначальное значение в лечении как гастродуоденальных язв, так и их осложнений. М1-холинолитики оказались вытеснены препаратами, действующими на молекулярном уровне и блокирующими субклеточные процессы – блокаторами Н2-рецепторов и ингибиторами протонной помпы.
Блокаторы Н2-рецепторов гистамина (Н2-блокаторы) до настоящего времени являются одним из самых популярных классов лекарственных препаратов, применяющихся для терапии кислотозависимых заболеваний. В 70-е и 80-е годы ХХ века Н2-блокаторы совершили поистине переворот в гастроэнтерологии, заставив пересмотреть сложившиеся концепции фармацевтического потенциала в лечении язвенной болезни. С внедрением в клиническую практику Н2-блокаторов появилась возможность если не излечения пациента от язвенной болезни, то, по крайней мере, достижения ее стойкой ремиссии. Терапия Н2-блокаторами, именуемая многими «медикаментозной ваготомией», заставила также пересмотреть вопрос о показаниях к оперативному лечению пациентов с язвенной болезнью, с одной стороны, сузив до минимума показания к плановым операциям, а с другой – поставив под сомнение целесообразность выполнения вмешательств, имеющих в своей основе различные варианты ваготомии. Появление в клинической практике блокаторов Н2-гистаминовых рецепторов обязано целому ряду научных открытий. В начале ХХ века физиолог H. Dale выделил из спорыньи неизвестное биологически активное вещество, идентифицированное как бета-имидазолилэтиламин и позже получившее наименование «гистамин». В 1936 году H. Dale за серию экспериментальных исследований, установивших связь между усилением желудочной секреции после внутривенного введения гистамина и образованием язв желудка, был удостоен Нобелевской премии. Значительно позднее, в 1972 году, фармаколог J. Black установил наличие Н2-гистаминовых рецепторов в желудке и выделил вещество, избирательно действующее на Н2-рецепторы и не влияющее на Н1-рецепторы – буримамид. Данное вещество ингибировало желудочную секрецию, стимулированную пентагастрином и гистамином, что позволило определить гистамин как конечное звено в цепи передачи стимулирующих импульсов на париетальную клетку. За идентификацию Н2-рецепторов и разработку лекарственных средств, их блокирующих, J. Black в 1988 году был удостоен Нобелевской премии.
По своему химическому строению Н2-блокаторы можно рассматривать как модифицированные производные гистамина. Различие заключается в наличии у Н2-блокаторов модифицированной боковой цепи имидазольной части молекулы. Действие Н2-блокаторов основано на конкурентном по отношению к гистамину воздействии на Н2-гистаминовые рецепторы париетальных клеток. Ингибирование секреции соляной кислоты Н2-блокаторами является опосредованным и обусловлено инактивацией аденилатциклазы париетальной клетки при блокировании Н2-рецепторов. Инактивация аденилатциклазы, в свою очередь, приводит к уменьшению концентрации цАМФ в париетальной клетке и резкому снижению активности Н+/К+-АТФазы, что в конечном счете и приводит к снижению секреции Н+ в просвет канальцев париетальной клетки. Н2-блокаторы ингибируют как стимулированную, так и базальную желудочную секрецию. В значительно меньшей степени угнетается секреция пепсина.
Несмотря на то, что первые представители Н2-блокаторов были синтезированы уже в 1972 году, их широкое клиническое применение ограничивалось рядом серьезных побочных эффектов. Так, циметидин может вызывать гинекомастию (за счет стимуляции секреции пролактина) и нарушение толерантности к глюкозе (из-за снижения концентрации инсулина в плазме). Циметидин блокирует также периферические рецепторы мужских половых гормонов, что может приводить к снижению либидо и потенции; может оказывать гепатотоксическое действие (снижение кровотока в печени, повышение уровня трансаминаз); взаимодействует с системой цитохрома Р450; способен вызывать повышение уровня креатинина в крови, поражение центральной нервной системы, гематологические изменения, оказывать кардиотоксические эффекты и иммуносупрессивное действие. В данной связи описание циметидина в различных руководствах – не более как дань истории, сам препарат в клинической практике сейчас практически не применяется.
В настоящее время терапия Н2-блокаторами в подавляющем большинстве случаев осуществляется назначением фамотидина. Широкое применение, которое фамотидин в форме для парентерального введения находил в практике неотложной хирургической гастроэнтерологии в 90-е годы ХХ века, связано с относительно благоприятным профилем переносимости этого препарата. Фамотидин не оказывает гепатотоксического действия, не взаимодействует с системой цитохрома Р450, не повышает уровень креатинина в плазме, не проникает через гематоэнцефалический барьер и не вызывает нервно-психических нарушений. Известно, что антисекреторная активность фамотидина в 20-60 раз превышает активность циметидина и в 3-20 раз – активность ранитидина. По сравнению с ранитидином, фамотидин более эффективно повышает рН и снижает объем желудочного содержимого. По данным J.L. Smith (1997), у здоровых добровольцев однократный прием фамотидина в дозе от 5 до 20 мг вызывал снижение базального кислотообразования соответственно на 94% и 97%. Продукция соляной кислоты после стимуляции пентагастрином снижалась соответственно на 41-90%. Длительность действия препаратов этой группы определяется силой связывания с Н2-рецепторами гистамина. У фамотидина эта связь наиболее прочная, поэтому среди блокаторов Н2-гистаминовых рецепторов он обеспечивает самое длительное снижение базальной секреции – примерно в течение 12 часов, что позволяет в клинической практике использовать невысокие дозы препарата и довести кратность приема последнего до 1 раза в сутки на ночь.
К сожалению, существует группа пациентов, резистентных к Н2-блокаторам. Резистентность к Н2-блокаторам наблюдается, по клиническим данным, у 15-25% всех больных язвенной болезнью. По данным лекарственной пробы с ранитидином с проведением внутрижелудочной рН-метрии, это явление наблюдалось у 11,5% больных язвенной болезнью двенадцатиперстной кишки и хроническим гастродуоденитом. Эффективность Н2-блокаторов неодинакова у различных групп пациентов. В частности, серьезным фактором, снижающим эффективность этих препаратов, является курение.
3. Ингибиторы протонной помпы
На сегодняшний день ингибиторы протонной помпы (ИПП) – блокаторы Н+/К+-АТФазы париетальной клетки – занимают центральное место в ряду лекарственных препаратов, подавляющих секрецию соляной кислоты, и являются «золотым стандартом» в терапии кислотозависимых заболеваний. По своей химической структуре ИПП относятся к производным бензимидазола. Сами ИПП, являющиеся слабыми основаниями, при нейтральном значении рН неэффективны. Но в кислой среде канальцев париетальных клеток (только при рН 4 при приеме омепразола или рабепразола составила 14 часов, при приеме ланзопразола – 12 часов, пантопразола – 10 часов. Оценивая клиническую эффективность ИПП при ГЭРБ и при обострении язвенной болезни как по динамике клинических симптомов, так и по эндоскопически верифицированной динамике репаративных процессов, G. Armstrong (2004), H. Lauritsen (2003), R. Miner (2003) расположили препараты по мере уменьшения выраженности антисекреторного эффекта (способности к поддержанию интрагастрального рН > 4) и по снижению клинической эффективности в следующей последовательности: омепразол, рабепразол, ланзопразол, пантопразол.
Поворотным моментом в истории ИПП стало начало производства компанией AstraZeneca лекарственной формы омепразола (Лосек®) для внутривенного введения. Данное обстоятельство сделало возможным применение ИПП в неотложной гастроэнтерологии и хирургии: при острых гастродуоденальных язвенных кровотечениях, после ушивания перфоративных гастродуоденальных язв, при остром панкреатите и, наконец, в случае кровотечений из эрозий и язв пищевода. Внутривенное введение омепразола оказывает дозозависимое угнетение секреции соляной кислоты. Объем распределения независимо от функционального состояния почек составляет 0,3 л/кг, средний показатель полувыведения в терминальной фазе не зависит от длительности терапии и составляет 40 минут. При внутривенном введении биодоступность омепразола равняется 100%, т.е. все молекулы лекарственного вещества достигают париетальных клеток. Медиана времени для достижения рН более 4 при болюсном введении 40 и 80 мг омепразола составляет соответственно 39 и 20 мин. Для достижения стойкого и длительного повышения интрагастрального рН оптимальным методом введения становится постоянная инфузия препарата с первичным введением высокой болюсной дозы. Так как протонные помпы постоянно образуются в париетальных клетках, а период полувыведения ингибиторов протонной помпы из кровотока достаточно короткий (1 – 2 часа), смысл непрерывной инфузии омепразола заключается в первичной инактивации всех активно секретирующих протонных помп болюсным введением с последующей инактивацией вновь образующихся протонных помп постоянным введением. После введения начальной болюсной дозы 80 мг препарат вводится постоянно в дозе 8 мг/ч, что позволяет постоянно поддерживать уровень рН в желудке выше 6,0.
Более чем десятилетний опыт применения парентеральной формы омепразола позволил выявить преимущества препарата, прежде всего – при жизнеугрожающем осложнении гастродуоденальных язв – остром кровотечении. В проспективных рандомизированных исследованиях Hwan-Jeng Lin (1998), P. Netzer (1999) показали, что применение омепразола значительно более эффективно по сравнению с циметидином и фамотидином в отношении повышения рН желудочного сока и уменьшения количества повторных кровотечений из гастродуоденальных язв. Так, уже через 1 час после болюсного введения омепразола значение внутрижелудочного рН было выше 6 и поддерживалось на этом уровне в течение суток. В то же время, после болюсного введения фамотидина значение внутрижелудоного рН достигало показателя 4,5 только через 5 часов и имело тенденцию к снижению на протяжении первых суток наблюдения. Анализ результатов применения препаратов различных фармацевтических групп в плане обеспечения стабильного гемостаза при ОГДЯК, проводимый в течение последних 15 лет большим числом авторов, показывает, что наибольшей эффективностью при гастродуоденальных кровотечениях из хронических, острых и НПВП-индуцированных язв обладает омепразол для внутривенного введения. Наименьшая эффективность при ОГДЯК различной этиологии (за исключением острых язв) отмечена у пирензепина и фамотидина для внутривенного введения. В случае острых язв наибольшей эффективностью обладает сочетанное применение внутривенных форм омепразола с мизопростолом. У пациентов с кровотечением из НПВП-индуцированных язв не было отмечено случаев нестабильного гемостаза на фоне внутривенного применения омепразола в виде монотерапии или в сочетании с мизопростолом. В то же время, при терапии кровоточащих НПВП-индуцированных язв препаратами группы пирензепина и фамотидина состояние нестабильного гемостаза было отмечено примерно у 20% пациентов, что свидетельствует о достоверно меньшей эффективности применения этих препаратов у данной категории больных. Наименьшую эффективность пирензепина следует объяснять его наименьшей антисекреторной активностью по сравнению с препаратами других групп. С другой стороны, различную эффективность внутривенных форм фамотидина и омепразола нельзя объяснить только принципиальным различием антисекреторной активности этих препаратов, поскольку парентеральное введение данных препаратов в адекватных дозировках позволяет поддерживать интрагастральное рН выше 4 в течение 48 – 72 часов у большинства больных, что достаточно для исключения влияния кислотно-пептического фактора на прогрессирование фибриноидного некроза и обеспечения репарации язвы. В повседневной клинической практике применяется следующий режим дозирования омепразола в/в: 1) 80 мг препарата однократно вводится внутривенно болюсно в течение 15-20 минут; 2) после болюсного введения препарат вводится внутривенно через инфузомат со скоростью 4-8 мг/час в течение 96 часов.
Статья добавлена 28 апреля 2016 г.
Ингибиторы протонной помпы — это близкие или дальние родственники? (Лекция)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Ключевые слова: ингибиторы протонной помпы, инструкции по применению, побочные эффекты, эрадикация, Helicobacter pilori.
Для цитирования: Плюснин С.В. Ингибиторы протонной помпы — это близкие или дальние родственники? (Лекция). РМЖ. Медицинское обозрение. 2021;5(6):398-403. DOI: 10.32364/2587-6821-2021-5-6-398-403.
Non-State Educational Private Institution Of Additional Professional Education
“Medical Dental Institute”, Moscow, Russian Federation
Keywords: proton pump inhibitors, patient information leaflet, adverse events, eradication, Helicobacter pylori.
For citation: Plyusnin S.V. Are proton pump inhibitors close or distant relatives? (Lecture). Russian Medical Inquiry. 2021;5(6):398–403 (in Russ.). DOI: 10.32364/2587-6821-2021-5-6-398-403.
Введение
Особенности ИПП
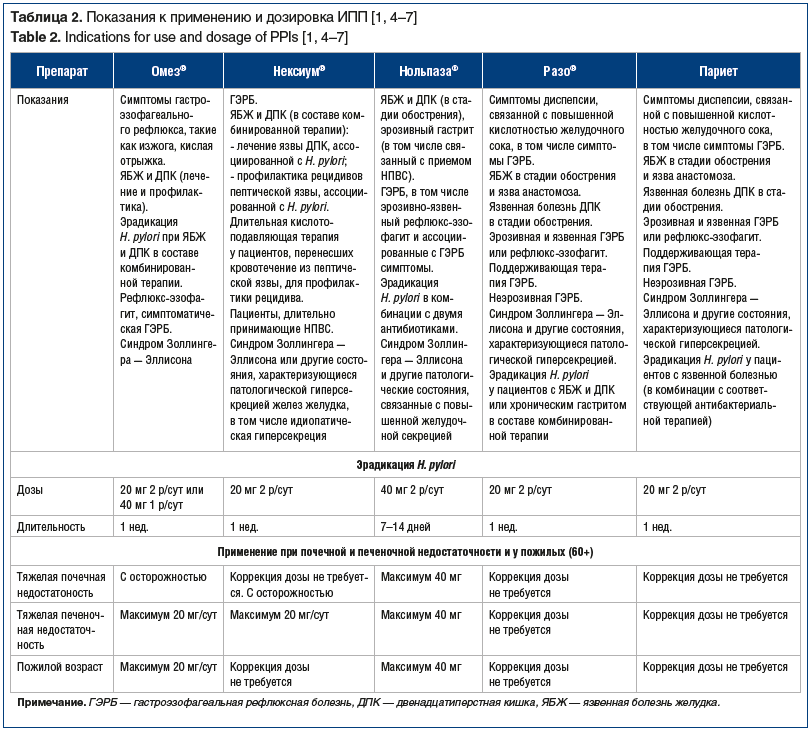
Лидером по количеству зарегистрированных торговых наименований является, конечно, первый ИПП — омепразол. В мире он начал применяться в 1988 г., а в России — в начале 90-х. Именно омепразол благодаря своему появлению на фармацевтическом рынке и доступной цене изменил всю ситуацию с язвенной болезнью желудка и двенадцатиперстной кишки в Росcии. До его появления лучшим средством лечения язвенной болезни считался хороший хирург. Молодым врачам может показаться невероятным, но до появления омепразола в СССР, а затем в России язвенную болезнь желудка и двенадцатиперстной кишки эффективно лечили атропином в каплях. В 2022 г. практическому применению омепразола в России исполнится 30 лет.
Омепразол и эзомепразол иногда в сознании практикующего врача разнесены друг от друга достаточно далеко. На самом деле их можно назвать очень близкими родственниками. Основой омепразола и эзомепразола служит одна молекула. Омепразол — смесь (рацемат) левых и правых оптических изомеров, тогда как эзомепразол является S (левым)-изомером омепразола. S- и R-изомеры омепразола обладают сходной фармакодинамической активностью, часть S-изомера in vivo превращается в R-изомер [1]. При внимательном прочтении инструкции по применению ззомепразола можно встретить множество отсылок именно к омепразолу [1]. Ситуация с лансопразолом и декслансопразолом напоминает описанную выше с омепразолом и эзомепразолом, только здесь преимущество отдано правым изомерам при создании декслансопразола (лат.: dexter — «правый»). Пантопразол, согласно данным
J. Kirchheimer et al. [2], имел самый низкий потенциал кислотосупрессии среди ИПП, а рабепразол — наиболее высокий. Другой отличительной особенностью рабепразола является преимущественно неферментативный метаболизм, минимальная способность вступать в межлекарственные взаимодействия и, как следствие, минимальная возможность развития побочных эффектов [3], а также эзофагопротекторный потенциал.
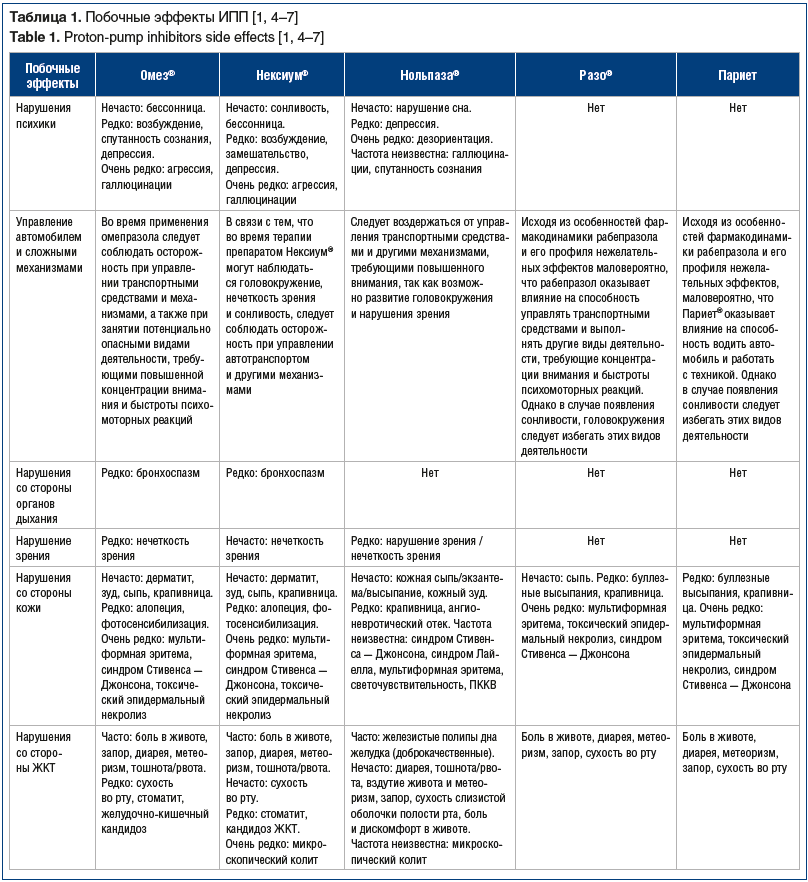
Побочные эффекты ИПП
Для большинства ИПП беременность и лактация являются противопоказаниями для применения (см. табл. 1), однако в ИМП препарата Омез ® указано, что результаты эпидемиологических исследований свидетельствуют об отсутствии клинически значимого негативного влияния омепразола на беременность и состояние здоровья плода или новорожденного. Омепразол проникает в материнское молоко, однако при применении препарата в терапевтических дозах негативного влияния на ребенка не ожидается.
Из ИПП, применяемых при почечной, печеночной недостаточности и у пожилых пациентов наибольшую безопасность продемонстрировал рабепразол (табл. 2). Так, в ИМП препаратов Разо ® и Париет® отмечено, что пациенты с хроническим компенсированным циррозом печени хорошо переносят рабепразол в дозе даже 20 мг 1 р/сут, хотя терапевтическая доза рабепразола составляет 10 мг/сут (самая низкая терапевтическая доза из всех ИПП).
Минимум побочных эффектов при использовании рабепразола обусловлен его фармакокинетическими особенностями. Рабепразол метаболизируется двумя путями: значительная часть принятой дозы рабепразола метаболизируется системно неферментативным путем с образованием тиоэфирных производных, а меньшая часть дозы подвергается метаболизму в печени посредством цитохрома Р450 (cytochrome P450, CYP) с образованием сульфонового и десметилового производных [3]. Например, при приеме эзомепразола рекомендуется контролировать международное нормализованное отношение (МНО) в начале и по окончании совместного применения эзомепразола и варфарина или других производных кумарина. Рабепразол, согласно результатам исследований с участием здоровых добровольцев, не вступает в фармакокинетические и клинически значимые взаимодействия с лекарственными веществами, которые метаболизируются системой CYР (варфарин, фенитоин, теофиллин и диазепам) [1].
Потенциал кислотосупрессии ИПП
Практически ни одна из ИМП не укладывается в привычную для сознания врача схему эрадикационной терапии, либо длительность терапии кажется не такой, о которой обычно говорят на лекциях (для препаратов Нексиум ® и Париет® указанная продолжительность терапии ограничена одной неделей), либо комбинация антибиотиков исключает квадротерапию. Так, Нексиум ® однозначно рекомендуется комбинировать только с кларитромицином и амоксициллином [1]. Рекомендации по сочетанию ИПП с антибиотиками обоснованы тем, что у пациентов, получавших лечение метронидазолом в комбинации с другими антибиотиками, наблюдались случаи развития печеночной недостаточности, потребовавшей проведения трансплантации печени. При назначении метронидазола следует тщательно взвешивать показания для длительного приема данного лекарственного средства и при отсутствии строгих показаний избегать его длительного применения. При приеме тетрациклина, который тоже может входить в схемы эрадикационной терапии, со стороны пищеварительной системы, кроме рвоты, диареи, тошноты, эзофагита и гастрита, возможно развитие изъязвлений желудка и двенадцатиперстной кишки, гепатотоксическое действие, панкреатит, энтероколит.
Юридические аспекты
На сегодня понятно, что взаимодействие H. pylori с организмом человека сложное, в некоторой степени индивидуальное и до конца не изученное. Врач должен знать, что колонизация H. pylori снижает риск заболеваний пищевода (в том числе злокачественных) [12–14], бронхиальной астмы и атопии, а также, возможно, ожирения и сахарного диабета, и учитывать это при назначении лечения [15].
Что же делать практикующему врачу в ситуации разноречивых клинических рекомендаций? Нередко утверждается, что эрадикация H. pylori показана всем, у кого она обнаружена, при этом в качестве основания приводятся различные протоколы, стандарты и клинические рекомендации. Для того чтобы врач не оказался в сложной юридической ситуации, ему очень важно знать основные положения Федерального закона № 323 «Об основах охраны здоровья граждан в Российской Федерации». 18 декабря 2018 г. Президентом РФ подписан закон № 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций». Применение клинических рекомендаций в нашей стране стало регулироваться не просто приказом Минздрава России, а дополненным Федеральным законом № 323, в статье 37 которого предусмотрено, что клинические рекомендации необходимо утвердить установленным порядком до 31 декабря 2021 г. Ранее утвержденные клинические рекомендации (протоколы лечения) применяются до их пересмотра в соответствии с Федеральным законом от 25 декабря 2018 г. № 489 лишь до 31 декабря 2021 г. С 1 января 2022 г. будут действовать только те клинические рекомендации, что размещены на официальном сайте Минздрава России. При этом по каждому заболеванию, состоянию (группе заболеваний, состояний) для взрослых и детей может быть одобрено и утверждено соответственно не более одной клинической рекомендации. Для язвенной болезни клинические рекомендации существуют с 2019 г. В них безальтернативным основанием для эрадикации H. pylori признается язвенная болезнь после хирургического лечения (уровень убедительности рекомендаций А, уровень достоверности доказательств 1) [16].
Клинические рекомендации
Мы уже обсудили выше, какой рекомендацией будут пользоваться все врачи при эрадикации H. pylori. Следующей клинической рекомендацией воспользуются не все, но большинство врачей: всем пациентам с язвенной болезнью с положительными результатами тестирования на инфекцию H. рylori с целью профилактики последующих рецидивов язвенной болезни рекомендуется проведение эрадикационной терапии (уровень убедительности рекомендаций B, уровень достоверности доказательств 2) [16].
Рекомендацией о проведении эрадикационной терапии с целью профилактики язвенной болезни и ее обострений всем лицам с наличием инфекции H. pylori при отсутствии противопоказаний воспользуется, вероятно, меньшинство осведомленных врачей (уровень убедительности рекомендаций С, уровень достоверности доказательств 5) [16], т. е. части пациентов реализация данной рекомендации, как уже написано выше, может принести больше вреда, чем пользы, тем более с учетом новых данных [12]. Но для ряда пациентов, имеющих отягощенную наследственность, данная рекомендация может оказаться целесообразной, хотя в утвержденных Минздравом России рекомендациях по раку желудка в разделе «Профилактика рака желудка» не содержится указаний об эрадикационной терапии всем инфицированным H. pylori пациентам. Заключительным ограничением исследования [14] является отсутствие данных о взаимосвязи между инфекцией H. pylori, заболеваемостью раком желудка и смертностью. При этом снижение влияния курения и диеты с высоким содержанием соли на заболеваемость раком желудка, особенно среди мужчин и жителей Восточной Азии, может быть оптимальным вариантом первичной профилактики [12–14].
Заключение
В настоящей лекции много внимания уделено информации, содержащейся в инструкциях по применению лекарственных препаратов. На самом же деле Федеральным законом № 323 предусмотрено, что стандарт медицинской помощи разрабатывается на основе клинических рекомендаций и включает в себя усредненные показатели частоты предоставления и кратности применения зарегистрированных на территории Российской Федерации лекарственных препаратов в соответствии с инструкцией по применению лекарственного препарата и фармако-терапевтической группой по анатомо-терапевтическо-химической классификации, рекомендованной Всемирной организацией здравоохранения. Если опираться на ИМП лекарственного препарата, то можно убедиться, что наиболее безопасным ИПП, особенно для пожилых пациентов, пациентов с печеночной недостаточностью и при вынужденной полипрагмазии, к которой относится и эрадикационная терапия H. pylori, является в силу неферментативного метаболизма рабепразол.
Сведения об авторе:
Плюснин Сергей Вениаминович — д.м.н., профессор, заслуженный врач Российской Федерации, заведующий кафедрой терапии Ночу Дпо “Медицинский Стоматологический Институт”; 127253, Россия, г. Москва, ул. Псковская, д. 9, к. 1; ORCID iD 0000-0002-4885-8976.
Контактная информация: Плюснин Сергей Вениаминович, e-mail: plsv@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.07.2021.
Поступила после рецензирования 30.07.2021.
Принята в печать 24.08.2021.
Sergey V. Plyusnin — Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, Head of the Department of Therapy, Non-State Educational Private Institution Of Additional Professional Education “Medical Dental Institute”; 9/1, Pskovskaya str., Moscow, 127253, Russian Federation; ORCID iD 0000-0002-4885-8976.
Contact information: Sergey V. Plyusnin, e-mail: plsv@mail.ru.
Financial Disclosure: the author has not a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей