Ингибирование синтеза простагландинов что это
Существуют ли различия между нестероидными противовоспалительными препаратами? В центре внимания нимесулид
Опубликовано в
CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 2 |
Franco Dallegri, Luciano Ottonello
Введение
Эффективность нестероидных противовоспалительных препаратов (НПВП) не подвергается сомнению и является общепризнанной. НПВП обладают противовоспалительной, обезболивающей и жаропонижающей активностью. Входящие в состав НПВП вещества относятся к разным химическим классам, поэтому обладают разными фармакокинетическими и фарма-кодинамическими свойствами. Именно поэтому для облегчения боли и воспаления у пациентов с ревматологическими заболеваниями необходимо учитывать клиническую значимость различий между отдельными представителями класса НПВП.
Фармакологические свойства НПВП
Ингибирование синтеза простагландинов
ЦОГ-1 отвечает в основном за синтез простагланди-нов, участвующих в процессах гомеостаза в жизненно важных органах. Именно с ингибированием ЦОГ-1 связывают хорошо известные желудочно-кишечные побочные эффекты традиционных неселективных НПВП.
Ингибирование ЦОГ-2 обеспечивает противовоспалительный эффект НПВП, так как она участвует в синтезе воспалительных простагландинов.
Неселективные НПВП ингибируют обратимо или необратимо как ЦОГ-1, так и ЦОГ-2. Большинство токсических эффектов этих препаратов связано с их способностью блокировать синтез физиологических проста-гландинов, необходимых для обеспечения гомеостаза в почках, желудке и тромбоцитах за счет ингибирования ЦОГ-1.
Появление на рынке в конце 1990-х годов селективных ингибиторов ЦОГ-2 (коксибов) давало клиницистам надежду на то, что эта группа НПВП обеспечит высокую фармакологическую эффективность при более низком уровне желудочно-кишечных осложнений. Однако ожидания были оправданы не в полной мере, в частности, получены доказательства того, что применение коксибов сопровождается увеличением частоты тромбоэмболических осложнений, что привело к выводу с рынка во всем мире таких препаратов, как рофе-коксиб и валдекоксиб. Кроме того, применение валде-коксиба связывают с частым развитием нежелательных кожных реакций. Кардиотоксичность коксибов объясняют блокированием синтеза простациклинов, опосредованного ЦОГ-2, что нивелирует их защитные эффекты в отношении тромбогенеза, гипертензии и ате-рогенеза in vivo.
НПВП классифицируют по степени селективности в отношении изоформ ЦОГ (рис. 1). Селективность в отношении ЦОГ определяется химической структурой НПВП. Аминокислотная структура ЦОГ-1 и ЦОГ-2 является достаточно стабильной, однако рентгеновские кристаллографические исследования ЦОГ показали, что активная область связывания с НПВП у ЦОГ-2 позволяет связываться с большим количеством субстратов, чем центр связывания у ЦОГ-1. Этот активный канал является гидрофобным, у ЦОГ-2 возможно открытие бокового гидрофильного кармана, который у ЦОГ-1 закрыт изолейцином.
Так, флурбипрофен, который относят к неселективным НПВП, взаимодействует с ЦОГ-1 посредством связывания фенильной группы с гидрофобным каналом и карбоксильной группы с аргинином в положении 120. Взаимодействие флурбипрофена с ЦОГ-2 сходно с описанным, однако, связываясь с аргинином в положении 120, карбоксильная группа блокирует активный центр ЦОГ-2, не позволяя ему взаимодействовать с субстратом. Напротив, селективные ингибиторы ЦОГ-2 не могут войти в активный канал ЦОГ-1 и не имеют карбоксильной группы для связывания с аргинином в положении 120.
Фармакокинетический профиль
На основании периода полувыведения НПВП могут быть разделены на две большие группы: с коротким периодом полувыведения (менее 6 ч) и с длительным периодом полувыведения (более 10 ч). Группа НПВП с коротким периодом полувыведения включает АСК, диклофенак, ибупрофен, флурбипрофен, индометацин, лумиракоксиб и нимесулид. Группа препаратов с длительным периодом полувыведения включает целекоксиб, напроксен, сулиндак, рофекоксиб, оксапрозин, пирок-сикам. Достижение равновесной концентрации препарата в плазме крови происходит после его применения в течение периода, превосходящего период полувыведения в 3-5 раз, поэтому достижение пиковой концентрации в плазме крови и максимального клинического эффекта НПВП с коротким периодом полувыведения происходит быстрее, чем препаратов с длительным периодом полувыведения.
Нимесулид: фармакологический профиль
Нимесулид оказывает быстрое обезболивающее действие, что подтверждают следующие исследования. Применение нимесулида у пациентов с острым артритом характеризуется быстрым началом действия и ранним ингибированием образования простагландина E2 (маркера активности ЦОГ-2). В клинических исследованиях у пациентов с остеоартритом коленных суставов были получены доказательства быстрого начала действия нимесулида. У данной категории больных нимесу-лид вызывал достоверно более значимое облегчение боли, связанной с ходьбой, и эффект наступал быстрее, чем при применении целекоксиба и рофекоксиба. Начало обезболивающего действия нимесулида фиксировалось уже через 15 мин после приема. Согласно недавним исследованиям, эффективные концентрации ни-месулида в плазме крови и синовиальной жидкости обнаруживаются уже через 30 мин после его приема.
НПВП могут обладать противовоспалительными свойствами, которые не зависят от ЦОГ. Было показано, что нимесулид, помимо периферического ингибирую-щего воздействия на ЦОГ, может ингибировать высвобождение фактора некроза опухолей a (ФНО-a), гиста-мина, образования активных форм кислорода (АФК), высвобождения матриксных металлопротеаз (ММП) и гибели хондроцитов (рис. 2).
Влияние нимесулида на медиаторы воспаления
ФНО-a играет ведущую роль в воспалительном процессе, что делает его идеальной целью при терапии ревматоидного артрита. В исследованиях на крысах, которым вводили липополисахариды для увеличения уровня ФНО-a, нимесулид эффективно ингибировал его высвобождение.
Выработка фагоцитами супероксида и высвобождение лактоферрина из нейтрофилов были исследованы у 8 добровольцев до и после приема нимесулида внутрь. В качестве активирующих стимулов были использованы фактор хемотаксиса N-формил-метионил-лейцил-фенилаланин (ФМЛФ) и частицы опсонизированного зимозана (ЧОЗ). Нимесулид значимо ингибировал образование АФК ФМЛФ и активированными за счет воздействия ЧОЗ фагоцитами (ингибирование до 67,6 и 36,8% соответственно; рис. 3). Он не оказывал влияния на высвобождение лактоферрина нейтрофилами, что позволило авторам предположить, что нимесулид не оказывает влияния на механизмы, происходящие при экзоцитозе специфичных гранул.
В ходе воспалительной реакции для предупреждения повреждения тканей требуется поддержание баланса между протеиназами (преимущественно эластазами, выделяемыми мигрировавшими в очаг нейтрофилами) и антипротеазами (в основном эластаза-специфиче-ским a-1-ингибитором протеиназ; A1PI). Нейтрофиль-ные клетки способны инактивировать A1PI с помощью серии окислительных реакций с участием хлорноватистой кислоты, что позволяет эластазе свободно разрушать соединительную ткань. Возможным способом регулирования активности нейтрофильной эластазы является фармакологическая защита A1PI от окислительной инактивации под действием хлорноватистой кислоты нейтрофилов. В доклинических исследованиях было показано, что нимесулид предотвращал инактивацию A1PI под действием выделяемой нейтрофилами хлорноватистой кислоты, что позволяет осуществлять опосредованный А1Р1-контроль гистотоксической функции эластазы. Полученные данные позволяют предполагать, что защитное влияние нимесулида на A1PI может иметь значение в реализации его противовоспалительного действия.
В другом исследовании морским свинкам предварительно вводили нимесулид или индометацин, после чего ацетальдегидом провоцировали выброс гистамина и бронхоспазм (рис. 4). В контрольной группе, получавшей только ацетальдегид, концентрация гистамина в крови была равна 195±12 мг/л, в группе, получавшей нимесулид, при использовании дозы 0,1 мг/кг она была равна 154±10 мг/л (p
Простагландины – универсальные биорегуляторы в организме человека (обзор литературы)
Авторы
Ключевые слова:
Аннотация
В последнее время учеными разных отраслей уделяется огромное внимание проблеме простагландинов.
Цель работы – на основе анализа данных отечественной и зарубежной литературы изучить и систематизировать основные вопросы структуры, биологического действия, метаболизма простагландинов в организме человека и применение их аналогов в фармации.
Простагландины – биологически активные вещества, близкие по своему действию к гормонам, но, в отличие от гормонов, они синтезируются не в эндокринных железах, а в клетках различных тканей организма. Простагландины как универсальные клеточные медиаторы широко распространены в организме, синтезируются в минимальных количествах практически во всех тканях, имеют как местное, так и системное воздействие. Для каждого простагландина существует свой орган-мишень. По химическому строению они небольшие молекулы, относящихся к эйкозаноидам – группе жироподобных веществ (липидов). В зависимости от химической структуры простагландины делятся на серии (A, B, C, D, E, F, G, H, I и J) и три группы (1–3); изомеры типа F обозначаются дополнительно буквами α и β.
Простагландины обладают чрезвычайно широким спектром физиологических эффектов, относятся к самым активным биогенных веществам, выполняют в организме три основные функции: поддерживающую, молекулярную, медиаторную. Большинство простагландинов взаимодействуют со специфическими рецепторами цитоплазматических мембран, однако некоторые простагландины (группа А) могут действовать нерецепторно. Запас простагландинов в организме отсутствует, жизненный цикл их короткий, они быстро образуются в ответ на воздействие биологических стимуляторов, проявляют свое действие в чрезвычайно скудных количествах и быстро инактивируются, попадая в кровь. В связи с чрезвычайно быстрым распадом в организме простагландины действуют в основном вблизи места их секреции. Препараты простагландинов и их производных используют в экспериментальной и клинической медицине для прерывания беременности и стимуляции родовой деятельности, терапии язвы желудка, бронхиальной астмы, некоторых сердечно-сосудистых заболеваний, врожденных пороков сердца у новорожденных, глаукомы, атеросклероза, ревматических, неврологических заболеваний, болезнях почек, сахарном диабете, коррекции гемостаза, как антикоагулянты при операциях с искусственным кровообращением, а также при гемодиализе.
Выводы. Простагландины – самые активные универсальные биогенные вещества в организме человека с чрезвычайно широким спектром физиологических эффектов. Они имеют как местное, так и системное воздействие, реализуют свое действие различными путями, их рецепторы содержатся практически во всех органах организма, для каждого простагландина существует свой орган-мишень. Указанные свойства простагландинов отражаются в их широком применении в медицине и фармации. Несмотря на активные исследования в данном направлении, у ученых остается много вопросов относительно механизмов действия, функций простагландинов и их аналогов в организме человека.
Библиографические ссылки
Bondarenko, O. A. (2012). Riven prostahlandyniv ta tsyklichnykh nukleotydiv u syrovattsi krovi khvorykh na khronichnyi pankreatyt, spoluchenyi z ozhyrinniam v dynamitsi zahalnopryiniatoho likuvannia [The level of prostaglandinums and cyclic nucleotides in serum blood of the patients with chronic pancreatitis, combined with obesity]. Ukrainskyi medychnyi almanakh, 15(2), 31–34 [in Ukrainian].
Victorov, О. P., Deyak, S. I., Bazyka, O. Y., Kashuba, O. V., & Matveyeva, О.V. (2011). Efektyvne ta bezpechne medychne zastosuvannia analhetykiv-antypiretykiv (pohliad na problemu) [Effective and safe analgetics-antipyretics use (problem view)]. Ukrainskyi medychnyi chasopys, 6(86), 90–93. [in Ukrainian].
Zharkova, T. S. (2015). Klinichne znachennia prostahlandyniv u formuvanni variantiv perebihu bakterialnykh kyshkovykh infektsii u ditei [Clinical significance of prostaglandins in the formation of courses of bacterial intestinal infections in children]. Zdorov’e rebenka, 62, 120–122. [in Ukrainian].
Zhuk, S. I., Khoroshaeva, N. E., & Salnikov, S. N. (2012). Dosvid dopolohovoi pidhotovky shyiky matky preparatamy, shcho mistiat promestryn [Experience of prenatal preparation of the cervix with drugs containing promestrin]. Reproduktivnaya e’ndokrinologiya, 4(6), 70–73 [in Ukrainian].
Ilkiv, I. I., Panasiuk, N. B., Biletska, L. P., & Skliarov, O. Ya. (2014). Zminy pokaznykiv systemy NO-syntaza/arhinaza za umov poiednanoi dii hostroho stresu ta blokuvannia tsyklooksyhenazy/lipooksyhenazy u tonkii kyshtsi [Changes indicators of NO-synthase/arginase under conditions combined effects of acute stress and blocking cyclooxygenase/lipooksyhenazе in the small intestine]. Eksperymentalna ta klinichna fiziolohiia i biokhimiia, 4, 19–25 [in Ukrainian].
Kuznietsov, S. V., & Zharkova, T. S. (2010). Rol prostahlandyniv u formuvanni klinichnoho variantu perebihu shyhelozu u ditei [The role of prostaglandins in the formation of the clinical alternative course of shigellosis in children]. Sovremennaya pediatriya, 3(31), 58–60 [in Ukrainian].
Pertseva, T. O., & Sanina, N. A. (2012). Rol systemnykh zapalnykh protsesiv u patohenezi khronichnoho obstruktyvnoho zakhvoriuvannia lehen [The role of systemic inflammation in the pathogenesis of chronic obstructive pulmonary disease]. Ukrainskyi pulmonolohichnyi zhurnal, 4, 48–50. [in Ukrainian].
Svintsitskyi, A. S., Kozak, N. P., & Antonenko, A. V. (2011). Adaptatsiia slyzovoi obolonky shlunka do dii nesteroidnykh protyzapalnykh preparativ [Adaptation of gastric mucosa to nonsteroidal anti-inflammatory drugs]. Ukrainskyi revmatolohichnyi zhurnal, 46(4), 1–3 [in Ukrainian].
Austin, S. C., Sanchez-Ramos, L., & Adair, C. D. (2010) Labor induction with intravaginal misoprostol compared with the dinoprostone vaginal insert: a systematic review and metaanalysis. Am J Obstet Gynecol, 202, 624.e1-9. doi: 10.1016/j.ajog.2010.03.014.
Brenneis, C., Coste, O., Altenrath, K., Angioni, C., Schmidt, H., Schuh, C. D., et al. (2011) Anti-inflammatory role of microsomal prostaglandin E synthase-1 in a model of neuroinflammation. J Biol Chem, 286(3), 2331–42. doi: 10.1074/jbc.M110.157362.
Brock, J. S., Hamberg, M., Balagunaseelan, N., Goodman, M., Morgenstern, R., Strandback, E., et al. (2016) A dynamic Asp-Arg interaction is essential for catalysis in microsomal prostaglandin E2 synthase. Proc Natl Acad Sci,113(4), 972–977. doi: 10.1073/pnas.1522891113.
Diakowska, D., Markocka-Mączka, K., Nienartowicz, M., Lewandowski, A., & Grabowski, K. (2014) Increased level of serum prostaglandin-2 in early stage of esophageal squamous cell carcinoma. Arch Med Sci., 10(5), 956–961. doi: 10.5114/aoms.2013.34985.
Facchinetti, F., Fontanesi, F., & Del Giovane, C. (2012) Pre-induction of labour: comparing dinoprostone vaginal insert to repeated prostaglandin administration: a systematic review and meta-analysis. J Matern Fetal Neonatal Med., 25, 1965–9. doi: 10.3109/14767058.2012.668584.
Hui, Y., Ricciotti, E., Crichton, I., Yu, Z., Wang, D., Stubbe, J., et al. (2010) Targeted deletions of cyclooxygenase-2 and atherogenesis in mice. Circulation, 121, 2654–2660. doi: 10.1161/CIRCULATIONAHA.109.910687.
Johansson, J. U., Woodling, N. S., Wang, Q., Panchal, M., Liang, X., Trueba-Saiz, A., et al. (2015) Prostaglandin signaling suppresses beneficial microglial function in Alzheimer’s disease models. J Clin Invest., 125(1), 350–364. doi: 10.1172/JCI77487.
Legler, D. F., Bruckne, M., Uetz-von Allmen, E., & Krause, P. (2010) Prostaglandin E2 at new glance: Novel insights in functional diversity offer therapeutic chances. Int J Biochem Cell Biol., 42, 198–201. doi: 10.1016/j.biocel.2009.09.015.
Rania, N., Ramzi, H., & Hébert, R. L. (2014) Chronic kidney disease: targeting prostaglandin E2 receptors. Am J Physiol Renal Physiol, 307, 243–250. doi: 10.1152/ajprenal.00224.2014.
Regner, K. R. (2012) Dual Role of Microsomal Prostaglandin E Synthase 1 in Chronic Kidney Disease. Hypertension, 59(1), 12–14. doi: 10.1161/HYPERTENSIONAHA.111.180034.
Ricciotti, E., & FitzGerald, G. A. (2011) Prostaglandins and Inflammation. Arterioscler Thromb Vasc Biol., 31(5), 986–1000. doi: 10.1161/ATVBAHA.110.207449.
Rooney Thompson, M., Towers, C. V., Howard, B. C., Hennessy, M. D., Wolfe, L., & Heitzman, C. (2015) The use of prostaglandin E1 in peripartum patients with asthma. Am J Obstet Gynecol, 212, 392.e1-3. doi: 10.1016/j.ajog.2014.11.042.
Samuelsson, B., Morgenstern, R., & Jakobsson, P. J. (2007) Membrane prostaglandin E synthase-1: a novel therapeutic target. Pharmacol Rev., 59, 207–24. doi: 10.1124/pr.59.3.1.
Satoh, H., Amagase, K., Ebara, S., Akiba, Y., & Takeuchi, K. (2013) Cyclooxygenase (COX)-1 and COX-2 both play an important role in the protection of the duodenal mucosa in cats. J. Pharmacol. Ther., 344(1), 189–195. doi: 10.1124/jpet.112.199182.
Ингибирование синтеза простагландинов что это
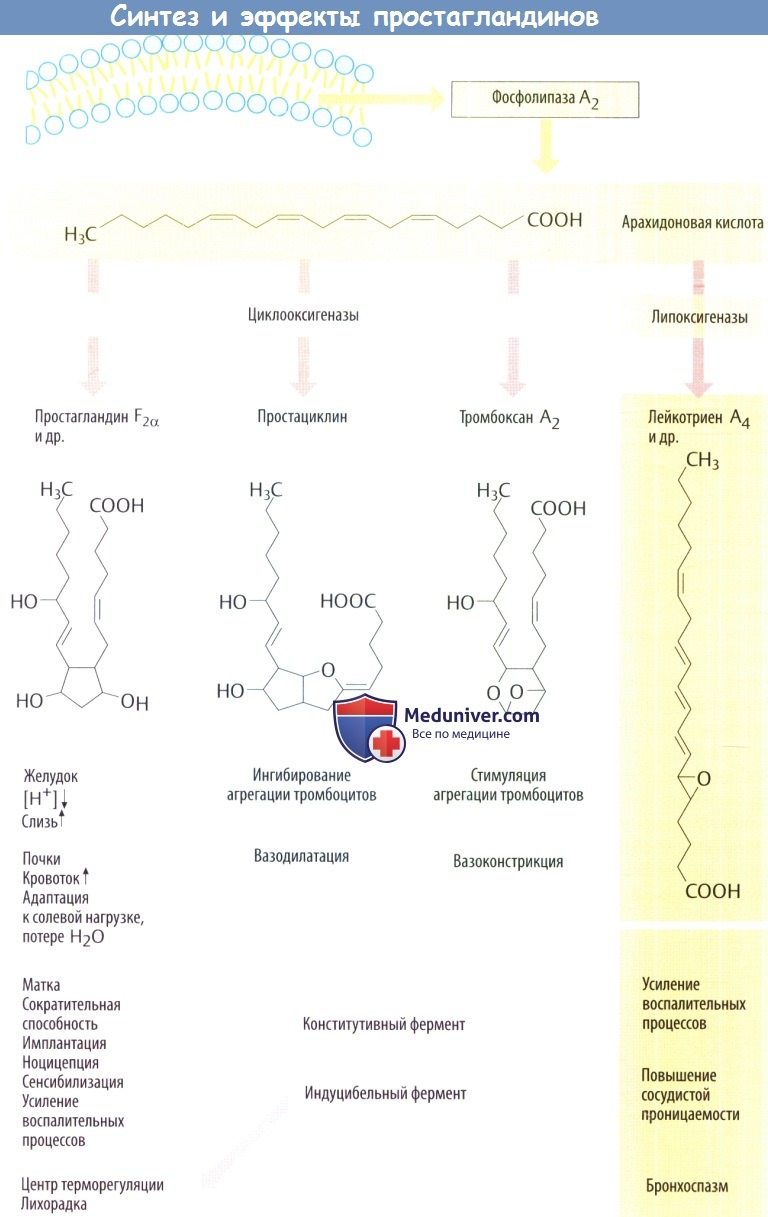
Под действием циклооксигеназ (ЦОГ-1, ЦОГ-2 и их сплайс-вариантов) растянутая молекула арахидоновой кислоты (эйкозатетраеновая кислота) превращается в соединения, содержащие центральное кольцо с двумя длинными заместителями: простагландины, простациклин и тромбоксаны.
Под действием липоксигеназы из арахидоновой кислоты синтезируются лейкотриены, которые в центре структуры не имеют кольца. Продукты, образованные из арахидоновой кислоты, действуют как местные гормоны и быстро инактивируются. В группы простагландинов и лейкотриенов входит большое количество близкородственных соединений. В данном разделе рассматриваются только наиболее важные простагландины и их основные эффекты.
а) Простагландин (PG) Е2 ингибирует секрецию желудочного сока и повышает выработку слизи, что защищает слизистую оболочку. PGF2α стимулирует сокращение матки. PGI2 (простациклин) вызывает расширение сосудов и способствует экскреции Na + в почках.
Кроме того, простагландины, синтезируемые ЦОГ-2, участвуют в воспалительных процессах, повышая чувствительность ноцицепторов, что снижает болевой порог, способствуя развитию воспалительной реакции за счет выделения медиаторов, таких как интерлейкин-1 и фактор некроза опухолей-α, и повышая температуру тела.
б) Простациклин синтезируется в эндотелии сосудов и участвует в регуляции кровотока. Он вызывает расширение сосудов и предотвращает агрегацию тромбоцитов, т. е. это функциональный антагонист тромбоксана.
Тромбоксан А2 —местный гормон, синтезируется в тромбоцитах и способствует их агрегации. Образование тромбоксана происходит при небольших дефектах в сосудистой или капиллярной стенке.
Лейкотриены образуются в основном в лейкоцитах и тучных клетках. Недавно установлено, что лейкотриены могут связываться с глутатионом. От этого комплекса отщепляется глутамин и глицин в результате чего образуется большее количество локальных гормонов. Лейкотриены обладают провоспалительным свойством; они стимулируют миграцию лейкоцитов и повышают их активность.
При анафилактических реакциях лейкотриены обусловливают расширение сосудов, повышение их проницаемости, а также могут вызывать сужение кровеносных сосудов.
Терапевтическое применение синтетических эйкозаноидов. Усилия по синтезу стабильных производных простагландинов для терапевтического применения пока не увенчались успехом. Динопростон (PGE2), гемепрост и сульпростан используются как стимуляторы сокращения матки. Мизопростон предназначен для защиты слизистой оболочки желудка, но характеризуется выраженными системными побочными эффектами. Все эти препараты не обладают органоспецифичностью.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ПРОСТАГЛАНДИНЫ
Простагландины — биологически активные вещества, представляющие собой производные полиненасыщенных жирных кислот, молекула которых содержит 20 углеродных атомов.
Биологическое действие Простагландинов чрезвычайно многообразно; одним из основных биологических эффектов Простагландинов является их выраженное действие на тонус гладкой мускулатуры различных органов. Простагландины снижают выделение желудочного сока (см.) и уменьшают его кислотность, являются медиаторами воспалительного процесса, принимают участие в деятельности различных звеньев репродуктивной системы. Они играют также важную роль в регуляции деятельности почек (см.), оказывают влияние на различные эндокринные железы. Некоторые Простагландины являются медиаторами аллергических реакций (см.). Нарушение биосинтеза Простагландинов может стать причиной тяжелых патологических состояний. В медицине в качестве лекарственных средств используют синтетические и полусинтетические простагландины.
В середине 30-х гг. 20 в. шведский ученый У. Эйлер опубликовал ряд работ, в которых доказал, что наблюдавшееся ранее миотропное и вазоактивное действие семенной жидкости и экстрактов из простаты (см. Предстательная железа) обусловлено содержанием в них нового семейства природных соединений. Эйлер назвал эти соединения простагландинами, полагая, что они вырабатываются только в простате. Позже было показано, что П. образуются практически во всех органах и тканях, однако термин «простагландины» для обозначения этих веществ сохранился. Впервые П. (ПГ, PG) получены в 1957 г. швед, химиком С. Бергстремом, а в 1962 г. была расшифрована их хим. структура. Было установлено, что углеродный скелет П. представлен пятичленным циклом и двумя боковыми цепями. Оказалось, что П. можно рассматривать как производные простановой к-ты — соединения, не существующего в природе, но полученного синтетически.
Известно ок. 20 различных П. В зависимости от строения пятичленного цикла в молекуле простагландины делят на несколько типов, обозначаемых буквами латинского алфавита: А, В, С, D, E, F и т. д.
Простагландин I2, открытый в 1976 г., больше известен под названием «простациклин».
П. каждого типа делят на 1, 2 и 3-ю серии в зависимости от числа двойных связей в боковых цепях молекулы. Т. о., сокращенно с учетом типа и серии II. обозначают так: ПГЕ2 (PGE2), ПГД1 (PGD1), ПГН2 (PGH2) и т. д.
В 70-х гг. 20 в. было обнаружено, что в организме человека и животных образуются и другие биологически активные производные полиненасыщенных жирных кислот (см.): в тромбоцитах — тромбоксаны (ТХ), в лейкоцитах — лейкотриены (ЛТ). От П. тромбоксаны отличаются наличием в молекуле вместо пятичленного цикла шестичленного оксанового кольца, в зависимости от структуры к-рого тромбоксаны делят на типы А и В (ТХА и ТХВ).
Тромбоксаны обоих типов, в свою очередь, делят на 1, 2 и 3-ю серии по тому же принципу, что и П.
Особенностью строения лейкотриенов является отсутствие в молекуле циклической структуры. В зависимости от строения функциональных группировок в углеродной цепи лейкотриены делят на типы А, В, С, D и E, а в зависимости от числа двойных связей — на серии 3, 4 и 5. Сокращенно лейкотриены обозначают следующим образом: ЛТВ3, ЛТС3 и т. п. В молекулах ЛТС, ЛТD и ЛТЕ к 6-му углеродному атому присоединены остатки глутатиона, цистеинилглицина и цистеина соответственно.
В организме человека и животных П., тромбоксаны и лейкотриены образуются из общего предшественника — незаменимых полиненасыщенных жирных к-т с соответствующим числом углеродных атомов и двойных связей в молекулах, в т. ч. из линолевой кислоты (см.) и арахидоновой кислоты (см.). Первый этап превращения жирных к-т в П. осуществляется при участии фермента циклооксигеназы. При действии циклооксигеназы вначале образуются ПГС соответствующих серий и далее ПГН тех же серий. На следующем этапе из ПГН параллельно образуются ПГЕ, ПГF, ПГD, ПГI и ТХА. Лейкотриены образуются из тех же жирных к-т под действием другого фермента — липоксигеназы (КФ 1.13.11.12). Фактором, лимитирующим скорость биосинтеза П., является пул свободных жирных к-т, поэтому вещества, влияющие на гидролитическое расщепление триглицеридов, фосфолипидов и эфиров холестерина, в состав которых входят полиненасыщенные жирные к-ты, могут регулировать интенсивность образования П. Так, катехоламины (см.), брадикинин, ангиотензин II (см. Ангиотензинамид) и др. повышают освобождение жирных к-т в организме, тем самым косвенно стимулируя образование П. По-видимому, таков же механизм стимуляции биосинтеза П., тромбоксанов и лейкотриенов при ишемии или механическом воздействии на клетки. Кортикостероидные гормоны, напротив, подавляют биосинтез П., тромбоксанов и лейкотриенов, т. к. они ингибируют выход свободных жирных к-т. Известно, что некоторые соединения влияют на образование отдельных типов П. и тромбоксанов; так, перекиси жирных к-т специфически угнетают биосинтез ПГI2, а имидазол — образование ТХА2. Целый ряд лекарственных средств оказывает выраженное действие на образование П., тромбоксанов и лейкотриенов, изменяя не только их общее количество, но и соотношение между отдельными типами и сериями. Напр., лекарственные средства, обладающие противовоспалительным действием,— салицилаты, индометацин (метиндол), бруфен и др.— ингибируют циклооксигеназу, катализирующую первый этап биосинтеза П. Это приводит к предпочтительному использованию свободных жирных к-т по липоксигеназному пути, в результате чего уменьшается образование П. и тромбоксанов и повышается выход лейкотриенов. В то же время некоторые флавоноиды (напр., рутин) ингибируют липоксигеназу и подавляют биосинтез лейкотриенов. Изменение соотношения образующихся П. имеет важное значение, поскольку индивидуальные П. обладают разным, а нередко и противоположным по характеру биол, действием.
П. и тромбоксаны являются короткоживущими соединениями. Время полужизни некоторых из них исчисляется секундами. Быстрое разрушение П. обусловливает локальность их эффектов — П. действуют гл. обр. в месте их синтеза. Метаболизм П., приводящий к их быстрой инактивации, осуществляется во всех тканях, но особенно активно в легких, печени и почках. В процессе метаболизма П. вначале образуются 15-кето-13,14-дигидропроизводные исходных П., которые подвергаются дальнейшему окислению, вплоть до образования конечных продуктов, выводимых из организма с мочой.
Биологическое действие П. чрезвычайно многообразно благодаря не только биол, «поливалентности» индивидуальных П., но и большому их разнообразию. Одним из биол, эффектов П. является их выраженное действие на тонус гладкой мускулатуры различных органов, причем действие разных типов П. часто является диаметрально противоположным. Так, простагландины F2 и D2 вызывают сокращение бронхов, а простагландин E2 — их расслабление. Тромбоксан А2 сокращает стенки кровеносных сосудов и повышает АД, а простагландин I2 оказывает сосудорасширяющее действие, сопровождающееся гипотензивным эффектом. Антагонистические взаимоотношения между тромбоксаном А2 и простагландином I2 проявляются и при их действии на систему свертывания крови: тромбоксан А2 является мощным природным индуктором агрегации тромбоцитов, а простагландин I2, синтезирующийся в стенках кровеносных сосудов, выполняет в организме человека и животных роль ингибитора агрегации тромбоцитов. Соотношение простагландин I2/тромбоксан A2 имеет важное значение для нормального функционирования сердечно-сосудистой системы.
П. необходимы для процесса овуляции (см.); они влияют на продвижение яйцеклетки и на подвижность сперматозоидов, на сократительную деятельность матки (см.). П. необходимы также для нормальной родовой деятельности: слабую родовую активность и перенашивание беременности (см.) связывают с недостатком П., а повышенное образование П. может стать причиной самопроизвольных абортов (см.) и преждевременных родов (см.). У новорожденных П. регулируют закрытие сосудов пуповины и артериального протока.
П. играют также важную роль в регуляции деятельности почек. Они стимулируют образование ренина (см.), регулируют водно-солевой обмен (см.). Простагландины I2 и Е2 обладают натрийуретическим и диуретическим действием. По-видимому, именно эти П., а не простагландин A2, как предполагали ранее, ответственны за гипотензивное действие так наз. медуллина почек.
П. оказывают влияние на деятельность различных органов эндокринной системы. Они воспроизводят биол, эффект соответствующих тройных гормонов в их органах-мишенях. Так, в щитовидной железе П. стимулируют образование коллоида, окисление глюкозы, связывание йода с белком. В надпочечниках и яичниках П. влияют на стероидогенез. Природа взаимоотношений между П. и гормонами остается пока неясной. Предполагают, что П. модулируют действие гормонов и могут усиливать или ослаблять их эффекты.
Важную роль в жизнедеятельности человека и животных играют также лейкотриены, которые, как и некоторые П. (в частности, простагландины Е и Г), являются медиаторами аллергических реакций. Открытие лейкотриенов позволило установить, что давно известная так наз. медленно реагирующая субстанция анафилаксии (SRS-A) тождественна лейкотриенам. Лейкотриены, образующиеся гл. обр. в лейкоцитах и тучных клетках, ответственны за спазмогенную активность SRS-A, влияют на проницаемость стенки кровеносных сосудов, вызывая отек тканей, оказывают хемотаксическое действие.
Нарушение образования П., тромбоксанов и лейкотриенов может быть причиной развития целого ряда патол. процессов. Давно известно, что длительное применение препаратов кортикостероидных гормонов может вызывать кишечные кровотечения и развитие язвенной болезни. Оказалось, что кортикостероидные гормоны и другие лекарственные средства, обладающие противовоспалительным действием, являются ингибиторами биосинтеза П., которые оказывают цитозащитное действие на клетки слизистой оболочки желудка и кишечника и угнетают секрецию соляной кислоты (см.). При язвенной болезни нелекарственного происхождения наблюдают значительное снижение синтеза П.; с избыточным образованием П., стимулирующих перистальтику кишечника, связывают появление диареи при некоторых инфекционных болезнях и раке. Нарушение биосинтеза простагландина I2 является одним из патогенетических факторов, обусловливающих развитие гипертонической болезни и атеросклероза. П. ответственны за появление отека и болевых ощущений при воспалении. Лейкотриены, обладающие спазмогенной активностью, играют существенную роль в патогенезе астмы. При дисменорее обнаружено повышенное образование П., поэтому индометацин и другие ингибиторы биосинтеза П. с успехом используются при этой патологии.
Количественное определение П. осуществляют при помощи хроматомасс-спектрофотометрии (см. Спектрофотометрия) и радиоиммунологического метода (см.). Предварительно П. экстрагируют из исследуемых образцов органическими растворителями. а затем хроматографируют на колонках с кремниевой к-той или на тонком слое силикагеля (см. Хроматография). Для тестирования новых соединений и изучения их биол, действия используют биол, методы.
Препараты простагландинов
Применение П. в клин, практике в качестве лекарственных средств ограничено, с одной стороны, их быстрой инактивацией в организме, а с другой — очень широким спектром действия, что обусловливает их побочные эффекты. В связи с этим постоянно ведутся поиски синтетических аналогов природных П., лишенных этих недостатков. В медицине в качестве лекарственных средств используют полусинтетические и синтетические П., в основном типа Е и Е.
Препараты П. выпускают в виде р-ров для инъекций, р-ров для пероральном применения, таблеток, аэрозолей, а также вагинальных лекарственных форм (шариков, силастиковых носителей П. и др.).
Препараты П. типа Е (динопростон, простин Е2 и др.) в дозах и концентрациях, близких к физиологическим, снижают моторику и тонус небеременной матки и усиливают их при беременности (см. Маточные средства), увеличивают сердечный выброс, кровяное давление в легочной артерии и проницаемость капилляров, снижают системное артериальное и венозное давление, усиливают коронарный и регионарный кровоток, расслабляют мышцы бронхов, тормозят секрецию желудочного сока, в зависимости от дозы усиливают или уменьшают почечный кровоток и диурез. Препараты простагландинов Е1, не оказывая влияния на процессы свертывания крови, тормозят агрегацию тромбоцитов, задерживают образование тромбов и ретракцию кровяного сгустка; препараты простагландинов Е2 стимулируют агрегацию тромбоцитов.
Препараты П. типа F (динопрост, простин F2-альфа, энзапрост F, 15-метил-ПГF2-альфа и др.) усиливают моторику беременной и небеременной матки, стимулируют стероидогенез в желтом теле и атрезию желтого тела, оказывают родостимулирующее и абортивное действие, усиливают сокращение маточных труб, обладают противозачаточным действием; повышают тонус мышц кишечника и бронхов, системное артериальное и венозное давление, но уменьшают регионарный артериальный кровоток, сужают почечные сосуды, оказывают антидиуретический эффект, стимулируют секрецию желудочного сока и соляной к-ты в желудке.
Использование препаратов П. противопоказано при воспалительных инф. заболеваниях, спастических заболеваниях жел.-киш. тракта, глаукоме, аллергических заболеваниях.
При применении препаратов П. часто наблюдаются побочные явления: тошнота, рвота, понос, головные боли, изменение АД, повышение температуры тела и внутриглазного давления, бронхоспазм п др.
Применение П. в качестве лекарственных средств допускается только в специализированных леч. учреждениях. Простагландины Е1 и Е2 применяются для профилактики и купирования бронхоспастических состояний различной этиологии, для лечения эссенциальной гипертонии и язвенной болезни желудка. В акушерской практике простагландины F2-альфа и Е2 и их аналоги используются для прерывания беременности на различных сроках, а также для возбуждения и стимуляции родовой деятельности.
Применение простагландинов в акушерстве и гинекологии
На основании многочисленных научных публикаций можно сделать вывод, что П. являются эффективным и щадящим средством для вызывания родов (см.), прерывания беременности и стимуляции родовой деятельности. П., применяемые в терапевтических дозах, не оказывают неблагоприятного влияния на мать в плод. Чувствительность матки к введению П. различна на разных сроках беременности; на очень ранних и на поздних сроках беременности стимулирующий эффект вызывается легко, а в промежутке между ними миометрий на введение препаратов П. реагирует слабо.
Для искусственного прерывания беременности используются внутривенное, внутримышечное, вагинальное, пероральное, экстра- и интраамниальное введения П. При прерывании беременности на ранних сроках наиболее эффективным оказалось введение 15-метил-ПГF2-альфа (метилового эфира простагландина F2альфа) в виде свечей (3 мг) или внутримышечно (по 200—300 мкг 5 раз через каждые 3 часа); при беременности сроком 13—14 нед.— экстраамниальное однократное введение 15-метил-ПГF2альфа (2,5 мг) с вяжущим веществом (гискон) или в виде свечей (3 мг); после 15-й недели беременности — интраамниальное введение 2,5 мг 15-метил-ПГF2альфа или 40—50 мг ПГF2-альфа, а также свечи с 15-метил-ПГF2-альфа (3 мг).
Для возбуждения и стимуляции родовой деятельности можно использовать внутривенное, пероральное, экстраамниальное, вагинальное и ректальное введение препаратов П.; наибольшее распространение получило внутривенное капельное строго дозированное введение. Для внутривенного введения используется р-р ПГF2альфа в разведении 5 мг на 500 мл изотонического р-ра хлорида натрия или 5% р-ра глюкозы и р-р ПГЕ2 в разведении 1 мг на 500 мл растворителя (растворители те же). Приготовленный р-р вводится со скоростью от 6—8 до 40 капель в 1 мин.
В акушерской практике ПГF2-альфа и ПГЕ2 в виде свечей или р-ра, которые вводятся в канал шейки матки или нижний сегмент матки, используются для подготовки женского организма к родам и с целью родовозбуждения.
При использовании Простагландинов в качестве лекарственных средств в акушерской и гинекологической практике, помимо отмеченных выше побочных реакций, иногда наблюдают гипертонус и гиперсистолию матки, нарушение сердечной деятельности плода. Побочные реакции и осложнения чаще бывают при прерывании беременности, т. к, в этих случаях применяют большие дозы П.; для профилактики и лечения побочных реакций и осложнений рекомендуется ритодрин.
Противопоказания к применению Простагландинов с целью вызывания аборта, возбуждения и стимуляции родовой деятельности: тяжелые соматические заболевания, аллергические реакции на введение лекарственных средств, бронхиальная астма, эпилепсия, рубец на матке, анатомически и клинически узкий таз, предлежание плаценты, преждевременная отслойка нормально расположенной плаценты.
Библиография: Биохимия гормонов и гормональной регуляции, под ред. Н. А. Юдаева, с. 300, М., 1976; Кудрин А. Н., Персианинов Л. С. и Короза Г. С. Механизмы стимулирующего действия простагландина F2α на сократительную деятельность матки, Акуш. и гинек., № 11, с. 1, 1973; Машковский М. Д. Простагландины как возможные лекарственные средства, Хим.-фарм. журн., т. 7, № 7, с. 7, 1973; Персианинов Л. С. Механизм действия простагландина F2a и его клиническое применение в акушерстве, Акуш. и гинек., № 6, с. 7, 1975; Пивницкий К. К. Достижения биохимии простагландинов, Пробл. эндокринол., т. 20, № 6, с. 98, 1974, библиогр.; он же, Биосинтез, метаболизм и действие простагландинов, Вестн. АМН СССР, № 9, с. 69, 1976; Простагландины, под ред. И. С. Ашгихина, М., 1978; Простагландины и их применение в акушерстве, под ред. Л. С. Персианинова, М., 1977; Чернуха Е. А., Персианинов Л. С. и Ботвин М. Л. Родовозбушдение простагландином F2α и его аналогом 15-ME-nrF2a, Сов. мед., №6, с. 78, 1977; Эмбри М. П. Простагландины в репродуктивной функции человека, пер. с англ.; М., 1978, библиогр.; Advances in prostaglandin and thromboxane research, ed. by B. Samuelsson a. R. Paoletti, v. 1 — 8, N. Y., 1976—1980; Anderson A. B. a. o. Trial of prostaglandin-synthetase inhibitors in primary dysmenorrea, Lancet, v. 1, p. 345, 1978; С sap о A. I. a. Pulkkinen M. O. The mechanism of prostaglandin action on the early pregnant human uterus, Prostaglandins, v. 18, p. 479, 1979; Embrey M. P., Hillier K. a. Mahendran P. Termination of pregnancy by extraamniotic prostaglandins and the synergistic action of oxytocin, в кн.: Advanc. in Biosci., ed. by S. Bergstrom, v. 9, p. 507, Oxford a. o., 1973; Horrobin D. F. Prostaglandins, physiology, pharmacology and chemical significance, Montreal, 1978; The pharmacological basis of therapeutics, ed. by A. G. Gilmar a. o., N. Y., 1980; Practical applications of prostaglandins and their synthesis inhibitors, ed. by S. M. M. Karim, Baltimore, 1979; Prostacyclin, ed. by J. R. Yanea. S. Bergstrom, N. Y., 1979.
B. H. Гончарова (биологическое действие и роль простагландинов в патологии), Е. А. Чернуха (гин.), Г. Я. Шварц (фарм.).