Ингибитор ацетилхолинэстеразы что это
PsyAndNeuro.ru
Смертельный чай: ингибиторы ацетилхолинэстеразы
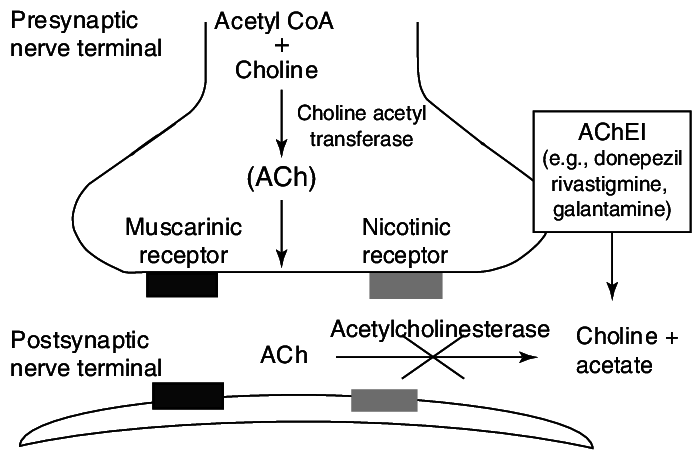
Ацетилхолин является одним из основных нейромедиаторов как в периферической, так и в центральной нервной системе. За его утилизацию в синаптической щели отвечает АХЭ (рис. 1). Соответственно, все вещества, которые прекращают или замедляют активность АХЭ, называются ингибиторами АХЭ и приводят к увеличенной концентрации ацетилхолина в синаптической щели.
Рис. 1 Схема действия АХЭ
Так как ацетилхолин является основным медиатором парасимпатической нервной системы, основные симптомы отравления ингибиторами АХЭ будут проявляться через усиление ее активности, то есть, у человека будет наблюдаться брадикардия, гипотензия, сужение просвета бронхов, также возможна диарея.
При длительном воздействии таких препаратов или при действии особо сильных ингибиторов АХЭ развивается холинергический криз, при котором мышцы не успевают отдохнуть от избыточной стимуляции ацетилхолином и, в результате, перестают на него реагировать. Клинически это проявляется вялым параличом и острой дыхательной недостаточностью. Лечение холинергического криза состоит во введении антагонистов холинергических рецепторов (атропин) и поддержании жизненно важных функций организма при помощи, например, ИВЛ (искусственной вентиляции лёгких). К сожалению, из-за узкой специфики ацетилхолина в центральной нервной системе, предсказать последствия такого отравления для когнитивных способностей является проблематичным.
Ингибиторы АХЭ применяются как в медицине, так и за ее пределами. В медицине ингибиторы АХЭ хорошо известны как лекарства для лечения болезни Альцгеймера, как например галантамин или физостигмин. Данные препараты, как правило, являются обратимыми ингибиторами АХЭ. Проще говоря, они выводят фермент из строя не навсегда.
Самой известной группой таких ядов являются фосфорорганические соединения, сокращенно ФОС. Они широко используются, как в качестве инсектицидов в домашнем хозяйстве (дихлофос относится именно к этой группе веществ), так и в качестве боевых отравляющих веществ.
Механизм ФОС как необратимого ингибитора заключается в том, что они фосфорилируют АХЭ, навсегда выводя этот фермент из строя.
Есть две основные серии нервно-паралитических агентов ФОС: серия G и серия V. Члены одной серии имеют схожие свойства и получают общее имя (например, зарин) и идентификатор НАТО (например, GB). Агенты серии G известны как нестойкие, а агенты серии V – стойкие.
Серия G названа так потому, что их первыми синтезировали немецкие ученые (G как указание на страну – Germany). Все соединения этого класса были обнаружены и синтезированы во время Второй мировой войны или незадолго до нее под руководством Герхарда Шрадера (позже под руководством компании IG Farben ).
Эта серия является первым семейством нервно-паралитических агентов. Первым синтезированным нервно-паралитическим агентом был GA (табун) в 1936 году, за ним последовал GD (зоман) в 1944 году и, наконец, GF (циклозарин) в 1949 году.
Газ зарин, печально известный после террористической атаки секты Аум Синрикё в токийском метро также относится к ФОС G-серии и был синтезирован в 1939 году.
Рис. 2 боеголовка американской ракеты Honest John с зариновыми бомбами M134 (ок. 1960 г.)
V-серия является вторым семейством нервно-паралитических агентов и включает пять хорошо известных представителей: VE, VG, VM, VR и VX, а также еще несколько малоизвестных аналогов.
Самый изученный агент в этой семье, VX, был изобретен в 1950-х годах в Портон-Дауне в Соединенном Королевстве. Ранаджит Гош, химик из Лаборатории защиты растений компании Imperial Chemical Industries (ICI), исследовал класс органофосфатных соединений (фосфорорганические эфиры замещенных аминоэтантиолов). Как и Шредер, Гош обнаружил, что это довольно эффективные пестициды. В 1954 году ICI выпустила на рынок один из них под торговой маркой Amiton. Впоследствии его отозвали, так как он был слишком токсичным и не подходил для безопасного использования. Токсичность не осталась незамеченной, и некоторые из наиболее токсичных материалов были отправлены в исследовательский центр британских вооруженных сил в Портон-Дауне. После завершения оценки несколько членов этого класса соединений стали новой группой нервно-паралитических агентов, V-агентами (в зависимости от источника, V обозначает Победа (Victory), Ядовитый (Venomous) или Вязкий (Viscous)). [5]
Самым известным из них, вероятно, является VX. Все V-агенты являются стойкими агентами, а это означает, что они не разлагаются и не смываются, а следовательно, могут оставаться на одежде и других поверхностях в течение длительного времени. По консистенции эти средства похожи на масло.
VX был использован сектой Аум Синрикё в покушении на двух человек, один из которых скончался[1]. Также с помощью VX 13-го февраля 2017-го года был убит единокровный брат Ким Чен Ына – Ким Чон Нам [2], [3].
Часть веществ серии “Новичок” превосходят по мощности газ VX в пять или восемь раз [4]. Все вещества серии “Новичок” являются бинарными агентами, это означает, что непосредственно перед применением яда, его прекурсоры смешиваются. Прекурсоры, как правило, значительно менее опасны, чем сами агенты, поэтому этот метод значительно упрощает транспортировку яда. Кроме того, прекурсоры обычно намного легче стабилизировать, чем сами агенты, поэтому этот метод также позволяет увеличить срок хранения агента.[6]
Серия “Новичок” получила широкую известность после отравления Сергея Скрипаля и его дочери Юлии 4 марта 2018 года в г. Солсбери.
Эта статья не является расследованием состояния Алексея Навального. Она лишь поверхностно описывает группы веществ, которые, по мнению врачей клиники Шарите, ответственны за нынешнее состояние его здоровья.
Авторы текста: Коровин А.С., Алмазова Т.А.
Лечение психических расстройств (ингибиторы холинэстеразы)
Ингибиторы холинэстеразы также имеют названия ингибиторов ацетилхолинэстеразы (AChE) или антихолинэстераз.Они представляют собой группу препаратов, которые блокируют нормальное расщепление ацетилхолина (АХ) на ацетат и холин и тем самым увеличивают как уровни, так и продолжительность действия ацетилхолина в центральной и периферической нервной системе. Ингибиторы ацетилхолинэстеразы чаще всего используют при лечении нейрогенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и деменция тела Леви. Различные физиологические процессы при этих дегенеративных нарушениях разрушают клетки, которые продуцируют АХ, и тем самым снижают холинергическую передачу в разных областях мозга. Препараты, ингибирующие холинэстеразу, ингибируют активность AChE и поддерживают уровень ACh, уменьшая скорость его распада.
Кроме того, ингибиторы холинэстеразы часто используются у пациентов с миастенией. Повышенный уровень ацетилхолина в нервно-мышечном соединении, следовательно, приводит к повышенной активации рецепторов ACh, обнаруженных на постсинаптических мембранах, что приводит к улучшению мышечной активации, сокращения и силы. В конце терапии вводят ингибиторы холинэстеразы, чаще всего неостигмин, чтобы обратить вспять эффекты недеполяризующих мышечных агентов, таких как рокуроний.
Ингибиторы холинэстеразы также необходимы для применения при подозрении на антихолинергическое отравление. Симптомы антихолинергического отравления включают вазодилатацию, ангидроз, мидриаз, бред и задержку мочи. Другие менее распространенные показания к применению ингибиторов холинэстеразы включают лечение пациентов с диагнозом определенных психических расстройств, таких как шизофрения, и лечение глаукомы путем сброса давления водянистой влаги.
Ингибиторы холинэстеразы функционируют, подавляя холинэстеразу от гидролиза ацетилхолина до компонентов ацетата и холина, что позволяет увеличить доступность и продолжительность действия ацетилхолина в нервно-мышечных соединениях. Фермент холинэстераза имеет два активных сайта: анионный сайт, образованный триптофаном, и эстерактический сайт, образованный серином. Ингибиторы холинэстеразы, такие как органофосфаты, препятствуют расщеплению холинэстеразы ацетилхолином путем взаимодействия с сайтинэстерактическим сайтом. В результате ацетилхолин будет продолжать накапливать и активировать связанные рецепторы.
Ингибиторы холинэстеразы классифицируют как обратимые, необратимые или псевдообратные. Обратимые ингибиторы холинэстеразы обычно используются в терапевтических целях. Напротив, необратимые и псевдообратимые ингибиторы часто используются в пестицидах и для биологической войны (нервные агенты).
Ингибиторы холинэстеразы увеличивают общее количество доступного ацетилхолина. Таким образом, могут присутствовать симптомы чрезмерной стимуляции парасимпатической нервной системы, такие как повышенная гиперчувствительность, гиперсекреция, брадикардия, миоз, диарея и гипотония.
Из-за способности повышать тонус блуждающего нерва через активацию парасимпатической нервной системы необходимо соблюдать осторожность при назначении ингибиторов холинэстеразы лицам, страдающим брадикардией или заболеваниями сердечной проводимости, такими как синдром слабости синусового узла. Эти люди подвергаются риску обморока и падений. Осторожность также рекомендуется пациентам, принимающим антигипертензивные препараты в связи с возможностью развития тяжелой гипотонии. Кроме того, ингибиторы холинэстеразы также противопоказаны пациентам с язвой желудка из-за повышенного риска желудочно-кишечных кровотечений. Пациенты с задержкой мочи также не должны получать ингибиторы холинэстеразы из-за риска повышенной задержки. Этот эффект особенно заметен у пациентов, проходящих лечение от деменции и болезни Альцгеймера, поскольку недержание мочи является частой клинической особенностью у этих пациентов. Назначение пациентам с предшествующими аллергиями или повышенной чувствительностью к ингибиторам холинэстеразы и ее производным также противопоказано.
Ингибитор ацетилхолинэстеразы что это
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Роль антихолинэстеразных средств в оптимизации лечения цереброваскулярных заболеваний (теоретические предпосылки и клиническая феноменология)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(8-2): 57-64
Живолупов С. А., Бардаков С. Н., Самарцев И. Н., Гневышев Е. Н. Роль антихолинэстеразных средств в оптимизации лечения цереброваскулярных заболеваний (теоретические предпосылки и клиническая феноменология). Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(8-2):57-64.
Zhivolupov S A, Bardakov S N, Samartsev I N, Gnevyshev E N. The role of cholinesterase inhibitors in optimization of brain`s vascular pathology treatment (theoretical basis and clinical phenomenology). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(8-2):57-64.
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Холинергическая нейротрансмиттерная система является наиболее распространенной в организме человека. Ацетилхолин обеспечивает взаимодействие нейронов центральной нервной системы, а также обусловливает передачу нервных импульсов от периферических нейронов к органам эффекторам. Результаты исследований последних лет продемонстрировали значимость дисфункции холинергической системы в развитии целого комплекса неврологических заболеваний. Oдной из наиболее широко используемых групп фармакологических средств для их лечения являются ингибиторы холинэстеразы. В обзоре рассмотрены особенности препаратов этой группы и их практическое применение при сосудистых заболеваниях нервной системы.
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Кафедра нервных болезней Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
Военно-медицинская академия, Санкт-Петербург
Реализация национальной программы по борьбе с инсультами значительно расширила современные представления о патогенезе, своевременной диагностике и рациональной терапии цереброваскулярных заболеваний (ЦВЗ). В частности, общепризнанной считается парадигма агрессивной стратегии консервативной терапии, направленной на контроль факторов риска ЦВЗ и нейропротекцию.
М-холинорецепторы. Мускариновые рецепторы являются метаботропными, сопряженными и состоят из одной полипептидной цепи длиной 440-540 остатков аминокислот с внеклеточным N-концом и внутриклеточным С-концом. Аминокислотная последовательность в этих отрезках является очень консервативной (более 90% совпадений) во всех пяти типах мускариновых рецепторов. На третьей внутриклеточной петле, а также на С-конце рецепторной молекулы расположено несколько последовательных отрезков, на которых происходит фосфорилирование при передаче нервного импульса. Ацетилхолин связывается с участком, который находится в складке, сформированной спирально закрученными трансмембранными доменами [4].
М-холинорецепторы расположены в постсинаптической мембране клеток эффекторных органов у окончаний постганглионарных холинергических (парасимпатических) волокон. Кроме того, они имеются на нейронах вегетативных ганглиев и в ЦНС (табл.1, см. рис.1) [4].
Пресинаптические М-холинорецепторы локализуются на симпатических сосудосуживающих нервах. Их активация сопровождается снижением выброса норадреналина в ответ на нервные импульсы. Введение эфиров холина приводит к расширению сосудов. Точек приложения у этих веществ несколько: холинорецепторы тормозных синапсов на пресинаптических симпатических окончаниях и холинорецепторы на сосудах, расположенные вне синапсов. Сосудорасширяющее действие ацетилхолина возможно только при неповрежденном эндотелии. Активация М-холинорецепторов эндотелия приводит к выделению из него NО (эндотелиального фактора расслабления сосудов). Диффундируя от эндотелия к гладким мышцам, NО вызывает расширение сосудов [5].
Холинергические волокна направляются во все слои коры головного мозга; самая высокая плотность холинергических волокон наблюдается в первом и втором слоях, а также в верхней части третьего слоя коры [7]. Мускариновое действие растормаживает клетки пирамидного слоя коры мозга, усиливая внутрислойную передачу информации между группами клеток. Наоборот, никотиновое действие усиливает торможение [8]. Различные зоны коры человеческого мозга различаются по концентрации холинергической иннервации: самая большая плотность аксонов этого типа отмечается в образованиях лимбической системы, к которой относятся миндалевидные ядра и гиппокамп; следующее место по плотности аксонов занимают образования паралимбической области; уни- и гетеромодальные ассоциативные пути коры имеют среднюю плотность холинергических волокон, а основная часть зрительной коры имеет самое незначительное представительство холинергических волокон [9].
В настоящее время установлено, что по мере старения организма происходит угасание активности холинергической системы ЦНС (снижение «холинергического профиля»), приводящее к формированию когнитивных нарушений и всей гаммы проявлений старения. Одной из главных причин данного феномена считается прогрессирующее с возрастом повышение активности холинэстераз [11].
В синапсах АХЭ присутствует в виде тетрамера изоформы T, присоединенного к коллагеноподобному белку, который кодируется отдельным геном COLQ и обеспечивает фиксацию АХЭ на постсинаптической мембране. Мутация этого гена является одной из наиболее распространенных причин наследственной миастении. Кроме этого АХЭ обнаружена в плазматических мембранах эритроцитов (изоформа H) и является Yt-антигеном крови. В нейронах АХЭ может локализоваться внутриклеточно (изоформа T); причем накопление АХЭ внутри ядер клеток нейробластомы приводит к апоптозу [12].
АХЭ и БХЭ различаются по скорости гидролиза ацетилхолина и бутирилхолина, а также по реакции на избирательные ингибиторы. Почти все фармакологические эффекты ингибиторов АХЭ обусловлены подавлением активности именно этого фермента и, как следствие, накоплением эндогенного ацетилхолина в холинергических синапсах и окружающих тканях. ИХЭ являются некоторые природные и синтетические соединения: фосфорорганические соединения (ФОС), эфиры N-алкилкарбаминовых кислот (карбаматы), четвертичные аммониевые основания, гетероциклические соединения, содержащие третичный или четвертичный атом азота. ИХЭ относятся к непрямым холиномиметикам, хотя в высоких дозах многие из них способны непосредственно взаимодействовать с холинорецепторами.
В терапевтических дозах они, в отличие от холиномиметиков прямого действия, усиливают возбуждение всех типов периферических холинорецепторов, а проходящие гематоэнцефалический барьер, также холинорецепторов ЦНС (табл.2) [13].
Ингибиторы АХЭ связываются с тремя доменами фермента: ацильным карманом активного центра, холиновым участком и периферическим анионным участком. Эти же домены определяют различия между АХЭ и БХЭ (табл.3).
По механизму инактивации фермента антихолинэстеразные средства делятся на три группы:
Ингибиторы анионного центра
Применение ингибиторов ацетилхолинэстеразы при лечении заболеваний периферической нервной системы
Опубликовано в журнале:
«Фарматека», 2009, №15, с. 52-55
Е.А. Катунина, О.В. Аванесова, О.Р. Пестовская, Е.К. Абдрахманова, Ю.Н. Бездольный
Кафедра неврологии и нейрохирургии лечебного факультета РГМУ, Москва
Рассматриваются возможности применения ингибиторов ацетилхолинэстеразы, в первую очередь ипидакрина (Аксамона), при лечении заболеваний периферической нервной системы (различных моно- и полиневропатий, невралгий и др.). Подчеркивается, что включение ипидакрина в комплекс лечебных мероприятий при поражениях периферических нервов позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.
Ключевые слова: заболевания периферической нервной системы, невропатии, ингибиторы ацетилхолинэстеразы, ипидакрин
Поражения периферической нервной системы (ПНС) относятся к числу наиболее часто встречающихся заболеваний. Их распространенность, по данным ВОЗ, составляет от 8 до 10 % от общей заболеваемости, на их долю приходится до 50 % заболеваний нервной системы. Высокая частота заболеваний ПНС обусловлена тем, что входящие в ее состав структуры имеют большую протяженность, обычно лишены костной защиты и нередко подвергаются травматизации. Незащищенность ПНС гематоэнцефалическим барьером (ГЭБ) приводит к ее уязвимости при действии токсических и инфекционных агентов. Заболеваниям ПНС подвержены в основном люди трудоспособного возраста. Поэтому скорейшее восстановление нарушенных функций у таких больных является не только медицинской, но и социальной проблемой [8, 12].
К заболеваниям ПНС относят довольно большую группу патологий: фокальные невропатии, множественные невропатии, поли-, радикуло-, полирадикулоневропатии, невралгии. Этиологические факторы, вызывающие повреждение структур ПНС, можно разделить на воспалительные, токсико-аллергические, дисметаболические и травматические. Травматическое повреждение может возникать в результате воздействия внешних факторов или быть обусловленным эндогенными причинами, например сдавлением нерва мышцами, связками, остеофитами (компрессионно-ишемические невропатии). К той же группе можно отнести и повреждения нервных корешков межпозвоночными дисками или костными разрастаниями (радикулоишемии).
Патогенетические факторы могут приводить к валлеровскому перерождению – дегенерации нерва ниже его пересечения, преимущественному повреждению аксона (аксонопатиям) или миелиновой оболочки (миелинопатиям), сочетанному повреждению аксона и миелиновой оболочки (аксономиелинопатиям).
Аксонопатии обычно возникают при токсических и дисметаболических процессах (сахарный диабет, алкоголизм, заболевания печени и почек, дефицит витаминов группы В, интоксикации мышьяком, метиловым спиртом, фосфорорганическими соединениями, угарным газом и т. д.), а также при наличии наследственного дефекта (болезнь Шарко–Мари типа 2).
Развитие аксонопатии характеризуется следующей клинической картиной:
Миелинопатии развиваются вследствие аутоиммунных процессов (синдром Гийена–Барре, хроническая воспалительная демиелинизирующая полиневропатия), токсических факторов (дифтерия), наследственных заболеваний (болезнь Шарко–Мари типа 1).
Для развития миелинопатии характерно:
Восстановление функции периферического нерва или корешка может продолжаться в течение нескольких месяцев или даже лет.
Длительность восстановительного периода во многом определяется адекватностью проводимых лечебных мероприятий, которые должны включать проведение этиопатогенетической терапии, начинаться как можно в более ранние сроки вне зависимости от причины заболевания и решать следующие основные задачи:
Одним из важнейших направлений лечения является активация процессов регенерации и реиннервации, особенно в случае внешнего травматического повреждения нерва или при компрессионно-ишемических процессах. Даже при реконструкции анатомической непрерывности или декомпрессии нервного ствола регенераторный спрутинг протекает очень медленно и требует длительной консервативной терапии. Традиционно для активации процессов реиннервации используются антихолинэстеразные препараты. Кроме того, при поражении ПНС может нарушаться нервно-мышечная передача вследствие разрушения “старых” неэффективных синапсов, поэтому необходима ее стимуляция во вновь образующихся в результате спрутинга синапсах [15].
Механизм действия антихолиностеразных препаратов связан с блокадой ферментов, разрушающих ацетилхолин внутри синаптической щели и, таким образом, повышающих рабочую концентрацию медиатора вблизи постсинаптической мембраны. К числу указанных ферментов относятся ацетилхолинэстераза и бутирилхолинэстераза. Холинергические синапсы локализуются в головном мозге, ПНС, вегетативных ганглиях. Ингибирование распада ацетилхолина в головном мозге приводит к повышению уровня медиатора и улучшению мнестических процессов, что используется для лечения как альцгеймеровской деменции, так и сосудистых когнитивных нарушений [3–6]. Применение ингибиторов ацетилхолниэстеразы при заболеваниях ПНС приводит к стимуляции нервно-мышечной передачи, улучшению проведения импульса по периферическим нервам и вегетативным волокнам. В результате этого повышается сила сокращения скелетных мышц и сократимость гладкомышечной мускулатуры.
В настоящее время существует довольно большой выбор препаратов с антихолинэстеразным действием. Они различаются активностью, способностью проникать через тканевые барьеры, длительностью действия, наличием раздражающих свойств, токсичностью. Так, галантамин, ривастигмин и донепезил хорошо проникают через ГЭБ и используются для лечения когнитивной дисфункции. Прозерин, оксазил и калимин действуют периферически. Среди препаратов этой группы только ипидакрин обладает как центральными, так и периферическими эффектами, что обусловлено оригинальным механизмом его действия.
Ипидакрин представляет собой совместную разработку ВНЦ БАВ (Всероссийский научный центр по безопасности биологически активных веществ) и АО ГИАП (Научно-исследовательский и проектный институт азотной промышленности и продуктов органического синтеза) конца 1980-гг. По химической структуре ипидакрин представляет собой 9-амино-2,3,5,6,7,8-гесагидро-1Н-циклопентанхолина гидрохлорид моногидрат [11]. В СССР ипидакрин выпускался под торговым названием Амиридин. В настоящее время выпуск ипидакрина в России восстановлен фармацевтической компанией ПИК-ФАРМА под торговой маркой “Аксамон” в виде таблеток по 20 мг.
Механизм действия ипидакрина связан с блокадой ацетилхолинэстеразы в головном мозге и нервно-мышечных синапсах, а также с избирательной блокадой калиевых каналов мембран, что опосредованно увеличивает скорость вхождения ионов кальция в окончание аксона [11]. Именно влияние ипидакрина на транспорт ионов калия, по-видимому, является основным механизмом действия препарата. Блокада калиевых каналов вызывает удлинение периода возбуждения в пресинаптическом волокне во время прохождения нервного импульса, обеспечивает выход больших количеств ацетилхолина в синаптическую щель. Следует также отметить, что антихолинэстеразный эффект ипидакрина отличается кратковременностью (20–30 минут) и обратимостью, в то время как блокада калиевой проницаемости мембраны обнаруживается в течение 2 часов после введения препарата. В меньшей степени ипидакрин блокирует активность натриевых каналов. С действием ипидакрина на натриевую проницаемость мембраны можно частично связать его слабые седативные и анальгетические свойства.
В ряде исследований показано, что ипидакрин обладает свойствами частичного агониста М2-холинергических рецепторов, располагающихся в нервной и кардиальной тканях [6]. Этот эффект носит дозозависимый характер, и именно с ним связано влияние ипидакрина на механизмы нейропластичности. В настоящее время имеется опыт применения ипидакрина в восстановительном периоде инсульта, травматической болезни головного мозга, при нейродегенеративных процессах [9, 10]. Предполагается влияние ипидакрина не только на ацетилхолинергическую, но и ГАМКергическую системы, а также обмен катехоламинов.
Максимальная концентрация препарата в крови достигается через час после перорального приема, период полувыведения составляет 0,7 часа. Ипидакрин на 40–55 % связывается с белками крови, адсорбируется преимущественно из 12-перстной кишки, в меньшей степени – из желудка и кишечника. Элиминируется через почки и внепочечные механизмы (биотрансформация, секреция с желчью).
Результаты многочисленных исследований показали эффективность включения ипидакрина в комплекс лечения различных заболеваний ПНС [1, 2, 5, 7, 13, 14]. Прежде всего ипидакрин эффективен при компрессионно-ишемических и травматических поражениях периферических нервов и невропатии лицевого нерва. Назначение ипидакрина больным с нейропатиями конечностей в дополнение к сосудистой терапии и назначению витаминов группы В в дозе 40–80 мг/сут позволило сократить длительность восстановительного периода в среднем на 6,7 ± 2,1 дня [13]. Увеличивалась доля пациентов с наиболее полным восстановлением нарушенных функции. При своевременно начатом лечении эффект отмечен к 14–19-му дню [13, 14]. Положительная клиническая динамика подтверждалась результатами электрофизиологических исследований – электронейро- и электромиографии. Большинство авторов отмечают, что на фоне лечения ипидакрином увеличивались амплитуда М-ответа в мышцах кистей и стоп, амплитуда и длительность потенциалов двигательных единиц, уменьшалась резидуальная латентность, что указывает на активизацию процессов реиннервации [5, 13, 14]. Показатель резидуальной латентности отражает состояние окончаний двигательных аксонов. Снижение этого показателя демонстрирует улучшение аксональной трофики и рассматривается как хороший прогностический признак. Рядом авторов при длительном применении ипидакрина отмечено повышение скорости распространения возбуждения по периферическим нервам. Скорость распространения отражает активность ремиелинизирующих процессов и является более инертным показателем. В исследовании, проведенном на кафедре неврологии ММА им. И.М. Сеченова, отмечена эффективность назначения ипидакрина в дозе 60 мг/сут в течение 6 недель больным с диабетической полиневропатией [15].
Отдельно следует остановиться на возможностях применения ипидакрина у больных с невропатией лицевого нерва, обусловленной компрессионно-ишемическим процессом в области фаллопиева канала. Назначение антихолинэстеразных препаратов, в частности прозерина, этой категории больных часто сопряжено с опасностью развития вторичных контрактур. В опубликованных исследованиях, посвященных этому вопросу, ни у одного больного, получавшего ипидакрин в комплексной терапии в дозе 40–60 мг/сут, развитие мышечных контрактур не отмечено [1, 5, 13, 14]. В связи с этим ипидакрин можно назначать начиная с первых дней заболевания. На фоне приема ипидакрина увеличивался процент больных с полным восстановлением функций лицевого нерва, уменьшались сроки регресса пареза мимических мышц.
Накоплен большой опыт применения ипидакрина у пациентов с дорсопатиями поясничного отдела позвоночника. На фоне назначения ипидакрина отмечено достоверное снижение степени выраженности болевого синдрома, нарушений поверхностной чувствительности [2, 7]. Регресс болевого и других сенсорных симптомов, по-видимому, связан с блокадой К+/Na+-каналов. Именно с блокадой натриевых каналов связывают один из механизмов противоболевого эффекта габапентина. Вероятно, ипидакрин за счет удлинения периода реполяризации пресинаптической мембраны способен блокировать эктопические очаги и эфаптическую передачу возбуждения, которые являются причиной формирования боли, парестезий, крампи. Уменьшение крампи – это особенность действия ипидакрина, которая была отмечена в нескольких исследованиях: при диабетической полиневропатии, у больных с миастенией [5, 15].
Изучалась эффективность ипидакрина у больных миастенией и синдромом Ламберта–Итона. Курсовое назначение препарата в ряде случаев сопровождалось улучшением состояния, длительной ремиссией заболевания. Сравнение эффекта от однократного введения ипидакрина и прозерина показало, что ипидакрин начинал действовать в среднем на 5–10 минут позже, его действие было слабее, чем у прозерина, но продолжалось дольше – в среднем 3–5 часов. Прозерин заканчивал свое действие через 2,0–2,5 часа после введения. В целом эффективность ипидакрина при лечении миастении в монотерапии уступает таковой классических антихолинэстеразных препаратов, что отражает вторичность ингибирования ацетилхолинэстеразы в механизмах действия ипидакрина [5, 14].
Ипидакрин отличается хорошей переносимостью. Побочные эффекты сходны с таковыми группы ингибиторов ацетилхолинэстеразы и связаны с активацией М-холинорецепторов, но проявляются реже. Чаще всего встречаются тошнота, головокружение, увеличение частоты стула, усиление перистальтики. Побочные эффекты чаще всего возникают в начале терапии и проходят самостоятельно, либо при снижении дозы.
По данным клинических исследований, терапия ипидакрином не сопровождается отрицательной динамикой лабораторных показателей, изменениями артериального давления, частоты сердечных сокращений, ЭКГ, развитием гепатотоксичности [1, 2, 5–7, 9, 13–15]. Вместе с тем следует с осторожностью назначать ипидакрин больным со склонностью к брадикардии, при стенокардии. Ипидакрин противопоказан при эпилепсии, различных видах экстрапирамидных гиперкинезов, бронхиальной астме, в период беременности и лактации.
Таким образом, ипидакрин (Аксамон) представляется весьма эффективным препаратом для лечения моно- и полиневропатий различного генеза, невропатии лицевого нерва, дорсопатий. Включение ипидакрина в комплекс лечебных мероприятий позволяет повысить результативность лечения, сократить сроки восстановительного периода и не сопровождается риском развития мышечных контрактур. Помимо положительного влияния на восстановление проведения импульса по периферическим нервам и процесс реиннервации ипидакрин обладает противоболевым эффектом. Хорошая переносимость препарата позволяет рекомендовать его широкому кругу пациентов, в т. ч. и пожилого возраста с сопутствующей патологией.
ЛИТЕРАТУРА
1. Батышева Т.Т., Костенко Е.В., Бойко А.Н. Комплексное лечение невропатии лицевого нерва с применением нейромидина и антиоксидантой терапии // Психиатрия и психофармакотерапия. 2004. Т. 6. № 4. С. 199-202.
2. Бойко А.Н., БатышеваТ.Т. и др. Применение препарата аксамон в комплексной реабилитации больных с двигательными нарушениями при патологии поясничного отдела позвоночника // Журнал неврологии и психиатрии им. С.С. Корсакова. 2008. Т. 108. № 9. С. 45-47.
3. Букатина Е.Е., Смирнов О.Р., Григорьева И.В. Эффективность нейромидина при мультиинфарктной деменции // Социальная и клиническая психиатрия. 1992. Т. 2. С. 126-133.
4. Букатина Е.Е., Григорьева И.В., Сокольчик Е.И. Эффективность амиридина при сенильной деменции альцгеймеровского типа // Журнал неврологии и психиатрии им. С.С. Корсакова. 1991. № 9. С. 53-58.
5. Гехт Б.М. Нейромидин в лечении заболеваний периферического нейромоторного аппарата // Доктор Ру. 2003. С. 3-5.
6. Дамулин И.В. Использование ипидакрина (аксамона) в неврологической практике // Трудный пациент. 2007. Т. 5. № 11. С. 15-20.
7. Дзяк Л.А., Зорин Н.А. и др. Результаты комплексного лечения больных с радикулопатией и радикулоишемией, обусловленными патологией межпозвоночных дисков поясничного отдела позвоночника, с включением препарата нейромидин // Украинский нейрохирургический журнал. 2004. № 4. С. 98-101.
8. Жулев Н.М. Невропатии. Руководство для врачей. СПб., 2005.
9. Катунина Е.А. Холинергическая терапия в восстановительном периоде ишемического инсульта. Атмосфера // Нервные болезни. 2008. № 3. С. 2-8.
10. Козелкин А.А., Сикорская М.В., Козелкина С.А. Опыт применения препарата нейромидин у больных с ишемическими инсультами в остром и раннем восстановительном периоде // Украинский вестник психоневрологии. 2004. Т. 12. № 2. С. 12-14.
11. Лаврецкая Э.Ф. Амиридин. М., 1995. 22 с.
12. Левин О.С. Полиневропатии. Клиническое руководство. М., 2006. 496 с.
13. Парпалей И.А. и др. Применение нейромидина в комплексной терапии заболеваний периферической нервной системы // Украинский вестник психоневрологии. 2003. Т. 11. № 1(34).
14. Санадзе А.Г., Касаткина Л.Ф., Самойлов М.И. Применение нейромидина в лечении заболеваний периферической нервной системы // Атмосфера. Нервные болезни. 2003. № 3. С. 17-18.
15. Строков И.А., Зиновьева О.Е., Баринов А.Н. и др. Нейромидин в лечении диабетической невропатии // Неврологический журнал. 2007. Т. 12. № 6. С. 52-55.