Ингибитор протеолиза что это
Антисекреторные препараты в комплексном лечении острого панкреатита
Острый панкреатит – острое асептическое воспаление ткани поджелудочной железы демаркационного типа, в основе которого лежат острая дистрофия, ферментная аутоагрессия с некробиозом панкреатоцитов и последующим исходом в некроз ткани железы и окружающих структур с присоединением эндогенной вторичной гнойной инфекции или в склероз поджелудочной железы с атрофией ее железистого аппарата.
В современной клинике ургентной хирургии острый панкреатит занимает третье место по числу экстренно госпитализированных больных, уступая лишь острому аппендициту и острому холециститу. Несмотря на постоянное совершенствование лечебной тактики и внедрение новых диагностических и лечебных технологий, на протяжении последнего десятилетия летальность при остром панкреатите колеблется в пределах 7-15%, а при деструктивных формах панкреатита достигает 40-80%.
На сегодняшний день опубликовано колоссальное количество работ, посвященных проблеме острого панкреатита. Однако до сих пор большинство положений относительно этиологии, патогенеза, классификации и лечебной тактики при данной патологии остаются весьма дискутабельными. Принято считать, что острый панкреатит является полиэтиологическим заболеванием. При этом американские авторы основной его причиной считают злоупотребление алкоголем, немецкие – желчнокаменную болезнь, китайские и вьетнамские авторы – аскаридоз. Тем не менее, традиционно выделяют две группы этиологических факторов данного заболевания. К первой группе относятся факторы, определяющие нарушение оттока панкреатического секрета из ацинусов по внутридольковым протокам в главный панкреатический проток и далее в ДПК, что приводит к резкому повышению давления в протоковой системе поджелудочной железы (гипертензионно-протоковые факторы). Внутрипротоковая гипертензия возникает при спазме, воспалительных, рубцовых и неопластических стенозах большого дуоденального сосочка, том числе и сфинктера Одди, холедохолитиазе. Спазм сфинктера Одди может быть следствием как различных нервно-рефлекторных влияний с рецепторов гепатогастродуоденальной зоны, так и непосредственного раздражения симпатического и парасимпатического отделов нервной системы. Возбуждение блуждающего нерва обуславливает гиперсекрецию панкреатического сока, спазм сфинктера Одди, возникновение стаза и гипертензии в системе панкреатических протоков. Установлено, что длительный прием алкоголя в относительно больших дозах непосредственно вызывает повышение давления в мелких протоках поджелудочной железы. Этиологические факторы, относящиеся ко второй группе, приводят к первичному поражению ацинарных клеток в условиях нормального внутрипротокового давления (первично ацинарные факторы). Известно, что первичное поражение ацинарных клеток поджелудочной железы может возникать при локальных расстройствах гемоперфузии, аллергических реакциях, метаболических нарушениях, гормональном дисбалансе, токсических воздействиях, инфекциях, травме поджелудочной железы. Роль алиментарного этиологического фактора острого панкреатита может быть сведена к следующему. Пища, богатая белками и жирами, алкоголь вызывают выраженную секрецию панкреатического сока, богатого белком и бедного бикарбонатами, что при неадекватном оттоке может служить причиной развития алиментарного панкреатита.. Усиленная секреторная деятельность ацинарных клеток при чрезмерных пищевых раздражениях или при употреблении бедной белком пищи сопровождается необратимыми внутриклеточными повреждениями ацинарного аппарата и развитием метаболического панкреатита. Отмечено, что чрезмерное употребление богатой белками пищи может приводить к сенсибилизации организма белковыми метаболитами, что приводит к развитию аллергического панкреатита.. Таким образом, основными этиологическими факторами острого панкреатита можно назвать следующие: желчнокаменная болезнь, патология терминального отдела общего желчного протока и БДС, злоупотребление алкоголем, травмы (в т. ч. и операционные) поджелудочной железы, сосудистые заболевания, нарушения обмена веществ, инфекции, интоксикации, аутоаллергические состояния. Экспериментально показано и подтверждено клинически, что наиболее тяжелые формы острого панкреатита развиваются при сочетании трех этиологических факторов:
острой внутрипротоковой гипертензии;
внутриканальцевой активации панкреатических ферментов.
Патогенез острого панкреатита в настоящее время также остается предметом острых дискуссий. Считается, что к развитию острого панкреатита приводит нарушение внутриклеточного образования и транспорта ферментов поджелудочной железы, а также интраацинарная активация проферментов гидролазами. Пусковым механизмом патологических реакций, являющихся основой воспалительно-некротического поражения поджелудочной железы, служит высвобождение из ацинарных клеток активированных панкреатических ферментов, в норме присутствующих в виде неактивных проферментов. При этом сегодня принято считать, что процессы аутолиза первично обусловлены действием именно липолитических ферментов. Активация липаз происходит при контакте проферментов последних с желчными кислотами и энтерокиназами. Данная ситуация возникает при гидравлической деструкции ацинусов вследствие внутрипротоковой гипертензии, которая является, в основном, следствием гиперсекреции поджелудочной железы и билиарно-панкреатического или дуодено-панкреатического рефлюкса при стенозе или недостаточности сфинктера Одди и дуоденальной гипертензии. Предполагается, что алкоголь оказывает не только непосредственный токсический эффект на панкреатоциты, но также вызывает образование белковых микроконгломератов, окклюзирующих мелкие панкреатические протоки. Заметим, что липаза поджелудочной железы не повреждает здоровую клетку. Повреждение обусловлено действием фосфолипазы А, приводящим к деструкции клеточных мембран, что делает возможным проникновение в клетку липазы. При реализации данного механизма формируются локусы жирового панкреонекробиоза с перифокальным демаркационным валом. Если патобиохимический процесс ограничивается этим, то формируется жировой панкреонекроз. В том случае, если при чрезмерном накоплении в ткани железы жирных кислот рН достигает 3, 4-4, 3, происходит трансформация внутриклеточного трипсиногена в трипсин. При этом трипсин активирует проферменты лизосом, а также другие протеиназы, вызывающие протеолиз панкреатоцитов. Активированная эластаза лизирует стенки сосудов, междольковые соединительнотканные перемычки, что способствует быстрому распространению ферментного аутолиза в поджелудочной железе и в окружающих структурах. Под действием трипсина активизируются все проферменты поджелудочной железы (эластазы, карбоксипептидазы, профермент химотрипсина), проферменты калликреин-кининовой системы, фибринолитические ферменты и профакторы гемокоагуляции, что, в конечном счете, приводит к местным и общим патобиохимическим расстройствам с возможным финалом в виде синдрома полиорганной недостаточности. Принято выделять доинфекционную стадию заболевания, при которой формируются асептические воспалительные и некротические очаги, и фазу инфекционных осложнений – инфицированный панкреонекроз, инфицированный панкреонекроз с панкреатогенным абсцессом, забрюшинная флегмона.
Таким образом, одним из основополагающих моментов комплекса патологических реакций, объединяемых понятием «острый панкреатит», служит внутрипротоковая гипертензия в поджелудочной железе. При этом основной составляющей повышения внутрипротокового давления является секреция (в ряде ситуаций – гиперсекреция) панкреатического сока.
Традиционной классификацией острого панкреатита, принятой практическими хирургами, является клинико-морфологическая классификация, выделяющая острый отечный панкреатит и деструктивные формы панкреатита – жировой панкреонекроз, геморрагический панкреонекроз, а также предусматривающая возможное развитие ранних и поздних осложнений. С. Ф. Багненко, А. Д. Толстой, А. А. Курыгин (2004) выделяют следующие клинические формы острого панкреатита, соответствующие патофизиологической фазности его течения:
I фаза – ферментативная, составляет первые пять суток заболевания. В этот период происходит формирование панкреонекроза различной протяжённости, развитие эндотоксикоза (средняя длительность гиперферментемии составляет 5 суток), а у части пациентов – полиорганной недостаточности и эндотоксинового шока. Максимальный срок формирования панкреонекроза составляет трое суток, после этого срока он в дальнейшем не прогрессирует. Однако при тяжёлом панкреатите период формирования панкреонекроза гораздо меньше (24-36 часов). Целесообразно выделять две клинические формы: тяжёлый и нетяжёлый острый панкреатит.
II фаза – реактивная (2-я неделя заболевания), характеризуется реакцией организма на сформировавшиеся очаги некроза (как в поджелудочной железе, так и в парапанкреальной клетчатке). Клинической формой данной фазы является перипанкреатический инфильтрат.
III фаза – расплавления и секвестрации (начинается с 3-ей недели заболевания, может длиться несколько месяцев). Секвестры в поджелудочной железе и в забрюшинной клетчатке начинают формироваться с 14-х суток от начала заболевания. Возможно два варианта течения этой фазы:
Следует заметить, что далеко не все авторы разделяют точку зрения об эволюции патоморфологических изменений при остром панкреатите и предполагают возможность возникновения первично-деструктивного процесса (геморрагический панкреонекроз) без предшествующего острого отечного панкреатита и жирового панкреонекроза. Возможно, это связано с тем, что пациенты вследствие известной социальной подоплеки госпитализируются уже на стадии геморрагического панкреонекроза или при наличии гнойных осложнений. Тем не менее, большинством исследователей поддерживается мнение о преемственности морфологических фаз острого панкреатита. Так, M. Schein (2004) называет панкреатит «болезнью четырех недель». И это вполне объяснимо, как с точки зрения патоморфологии, так и с прагматичной точки зрения практикующего американского хирурга. Действительно, первые две недели – настойчивое комплексное консервативное лечение, в последующем периоде – оперативные вмешательства от малоинвазивных (лапароскопия, транспариетальные пункции) до весьма агрессивных (некрсеквестрэктомия, оментопанкреатобурсостомия, вскрытие панкреатогенных абсцессов и флегмоны забрюшинного пространства). Поскольку в рамках настоящего раздела автор не ставил своей целью продолжение дискуссии о лечебной тактике при остром панкреатите (прежде всего – о показаниях, сроках и объеме оперативного пособия), основное внимание уделено вопросу консервативного лечения пациентов с данной патологией. Следует отметить, что, по мнению целого ряда авторов (А. Д. Толстой, 2003, M. Schein, 2004), именно патогенетически обоснованная комплексная консервативная терапия при остром панкреатите имеет решающее значение для исхода заболевания. Это особенно актуально при остром отечном панкреатите, поскольку предотвращает переход данной формы панкреатита в панкреонекроз. Не менее актуальной является интенсивная консервативная терапия при уже сформировавшихся очагах жировой или геморрагической деструкции, предупреждающая в данном случае распространение воспалительно-некротических очагов на ранее интактную ткань. Кроме того, учитывая первичную асептичность процесса при остром панкреатите в начальный период заболевания с позиций здравого смысла целесообразно именно активное терапевтическое лечение, направленное на купирование патологических процессов в самой поджелудочной железе, предупреждение и лечение синдрома панкреатогенной токсемии, профилактику гнойно-септических осложнений.
В настоящее время принципиальные положения консервативного лечения острого панкреатита изложены во всех руководствах по неотложной абдоминальной хирургии. Позволим напомнить их читателю с некоторыми комментариями. Итак, при остром панкреатите показаны:
В работах различных авторов за последние пять-десять лет отчетливо прослеживается эволюция лечебной тактики у больных с острым панкреатитом от агрессивной хирургической до консервативной выжидательной. Современный подход к лечению больных острым панкреатитом диктует необходимость выбора конкретного варианта проводимой терапии с учетом стадийности течения панкреатита, принимая во внимание динамику лабораторных показателей и данных инструментальных исследований – ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография.
Следует отметить, что непременным условием лечения пациентов с любой клинико-морфологической формой острого панкреатита является соблюдение главного условия – создания покоя для поджелудочной железы. Это достигается путем подавления продукции ферментов панкреатоцитами, вследствие чего значительно уменьшается выделение ферментов, лизирующих белки (трипсин, химотрипсин, эластаза) и фосфолипидные мембраны клеток (фосфолипазы, холестеролэстераза). Таким образом, состояние покоя панкреатоцита способствует регрессу аутолиза и предупреждает некротические изменения тканей. В этой связи в комплексной терапии острого панкреатита ведущее место занимают препараты, прямо или косвенно угнетающие экзокринную функцию поджелудочной железы. Максимальный лечебный эффект достигается при синергичном подавлении синтеза ферментов на уровне поджелудочной железы, выведении и инактивации уже циркулирующих в крови энзимов.
Исторически первым классом соединений, используемым с этой целью при остром панкреатите, явились цитостатики – 5-фторурацил, тегафур. Недостатком этих препаратов является угнетение лейкопоэза, нарушение иммуногенеза, возникновение гипо- и диспротеинемии. Применение данных препаратов оправдано при верифицированном панкреонекрозе с целью максимального подавления секреторной функции поджелудочной железы и тем самым снижения уровня панкреатических ферментов в плазме. Ранее для ингибирования секреции поджелудочной железы широко применялись препараты класса ингибиторов протеаз, но в настоящее время установлено, что препараты ингибиторов протеаз активны лишь в крови. Ингибиторы протеаз в ткань поджелудочной железы, как правило, не попадают в достаточных концентрациях и не могут эффективно осуществлять свою функцию по отношению к ферментам поджелудочного сока. Кроме того, ингибиторы протеаз обладают аутоиммунизирующим действием. Для угнетения экзокринной функции поджелудочной железы оправдано применение агонистов опиоидных рецепторов (даларгин), избирательно накапливающихся в панкреатоцитах и угнетающих синтез панкреатических проферментов. Близким по механизму действием обладает панкреатическая рибонуклеаза, разрушающая матричную РНК клеток, за счет чего ингибируется синтез белков панкреатоцитами. К препаратам выбора при остром панкреатите относится синтетический аналог гормона соматостатина – октреотид, оказывающий выраженное ингибирующее действие на экзокринную функцию поджелудочной железы за счет активации специфических D-рецепторов панкреатоцитов. Основными направлениями его действия являются ингибирование базальной и стимулированной секреции поджелудочной железы, желудка, тонкой кишки, регуляция активности иммунной системы, выработки цитокинов, цитопротективный эффект. Кроме того, октреотид таким же образом действует на париетальные и главные клетки желудка, способствуя снижению кислотообразования. Обычный режим дозирования октреотида 300-600 мкг/сут. при трехкратном внутривенном или подкожном введении.
Патогенетически обоснованным методом ингибирования секреции поджелудочной железы является применение средств, снижающих желудочную секрецию – антисекреторных препаратов. Для понимания механизма действия антисекреторных препаратов при остром панкреатите следует коротко остановиться на регуляции секреции поджелудочной железы. Регуляция секреции сока поджелудочной железы осуществляется нейрогуморальными механизмами, причем основное значение отводится гуморальным факторам – гастроинтестинальным гормонам (секретин, холецистокинин-панкреозимин), активизирующихся с участием рилизинг-пептидов, секретируемых в слизистой оболочке двенадцатиперстной кишки. Секретин усиливает продукцию жидкой части сока, а холецистокинин-панкреозимин стимулирует ферментативную активность поджелудочной железы. Инсулин, гастрин, бомбензин, соли желчных кислот, серотонин также усиливают секреторную активность железы. Выделение панкреатического сока тормозят: глюкагон, кальцитонин, соматостатин. Процесс панкреатической секреции включает в себя три фазы. Цефалическая (сложнорефлекторная) фаза обусловлена преимущественно рефлекторным возбуждением блуждающего нерва. Желудочная фаза связана с эффектами блуждающего нерва и гастрина, секретируемого антральными железами при поступлении пищи в желудок. Во время кишечной (интестинальной) фазы, когда кислый химус начинает поступать в тонкий кишечник, скорость панкреатической секреции становится максимальной, что, в первую очередь, связано с выделением клетками слизистой кишечника секретина и холецистокинина. Таким образом, имеется прямая связь между секрецией соляной кислоты париетальными клетками желудка, снижением интрадуоденального рН, выработкой секретина слизистой двенадцатиперстной кишки и увеличением секреции панкреатического сока. Именно поэтому для ингибирования секреции панкреатического сока, снижения внутрипротокового давления в поджелудочной железе и, в конечном счете, для уменьшения внутрипанкреатической активации ферментов используют меры, направление на подавление секреции соляной кислоты в желудке – физиологического стимулятора секреции поджелудочной железы. Снижение кислотности желудочного сока обусловливает менее выраженное закисление двенадцатиперстной кишки, вследствие чего уменьшается выделение секретина – основного гормона, стимулирующего экскреторную функцию поджелудочной железы.
Следует отметить, что, несмотря на широкое (а в ряде клиник – облигатное) использование антисекреторных препаратов для терапии больных с острым панкреатитом, систематические исследования по данному вопросу ни в России, ни за рубежом не проводились. Из отдельных сообщений известно, что:
Учитывая тот факт, что для исключения ацидификации двенадцатиперстной кишки интрагастральный рН должен быть не ниже 4, оптимальным режимом применения парентеральной формы омепразола (Лосек) при остром панкреатите следует считать болюсное введение 80 мг препарата с последующей непрерывной инфузией со скоростью 4 мг/ч.
Необходимость применения антисекреторных препаратов при остром панкреатите обусловлена еще двумя обстоятельствами. Очень часто (не менее чем в 20% случаев) острые панкреатиты сочетаются с язвенной болезнью. При этом очевидно наличие как минимум одной причинно-следственной связи: язвообразование – острый панкреатит. Во-первых, возможно развитие воспалительно-некротического процесса в поджелудочной железе вследствие пенетрации язв в головку и тело железы. Во-вторых, язвенная болезнь, как правило, сочетается с выраженными нарушениями моторики двенадцатиперстной кишки, что, реализуясь посредством дуоденальной гипертензии, приводит к формированию дуоденально-панкреатического рефлюкса. В этих сложных клинических ситуациях контроль над кислотообразованием в желудке является одной из основных задач лечения. Поэтому в данном случае применение антисекреторных препаратов, в том числе и длительное, имеет абсолютные показания. Наконец, еще одним показанием для назначения антисекреторных препаратов при остром панкреатите является профилактика стрессового эрозивно-язвенного повреждения, необходимость которой особенно актуальна при тяжелом течении острого панкреатита с развитием крупноочагового панкреонекроза, гнойно-септических осложнений и синдрома полиорганной недостаточности.
В заключение хотим еще раз подчеркнуть, что применение комплекса современных мероприятий интенсивной терапии (антисекреторная терапия, другие ингибиторы секреции поджелудочной железы и протеолитических ферментов, средства детоксикации) у пациентов с острым панкреатитом, с учетом стадийности и индивидуальной динамики заболевания, как и своевременная профилактика гнойных осложнений панкреонекрозов несомненно позволят улучшить результаты лечения больных с острым панкреатитом, сократить пребывание больных в стационаре, уменьшить потребность в проведении инвазивных методов лечения и, самое главное, снизить летальность.
Статья добавлена 29 марта 2016 г.
Голодные химеры: направленный протеолиз в качестве лекарства
Молекула PROTAC одновременно связывает мишень и убиквитинлигазу, которая помечает ее для деградации в протеасоме. Рисунок в полном размере.
Автор
Редакторы
Большинство таргетных препаратов направлено на предотвращение работы белка-мишени путем ингибирования. Новый класс препаратов работает совершенно по другому принципу: он использует клеточную систему деградации белка для того, чтобы уничтожить мишень. PROTAC — протеолиз-таргетированная химера — как мостик связывает белок-мишень с убиквитинлигазой, которая метит его для деградации. Этот класс препаратов открывает новые принципы работы лекарств и мишени, доселе неизвестные. В этой статье спецпроекта о современных лекарствах рассказывается история создания PROTAC’ов и их современное состояние.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
В 1970-х годах в изучении онкологических заболеваний произошел переворот. В 1970 году Питер Фогт и Питер Дюсберг обнаружили трансформирующий фактор вируса саркомы Рауса [1], позже названный v-src. В 1976 году Гарольд Вармус и Майкл Бишоп обнаружили, что в клетках человека есть аналог вирусного src, клеточный ген с-src, который, как оказалось позже, кодирует тирозинкиназу. В последующие годы были идентифицированы и другие онкогены и опухолевые супрессоры: гены, которые контролируют опухолевую трансформацию и прогрессию.
Теперь у исследователей-онкологов появились мишени для направленной терапии и надежда, что можно отойти от токсичных препаратов, которые были единственным доступным средством химиотерапии (в рамка нашего спецпроекта выходила статья о поиске мишеней [2]). В 1980-х годах были предприняты первые попытки ингибировать продукты онкогенов с помощью мышиных антител [3], но такие препараты оказались малоэффективными и вызывали иммунную реакцию. В начале 1990-х случился прорыв [4]: практически одновременно были созданы и одобрены первый киназный ингибитор — иматиниб («Гливек») [5] — и первое антитело — трастузумаб («Герцептин»).
За этим последовал бум ингибиторов киназ и терапевтических антител, в результате которого создали препараты против множества релевантных киназ и поверхностных белков. Однако многие из идентифицированных онкогенов не являются киназами, или даже не обладают ферментативной активностью. Поэтому у них просто нет активного центра, который можно заблокировать низкомолекулярным веществом. Для того чтобы на них воздействовать, приходится использовать сравнительно большие молекулы — ингибиторы белок-белковых взаимодействий (PPI inhibitors), — часто требующие многих сложных методов для подтверждения правильного связывания с мишенью (рентгеноструктурного анализа комплекса, ЯМР и других [6]). Иногда такие мишени оказывались undruggable, то есть не поддающимися воздействию лекарствами.
Жизнь белков внутри клетки сложна и сурова. Как быть, если тебе вручили «черную метку»? На «Биомолекуле» уже немало было сказано про природу этой метки (белка убиквитина): «Вездесущий убиквитин» [8], «“Вездесущий убиквитин” возвращается» [9]; а недавно вышел обзор про протеостаз, передающий весь масштаб жизни и смерти белков: «Война и мир: как устроить белковую жизнь?» [10].
Протеасома
Протеасомную систему деградации открыли в 1970-х годах в лабораториях Аврама Гершко в Хайфе и Ирвина Роуза в Филадельфии. До этих исследований считалось, что белки могут деградировать только неспецифично в лизосомах, без затрат АТФ, несмотря на ряд работ (например Симпсона в 1953-м [11]), показывающих энергозависимую деградацию белков внутри клетки. Гершко и его аспирант Аарон Чехановер обнаружили, что деградация белков осуществляется двумя белковыми комплексами, один из которых деградирует белки (протеасома), а второй помечает их специальными метками, позже идентифицированными как полимеры белка убиквитина [8], направляя их на деградацию. В результате работ этой группы, лаборатории Александра Варшавского и ряда других в 1980-х была полностью идентифицирована система протеасомной деградации.
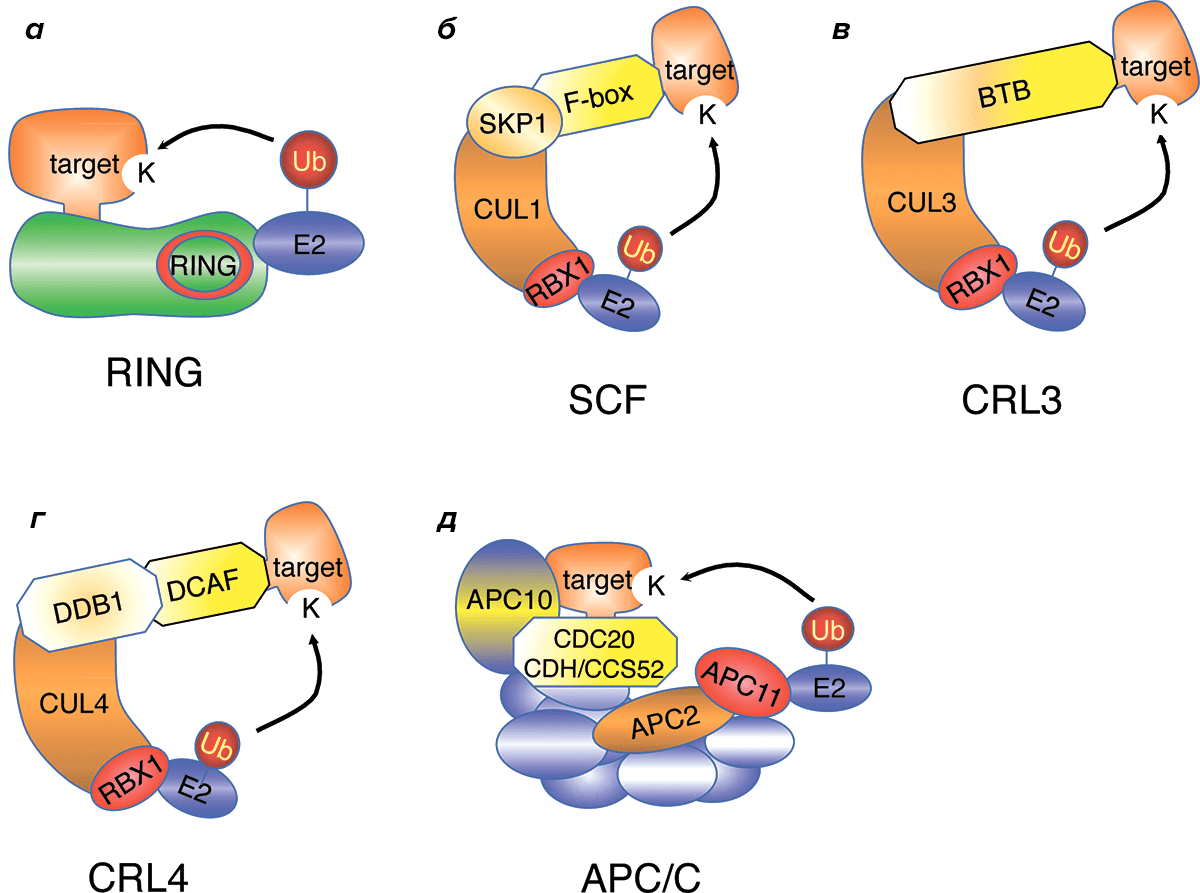
Ключевой частью системы протеасомы выступают ферменты, помечающие белки полиубиквитином. Существуют три группы ферментов, участвующие в этом процессе. E1-ферменты активируют убиквитин и переносят его на убиквитинконъюгирующий фермент E2. Наиболее многочисленны белки E3, которые обеспечивают специфичное связывание комплекса E2 с мишенью для деградации и переносят на нее убиквитиновую метку. Именно их разнообразие позволяет очень точно регулировать время полужизни каждого белка в клетке (рис. 1) [12].
Рисунок 1. Разные классы убиквитинлигаз, вовлеченные в регуляцию клеточного цикла. Мономерные RING-лигазы (а) напрямую связывают убиквитинконъюгирующий фермент E2 и мишень, в то время как SCF/CRL1, CRL3, и CRL4 (б–г) состоят из комплекса скаффолдных белков и RING-белка RBX1. APC/C (д) является огромным мультимерным комплексом, в который входят активирующие белки WD40, RING-доменный белок APC11 и другие.
История PROTAC
В 2001 году группы Реймонда Дешейза и Крейга Крюза придумали, как «натравить» систему протеасомной деградации на новые субстраты. Для этого они создали химерный пептид, состоящий из двух частей:
Получившаяся молекула работала как мостик, который связывал убиквитинлигазу E3 с ее новой мишенью. Исследователи увидели, что молекула не только физически сближает SCFβ-TRCP с новой мишенью, но и обеспечивает ее полиубиквитинилирование, а затем деградацию. Две особенности получившейся молекулы особо ценны:
Статья с описанием работы вышла в PNAS в 2001 году [7], и получившийся класс молекул окрестили PROTAC — proteolysis targeting chimera, или протеолиз-таргетированная химера. Авторы сразу предположили, что PROTAC можно использовать для терапии заболеваний, деградируя белки, участвующие в патогенезе, а также что можно деградировать белки только в определенных клетках и тканях, направляя к ним убиквитинлигазы, которые не синтезируются во всем организме. Однако они также отметили большое ограничение получившейся молекулы — пептидная конструкция не проникает в клетки сама собой.
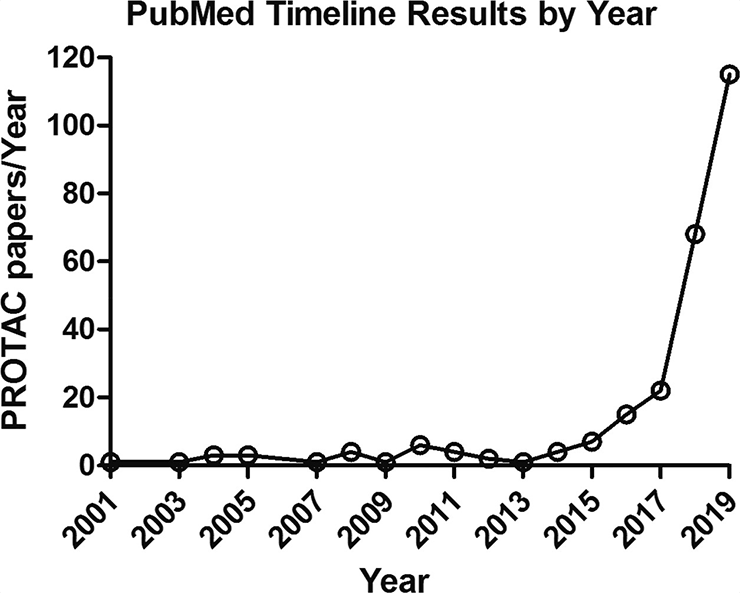
Рисунок 2. Динамика публикаций о PROTAC в Pubmed
Интерес к PROTAC был довольно скромным до 2015 года (рис. 2), однако затем область взорвалась десятками и сотнями статей [13]. Но для этого надо было решить проблему с доставкой в клетку и найти больше молекул, которые могут связывать E3-лигазы. Первый PROTAC, который мог проходить в клетку, был сделан той же парой Дешейза и Крюза, которые использовали пептид из транскрипционного фактора HIF-1α, субстрата E3-убиквитинлигазы VHL, помеченный поли-D-аргинином для проникновения в клетку. Полученный пептид мог направлять андрогеновый рецептор и белок FKBP12 на деградацию.
В лаборатории Крюза решили отойти от использования пептидов, и к 2008 году им удалось создать малую молекулу, которая позволяла деградировать андрогеновый рецептор [14]. Для этого они использовали селективный модулятор андрогеновых рецепторов (SARM), который эффективно связывался с рецептором. Второй частью молекулы был нутлин-3 — вещество, которое разрывало связь p53 c его убиквитинлигазой MDM2, связываясь с последней (рис. 3). Две части соединили ПЭГ-линкером, и получившаяся молекула работала внутри клетки, хотя и с не очень высокой активностью.
Вторым классом E3-лигаз, для которого были найдены низкомолекулярные ингибиторы, стали белки ингибиторы апоптоза IAP и XIAP, у которых также есть убиквитинлигазная активность. Ингибиторы этих белков разрабатывались как антиапоптотические белки, однако их конъюгация с мишенями позволила получить эффективные деградирующие химеры (названные SNIPER [15]).
Коммерциализация и начало клинических испытаний
Молекулы, связывающие убиквитинлигазу VHL, также находились в разработке, и в 2012 году в лаборатории Крюза создали первую малую молекулу, которая могла связывать VHL. В том же 2012 году Крюз основал Arvinas — первую компанию, которая планировала использовать PROTAC в клинике.
Вещества, привлекающие E3-лигазы VHL и CRBN, стали самыми популярными платформами для разработки низкомолекулярных PROTAC. В течение нескольких лет, начиная с 2015 года, были получены PROTAC против эстрогенового рецептора, BCR-ABL, Brd4, разнообразных рецепторных тирозинкиназ и множества других онкологических мишеней. К 2021 году количество описанных PROTAC-молекул увеличилось до 1600, а число мишеней — до 100.
В 2015 году были основаны две другие компании, решившие сделать ставку на использование PROTAC: Kymera Therapeutics и C4 Therapeutics. Рост числа, разнообразия и активности PROTAC привлек внимание крупных фармацевтических компаний: Arvinas заключил партнерские соглашения с Merck и Genentech, C4 — с Roche, а Kymera — с Sanofi.
В 2019 году Arvinas начала первые клинические испытания PROTAC-молекулы ARV110, направленной против того же андрогенового рецептора, в том числе и с мутациями, устойчивыми к имеющимся ингибиторам этого рецептора (например энзалутамиду). Для того чтобы PROTAC достигли клиники, пришлось решить множество проблем с биодоступностью, стабильностью и другими параметрами. Огромные молекулы PROTAC нарушали множество устоявшихся правил медицинской химии (такие как правило пяти Липинского), вначале вызывая ужас технологов и сомнения в том, что эти молекулы могут реально работать в организме. Однако все эти проблемы были решены, и к концу 2021 года количество клинических испытаний PROTAC должно увеличиться до 15 [18].
Среди мишеней PROTAC множество популярных онкологических мишеней: упомянутый выше эстрогеновый и андрогеновый рецепторы; эпигенетические белки BRD4 и BRD9, которые считывают гистоновые метки [19]; транскрипционный фактор STAT3 и другие. Один из клинических кандидатов — DT2216, деградирующий антиапоптотический белок Bcl-xL, — иллюстрирует сильные стороны PROTAC по сравнению с обычными ингибиторами: в свое время разработка ингибиторов Bcl-xL приостановилась из-за того, что тромбоциты гибнут при инактивации Bcl-xL. Решение, ставшее возможным с использованием подхода PROTAC, основано на том, что DT2216 таргетирует этот белок к убиквитинлигазе VHL, которая не производится в тромбоцитах.
У молекул PROTAC обнаружились и неожиданные преимущества — они оказались гораздо активнее, чем простые ингибиторы тех же молекул, работая скорее как катализаторы деградации: после того, как мишень деградировала в протеасоме, PROTAC освобождается для нового раунда связывания. Еще одно преимущество — PROTAС, убирая сам белок (а не только его активность), часто влияют на неферментативные функции своих мишеней, например, на стабилизацию комплексов, в которые они входят. Так, опухолевые линии, не чувствительные к ингибиторам BRD9, оказались очень чувствительными к его деградации.
Кроме онкологических, PROTAC разрабатываются и для других заболеваний. В Kymera сосредоточены на мишенях, важных не только для опухолей, но и для иммунной системы, таких как IRAK4 и вышеупомянутый STAT3. У Arvinas есть ряд молекул, направленных на нейродегенеративные заболевания — в разработке находятся молекулы, деградирующие хантингтин, ɑ-синуклеин и тау-белок. В 2019 году вышло несколько работ, показывающих эффективность тау-направленных PROTAC на животных моделях болезни Альцгеймера [20].
К сожалению, первые результаты клинических испытаний ARV110 немного охладили энтузиазм по поводу PROTAC: несмотря на очень впечатляющие результаты в мышиной модели, лишь у двоих из 22 пациентов наблюдалось значительное сокращение объема опухоли, и у части пациентов — отсутствие дальнейшего прогрессирования заболевания. Однако больше половины пациентов (которые прошли множество предыдущих линий терапии) продолжают получать терапию, и окончательные результаты испытания еще не представлены. Другой претензией скептиков PROTAC является то, что для большинства мишеней, против которых показана активность, уже имеются обычные ингибиторы. Пока обещания найти PROTAC для белков, недоступных для «обычных» ингибиторов, остаются невыполненными.
Другие бифункциональные молекулы
Способность молекул PROTAC привлекать к мишени белок, который ранее с ней не связывался, вызвала интерес — можно ли нацеливать другие ферменты на белки-мишени. Прежде всего были получены молекулы, направляющие мишени на другие пути деградации.
Lysosomal-targeting chimera (LYTAC) и MoDE-A являются модифицированными антителами, которые связывают мишень вне клетки и затем поглощаются эндоцитозом, связываясь с рецепторами (CI-M6PR и ASGPR) через линкерную молекулу. Поглощенный таким образом комплекс из антитела и белка-мишени направляется в лизосому.
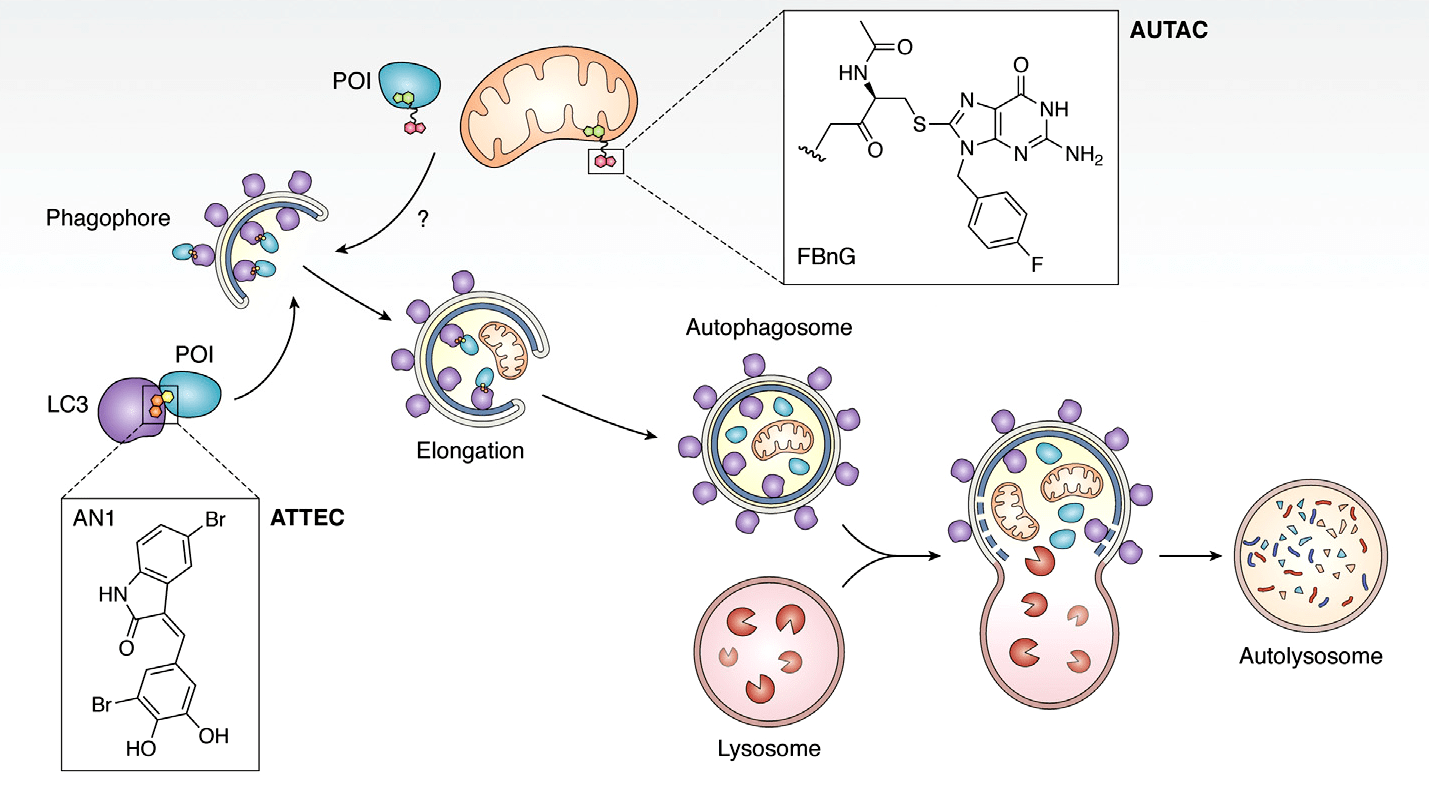
MADTAC-молекулы (macroautophagy degradation targeting chimeras, химера для направленной деградации макроаутофагией) используют еще один путь для деградации — аутофагию [21], [22]: ATTEC-молекулы (autophagosome-tethering compound, соединение, связывающее аутофагосомы) связывают мишень с LC3, компонентом мембраны аутофагосомы, в то время как AUTAC (autophagy-targeting chimera, химера для направленной аутофагии) направляют мишень в аутофагосому с помощью гуаниновой метки по неизвестному механизму [23]. AUTAC-молекулы могут помечать даже целые органеллы (например поврежденные митохондрии) для деградации (рис. 4).
Рисунок 4. Механизмы действия MADTAC (macroautophagy degradation targeting chimeras). ATTEC связывает белок-мишень и компонент аутофагосомы LC3. AUTAC-молекулы содержат гуаниновую метку, которая помечает мишень (в том числе целые органеллы) для включения в аутофагосому.
В 2019 году исследователи из Genentech сделали бифункциональную молекулу, привлекающую фосфатазу к мишени. Получившийся класс назвали PhoRC [24]. Обратный процесс позволяет направить киназы для фосфорилирования новых мишеней (эти вещества названы PHIC [25]). РНК-связывающие лиганды можно совместить с молекулой, привлекающей РНКазу L, получив RIBOTAC [26], [27]. Многие из этих молекул выглядят скорее как научные игрушки, чем клинические кандидаты, но и сами PROTAC вначале не казались похожими на реальные лекарственные молекулы.
Заключение
PROTAC представляет собой одну из удивительных историй успеха современной фармакологии. Всего за 20 лет эти вещества прошли от первоначальной идеи до множества реальных клинических кандидатов. PROTAC создал новую парадигму в медицинской химии, открыв новые принципы воздействия на мишень и существенно расширив горизонты возможного для низкомолекулярных соединений, связанные не только с ингибированием ферментов. И хотя нельзя предсказать, насколько эти молекулы будут клинически эффективны, в ближайшие годы их явно ждет большое будущее.
Партнер спецпроекта — компания Cytiva
1 апреля 2020 г. в результате приобретения подразделения GE Healthcare за 21,4 млрд долларов компанией Danaher Corporation была создана компания Cytiva. Cytiva аккумулировала в себе наследие передовых инноваций и разработок в таких областях, как очистка белка, одноразовые технологии, а также клеточная и генная терапии.
Ведущими брендами Cytiva являются: ÄKTA, Amersham, Biacore, FlexFactory, HyClone, KUBio, MabSelect, Whatman, Xuri, Xcellerex.
Компания Cytiva — номер один в очистке антител.
Cytiva оперирует в 40 странах и регионах, охватывая Европу, Азию, Северную и Латинскую Америки, а также Ближний Восток. Тысячи сотрудников занимаются развитием и ускорением разработки и производства терапевтических препаратов.
Во всем мире используется 100 000 систем компании Cytiva, а также более 60 установок технологических платформ «ФлексФактори».
Cytiva имеет 15 производственных площадок, 11 клиентоориентированных объектов, которые помогут масштабировать процесс от идеи до коммерческого производства, 7 глобальных складов, а также 6 учебных центров.
Ви́дение Cytiva — это мир, в котором доступ к жизненно важным методам лечения трансформирует здоровье человека. Являясь надежным партнером для клиентов различных масштабов и уровней, компания Cytiva повышает эффективность исследований и производственных процессов, обеспечивая разработку, производство и поставку революционных и инновационных препаратов для пациентов.
С использованием технологий Cytiva производится 75% утвержденных FDA биофармпрепаратов.
Посетите наш сайт www.cytivalifesciences.com для получения дополнительной информации.
Материал предоставлен партнёром — компанией Cytiva