Инотропное действие что это
ИНОТРОПНОЕ ДЕЙСТВИЕ
Полезное
Смотреть что такое “ИНОТРОПНОЕ ДЕЙСТВИЕ” в других словарях:
инотропное действие — (ино + греч. tropos направление) действие какого либо фактора, изменяющее силу мышечного сокращения … Большой медицинский словарь
ДРОМОТРОПНОЕ ДЕЙСТВИЕ — (от греч. dromos бег), влияние различных факторов на способность сердца проводить импульсы. Термин Д. д. введен в 1900 г. Энгельманом (Engelmann). Раздражение сердечных ветвей п. vagi вызывает замедление в проведении импульса (отрицательное Д.… … Большая медицинская энциклопедия
Антиаритмические препараты — Антиаритмические препараты группа лекарственных средств, применяющихся при разнообразных нарушениях сердечного ритма, таких как экстрасистолия, мерцательная аритмия, пароксизмальная тахикардия, фибрилляция желудочков и др. Содержание 1… … Википедия
СЕРДЕЧНЫЕ СРЕДСТВА — в общем смысле слова лекарственные вещества, применяемые для терапии расстройств сердечной деятельности. Сюда относятся представители различных фар макол. групп, имеющие в той или иной степени сердечное действие. В более узком смысле сердечными… … Большая медицинская энциклопедия
Кардиотонические средства — I Кардиотонические средства лекарственные средства, увеличивающие сократимость миокарда вне зависимости от изменений пред и постнагрузки на сердце. Общим свойством К. с. является положительное инотропное действие на сердце, т.е. способность… … Медицинская энциклопедия
Арител — Действующее вещество ›› Бисопролол* (Bisoprolol*) Латинское название Arital АТХ: ›› C07AB07 Бисопролол Фармакологическая группа: Бета адреноблокаторы Нозологическая классификация (МКБ 10) ›› I10 I15 Болезни, характеризующиеся повышенным кровяным… … Словарь медицинских препаратов
Коринфар УНО — Действующее вещество ›› Нифедипин* (Nifedipine*) Латинское название Corinfar UNO АТХ: ›› C08CA05 Нифедипин Фармакологическая группа: Блокаторы кальциевых каналов Нозологическая классификация (МКБ 10) ›› I10 I15 Болезни, характеризующиеся… … Словарь медицинских препаратов
Диуретики — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
МУСКАРИН — МУСКАРИН, Muscarinum, чрезвычайно ядовитый алкалоид, открытый Шмидебер гом (Schmiedeberg) в 1868 г. в грибе мухоморе Agaricus muscarius L., или Amanita muscaria Pers., принадлежащем к подсемейству пластинчатых грибов (Agaricini, сем.… … Большая медицинская энциклопедия
Противоаритмические средства — I Противоаритмические средства (синоним антиаритмические средства) лекарственные средства, применяемые для предупреждения и купирования нарушений ритма сердечной деятельности. С учетом основной направленности и особенностей механизма действия… … Медицинская энциклопедия
Инотропный эффект
См. также
Полезное
Смотреть что такое “Инотропный эффект” в других словарях:
Дромотропный эффект — (от др. греч. δρόμος бег, быстрое движение; др. греч. τρόπος направление действия, способ действия) изменение скорости проведения возбуждения через атрио вентрикулярный узел. Положительный дромоторопный эффект увеличение… … Википедия
Хронотропный эффект — (chronotropic effect, др. греч. χρόνος время + τρόπος направление действия, способ действия) изменение частоты ритмических сокращений (изменение автоматии) сердца. Положительный хронотропный эффект увеличение частоты… … Википедия
Батмотропный эффект — (bathmotropic effect, греч.: βαθμός порог + τρόπος направление действия, способ действия) изменение возбудимости различных структур сердца. Положительный батмотропный эффект увеличение возбудимости сердца Отрицательный… … Википедия
ИНОТРОПНОЕ ДЕЙСТВИЕ — (буквально вменяющее силу»),изменение амплитуды сердечных сокращений под влиянием различных физиологических и фармакологических агентов. Положительное И. действие, т. е. увеличение амплитуды сердечных сокращений, вызывается раздражением… … Большая медицинская энциклопедия
Дилтиазем — (Diltiazem) … Википедия
Сердце — I Сердце Сердце (лат. соr, греч. cardia) полый фиброзно мышечный орган, который, функционируя как насос, обеспечивает движение крови а системе кровообращения. Анатомия Сердце находится в переднем средостении (Средостение) в Перикарде между… … Медицинская энциклопедия
Ирунин — Действующее вещество ›› Итраконазол* (Itraconazole*) Латинское название Irunin АТХ: ›› J02AC02 Итраконазол Фармакологическая группа: Противогрибковые средства Нозологическая классификация (МКБ 10) ›› B36.0 Разноцветный лишай ›› B37 Кандидоз… … Словарь медицинских препаратов
Допамин Солвей 200 — Действующее вещество ›› Допамин* (Dopamine*) Латинское название Dopamin Solvay 200 АТХ: ›› C01CA04 Допамин Фармакологические группы: Сердечные гликозиды и негликозидные кардиотонические средства ›› Дофаминомиметики ›› Гипертензивные средства… … Словарь медицинских препаратов
Допамин Солвей 50 — Действующее вещество ›› Допамин* (Dopamine*) Латинское название Dopamin Solvay 50 АТХ: ›› C01CA04 Допамин Фармакологические группы: Сердечные гликозиды и негликозидные кардиотонические средства ›› Дофаминомиметики ›› Гипертензивные средства… … Словарь медицинских препаратов
Блока́торы ка́льциевых кана́лов — лекарственные средства, блокирующие ток ионов кальция через медленные кальциевые каналы клеточных мембран. В медицинской практике из препаратов данной группы применяют верапамил, фенигидин и дилтиазем. Медленные кальциевые каналы имеют важное… … Медицинская энциклопедия
Инотропная поддержка в терапии больных ИБС, осложненной ХСН, рефрактерной к стандартной терапии
В России около 3,3 млн пациентов страдают хронической сердечной недостаточностью. ХСН является наиболее частой причиной госпитализации.
Расходы на госпитализацию по поводу обострений ХСН достигают 184,7 млрд рублей.
В начале 90-х годов прошлого века, учитывая мультифакторность развития синдрома ХСН, была выдвинута концепция сердечно-сосудистого континуума [Dzau V.J., Braunwald Е., 1991]. В основе концепции лежит предположение о ключевой роли сочетания (синтропности) многих самостоятельных риск-факторов (артериальной гипертонии, гипертрофии левого желудочка, сахарного диабета 2-го типа, ожирение и дислипидемии) в формировании выраженной сердечной недостаточности и развитии патофизиологического и сердечно-сосудистого континуума.
Главными стpатегическими задачами лечения ХСН должны быть: восстановление насосной деятельности сеpдца, устpанение излишней нейpогоpмональной активности плазмы кpови, ликвидация поpочного кpуга пpогpессиpования СH, котоpый, в случае успешного pешения пеpвой задачи будет устраняться сам при условии одновременного устpанения биоэнергетической недостаточности ткани, миокарда, почек. Рис.№1
В отделение кардиологии нашей больницы в течении года от 50% до 85% находятся пациенты с сердечной недостаточностью, из них с декомпенсацией ХСН до 30%. Это тяжелая ХСН (III-IV ФК по NYHA), с дисфункцией миокарда, обусловленной ишемической и дилатационной кардиомиопатиями, с большими полостями сердца, низкой ФВ (40 и довольно часто менее 30), массивным отёчным синдромом, одышкой. Рис. №2
Для лечения декомпенсации ХСН мы использовуем стандартную терапию, включающую ИАПФ, мочегонные, антиагреганты, б-блокаторы, антикоагулянты (по показаниям), дополнительно препараты калия, магния. Даже при длительном лечении вышеуказанными препаратами встречаемся с ХСН, рефрактерной к стандартной терапии,. Такая сердечная недостаточность относится к стадии Д сердечного- сосудистого континуума- самой дорогой и самой сложной для лечения.. В подобных клинических ситуациях применяем инотропные препараты. Начиная с 2004года таким пациентам мы проводим инфузию левосимендана. Это кардиотоник с вазодилатирующим эффектом. Рис.№3.
10 больным с ХСН III и IV ФК (по NYHA) препарат вводился в виде 24_часовой инфузии со скоростью 0,1 мкг/кг/мин ежемесячно в течение полугода. Сравнение показателей ФВ ЛЖ выявило улучшение сократительной функции ЛЖ после терапии левосименданом – ФВ увеличилась с 28,3±6,9 до 32,1±7,4% (p=0,01). Таким образом, курсовая инфузия левосимендана улучшила как объективные ЭхоКГ_признаки, так и субъективно оцениваемое пациентами качество жизни. Уровень мозгового натрийуретического пептида (BNP) значительно снизился после инфузий левосимендана – с 1081,1 до 176,0.
На фоне проводимой терапии удалось уменьшить функциональный класс сердечной недостаточности Рис 5.
Принимая во внимание то, что явные клинические симптомы появляются только при достаточно далеко зашедшем процессе, современные принципы терапии сердечной недостаточности требуют агрессивного, раннего, постоянного клинически и патогенетически обоснованного лечения, можно сформулировать шесть очевидных целей при лечении ХСН:
В настоящее время в нашем отделении препарат назначается пациентам с хсн при повышении маркёров сердечной недостаточности, (BNP). Степень эффективности зависит от тяжести течения сердечной недостаточности. Более выраженный эффект у тех пациентов, у которых сократительная способность от 30% до 40%.
Таким образом применение и своевременное назначение современных иноторопных препаратов улучшает клиническое течение ХСН, оказывает долгосрочное позитивное влияние на частоту нежелательных исходов (смерть, необходимость в повторной госпитализации).
Источник: К.м.н. ДОНЕЦКАЯ О.П., ТУЛУПОВА В.А., ШУЛЬДЕШОВА Н.В.
Бета-адреноблокаторы III поколения в лечении сердечно-сосудистых заболеваний
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований.
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований. Необходимость включения бета-адреноблокаторов в программу лечения сердечно-сосудистых заболеваний (ССЗ) очевидна: за последние 50 лет кардиологической клинической практики бета-адреноблокаторы заняли прочные позиции в профилактике осложнений и в фармакотерапии артериальной гипертонии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН), метаболическом синдроме (МС), а также при некоторых формах тахиаритмий. Традиционно в неосложненных случаях медикаментозное лечение АГ начинают с бета-адреноблокаторов и диуретиков, снижающих риск развития инфаркта миокарда (ИМ), нарушения мозгового кровообращения и внезапной кардиогенной смерти.
Концепция опосредованного действия лекарственных средств через рецепторы тканей различных органов была предложена N.?Langly в 1905 г., а в 1906 г. H.?Dale подтвердил ее в практике.
В 90-е годы было установлено, что бета-адренорецепторы подразделяются на три подтипа:
Способность блокировать влияние медиаторов на бета1-адренорецепторы миокарда и ослабление влияния катехоламинов на мембранную аденилатциклазу кардиомиоцитов с уменьшением образования циклического аденозинмонофосфата (цАМФ) определяют основные кардиотерапевтические эффекты бета-адреноблокаторов.
Антиишемический эффект бета-адреноблокаторов объясняется снижением потребности миокарда в кислороде, вследствие уменьшения частоты сердечных сокращений (ЧСС) и силы сердечных сокращений, возникающих при блокировании бета-адренорецепторов миокарда.
Бета-блокаторы одновременно обеспечивают улучшение перфузии миокарда за счет уменьшения конечного диастолического давления в левом желудочке (ЛЖ) и увеличения градиента давления, определяющего коронарную перфузию во время диастолы, длительность которой увеличивается в результате урежения ритма сердечной деятельности.
Антиаритмическое действие бета-адреноблокаторов, основанное на их способности уменьшать адренергическое влияние на сердце, приводит к:
Бета-адреноблокаторы повышают порог возникновения фибрилляции желудочков у больных острым ИМ и могут рассматриваться как средства профилактики фатальных аритмий в остром периоде ИМ.
Гипотензивное действие бета-адреноблокаторов обусловлено:
Препараты из группы бета-адреноблокаторов отличаются по наличию или отсутствию кардиоселективности, внутренней симпатической активности, мембраностабилизирующим, вазодилятирующим свойствам, растворимости в липидах и воде, влиянию на агрегацию тромбоцитов, а также по продолжительности действия.
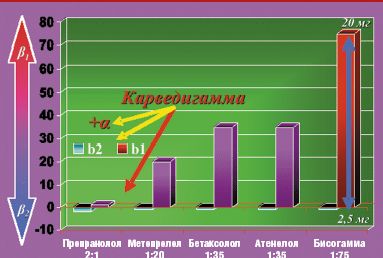
Влияние на бета2-адренорецепторы определяет значительную часть побочных эффектов и противопоказаний к их применению (бронхоспазм, сужение периферических сосудов). Особенностью кардиоселективных бета-адреноблокаторов по сравнению с неселективными является большое сродство к бета1-рецепторам сердца, чем к бета2-адренорецепторам. Поэтому при использовании в небольших и средних дозах эти препараты оказывают менее выраженное влияние на гладкую мускулатуру бронхов и периферических артерий. Следует учитывать, что степень кардиоселективности неодинакова у различных препаратов. Индекс ci/бета1 к ci/бета2, характеризующий степень кардиоселективности, составляет 1,8:1 для неселективного пропранолола, 1:35 — для атенолола и бетаксолола, 1:20 — для метопролола, 1:75 — для бисопролола (Бисогамма). Однако следует помнить, что селективность дозозависима, она снижается с повышением дозы препарата (рис. 1).
В настоящее время клиницисты выделяют три поколения препаратов с бета-блокирующим эффектом.
I поколение — неселективные бета1- и бета2-адреноблокаторы (пропранолол, надолол), которые наряду с отрицательными ино-, хроно- и дромотропными эффектами обладают способностью повышать тонус гладкой мускулатуры бронхов, сосудистой стенки, миометрия, что существенно ограничивает их использование в клинической практике.
II поколение — кардиоселективные бета1-адреноблокаторы (метопролол, бисопролол), благодаря высокой селективности в отношении бета1-адренорецепторов миокарда обладают более благоприятной переносимостью при длительном применении и убедительной доказательной базой долгосрочного прогноза жизни при лечении АГ, ИБС и ХСН.
В середине 1980-х годов на мировом фармацевтическом рынке появились бета-адреноблокаторы III поколения с низкой селективностью к бета1, 2-адренорецепторам, но с сочетанной блокадой альфа-адренорецепторов.
Препараты III поколения — целипролол, буциндолол, карведилол (его дженерический аналог с брендовым названием Карведигамма®) обладают дополнительными вазодилятирующими свойствами за счет блокады альфа-адренорецепторов, без внутренней симпатомиметической активности.
В 1982–1983 годах в научной медицинской литературе появились первые сообщения о клиническом опыте применения карведилола при лечении ССЗ.
Ряд авторов выявили протективное действие бета-адреноблокаторов III поколения на клеточные мембраны. Это объясняется, во-первых, ингибированием процессов перекисного окисления липидов (ПОЛ) мембран и антиоксидантным действием бета-блокаторов и, во-вторых, снижением влияния катехоламинов на бета-рецепторы. Некоторые авторы связывают мембранстабилизирующее действие бета-блокаторов с изменением проводимости натрия через них и ингибированием ПОЛ.
Указанные дополнительные свойства расширяют перспективы применения данных лекарственных средств, поскольку нивелируют характерное для первых двух поколений отрицательное влияние на сократительную функцию миокарда, углеводный и липидный обмен и в то же время обеспечивают улучшение перфузии тканей, позитивное влияние на показатели гемостаза и уровень оксидативных процессов в организме.
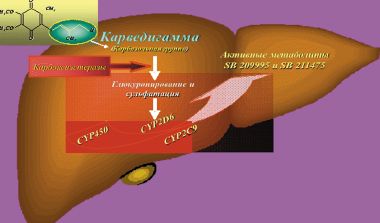
Карведилол метаболизируется в печени (глюкуронирование и сульфатация) с помощью ферментной системы цитохрома Р450, с использованием семейства ферментов — CYP2D6 и CYP2C9. Антиоксидантное действие карведилола и его метаболитов обусловлено наличием в молекулах карбазольной группы (рис. 2).
Метаболиты карведилола — SB 211475, SB 209995 угнетают ПОЛ в 40–100 раз активнее, чем сам препарат, а витамин Е — примерно в 1000 раз.
Применение карведилола (Карведигаммы®) при лечении ИБС
Согласно результатам целого ряда завершенных многоцентровых исследований, бета-адреноблокаторы оказывают выраженный антиишемический эффект. Необходимо отметить, что антиишемическая активность бета-адреноблокаторов соизмерима с активностью антагонистов кальция и нитратов, но, в отличие от этих групп, бета-адреноблокаторы не только улучшают качество, но и увеличивают продолжительность жизни пациентов с ИБС. Согласно результатам метаанализа 27 многоцентровых исследований, в которых приняло участие более 27 тыс. человек, селективные бета-адреноблокаторы без внутренней симпатомиметической активности у больных с острым коронарным синдромом в анамнезе снижают риск развития повторного ИМ и смертность от инфаркта на 20% [1].
Однако не только селективные бета-адреноблокаторы положительно влияют на характер течения и прогноз у пациентов с ИБС. Неселективный бета-адреноблокатор карведилол также продемонстрировал очень хорошую эффективность у больных со стабильной стенокардией. Высокая антиишемическая эффективность данного препарата объясняется наличием дополнительной альфа1-блокирующей активности, способствующей дилятации коронарных сосудов и коллатералей постстенотической области, а значит — улучшению перфузии миокарда. Кроме того, карведилол обладает доказанным антиоксидантным эффектом, связанным с захватом свободных радикалов, высвобождающихся в период ишемии, что обусловливает его дополнительное кардиопротекторное действие. Одновременно карведилол блокирует апоптоз (программируемая смерть) кардиомиоцитов в зоне ишемии, сохраняя объем функционирующего миокарда. Как было показано, метаболит карведилола (ВМ 910228) обладает меньшим бета-блокирующим эффектом, но является активным антиоксидантом, блокируя перекисное окисление липидов, «отлавливая» активные свободные радикалы OH–. Этот дериват сохраняет инотропный ответ кардиомиоцитов на Ca++, внутриклеточная концентрация которого в кардиомиоците регулируется Ca++-насосом саркоплазматического ретикулума. Поэтому карведилол оказывается более эффективным в лечении ишемии миокарда через ингибирование повреждающего действия свободных радикалов на липиды мембран субклеточных структур кардиомиоцитов [2].
Благодаря этим уникальным фармакологическим свойствам, карведилол может превосходить традиционные бета1-селективные адреноблокаторы в плане улучшения перфузии миокарда и способствовать сохранению систолической функции у больных ИБС. Как показано Das Gupta et al., у больных с дисфункцией ЛЖ и сердечной недостаточностью, развившейся вследствие ИБС, монотерапия карведилолом снижала давление наполнения, а также увеличивала фракцию выброса (ФВ) ЛЖ и улучшала показатели гемодинамики, при этом не сопровождаясь развитием брадикардии [3].
Согласно результатам клинических исследований у больных хронической стабильной стенокардией, карведилол снижает ЧСС в покое и при физической нагрузке, а также увеличивает ФВ в покое. Сравнительное исследование карведилола и верапамила, в котором принимало участие 313 пациентов, показало, что, по сравнению с верапамилом, карведилол в большей степени уменьшает ЧСС, систолическое АД и произведение ЧСС ´ АД при максимально переносимой физической нагрузке. Более того, карведилол обладает более благоприятным профилем переносимости [4].
Важно, что карведилол, по-видимому, более эффективен при лечении стенокардии, чем обычные бета1-адреноблокаторы. Так, в ходе 3-месячного рандомизированного многоцентрового двойного слепого исследования карведилол напрямую сравнивали с метопрололом у 364 пациентов со стабильной хронической стенокардией. Они принимали карведилол по 25–50 мг два раза в сутки или метопролол по 50–100 мг два раза в сутки [5]. В то время как оба препарата продемонстрировали хорошее антиангинальное и противоишемическое действие, карведилол более значительно увеличивал время до депрессии сегмента ST на 1 мм при физической нагрузке, чем метопролол. Переносимость карведилола была очень хорошей, и, что важно, при увеличении дозы карведилола не произошло заметных изменений типов нежелательных явлений.
Примечательно, что карведилол, не обладающий, в отличие от других бета-адреноблокаторов, кардиодепрессивным действием, улучшает качество и продолжительность жизни пациентов с острым ИМ (CHAPS) [6] и постинфарктной ишемической дисфункцией ЛЖ (CAPRICORN) [7]. Многообещающие данные были получены в ходе исследования Carvedilol Heart Attack Pilot Study (CHAPS) — пилотного исследования влияния карведилола на развитие ИМ. Это было первое рандомизированное исследование, в котором сравнивали карведилол с плацебо у 151 больного после острого ИМ. Лечение начинали в течение 24 часов с момента появления болей в грудной клетке, а дозу препарата увеличивали до 25 мг два раза в сутки. Главными конечными точками исследования были функция ЛЖ и безопасность препарата. Больных наблюдали в течение 6 месяцев с момента начала заболевания. Согласно полученным данным, частота развития серьезных кардиальных событий уменьшилась на 49%.
Полученные в ходе исследования CHAPS эхографические данные 49 пациентов со сниженной ФВ ЛЖ (
А. М. Шилов*, доктор медицинских наук, профессор
М. В. Мельник*, доктор медицинских наук, профессор
А. Ш. Авшалумов**
*ММА им. И. М. Сеченова, Москва
**Клиника Московского института кибернетической медицины, Москва
Инотропное действие что это
О недостаточности того или иного органа мы обычно говорим, когда он не в состоянии в полном объеме выполнять свои функции. Функция сердца заключается в выбросе в аорту количества крови, адекватного потребностям организма. Таким образом, сердечная недостаточность (СН) может быть определена как нарушение структуры и функции сердечной мышцы, ведущее к неспособности переносить кислород в том количестве, которое необходимо для тканевого метаболизма [12].
Основной причиной является повреждение миокарда, ведущее к патологическому ремоделированию желудочка вследствие расширения камеры и нарушения сократимости. Эти изменения приводят к снижению сердечного выброса, уменьшению перфузии органов и активации компенсаторных нейрогормональных систем [39].
Главными проявлениями сердечной недостаточности являются одышка и утомляемость. Эти симптомы могут ухудшить функциональные возможности и качество жизни пациентов [8].
Если объем поражения достаточно велик, то в первый момент произойдет падение выброса крови из левого желудочка и снижение ее давления на стенки аорты и крупных сосудов. Это приведет к активации расположенных там барорецепторов. Ответом будет немедленная активация симпато-адреналовой системы (САС). Стимуляция находящихся в сердце β-рецепторов ведет к увеличению ЧСС и повышению сократимости миокарда. Стимуляция находящихся в стенке сосудов рецепторов катехоламинами вызывает реакцию централизации кровотока, а за счет спазма вен увеличивается возврат крови к сердцу во время диастолы [39].
Активация САС ведет к активации ренин-ангиотензин-альдостероновой системы (РААС) [3, 12].
Ренин является ферментом превращающим физиологически неактивный ангиотензиноген в ангиотензин-1. Последний под влиянием ангиотензинпревращающего фермента превращается в одно из наиболее биологически активных веществ – ангиотензин-2. Его образование существенно усиливает спазм сосудов, обусловленный реакцией централизации кровотока. Помимо вазоконстрикции ангиотензин-2 вызывает рост клеток, способствует апоптозу и,что важно в данном случае, увеличивает синтез альдостерона. Альдостерон способствует реабсорбции жидкости в дистальных отделах нефрона. Таким образом, возникающая в ответ на повреждение миокарда активация САС и РААС приводит к постепенному накоплению избытка жидкости в организме. Этот процесс требует времени и достигает клинически значимого эффекта только спустя несколько суток после острой сердечной катастрофы [12].
Несмотря на серьезные достижения в лечении хронической сердечной недостаточности, терапия острой сердечной недостаточности остается практически неизменной. В частности, лечение острой сердечной недостаточности во многом основывается не на доказательной медицине, а на эмпирических данных [15].
Острая сердечная недостаточность (ОСН) – синдром, характеризующийся застойными явлениями по малому и/или большому кругу кровообращения вследствие увеличения давления наполнения левого желудочка с или без уменьшения сердечного выброса. Риск смерти и повторной госпитализации больных ОСН после выписки из стационара остаётся высоким и составляет от 10 до 20%, и от 20 до 30% – в течение180 дней, соответственно [15].
Если отбросить все остальное, то все, что требует организм от сердца, это поддержать кровоток на должном уровне. Сердечный выброс (СВ) – это производное частоты сердечных сокращений (ЧСС) и ударного объема (УО) сердца (объема крови, выталкиваемого из желудочков в ходе каждого сокращения). Увеличение ЧСС является важным ранним компенсаторным механизмом, нормальным ответом сердца на снижение СВ. У здоровых молодых людей СВ возрастает при росте ЧСС до 170–180 уд./мин, а затем начинает снижаться (так как продолжительность диастолы становится слишком короткой для того, чтобы обеспечить достаточное наполнение желудочков). У пожилых пациентов с дисфункцией сердца падение СВ наблюдается при ЧСС менее 150 уд./мин. Имеется три основных фактора, определяющих УО желудочков: преднагрузка, постнагрузка и сократимость миокарда [10, 34].
Преднагрузка характеризует напряжение стенки желудочка в конце диастолы (при максимальном наполнении сердца перед сокращением). Это напряжение трудно измерить, а в качестве «суррогата» (или максимально приближенного показателя) обычно используется конечно-диастолическое давление (КДД). Эта величина определяется венозным возвратом и дает представление о давлении заполнения желудочков [7].
Сократимость — работа, производимая сердцем на данном уровне преднагрузки и постнагрузки. Определяется максимальной скоростью, с которой желудочек может генерировать изменение давления за единицу времени. Понятие «инотропизм» используется для объяснения усиления работы, выполняемой сердцем, независимо от ЧСС, преднагрузки и постнагрузки [7].
Постнагрузка — это напряжение, которое должно быть сгенерировано в стенке желудочка для того, чтобы выбросить кровь во время систолы в артериальную систему. Этот показатель находится под сильным влиянием сопротивления артерий — системного сосудистого сопротивления [7].
В интактном сердце длина мышечных волокон пропорциональна конечному диастолическому объему (КДО) желудочков. Поэтому увеличение наполнения желудочков во время диастолы (или рост преднагрузки) вызывает рост силы последующего сокращения и увеличение УО и СВ. Вот почему факторы, способствующие увеличению объема внутрисосудистой жидкости (а именно – задержка натрия и воды) являются одними из основных компенсаторных механизмов СН. В этом случае увеличение объема внутрисосудистой жидкости приводит к росту венозного возврата к обоим желудочкам, увеличению их КДО и, в конце концов, к повышению УО. Исходя из того, что увеличение преднагрузки способствует росту УО и СВ, можно было бы предположить, что лечение, направленное на повышение объема внутрисосудистой жидкости, было бы полезным в тех случаях, когда функция желудочков угнетена. Но основная проблема такого «лечения» заключается в том, какой именно объем внутрисосудистой жидкости необходим для оптимальной преднагрузки и как его определить у конкретного пациента [10].
В начальной стадии СН снижение сократимости желудочка компенсируется повышением преднагрузки (КДО и КДД), что приводит к нарастанию ударного объема; кроме того, увеличивается частота сердечных сокращений (ЧСС). По мере прогрессирования СН повышение КДД в желудочке все меньше сказывается на ударном объеме; вместе с тем растет давление в венах малого и большого круга кровообращения, вызывая симптомы застоя. Повышается напряжение в стенке желудочка и снижается коронарный кровоток в диастолу, вследствие ухудшается энергетический баланс миокарда [2].
Сопряжение возбуждения и сокращения в миокарде
Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые кальциевые каналы L-типа, обеспечивающие формирование входящего кальциевого тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются потенциалзависимые кальциевые ионные каналы мембраны T-трубочек и рианодиновые рецепторы саркоплазматического ретикулума. Резкое повышение концентрации ионов кальция в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов. Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока [3, 5]. Существует и другой механизм поступления больших количеств ионов кальция в цитоплазму рабочего кардиомиоцита при его возбуждении. Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть натрий-кальциевым обменом. Во время диастолы натрий-кальциевая помпа активно удаляет из клетки ионы кальция в обмен на ионы натрия. При возбуждении кардиомиоцита направление натрий-кальциевого обмена меняется на противоположное: ионы кальция активно переносятся в клетку, тогда как ионы натрия, напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает [5, 26].
Комплекс актина и тропонина
Несмотря на то, что ионы кальция, соединяясь с ТрС (тропонин С), дают сигнал к запуску цикла поперечных мостиков, есть доказательства, что начинается не только сигнальный процесс включения-выключения. Чтобы понять роль кальция, нужно описать молекулярную структуру комплекса актина и тропонина. Тонкие филаменты состоят из двух актиновых частей, сплетенных в спираль; обе части находятся на более тяжелой молекуле тропомиозина, которая играет роль стержня. С равными интервалами к этим закручивающимся структурам прикреплены три регуляторных белка, называемых тропониновым комплексом. ТрС состоит из короткого N-концевого домена и четырех кальций?связывающих EF-рук, объединенных попарно в глобулярный N-концевой и С-концевой домены [6, 20].
Распространение потенциала действия по мышечному волокну в начале систолы приводит к выходу ионов кальция из саркоплазматического ретикулума и повышению концентрации свободного кальция в цитоплазме. Присоединение кальция ко второй EF-руке ТрС приводит к изменению конформации всего N-концевого домена белка. При этом появление на поверхности N-концевого домена ТрС гидрофобной области, с которой связывается регуляторный домен ТрI (тропонин I). Он перемещается на новое место на тонком филаменте, ослабляя таким образом взаимодействие между ТрТ (тропонин Т) и тропомиозином. В результате тропомиозин перемещается по тонкому филаменту, и устраняется торможение, оказываемое тропомиозином на взаимодействие актина и миозина [6, 20].
АТФ как источник энергии для сокращения
Сокращение сердечной мышцы происходит благодаря скольжению тонких актиновых филаментов относительно толстых миозиновых. Данный процесс обеспечивается за счет циклического АТФ-зависимого взаимодействия миозина и актина. Миозин связывает и гидролизует АТФ до АДФ и неорганического фосфата, но при этом практически не способен избавляться от накопившихся в активном центре продуктов АТФазной реакции. Головка миозина, содержащая в своем составе АДФ и фосфат, способна слабо взаимодействовать с актином, что активирует процесс освобождения фосфата из активного центра миозина. Освобождение неорганического фосфата (а вслед за этим и АДФ) из активного центра миозина сопровождается изменением ориентации «шейки» головки миозина, протягиванием нити актина относительно головки миозина и развитием натяжения. Связывание новой молекулы АТФ приводит к диссоциации миозина от актина и после гидролиза АТФ происходит очередное циклическое присоединение головки миозина к актину и осуществляется новый «шаг» миозина по актину [3].
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролиз АТФ поставляет энергию для движения поперечного мостика;
2) связывание (но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков [1].
Миозиновая АТФазная активность реагирует на воздействие кальция следующим образом: во время цикла сокращения сердца концентрация кальция повышается, что ведет к повышению миозиновой АТФазной активности в несколько раз, а также к повышению присоединения кальция к ТрС [3].
Подходы к лечению сердечной недостаточности
Подходы к лечению сердечной недостаточности менялись неоднократно. В 50-60 годах 20 века основной терапией считали инотропную стимуляцию сердца, в 70-х упор делался на борьбу с задержкой жидкости, в 80-е надежды связывали с уменьшением нагрузки на сердце за счет использования вазодилататоров, в 80-х годах синтезировала ингибитор фосфодиэстеразы III (ФДЭ III), за двойной эффект – инотропное и вазодилатирующее, названное инодилататорами. Начиная с 90-х основой лечения стало подавление избыточной активации нейрогуморальных систем [12].
Механизм действия инотропных препаратов
Препараты, обычно используемые для достижения положительного иноторопного эффекта, включают катехоламины, напр. добутамин, и ингибиторы ФДЭ III, напр. милринон. У этих веществ разные точки приложения, но они, в конечном счете, запускают каскад событий, приводящих к улучшению сократимости путем увеличения концентрации внутриклеточного кальция. Взаимодействие катехоламинов с β1-адренорецепторами на поверхности кардиомиоцитов активирует аденилатциклазу, катализирующую превращение АТФ в цАМФ. цАМФ активирует протеинкиназу А, которая, в свою очередь, фосфорилирует внутриклеточные субстраты, включая потенциалзависимые кальциевые каналы L-типа, фосфоламбан, ТрI. Фосфорилирование потенциалзависимых кальциевые каналов L-типа стимулирует поступление кальция в цитозоль. Это является триггером для открытия рианодиновых рецепторов саркоплазматического ретикулума и мышечного сокращения (положительное инотропное действие катехоламинов и ингибиторов ФДЭ III). В то же время фосфорилирование фосфоламбана активирует SERCA2, что приводит к обратному захвату кальция саркоплазматическим ретикулумом во время диастолы. Это обусловливает люзитропный эффект катехоламинов и ингибиторов ФДЭ III. Также фосфорилирование ТрI уменьшает сродство миофиламентов к кальцию и способствует релаксации. Сердечные гликозиды, напр. дигоксин, селективно и обратимо ингибируют сарколеммальную натрий-калиевую АТФазу кардиомиоцитов, повышая т.о. концентрацию натрия внутри клетки, что, в свою очередь, ингибирует выкачивание кальция из клетки натрий-кальциевой помпой. Омекатив мекарбил – новый препарат – активатор миозина. Активирует миозиновую АТФазу [26, 32, 33].
За исключением дигоксина, не оказывающего эффекта на общую смертность, имеющиеся препараты с положительным инотропным действием, включая агонисты β1-адренорецепторов, ингибиторы ФДЭ III, оказались вредны для долгосрочного лечения СН, т.к. они могут способствовать развитию злокачественных желудочковых тахиаритмий и увеличить риск внезапной сердечной смерти. Также короткосрочное применение ингибиторов ФДЭ III ассоциируется с частым возникновением таких осложнений, как фибрилляция предсердий, гипотензия, особенно если у пациента имеется ишемия миокарда ввиду ишемической кардиомиопатии. Причины столь разочаровывающих открытий кроются в том, что, несмотря на различные точки приложения, все эти препараты усиливают сократимость миокарда путем увеличения внутриклеточного уровня цАМФ в кардиомиоцитах или благодаря его усиленному синтезу (при приеме агонистов β1-адренорецепторов), или снижению скорости его деградации (при приеме ингибиторов ФДЭ III), что усиливает высвобождение кальция из саркоплазматического ретикулума в цитозоль. Увеличение внутриклеточного кальция, в свою очередь, ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [17].
Инотропные препараты существенно увеличивают энергетические затраты кардиомиоцитов. Увеличение внутриклеточного кальция ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [19].
Было проведено значительное количество исследований, направленных на поиск нового инотропного препарата, действие которого не имеет под собой увеличения кальция в клетке. В теории такой препарат должен был усиливать сократимость без увеличения потребности миокарда в кислороде и без риска возникновения аритмий. Т.к. связь между уровнем внутриклеточного кальция и взаимодействием миофиламентов может быть нарушена ввиду таких патофизиологических состояний, как ишемия, ацидоз, сепсис или гипотермия, разрабатываемый препарат должен был укреплять эту связь, но не изменять внутриклеточную концентрацию кальция. Все «сенситизаторы кальция», включая левосимендан, пимобендан, EMD 57033, ORG 30029, MCI-154 и другие, имеют способность усиливать сократимость миокарда путем увеличения чувствительности миофиламентов к кальцию с различной интенсивностью, с помощью различных механизмов и точек приложения и различной степенью одновременного ингибирования фосфодиэстеразы III. Среди этих препаратов левосимендан наиболее эффективен в лечении хронической и острой левожелудочковой недостаточности [20].
Регистрационное свидетельство препарату левосимендан впервые было предоставлено в 2000 году в Швеции. В настоящее время левосимендан обладает
регистрационным свидетельством в более чем 50 странах по всему миру, при
этом установлено, что на декабрь 2014 года более 800 000 пациентов получили
инфузию препарата в рамках рутинной клинической практики [14].
Левосимендан – сенситизатор кальция, инодилататор, разработанный для внутривенного применения у пациентов, госпитализированных с острой декомпенсированной сердечной недостаточностью (ОДСН). Фармакологические действия левосимендана включают:
а) повышение сократимости сердца благодаря сенситизации тропонина С к кальцию;
б) вазодилатацию вследствие открытия калиевых каналов саркоплазматической мембраны в гладкомышечных клетках сосудов;
в) кардиопротекцию благодаря открытию митохондриальных калиевых каналов в кардиомиоцитах [25, 26, 31].