Интраэндометриальный кровоток что это
Цветовое допплеровское картирование в диагностике рака эндометрия
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Стандартным методом дифференциальной диагностики злокачественных и доброкачественных изменений является гистопатологическое исследование ткани, полученной при раздельном диагностическом выскабливании матки с гистероскопическим контролем. Сегодня актуален вопрос изыскания возможностей неинвазивной типизации тканей с помощью цветового допплеровского картирования, энергетического допплера, импульсной допплерометрии. Согласно данным литературы, систематическое использование эхографии способствует более ранней диагностике рака эндометрия, повышению частоты встречаемости рака I стадии на 50% и уменьшению заболеваемости раком III-IV стадий в 1,5 раза [7,8].
По мнению большинства авторов, применение комплексного ультразвукового исследования с анализом кривых скоростей кровотока является высокоинформативным методом неинвазивной диагностики карциномы эндометрия, так как в подавляющем большинстве случаев заболевания отмечаются патологические кривые скоростей кровотока, характерные для сосудистой сети с низким уровнем периферического сопротивления. Индексы резистентности и пульсации позволили доказать отсутствие мышечной оболочки в стенке артериальных сосудов в бассейне неоваскуляризации при злокачественном росте опухоли. Индекс резистентности (RI) при карциноме эндометрия составляет 0,42+0,02, тогда как в норме, при атрофии эндометрия и при простой гиперплазии, эндометриальный кровоток не регистрируется [9,10-14]. Однако ультразвуковых исследований, позволяющих выявить возможности цветовой допплерографии в диагностике рака эндометрия, крайне недостаточно.
Материалы и методы
| Морфологическая форма | Количество | % |
|---|---|---|
| Гиперпластические процессы | 17 | 42,5 |
| Железисто-кистозная гиперплазия Железисто-фиброзные полипы Атрофический эндометрий Атипическая гиперплазия | 9 4 1 3 | 22,5 10 2,5 7,5 |
| Злокачественная патология | 23 | 57,5 |
| Аденокарцинома Плоскоклеточный рак Аденоакантома Сочетание аденокарциномы и эндометриальной стромальной саркомы | 17 3 2 1 | 42,5 7,5 5 2,5 |
| Итого | 40 | 40 |
У 10 (58,8%) больных с гиперпластическими процессами и у 14 (60,9%) больных с аденокарциномой эндометрия наблюдалась сопутствующая миома матки небольших размеров (5-9 недель беременности). Длительное существование миомы матки (6-10 и более 10 лет) отмечено у всех пациентов с аденокарциномой.
Ультразвуковое исследование в сочетании с цветовым допплеровским картированием, энергетического допплера и импульсной допплерометрии выполнены всем пациентам на современных ультразвуковых аппаратах трансабдоминальным (конвексным датчиком с частотой 3,5 МГц) и трансвагинальным (конвексным датчиком с частотой 6,5 и 7 МГц) доступом. При эхографии оценивали размеры матки, величину, структуру, состояние полости матки и яичников. Допплеровский анализ включал определение: характера кровотока (артериальный или венозный), количества цветовых сигналов от сосудов в каждой опухоли, локализации внутриопухолевого кровотока (центральная или периферическая), наименьшего и среднего индекса резистентности (RImin и RImed) в маточных, аркуатных и опухолевых сосудах, максимальной скорости артериального (VAmax) и венозного кровотока (VVmax).
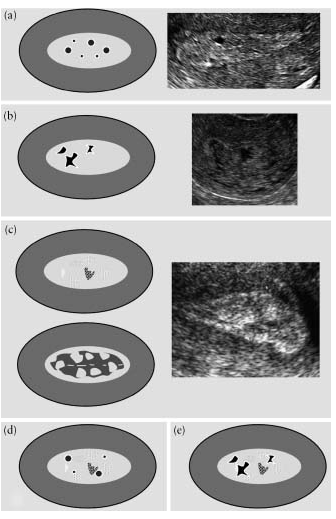
Для исключения субъективизма в оценке интенсивности внутриопухолевого кровотока нами предложена шкала. В 5-6 стопкадрах регистрировали количество цветовых сигналов от сосудов новообразования:
Для маточных артерий использовался частотный фильтр 100 и 50 Гц, для аркуатных и внутриопухолевых сосудов при размере “пробного объема” допплеровского луча 4 и 2 мм соответственно.
Результаты и их обсуждение
Цветовая допплерография не зарегистрировала внутриопухолевый кровоток у 23,5% больных: при атрофическом эндометрии и в 3 случаях железисто-кистозной гиперплазии. У 76,5% пациенток обнаружен различной интенсивности периферический кровоток со средними значениями индекса резистентности. При железисто-кистозной гиперплазии отмечались единичные цветовые сигналы от сосудов, расположенные по периферии, со средними и высокими значениями индекса резистентности. При фиброзно-железистых полипах визуализировался умеренно выраженный венозный и артериальный периферический кровоток со средними показателями периферического сосудистого сопротивления. При атипической гиперплазии регистрировался интенсивный центральный и периферический внутриопухолевый кровоток со средним уровнем резистентности сосудов.
Определение стадии рака осуществлено согласно Международной классификации рака тела матки (FIGO,1988). Сопоставление стадии и гистотипа представлено в табл. 2.
| Стадия | Аденокарцинома | Другие* | Всего | |
|---|---|---|---|---|
| высоко- дифферен- цированная | умеренно-дифферен- цированная | |||
| Ia | 4 | – | 1 | 5 |
| Ib | 4 | 4 | 4 | 12 |
| Ic | – | – | – | – |
| II | – | 2 | 1 | 3 |
| III | – | 2 | – | 2 |
| IVc | – | 1 | – | 1 |
| Итого: | 8 | 9 | 6 | 23 |
Ультразвуковыми признаками злокачественной патологии эндометрия были: неоднородость внутренней структуры образования, более высокая эхогенность по сравнению с миометрием, повышенная звукопроводимость ткани, неровный, “изъеденный” контур, проникающий в миометрий на различную глубину, наличие гипоэхогенного ободка вокруг новообразования.
У 30,4% больных с карциномой эндометрия при трансвагинальной эхографии обнаруживались локальные гиперэхогенные образования неоднородной внутренней структуры с преимущественной инвазией в определенном направлении одной из стенок матки или локализация в области дна либо одного из трубных углов. При морфологическом исследовании выявлена экзофитная форма роста опухоли I стадии. В остальных 69,6% клинических наблюдениях отмечалась эндофитная форма роста с равномерной инвазией в миометрий. У этих больных обнаружены неровные, “изъеденные” контуры опухоли, проникающей в миометрий на различную глубину, стертая граница между новообразованием и миометрием. Некроз опухоли с деформацией полости матки и наличие некоторого количества жидкости выявлены при III и IV стадиях процесса.
Неоваскуляризация эндометрия имела место у 91,3% (21) больных. Из них “бедный” и умеренно выраженный кровоток с низкими цифрами индекса резистентности наблюдался в 13% наблюдений высокодифференцированной аденокарциномы Ia стадии. Такой тип неоваскуляризации отмечен при экзофитной форме роста опухоли.
Особенности кровоснабжения матки у женщин с хроническим эндометритом в зависимости от длительности бесплодия
1) ФГАОУ ВО «Российский университет дружбы народов» (РУДН), Москва, Россия;
2) ООО Медицинский центр «Асклепион», Москва, Россия;
3) ООО «Научно-практический центр малоинвазивной хирургии и гинекологии», Москва, Россия
Цель. Оценить гемодинамику матки, в том числе эндометрия, у женщин с хроническим эндометритом в зависимости от длительности бесплодия.
Материалы и методы. Проведен ретроспективный анализ ультразвукового исследования 581 женщины репродуктивного возраста, страдающих бесплодием, у которых диагностирован эндометрит. Все женщины разделены на группы в соответствии с длительностью бесплодия: менее 2 лет, от 2 до 5 лет и более 5 лет. В матке и эндометрии оценивали индекс васкуляризации (VI), индекс потока (FI) и васкуляризационно-потоковый индекс (VFI). При допплерографии маточной артерии исследовали индекс артериальной перфузии (ИАП), который отражает перфузию 1 см3 тела матки.
Результаты. Васкуляризация матки и эндометрия по данным VI, FI и VFI снижалась не только в I, но и во II фазе цикла по мере увеличения длительности бесплодия. Артериальная перфузия матки снижалась в I фазу. Существенного изменения максимальной скорости кровотока (Vmax), пульсационного индекса (PI) и индекса резистентности (RI) в группах не отмечено.
Заключение. По мере увеличения длительности бесплодия снижается васкуляризация не только эндометрия, но и миометрия, а также уменьшается артериальный приток.
В начале прошлого века частота бесплодного брака составляла почти 10%, при этом доля женского бесплодия была от 33 до 50% [1]. В настоящее время отсутствие беременности отмечают до 30% супружеских пар стран Восточной Европы и Центральной Азии, женское бесплодие встречается в 45%, мужское – в 40% и сочетанное – в 15% [2, 3].
Как 100 лет тому назад, так и в настоящее время частой причиной женского бесплодия является хронический эндометрит (ХЭ), который характеризуется латентным, а потому длительным течением, нарушает репродуктивную функцию женщины, является одной из причин неудачных попыток экстракорпорального оплодотворения, препятствует имплантации и плацентации. Частота ХЭ у пациенток с бесплодием и привычным невынашиванием составляет 70–80% [4–6]. В.Е. Радзинский и соавт., ссылаясь на решение XVIII Всемирного конгресса акушеров-гинекологов (FIGO, 2006), сообщают, что ХЭ правомерно ставить абсолютно всем женщинам, имеющим в анамнезе неразвивающуюся беременность [7].
Эхография, как правило, является первым инструментальным методом диагностики гинекологических заболеваний. Проблеме бесплодия и патологии эндометрия посвящен ряд статей в отечественной и зарубежной литературе, в том числе в последнее время [8–12]. Большой обзор источников литературы представлен E. Puente et al. [13]. Авторы констатируют, что ХЭ является малоизученной патологией, связанной с неблагоприятными репродуктивными исходами. По их мнению, требуется стандартизация критериев всех методов диагностики ХЭ, включая гистопатологический анализ, иммуногистохимию и ультразвуковые исследования.
Первым специалистом в нашей стране, описавшим в 1993 г. ультразвуковые признаки ХЭ, был В.Н. Демидов, впоследствии добавив некоторые маркеры и рассчитав, что чувствительность эхографии составляет 86%, а специфичность – 92% [14]. Учитывая отсутствие достоверных признаков заболевания, трудности диагностики и дифференциальной диагностики с другими патологическими процессами в эндометрии, М.Н. Буланов предложил балльную шкалу [15], которую используют исследователи [16].
Воспалительный процесс вследствие триггерного воздействия инфекционных агентов, имеющих тропизм к сосудистой стенке, приводит к нарушению баланса про- и антиангиогенных факторов, возникает гипоксия и ишемия ткани, что отражается на кровоснабжении матки в целом и в эндометрии [7, 17, 18].
Для оценки кровотока в срединных отделах матки можно использовать метод визуализации сосудов с 4-балльной характеристикой по степени выраженности от 1 (эндометрий аваскулярный) до 4 (сосуды достигают линии смыкания листков слизистой полости матки), которую предлагают использовать специалисты, опубликовавшие рекомендации консенсуса IETA (International Endometrial Tumor Analysis) [19]. Недостатком этой методики является субъективизм, зависящий от опыта врача, настроек и технического уровня сканера.
Объективной оценкой является использование 3D-допплерографии, позволяющей при соблюдении рекомендаций по настройке опции получить цифровые значения васкуляризационного индекса (VI), потокового индекса (FI) и васкуляризационно-потокового индекса (VFI). Доказана более высокая точность применения VI, FI и VFI по сравнению со стандартным энергетическим допплером [20].
С начала 2000-х гг. появились работы, посвященные оценке кровоснабжения срединных структур матки с помощью 3D-допплерографии [21]. С этого же времени исследователи проявляют неослабевающий интерес к васкуляризации эндометрия и субэндометриальной зоны у женщин, страдающих бесплодием [22–25]. Выявление этих нарушений у женщин с бесплодием и невынашиванием беременности позволит повысить качество диагностики, провести соответствующее лечение, подготовить женщину к беременности. Однако работ, где представлены результаты ультразвукового исследования кровотока матки пациенток, у которых эндометрит является фактором бесплодия, как в нашей стране, так и за рубежом крайне мало [16, 26, 27].
Цель исследования состояла в оценке гемодинамики матки, в том числе эндометрия, у женщин с ХЭ в зависимости от длительности бесплодия.
Материалы и методы
Проведен ретроспективный анализ ультразвукового исследования 581 женщины репродуктивного возраста, страдающих бесплодием, у которых диагностирован эндометрит. Возраст пациенток колебался от 26 до 35 лет. Все женщины были разделены на группы в соответствии с длительностью бесплодия: менее 2 лет (1-я группа), от 2 до 5 лет (2-я группа) и более 5 лет (3-я группа). В I фазе менструального цикла находились 468 (80,6%) человек и во II фазе – 113 (19,4%).
Клиническая диагностика эндометрита осуществлялась на основании жалоб, данных анамнеза, бимануального исследования, результатов цитологического исследования мазков из цервикального канала, иммуногистохимического исследования эндометрия, полученного при пайпель-биопсии или гистероскопии, гистологического исследования эндометрия после гистероскопии. Цитологическое исследование отделяемого цервикального канала и влагалища проведено 581 (.
IETA оценка эндометрия и определение риска развития рака эндометрия по балльной системе (REC score)
Dueholm, C. Møller, S. Rydbjerg, E. S. Hansen, G. Ørtoft
P.G.Leone, D.Timmerman, T.Bourne, L.Valentin, E.Epstein, S.R.Goldstein, H.Marret, A.K.Parsons, B.Gull, O.Istre, W.Sepulveda, E.Ferrazzi, T.Van den Bosch
Трансвагинальное ультразвуковое обследование имеет большое значение в диагностике рака эндометрия у женщин с постменопаузальным кровотечением. Женщины с эндометрием толщиной ≤ 4 мм, измеренным с помощью трансвагинального сканирования, имеют низкий риск развития рака эндометрия (1 на 100 случаев, если они не принимают заместительную гормональную терапию, 1 на 1000, если они принимают терапию). У женщин с постменопаузальным кровотечением и толщиной эндометрия ≥ 5 мм присутствует высокий риск рака эндометрия (1 на 4 случая), поэтому необходимо получить качественный внутриматочный соскоб для гистологического анализа. Ультразвуковое исследование может предоставить информацию об индивидуальном риске злокачественных новообразований у женщин в постменопаузе с кровотечением и толщиной эндометрия ≥ 5 мм.
Наше исследование включает женщин с постменопаузальным кровотечением и толщиной эндометрия ≥ 5 мм, который был измерен трансвагинальным датчиком. Исследование проводилось в Университетской клинике в Орхусе, Дания, в период с ноября 2010 по февраль 2012. Всем женщинам проводили трансвагинальное сканирование (TVS) и гель-инфузионную сонографию (ГИС), все были запланированы на гистероскопию с резектоскопической биопсией и дополнительным выскабливанием для оценки внутриматочной патологии (Таб.1).
Таблица.1. Схема отбора пациентов для исследования.
Трансвагинальное сканирование (TVS)
TVS проводили на аппарате Voluson E8 Expert, оборудованном эндовагинальным датчиком (6-12 МГц), согласно протоколу сканирования. Параметры допплерографии была настроены заранее, стандартизировано (частота 6 МГц, коэффициент усиления мощности допплера 50, динамический диапазон 10 дБ; персистентность 2, цвет карты 1, фильтр 3).
TVS сканирование включало визуальную оценку следующих параметров, определенных Международной Группой Опухолевого Анализа Эндометрия (IETA): толщина эндометрия, его эхогенность (гипер-, гипо-, и изоэхогенный, гомо / гетерогенный), кистозный компонент (да / нет), если есть, то ровные или неровные пределы, границы эндометрия (ровные или неровные, гомо- / гетерогенные), линия смыкания (да / нет), прервана (да / нет)).
Гель-инфузионная сонография (ГИС)
ГИС была проведена после TVS. Мы использовали небольшой гибкий стерильный катетер, оснащенный шприцем на 10 мл, содержащий Instillagel® (E.Tjellesen A / S, Lynge, Дания), который вводился в полость матки. У пациентов с непроходимой шейкой матки мы использовали небольшой расширитель Гегара. Введение геля в полость матки проводили под контролем УЗИ.
Полость матки затем сканировали в сагиттальной и поперечной плоскостях, оценивая те же параметры, что и для обычного TVS. Также были оценены: наличие образования, его локализацию и процент поражения эндометрия (то есть повреждено ≤ 25% поверхности) (да / нет); Структура поверхности локального повреждения (равномерная / неравномерная); Структура общей поверхности эндометрия (гладкая, полиповидная, неровная).
Гистероскопия
Амбулаторная гистероскопия проведена всем пациентам с использованием местной или общей анестезии. У 112 пациентов гистероскопия была выполнена сразу после ультразвукового исследования, у других пациентов при следующем визите в течение 3-х недель после ультразвукового исследования. Во время гистероскопии были предприняты попытки удалить всю ткань из полости матки. У одного пациента были отобраны от трех до пяти образцов эндометрия.
Расчет риска развития рака эндометрия по балльной системе
(Risk of endometrial cancer score (REC score))
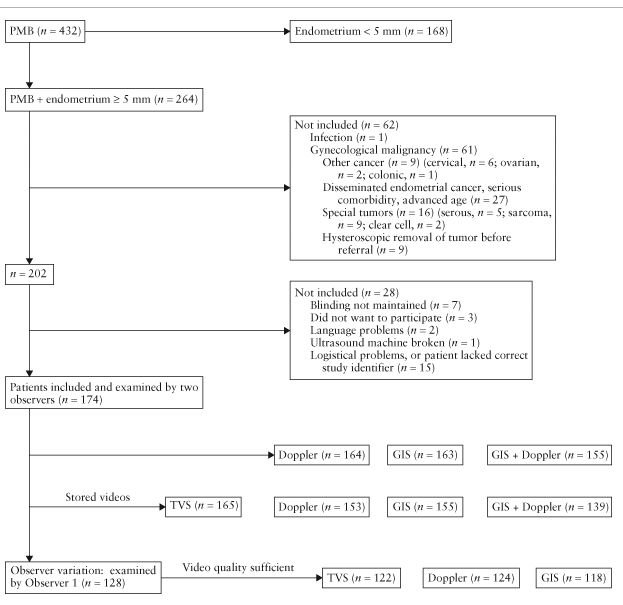
На основании наших анализов, мы разработали систему подсчета баллов риска развития рака эндометрия (Рис.1). Система подсчета баллов включила индекс массы тела (≥30 = 1 балл), толщину эндометрия (≥10мм = 1 балл), (≥15мм = 1 балл), наличие васкуляризации, доминантный сосуд (присутствует = 1 балл), несколько сосудов (присутствуют = 1 балл), большие сосуды (присутствуют = 1 балл) и плотно расположенные сосуды (присутствуют = 1 балл), прерывистая эндомиометриальная зона (присутствует = 1 балл) и неровная поверхность эндометрия при ГИС (присутствует = 1 балл). Добавление этих значений составляет балл риска развития рака эндометрия. Количество баллов 3 для TVS или 4 для ГИС показали хорошие результаты при сканировании и правильно диагностировали высокий уровень развития рака эндометрия у около 90% всех пациентов.
Рис.1. Схематическое изображение определения риска развития рака эндометрия по балльной системе.
УЗИ параметры исследования эндометрия определены Международной Группой Опухолевого Анализа Эндометрия (IETA)
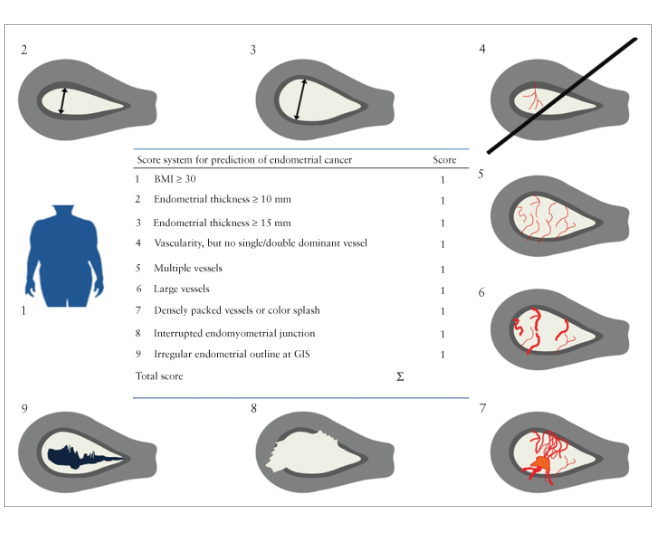
Толщина эндометрия измеряется в сагиттальной плоскости. Калиперы должны быть размещены на границе эндометриально-миометриального слоя, перпендикулярно средней линии эндометрия (рис.2). Когда присутствует жидкость, тогда измеряется толщина отдельных частей эндометрия и сумма их записывается (рис.2b).
Рис.2. Схематическое и УЗ-изображение измерения эндометрия в норме (а), и при наличии внутриматочной жидкости (b).
Эхогенность эндометрия оценивается по сравнению с эхогенностью миометрия, как гиперэхогенный, изоэхогенный или гипоэхогенный.
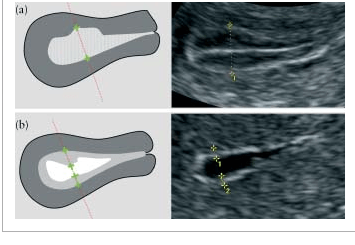
Гомогенность эндометрия оценивается по его структуре. “Гомогенный” эндометрий является однородным и имеет трехслойную структуру (Рис.3). “Гетерогенный” эндометрий описывается, если есть неоднородность структуры, асимметрия или кистозные образования (Рис.4).
Рис.3. “Гомогенный” эндометрий: (a) схематическое изображение трехслойного эндометрия, (b) гипоэхогенный, (c) гиперэхогенный, (d) изоэхогенный.
Рис.4. “Гетерогенный” эндометрий: на однородном фоне визуализируются кистозные образования с ровными краями (а), на однородном фоне наблюдаются кистозные образования с неровными краями (b), гетерогенный фон без кистозных участков (с), на гетерогенном фоне присутствуют кистозные образования с ровными краями (d) и на гетерогенном фоне кистозные образования с неровными краями (е).
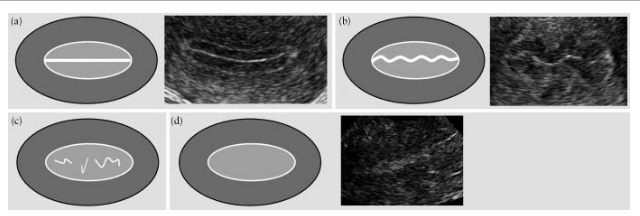
Эндометрий считается “линейным”, если линия смыкания листков эндометрия определяется как прямая, и “нелинейным”, если линия смыкания визуализируется как “зазубренная” или “прерванная” или вообще отсутствует (рис.5).
Рис.5. Линия смыкания листков эндометрия: “линейная” (а), “зазубренная” (b), “прерванная” (с) и такая, которая не визуализируется (d).
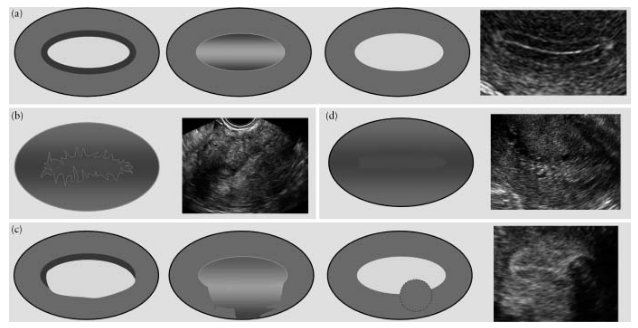
Эндометриально-миометриальный участок описывается как “ровный”, “неровный”, “прерванный” или “неопределенный” (рис.6).
Рис.6. Эндометриально-миометриальный участок: “ровный” (a), “неровный” (b), “прерванный” (c) и “неопределенный” (d).
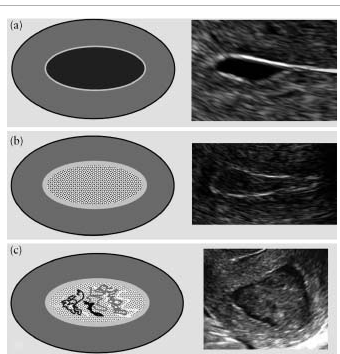
Внутриматочная жидкость описывается как анэхогенная, изоэхогенная, смешанной эхогенности (Рис.7).
Рис.7. Внутриматочная жидкость: (a) гипоэхогенная, (b) изоэхогенная, (c) смешанной эхогенности.
Оценка допплерометрии
Настройки допплера должны быть скорректированы, чтобы обеспечить максимальную чувствительность (частота ультразвука не менее 5,0 МГц, частота повторения импульсов (PRF) 0,3-0,9 кГц, фильтр стенки сосудов 30-50 Гц, усиление цвета допплера должно быть уменьшено до тех пор, пока все цветовые артефакты не исчезнут).
ОБСУЖДЕНИЕ
Мы построили систему подсчета баллов (REC), что позволяет эффективно отличать доброкачественные и злокачественные образования эндометрия. REC система подсчета баллов правильно определила новообразования у девяти из 10 женщин в постменопаузе с толщиной эндометрия ≥ 5 мм. Подход расчета баллов может быть использован для снижения количества проведения инвазивных процедур.
Мы пользовались терминами и классификацией, определенными Международной Группой Опухолевого Анализа Эндометрия (IETA), которые можно использовать для измерения и описания патологии с локализацией в полости матки. Основная цель данной работы заключается в создании списка терминов и определений, которые могут быть использованы как в ежедневной практике врачей, так и в научных исследованиях.
Интраэндометриальный кровоток что это
Согласно существующим представлениям, все причины безуспешности попыток ЭКО, в которых удается выполнить перенос полученных in vitro эмбрионов, могут быть связаны либо с их неспособностью к внутриматочной нидации (эмбриональный фактор), либо со снижением рецептивности эндометрия (эндометриальный фактор) [1, 2]. Необходимость совершенствования эндометриального фактора программ ЭКО определяется тем, что при использовании морфологически хороших эмбрионов, полученных при оплодотворении донорских ооцитов в программах ЭКО-ОД, только ненамного повышает частоту успешных имплантаций в сравнении со стандартным ЭКО (где качество переносимых эмбрионов может быть не столь хорошим). Это можно видеть из отчета РАРЧ за 2013 г. (опубликован в 2015 г.), согласно которому частота наступления беременности на перенос эмбрионов (ЧНБпэ) в программе ЭКО-ОД превысила лишь на 5,3% аналогичный показатель в стандартной программе ЭКО (43,8% против 38,5%) [3]. Данный факт указывает на то, что резерв для дальнейшего повышения эффективности ЭКО в посттрансферном периоде ассоциируется с эндометриальным, а не с эмбриональным фактором, что собственно и определяет актуальность оценки состояния рецептивности эндометрия и поиск подходов к ее повышению.
Для эндометрия, способного обеспечивать успешную имплантацию, типичны вполне определенные признаки [2, 4—6]:
1) морфологические признаки, определяемые при стандартном ультразвуковом исследовании (УЗИ):
а) толщина; б) макроструктура;
2) особенности кровоснабжения;
3) ультраструктурные изменения в клетках поверхностного слоя;
4) особенности популяционного состава присутствующих иммунокомпетентных клеток;
5) метаболические характеристики (уровень многочисленных молекулярных и генетических регуляторов эндометриального гомеостаза).
Соответственно выраженные отклонения морфологических, гемодинамических, ультраструктурных, иммунологических и молекулярно-генетических параметров, характеризующих нормальное прегравидарное состояние эндометрия, могут обусловливать снижение его рецептивности. Это в свою очередь означает, что перечисленные 5 групп оцениваемых параметров эндометриального гомеостаза потенциально могут рассматриваться как маркеры эндометриальной рецептивности.
Термином «маркер эндометриальной рецептивности» принято обозначать любой (инструментальный или лабораторный) показатель, изменения которого в той или иной мере влияют на клинические исходы ЭКО, оцениваемые по показателю ЧНБпэ [6, 7].
Для практикующих врачей маркеры эндометриальной рецептивности интересны тем, что получаемая при их определении информация может служить, во-первых, прогнозированию наступления индуцированной беременности и, во-вторых, контролю эффективности любой дополнительной терапии, ставящей целью улучшение рецептивных свойств эндометрия.
Толщина эндометрия в оценке его рецептивности, понятие «тонкий» эндометрий
По данным УЗИ, толщина эндометрия под влиянием стимулирующего эффекта эстрогенов в естественных циклах к моменту овуляции у подавляющего большинства фертильных женщин колеблется от 8—12 мм [6—8]. Такие же значения толщины эндометрия отмечаются и у большинства пациенток с наступившей беременностью в стимулированных циклах стандартных программ ЭКО в день введения триггера овуляции при наличии в яичниках хотя бы единственного нормально развивающегося фолликула [6, 7]. Исходя из этих наблюдений, логично рассматривать именно такую толщину прегравидарного эндометрия (8—12 мм) в преовуляторном периоде, к завершению фолликулярной фазы как оптимальную для имплантации переносимого эмбриона, хотя в литературе описаны случаи наступления беременности даже при его толщине 4 мм [9]. Соответственно в стандартных программах ЭКО «тонким» следовало бы считать эндометрий, не достигающий к моменту завершения контролируемой стимуляции положенных оптимальных значений, т. е. имеющий толщину менее 8 мм на фоне регистрируемого в яичниках нормального роста хотя бы одного фолликула. В программах ЭКО с переносом размороженных эмбрионов в проводимых у реципиентки циклах заместительной гормональной терапии (ЗГТ) наличие «тонкого» эндометрия также можно констатировать при его толщине менее 8 мм на день назначения прогестерона, т. е. к концу монотерапии эстрогенами, имитирующей фолликулярную (пролиферативную) фазу цикла.
Таким образом, эндометрий с толщиной менее 8 мм к моменту завершения естественной (в натуральных циклах), искусственной (при применении индукторов фолликулогенеза) или имитируемой (при ЗГТ эстрогенами) фолликулярной фазы целесообразно обозначать как «тонкий». А сам феномен недостаточности развития (рост) эндометрия в пролиферативной фазе цикла в отсутствие признаков гипоэстрогении следует рассматривать как проявление резистентности к эстрогенной стимуляции.
К сожалению, не все специалисты применяют словосочетание «тонкий эндометрий» для обозначения преовуляторного эндометрия с толщиной именно менее 8 мм. По мнению многих из них, «тонким» следует считать эндометрий лишь с такой толщиной, при которой отмечается статистически значимое снижение ЧНБпэ. С этой точки зрения, «тонким» эндометрием (т.е. достоверно ухудшающим клинические исходы ЭКО), по разным данным, следует считать преовуляторный эндометрий с толщиной:
Следует отметить, что именно из-за расхождений в представлении о том, какая именно толщина преовуляторного эндометрия должна соответствовать определению «тонкий», или гипоплазированный эндометрий, невозможно составить точное представление об истинной распространенности случаев отставания толщины эндометрия ко дню введения хорионического гонадотропина человека (чХГ) от минимального нормативного значения (если таковым считать 8 мм) в программах стандартного ЭКО. По этой же причине остается неизвестной и частота случаев отставания толщины эндометрия от минимального норматива к моменту завершения монотерапии эстрогенами при подготовке эндометрия реципиенток к переносу размороженных эмбрионов.
В приложении к вопросу о влиянии феномена «тонкого», или гипоплазированного эндометрия на результаты ЭКО нет единого мнения. Знакомство с литературой показывает, что одни [9, 14] исследователи вообще отрицают негативное влияние «тонкого» эндометрия на клинические исходы ЭКО, тогда как другие [11, 12] рассматривают этот феномен как весьма важный фактор, препятствующий успешной имплантации. Причиной таких расхождений, вероятно, является зависимость ухудшения результатов лечения от степени отставания толщины преовуляторного эндометрия от минимального нормативного значения. Следует предположить, что авторы, у которых под наблюдением находились в основном пациентки с умеренным отставанием развития эндометрия (6—8 мм в день введения чХГ), приходили к выводу об отсутствии негативного влияния «тонкого» эндометрия на его рецептивность, определяющую клинические исходы ЭКО. И наоборот, исследователи, у которых среди набранных «профильных» больных была значительнее доля пациенток с более выраженным отставанием развития эндометрия (5 мм и менее к моменту завершения фолликулярной фазы), суммарно констатировали статистически значимое ухудшение результатов лечения по показателю ЧНБпэ, которое они также связывали с феноменом «тонкого», или гипоплазированного эндометрия.
Вопрос о механизмах отрицательного влияния «тонкого» эндометрия на частоту имплантации переносимых эмбрионов остается открытым. Пока высказывается лишь предположение о том, что при слишком тонком эндометрии бластоциста в процессе имплантации очень близко соприкасается со спиральными артериями и находится в области высокой концентрации кислорода, что негативно отражается на ее способности к нидации. Последнее косвенно подтверждается работами, в которых было показано, что культивирование invitro бластоцист в условиях низкой концентрации кислорода сопровождается их большей выживаемостью и более высокой способностью к успешной имплантации при последующем переносе в матку [16]. Также можно предположить, что в «тонком» эндометрии создаются предпосылки для учащения отклонений в метаболизме многочисленных биологических субстанций, которые контролируют тканевый гомеостаз в эндометрии и соответственно влияют на его рецептивность.
Эхо-структура прегравидарного эндометрия как маркер его рецептивности
На основании своих наблюдений S. Chen и соавт. [17] указывают, что наличие в преовуляторном периоде трехслойного (вместо монослойного) паттерна эндометрия ассоциируется с более высокой вероятностью успешной имплантации. Эта закономерность проявляет себя как при нормальной (≥8 мм), так и при недостаточной ( 3,0).
В ряде исследований [26, 32] выявлена корреляция между недостаточной толщиной преовуляторного эндометрия ( 3,0, то в таких случаях вероятность наступления беременности равна нулю [35]. С учетом этого обстоятельства при прогнозировании исходов ЭКО ими рекомендуется одновременный учет толщины эндометрия и показателя РI.
Другие специалисты [36] высказывают мнение, что для прогноза наступления беременности целесообразно одновременно учитывать конечную диастолическую скорость в маточных артериях, толщину и структуру эндометрия. По их мнению, вероятность наступления беременности резко снижается при сочетании в преовуляторном периоде уменьшения конечной диастолической скорости с недостаточной толщиной эндометрия и отсутствием его трехслойности.
Также можно найти сообщения [37], согласно которым для оценки рецептивности эндометрия целесообразно одновременно оценивать показатели S/D и IR в спиральных артериях в день введения триггера овуляции. Причем получаемые при этом результаты рекомендуется использовать в составе достаточно сложной формулы, в которой фигурируют еще и параметры, учитывающие:
— оптическую плотность экспрессии лейкемияингибирующего фактора в поверхностном и железистом эпителии эндометрия в период предполагаемого «окна имплантации» в цикле, предшествующем проведению ЭКО (для получения такой информации надо выполнить биопсию эндометрия в нестимулированном цикле с проведением достаточно сложного иммуногистохимического исследования полученных образцов);
— содержание сосудистого эндотелиального фактора роста в цервикальной слизи в день трансвагинальной пункции фолликулов.
Следует, однако, подчеркнуть, что предлагаемые к допплерографической оценке спиральные артерии могут не визуализироваться (по признанию самих же авторов, предлагающих тестировать кровоток в этом типе артерий) почти у 30% женщин как с наступившей, так и с ненаступившей беременностью [37]. Очевидно, что это обстоятельство существенно обесценивает получаемую информацию о состоянии рецептивности эндометрия, основанную на исследовании кровотока именно в спиральных артериях.
Таким образом, возможность оценки состояния рецептивности эндометрия на основе данных допплерометрии сосудов матки, дополняемых результатами стандартного УЗИ и, возможно, определениями некоторых молекулярных регуляторов эндометриального гомеостаза, по-прежнему представляется малоубедительной.
Зависимость рецептивности эндометрия от его ультраструктуры
В период «окна имплантации» имеют место значительные ультраструктурные изменения в морфологии эндометриальных эпителиальных клеток. Сканирование электронным микроскопом поверхности эпителия в период его максимальной рецептивности выявляет эктоплазматические протрузии, называемые пиноподиями [38, 39]. В своей эволюции эти образования проходят три стадии: развивающиеся, полностью развитые и регрессирующие пиноподии. Функциональная роль развитых пиноподий в периоде «окна имплантации» состоит, вероятно, в облегчении прикрепления бластоцисты к поверхностному слою эндометриальных эпителиальных клеток в области их апикального пространства. Поэтому пиноподии можно рассматривать как специфический ультраструктурный маркер рецептивности эндометрия, поскольку обнаруживаемые отклонения динамики их образования, плотности экспрессии или нарушения их микроструктуры могут становиться причиной затруднения имплантации переносимых эмбрионов [39]. Тем не менее следует иметь в виду, что слишком многие случаи снижения рецептивности эндометрия, как показывает практика, не связаны именно с нарушением функции пиноподий. У многих пациенток с безуспешным использованием ЭКО в анамнезе последующее исследование пиноподий в периоде «окна имплантации» не выявляет каких-либо отклонений в эволюции ультраструктуры поверхности эпителиальных клеток. По этой причине ряд исследователей [40] приходят к выводу, что образование пиноподий не может быть точным (во всяком случае, единственным) маркером, характеризующим рецептивность эндометрия.
Показатели клеточного иммунитета в оценке рецептивности эндометрия
В эндометрии здоровых фертильных женщин обнаруживается большое разнообразие иммунокомпетентных клеток, количество и характеристики которых варьируют в течение менструального цикла. На примере инфертильных пациенток с эндометриозом показано [2, 41—43], что отсутствие имплантации часто ассоциируется c обнаруживаемыми в крови и аспирате эндометрия отклонениями фракций иммунокомпетентных клеток, несущих антигены:
— CD8+ (цитотоксические Т-клетки);
— CD56+ (натуральные киллеры и активированные Т-клетки);
— CD14+ (моноциты и макрофаги);
— CD19+ (дифференцирующиеся В-лимфоциты);
— CD3+ (общая популяция Т-клеток).
S. Chen и соавт. [44] отмечают особую значимость специализированных регуляторных лимфоцитов, несущих одновременно поверхностные антигены CD4+, CD25+ и FoxP3. Эта Т-клеточная субпопуляция, обозначаемая авторами как T-regs, контролирует и ослабляет иммунный ответ, тормозит высвобождение цитокинов и медиаторов воспаления, поддерживая толерантность к имплантирующейся бластоцисте и развивающемуся плоду. Установлено, что у женщин с эндометриозом снижается доля T-regs в общей популяции CD4+ лимфоцитов, что потенциально может провоцировать аутоиммунные реакции как препятствующие успешной имплантации переносимых эмбрионов, так и увеличивающие ранние репродуктивные потери.
Нельзя исключить, что ослабление рецептивности эндометрия, ассоциируемое с отклонениями местного клеточного иммунитета, может сопровождать не только эндометриоз, но и другие гинекологические заболевания. По этой причине при уточнении рецептивности эндометрия (в особенности у пациенток с подтвержденными неудачами имплантации в анамнезе), вероятно, целесообразно оценивать иммунный статус с определением субпопуляционного состава, несущего указанные выше CD-антигены [43, 44].
Молекулярные и генетические маркеры рецептивности эндометрия
В литературе можно найти сообщения, что рецептивность эндометрия может страдать при отклонениях в местной продукциии/или тканевой рецепции и экспрессии:
— лейкемияингибирующего фактора (LIF) [47];
— сосудисто-эндотелиального фактора роста (VEGF) [48];
— гепаринсвязывающего эпидермального фактора роста (ГС-ЭФР) [49];
— матриксных металлопротеиназ (ММР) и их тканевых ингибиторов (ТIMP) [50];
Перечисленные молекулярные маркеры могут определяться в крови, секрете эндометрия или в самой ткани эндометрия, полученной при его биопсии.
При изучении состава секрета эндометрия (секретомика) в последние годы активно применяют электрофорез в полиакриламидном геле в двух проекциях и высокочувствительную жидкостную хроматографию, которые позволяют с высокой точностью характеризовать уровень интересующих субстратов. С помощью этих методов, например, было установлено, что в период «окна имплантации» поддержание высокой рецептивности эндометрия ассоциируется со значительным увеличением концентрации 9 липидов (простагландинов E2, F1α, F2α, а также соединений этаноламина с различными жирными кислотами) [57]. С другой стороны, усиленное образование аполипопротеина А1 в указанные сроки может препятствовать имплантации, что было продемонстрировано в контингенте пациенток с эндометриозом [58].
При исследовании биоптатов эндометрия предметом изучения может быть его водорастворимая фракция. Так, В.А. Бурлев и соавт. [59] описывают метод исследования выделяемой из гомогената ткани эндометрия его водорастворимой фракции для определения особенностей ее белкового, липопротеидного и гликопротеидного состава. Получаемая при этом информация о количестве обнаруживаемых фракций протеидов, липопротеидов и гликопротеидов (насчитывающих десятки конкретных субстанций), по мнению авторов, позволяет диагностировать недостаточность рецептивных свойств эндометрия и подбирать медикаментозную терапию.
Полученная при биопсии ткань эндометрия может быть исследована и с применением иммуногистохимического анализа. С его помощью возможно характеризовать экспрессию специфических белков, а также рецепторов к многочисленным лигандам, контролирующим эндометриальный гомеостаз, и к гормонам. Так, по предложению В.А. Бурлева и соавт. [51], для уточнения состояния рецептивности эндометрия в период ожидаемого «окна имплантации» у всех пациенток в скрининговой манере следует сначала уточнить концентрацию L-селектина в крови. Далее у пациенток с его недостаточной сывороточной концентрацией (менее 1710 нг/мл) необходимо провести иммуногистохимическое исследование биоптата эндометрия для анализа экспрессии L-селектина в строме эндометрия и специфического селектинового лиганда МЕСА-79 в поверхностном эпителии. При высокой экспрессии L-селектина в строме эндометрия и низкой экспрессии МЕСА-79 в поверхностном эпителии и эпителии желез авторы рекомендуют проведение прегравидарной подготовки (в качестве которой ими предлагается использовать электроимпульсную физиотерапию в комбинации с циклической ЗГТ) перед программой ЭКО.
Другие специалисты указывают на целесообразность иммуногистохимического определения в биоптатах эндометрия уровня экспрессии стромальными клетками ингибитора активатора плазминогена 1-го типа (PAI-1) [60, 61]. Чрезмерно высокий уровень PAI-1 сопровождается подавлением активаторов плазминогена, секретируемых бластоцистой на этапе адгезии, из-за чего снижается вероятность успешной имплантации [62]. Причинами увеличения экспрессии PAI-1 могут выступать воспалительные и опухолевые процессы, заболевания соединительной ткани, спаечный процесс, атеросклероз, ожирение, эндометриоз. Возрастанию уровня PAI-1 способствует также мутация (полиморфизм) гена PAI-1 5G/4G, т. е. увеличение содержания белка PAI-1 в строме эндометрия может быть не только связано с приобретенными причинами, но и носить наследственный характер [60, 63].
Высказывается также предложение определять в эндометрии иммуногистохимическим методом уровень экспрессии LIF, TGF-β1 и VEGF [37] с использованием коммерческих наборов антител и системы компьютерного анализа микроскопических изображений Морфология 5.2. В процессе такого анализа проводится оценка относительной площади экспрессии и оптической плотности LIF, TGF-β1 в железистом и поверхностном эпителии и в строме эндометрия. Относительную площадь экспрессии рассчитывают как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражают в процентах. Оптическую плотность экспрессии названных показателей измеряют в условных единицах. Использование данного метода показало, что экспрессия LIF и VEGF тканью эндометрия достоверно более высокая в группе беременных женщин по сравнению с женщинами, у которых беременность не наступила в результате ЭКО. По мнению авторов, полученные данные можно применять в качестве предиктивных критериев адекватной рецептивности эндометрия, т. е. для прогнозирования клинических исходов ЭКО.
Кроме того, в последние годы при исследовании биоптатов эндометрия отдельные специалисты предлагают использовать еще и молекулярно-генетические методы (геномика), с помощью которых изучают экспрессию генов, функция которых связана с клеточным метаболизмом, железистой секрецией, дифференцировкой клеток, межклеточной коммуникацией, адгезией, механизмами репарации и регуляции протеолиза [64, 65]. Для описания экспрессионного профиля эндометрия можно применять технологию микрочипов и полимеразную цепную реакцию. Получаемая при этом информация служит характеристике состояния рецептивности эндометрия и соответственно может быть использована для прогнозирования клинических исходов ЭКО, оцениваемых на посттрансферном этапе.
Заслуживает внимания, что некоторые из выполнявшихся исследований по идентификации генетических маркеров эндометриальной рецептивности уже принесли практический результат. Так, в литературе имеются сообщения о том, что для оценки способности эндометрия обеспечивать успешную имплантацию полезно исследовать экспрессию генов Ced-3, Сed-4, Bcl-2, Bax, Fas, TNF-α, которые влияют на баланс между апоптозом и пролиферацией [66]. Известно, что максимальная активность апоптоза отмечается в норме в эпителиальных клетках эндометрия в местах тесного контакта с бластоцистой. Апоптоз эпителиальных клеток эндометрия является важным механизмом, позволяющим эмбриону преодолевать эпителий эндометрия, в результате чего достигается непосредственный контакт трофоэктодермы с базальной мембраной и становится возможна стромальная инвазия. Соответственно при нарушениях экспрессии перечисленных выше генов могут происходить сбои в механизмах регуляции апоптоза, что приводит к снижению готовности эндометрия к имплантации бластоцисты [66].
Высказываются также предложения определять экспрессию НОХ-генов, кодирующих транскрипционные факторы, контролирующие программы формирования органов и тканей. По данным ряда авторов [67], экспрессия НОХА-10 гена, участвующего в регуляции роста, дифференциации и рецептивности эндометрия, оказывается сниженной в период «окна имплантации» у пациенток с подтвержденной безуспешностью имплантации. Предполагается, что снижение экспрессии НОХА-10 (спровоцированное, например, его гиперметилированием) может приводить к устойчивости действия прогестерона в эндометрии, так как в норме НОХ-гены модулируют многие функции прогестерона [68]. Данный механизм сохранения устойчивости действия прогестерона может объяснять случаи неудачи терапии, направленной на повышение рецептивности эндометрия у пациенток с безуспешной имплантацией в анамнезе.
Есть сообщения, в которых авторы предлагают выполнять молекулярно-генетическое исследование биоптата эндометрия на предмет экспрессии сразу 238 генов. Рекомендуемый к определению массив генов (представленных в одном генетическом чипе) выбран этими специалистами в результате предварительно проведенного анализа диагностической значимости каждого из них для оценки рецептивности эндометрия. Данный метод, получивший название Endometrial Receptive Array (ERA), по мнению его разработчиков, позволяет подтвердить наличие удовлетворительной рецептивности в конкретном образце эндометрия со специфичностью 88% и чувствительностью 99% [69].
Другие исследователи для оценки имплантационного потенциала эндометрия рекомендуют анализировать эндометриальную экспрессию 179 генов, которые они называют RAGs (Receptivity Associated Genes) [70].
Приходится констатировать, что авторы, описывающие множество молекулярных и генетических факторов, по их мнению, контролирующих эндометриальный гомеостаз и процесс имплантации, сами же признают, что до настоящего времени не имеют четкого представления, как все эти факторы взаимодействуют друг с другом [59]. По этой причине пока представляется неясным, насколько отклонения какого-то одного из молекулярных или генетических показателей (позиционируемых как «маркеры эндометриальной рецептивности») могут быть компенсированы изменениями других регуляторов эндометриального гоместаза. Из всего этого следует, что вопрос о том, какой из молекулярно-генетических регуляторов эндометриального гомеостаза может быть еще и надежным, заслуживающим доверия, маркером эндометриальной рецептивности все еще остается открытым.
Таким образом, складывается впечатление, что так называемые «высокотехнологичные» молекулярные и генетические методы оценки состояния рецептивности эндометрия в большей степени пригодны для формирования фундаментальных представлений о процессе имплантации, но не для рутинного прогнозирования клинических исходов ЭКО и мониторинга лечения, направленного на повышение частоты имплантации. Очевидно, что сомнительная диагностическая ценность всех этих методов, сочетающаяся к тому же с трудоемкостью их выполнения и дополнительными материальными расходами на соответствующее сложное лабораторное оборудование и дорогостоящие реактивы, не добавляет популярности этим технологиям и вполне закономерно ограничивает их внедрение в широкую клиническую практику.
Заключение
Обзор описываемых в литературе существующих диагностических методов оценки рецептивности эндометрия позволяет заключить, что из всего их многообразия для рутинного использования, по нашему мнению, вероятно, пригодны лишь ультразвуковые методы, предоставляющие информацию о толщине и макроструктуре эндометрия. Также для этой цели в перспективе можно использовать и допплерографическую оценку маточного кровотока, особенно после того, как будут идентифицированы допплерографические показатели, которые действительно характеризуют эндометриальную рецептивность.
Специалистам, полагающим полезным дополнение диагностического этапа ЭКО методами, предусматривающими иммунологические, микроструктурные (с применением электронной микроскопии) и разного рода молекулярно-генетические исследования, не следует забывать о высокой стоимости процедуры ЭКО. Цена лечения остается высокой даже при выполнении ЭКО в его простейшем стандартном варианте с минимальным набором диагностических процедур. На наш взгляд, представляется неоправданным рекомендовать расширение диагностики в программах ЭКО за счет тестирования дополнительных маркеров эндометриальной рецептивности, поскольку это ведет к еще большему удорожанию лечения, не гарантируя повышения его эффективности. Подобные исследования необходимо продолжать в рамках научных разработок фундаментальной медицины и патофизиологии процесса имплантации.