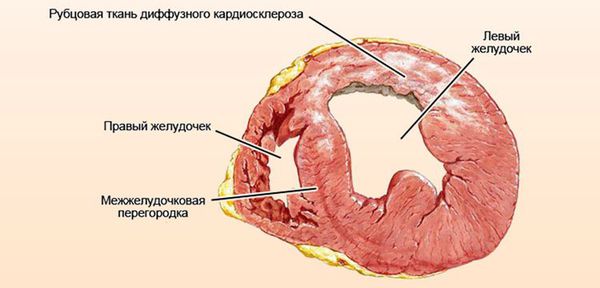
Истощение левого желудочка сердца что такое
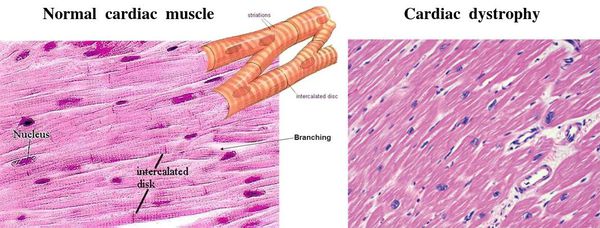
Дистрофия миокарда

Этиология
К причинами дистрофии относят:
Дистрофия миокарда может патологически не изменяться или наоборот ярко проявить себя разными дегенерализованными изменениями – жировым, белковым, восковидным перерождением мышечного волокна, мутными набуханиями, жировыми инфильтратами.
Клиника
У больных самым главным признаком является одышка, со временем присоединяется сердцебиение, неприятное чувство в области сердца, утомляемость, слабость, апатия, снижение трудоспособности. При аускультации прослушиваются систолические шумы, артериальное давление понижается, пульс учащается. Из-за задержки воды при гипотиреозе в организме мышечные сегменты сердца набухают, сердечные мышцы отекают и сердце увеличивается в размере, сердечные толчки слабеют, тон становится глухим. На электрокардиограмме отмечается синусовая брадикардия.
Прогноз
Прогноз при дистрофии миокарда более благоприятный, если во время вылечить главное заболевание, которое сподвигло дистрофические изменения в миокарде.
Лечение
На первом месте нужно выявить и начать лечить основное заболевание (тиреотоксикозы, анемию, интоксикацию, а так же инфекционные очаги), то, что могло стать причиной основного заболевания. Назначают сердечно-сосудистые средства, по показаниям диетотерапию, лечебную физкультуру и физиотерапию.
Профилактика
Рекомендуют вовремя и тщательно вылечить главное заболевание, исключать болезни инфекционного характера, посещать эндокринолога, улучшать условия быта и труда, заниматься лечебной гимнастикой, вести здоровый образ жизни, отказаться от табакокурения и злоупотребления алкоголем.
Что такое миокардиодистрофия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мадоян М. А., кардиолога со стажем в 20 лет.
Определение болезни. Причины заболевания
Миокардиодистрофия (МКД) — группа вторичных обратимых поражений мышечного слоя сердца (миокарда) невоспалительной и некоронарогенной природы, которые обусловлены нарушением обмена веществ в миокарде и проявляются нарушением его функций. [1] [3] [5]
Общие признаки миокардиодистрофий:
Заболевание поражает разные возрастные группы, но чаще встречается после 40 лет. [2] [3] [4] [6] [7]
К миокардиодистрофии могут приводить самые различные внутренние и внешние факторы, нарушающие обмен веществ и энергии в тканях сердца. [1] [3] [5] [6] [7]
Внутренние (эндогенные) факторы — патологические процессы в организме, осложнившиеся миокардиодистрофией. Эндогенные факторы можно разделить на две большие группы: сердечные и несердечные причины возникновения МКД.
К сердечным факторам относятся:
Внешние (экзогенные) факторы — патологические воздействия на организм внешней среды и образа жизни:
Симптомы миокардиодистрофии
Характеристика симптомов при миокардиодистрофии:
Виды симптомов при МКД:
Патогенез миокардиодистрофии
В патогенезе миокардиодистрофии задействованы ткани сердца следующих видов:
При нарушении обменных процессов (электролитного, белкового, энергетического) нарушаются и функции сердечных тканей [1] [2] [5] : мышечные клетки утрачивают способность к нормальным сокращениям, нервные — к генерированию и проведению нормальных импульсов.
Причём поражается не сразу вся ткань сердца. Сначала возникают одиночные очаги дистрофии из нескольких клеток, а соседние неповреждённые клетки пытаются восполнить потерю и усиливают свою функцию. Затем количество и размер поражённых очагов увеличиваются, происходит их слияние, здоровые участки теряют способность компенсировать ухудшение работы, появляется расширение сердечных камер и выраженное нарушение функций сердца. [3]
Далее при прекращении воздействия причинного фактора начинается медленное восстановление структуры и функции клеток. [7] При продолжающемся воздействии причинного фактора происходит гибель клеток и их замещение рубцовой (соединительной) тканью. Соединительная ткань не способна сокращаться и расслабляться, генерировать и проводить импульсы, заменяться здоровыми клетками. Процесс формирования соединительной ткани в сердце называется кардиосклероз, на этом этапе у болезни уже не может быть обратного развития. [3]
Классификация и стадии развития миокардиодистрофии
Миокардиодистрофии классифицируют по причинам возникновения, перечисленным выше, а также по скорости развития и стадиям заболевания. [1] [5]
По скорости развития миокардиодистрофий различают:
По стадиям миокардиодистрофий выделяют:
Осложнения миокардиодистрофии
Диагностика миокардиодистрофии
Задачи диагностического процесса:
В диагностике миокардиодистрофий большое значение имеет грамотный расспрос и внимательный осмотр пациента. Также проводят электрокардиографию, УЗИ сердца, рентгенологичесское исследование органов грудной клетки, лабораторные исследование крови и мочи. [3] Специфических изменений результатов данных исследований для миокардиодистрофий нет, но они позволяют выявить заболевания — причины миокардиодистрофий. ЭКГ и УЗИ сердца могут проводить повторно для оценки положительной динамики функций сердца на фоне проводимого лечения.
Лечение миокардиодистрофии
Задачи лечебного процесса:
Своевременность и полнота устранения причины миокардиодистрофии определяет эффективность терапии и её сроки. На этапе устранения причины лечебный процесс сильно разнится у больных с разными причинами заболевания: [1] [2] [5] [6] [7]
Однако не всякую выявленную причину миокардиодистрофии можно устранить. Например, сами заболевания (длительные или хронические) и токсические препараты, применяемые для их лечения, лучевая терапия онкологических больных, некупируемые зависимости и другое.
Параллельно лечению основного заболевания, вызвавшего миокардиодистрофию (независимо от того, можно его устранить или нет), всех больных наблюдает кардиолог, по его назначению применяются виды лечения, направленные на улучшение обмена веществ в сердечных тканях, уменьшение симптомов и профилактику осложнений. [3]
Немедикаментозное лечение — нормализация образа жизни и питания, отказ от вредных привычек. Важно, чтобы пациент придерживался определённого режима дня, полноценно отдыхал и питался, обязательно имел регулярные, адекватные именно для него физические нагрузки, ежедневно находился на свежем воздухе. Также очень важно, чтобы в жизни пациента было увлекающее его дело. Немедикаментозное лечение — это зона ответственности пациента. Врач может порекомендовать, но реализовывать должен сам пациент.
Медикаментозное лечение:
Медикаментозное лечение — это зона ответственности врача. Ни в коем случае не надо пытаться лечиться самостоятельно. Каждый медикаментозный препарат (витамины и стимуляторы обменных процессов в том числе) может при определённых условиях нанести вред.
Прогноз. Профилактика
При I и II стадиях прогноз благоприятный. После устранения причинного фактора функции сердца могут полностью восстановиться. Длительность периода восстановления зависит от времени начала лечения (чем быстрее начата адекватная терапия, тем быстрее регрессируют патологические изменения) и от общего состояния организма (молодой возраст, отсутствие сопутствующих заболеваний способствуют быстрейшему восстановлению) и может составлять от года до многих лет. [7]
При III стадии прогноз зависит от выраженности изменений и наличия осложнений. Так как изменения в сердце уже необратимы, речь идёт не о восстановлении нормальных параметров сердца и хорошего самочувствия, а о замедлении прогрессирования хронической сердечной недостаточности и нарушений ритма. При III стадии необходимо пожизненное лечение, профессиональная деятельность ограничена либо невозможна, а при отсутствии лечения неблагоприятным становится и прогноз жизни.
Профилактика:
Современные подходы к лечению больных гипертрофической кардиомиопатией
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
В 2003 г. создан Международный комитет (ACC/ESC), объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2].
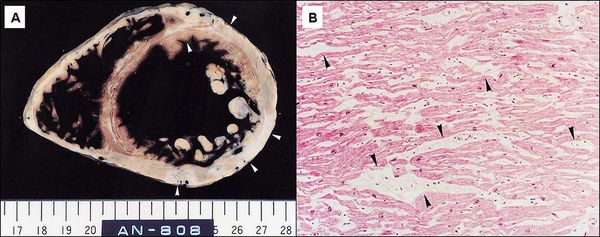
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
В настоящее время наблюдается повсеместный рост числа зарегистрированных случаев этой патологии как за счет внедрения в практику современных методов диагностики, так и, вероятно, в связи с истинным увеличением числа больных ГКМП [8, 9]. Согласно данным последних исследований, распространенность заболевания в общей популяции является более высокой, чем считалось ранее, и составляет 0,2% [10, 11]. ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста [12, 13]. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1–3% [14, 15], а в детском и подростковом возрасте у лиц с высоким риском ВС — 4–6% [16, 17].
Общепризнанна концепция о преимущественно наследственной природе ГКМП [18, 19]. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми [20, 21], при этом основной тип наследования — аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии. Мутации, которые ассоциируются с высокой пенетрантностью и плохим прогнозом, выражаются большей гипертрофией левого желудочка и толщиной МЖП, чем те, которые характеризуются низкой пенетрантностью и имеют хороший прогноз. Так, было показано, что лишь отдельные мутации ассоциированы с плохим прогнозом и высокой частотой ВС. К ним относятся замены Arg 403 Gln, Arg 453 Cys, Arg 719 Trp, Arg 719 Gln, Arg 249 Gln в гене тяжелой цепи β-миозина, InsG 791 в гене миозин-связывающего белка С и Asp 175 Asn в гене α-тропомиозина [23, 24, 25, 26]. Для мутаций в гене тропонина Т характерна умеренная гипертрофия миокарда, однако прогноз достаточно неблагоприятен, а вероятность внезапной остановки сердца высока [27]. Другие генетические аномалии, как правило, сопровождаются доброкачественным течением и благоприятным прогнозом или занимают промежуточное положение по тяжести вызываемых ими проявлений.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, Москва