Изотопный состав что это
СОСТАВ ИЗОТОПНЫЙ
Смотреть что такое “СОСТАВ ИЗОТОПНЫЙ” в других словарях:
Изотопный состав воды — Изотопный состав воды процент содержание молекул с различной изотопной массой (изотопологов) в воде. Содержание воды, состоящей из лёгких стабильных изотопов 1H216O («лёгкой воды», в отличие от содержащей повышенное количество тяжелого… … Википедия
СОСТАВ ВОДЫ — совокупность примесей в воде минеральных и органических веществ в ионном, молекулярном, комплексном, коллоидном и взвешенном состоянии, а также изотопный состав содержащихся в ней радионуклидов ( Правила охраны поверхностных вод, 1991. ) EdwART.… … Экологический словарь
изотопный анализ — 1. Анализ, при к ром определяется состав и структура вещ ва с помощью радиоакт. изотопов. 2. Анализ, при котором определяется изотопный состав анализир. вещ ва. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN isotopic analysis … Справочник технического переводчика
изотопный состав — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN isotopic composition … Справочник технического переводчика
изотопный состав солнечных космических лучей — Относительное содержание в солнечных космических лучах различных изотопов. [ГОСТ 25645.105 84] Тематики лучи космические Обобщающие термины физические характеристики солнечных космических лучей EN isotopic composition … Справочник технического переводчика
Изотопный обмен — реакция перераспределения изотопов какого либо элемента между реагирующими веществами. При изотопном обмене вещества сохраняют элементарный состав. Например, 14NH4+ + 15NH3 = 15NH4+ + 14NH3. Такие реакции могут протекать также между различными… … Википедия
СОСТАВ ВОДЫ — Совокупность примесей в воде минеральных и органических веществ в ионном, молекулярном, комплексном, коллоидном и взвешенном состоянии, а также изотопный состав содержащихся в ней радионуклидов Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
ИЗОТОПНЫЙ ОБМЕН — самопроизвольное перераспределение изотопов хим. элемента между разл. фазами системы (в частности, между разл. агрегатными состояниями одного и того же в ва), частицами (молекулами, ионами) или внутри молекул (сложных ионов). В И. о. могут… … Химическая энциклопедия
изотопный анализ — [isotopic analysis] 1. Анализ, при котором определяется состав и структура вещества с помощью радиоактивных изотопов. 2. Анализ, при котором определяется изотопный состав анализируемого вещества. Смотри также: Анализ электрометрический анализ … Энциклопедический словарь по металлургии
изотопный состав — izotopinė sudėtis statusas T sritis fizika atitikmenys: angl. isotopic composition vok. isotope Zusammensetzung, f; Isotopenzusammensetzung, f rus. изотопный состав, m pranc. composition isotopique, f; constitution isotopique, f … Fizikos terminų žodynas
Описание изотопов: определение, состав, превращения
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
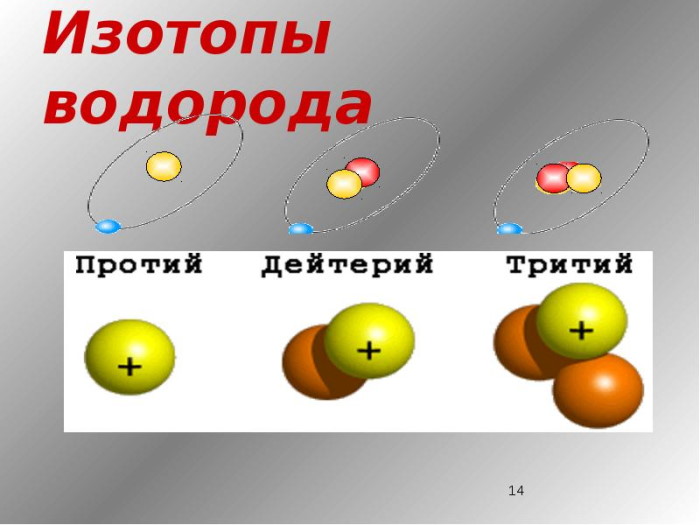
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Изотопы
Изото́п (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидность атома (и ядра) какого-либо химического элемента, отличающаяся от других изотопов только количеством нейтронов в ядре. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]
Изотоп
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
См. также
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.