Изотопы водорода это что
Изотопы водорода
Изото́пы водорода — разновидности атомов (и ядер) химического элемента водорода, имеющие разное содержание нейтронов в ядре. На данный момент известны 7 изотопов водорода.
Таблица изотопов водорода
Примечания
Полезное
Смотреть что такое “Изотопы водорода” в других словарях:
ИЗОТОПЫ ВОДОРОДА В ГЕОЛОГИИ — водород состоит из двух изотопов Н, или протия, и Н2, или дейтерия (Д), отношение которых в нормальном водороде Н/Д = 6000. Различие в массах изотопов водорода велико, и в ходе неорг. и орг. процессов происходит существенное фракционирование его… … Геологическая энциклопедия
изотопы — ов; мн. (ед. изотоп, а; м.). [от греч. isos равный и topos место] Спец. Разновидности одного и того же химического элемента, различающиеся массой атомов. Радиоактивные изотопы. Изотопы урана. ◁ Изотопный, ая, ое. И. индикатор. * * * изотопы (от… … Энциклопедический словарь
Изотопы гелия — разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре. Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Природный гелий состоит из двух стабильных изотопов: 4He… … Википедия
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
Изотопы кислорода — В конце жизни массивной звезды, H оболочке и He оболочке Изотопы кислорода разновидности атомов (и ядер) … Википедия
ИЗОТОПЫ — (от изо. и греч. topos место), нуклиды одного хим. элемента, т. е. разновидности атомов определенного элемента, имеющие одинаковый атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом протонов и разл. числом нейтронов,… … Химическая энциклопедия
ИЗОТОПЫ — (от греч. ísos одинаковый и tópos место), разновидности одного химического элемента, занимающие одно и то же место в периодической системе элементов Д. И. Менделеева, то есть имеющие одинаковый заряд ядра, но отличающиеся массами… … Ветеринарный энциклопедический словарь
Атом водорода — Атом водорода физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или… … Википедия
Изотопы водорода
Известно несколько изотопов водорода: дейтерий ( 2 H) с одним протоном и одним нейтроном в ядре, тритий ( 3 H) с одним протоном и двумя нейтронами в ядре и очень неустойчивые тяжелые изотопы 4 H, 5 H, 6 H и 7 H. Ядра протия и дейтерия стабильны, а ядра трития подвергаются бета-распаду:
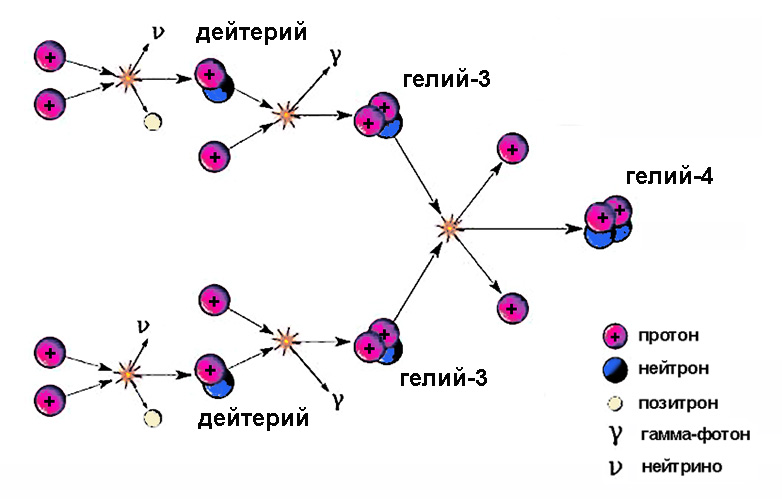
Предполагают, что эта реакция является главным источником изотопа гелия-3 в атмосфере.
Время жизни атомов остальных изотопов составляет ничтожные доли секунды.
Таблица изотопов водорода:
Содержание изотопов водорода в природе:
Массовая доля (в %) в природной смеси:
1 H – 99,9849 2 H – 0,0139 3 H – 0,0012
Нормальный изотопный состав природных соединений водорода соответствует отношению D : H=1 : 6800
3·10-18 % (мольные доли). Очевидно, он образуется в результате ядерных реакций, вызванных действием космических лучей.
Получение изотопов водорода
В настоящее время дейтерий получают ректификацией жидкого водорода и пот так называемому двухтемпературному сероводородному методу, в основе которого лежит реакция изотопного обмена:
Константа равновесия которой при 30 и 120 °C равна соответственно 2,31 и 1,86.
Тритий синтезируют, действуя на 6 Li3 нейтронами, получаемыми в ядерном реакторе:
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, несмотря на одинаковую электронную структуру, все изотопы заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому можно считать, что свойства природного водорода соответствуют свойствам чистого протия.
Небольшие различия свойств, называемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний атомов в молекулах и твердых телах. Так, колебательная энергия молекул T2 и D2 меньше, чем H2. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D2 по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность, а, следовательно, неравноценность активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза HBr и DBr равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в периодической системе. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
| Eдис(H2) = 436 кДж/моль | dH-H = 0,07414 нм |
| Eдис(D2) = 439,56 кДж/моль | dD-D = 0,07417 нм |
| t°пл(D2O) = 3,82 °C | t°кип(D2O) = 101,42 °C | ρ = 1,1050 г/см 3 (20 °C) |
Заметно с H2O различаются также энтальпия растворения солей, константы диссоциации кислот и другие характеристики растворов. Реакции в D2O идут медленнее, поэтому она является биологическим ядом.
Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×10 29 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1 H1 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.
В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2 H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.
Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3 H1. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.
Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
Содержание
Список изотопов
Водород-1 (протий)
1 ЧАС (атомная масса 1.007 825 032 241 (94) Да ) является наиболее распространенным изотопом водорода с содержанием более 99,98%. Поскольку ядро этого изотопа состоит только из одного протон, ему дается официальное имя протий.
Распад протона никогда не наблюдался, поэтому водород-1 считается стабильным изотопом. Немного теории великого объединения предложенные в 1970-х годах предсказывают, что распад протона может происходить с периодом полураспада 10 28 и 10 36 лет. [10] Если это предсказание окажется верным, то водород-1 (и действительно все ядра, которые сейчас считаются стабильными) только наблюдательно стабильный. На сегодняшний день эксперименты показали, что минимальный период полураспада протона превышает 10 34 лет.
Водород-2 (дейтерий)
2 ЧАС (атомная масса 2.014 101 778 11 (12) Да ), другой стабильный изотоп водорода, известен как дейтерий и содержит в своем ядре один протон и один нейтрон. Ядро дейтерия называется дейтроном. Дейтерий составляет 0,0026–0,0184% (по численности населения, а не по массе) образцов водорода на Земле, причем меньшее количество обычно обнаруживается в образцах газообразного водорода, а более высокое обогащение (0,015% или 150 частей на миллион) типично для океанской воды. Дейтерий на Земле был обогащен в отношении его начальной концентрации в Большом взрыве и внешней части Солнечной системы (около 27 ppm, по атомной доле) и его концентрации в более старых частях галактики Млечный Путь (около 23 ppm). Предположительно, разная концентрация дейтерия во внутренней части Солнечной системы связана с более низкой летучестью газа и соединений дейтерия, обогащающих фракции дейтерия в кометах и планетах, подвергшихся значительному воздействию солнечного тепла на протяжении миллиардов лет эволюции Солнечной системы.
Дейтерий не радиоактивен и не представляет значительной опасности токсичности. Вода, обогащенная молекулами, в состав которых входит дейтерий вместо протия, называется тяжелая вода. Дейтерий и его соединения используются в качестве нерадиоактивной метки в химических экспериментах и в растворителях для 1 ЧАС-ЯМР-спектроскопия. Тяжелая вода используется как замедлитель нейтронов и теплоноситель для ядерных реакторов. Дейтерий также является потенциальным топливом для коммерческих термоядерная реакция.
Водород-3 (тритий)
Когда-то тритий обычно использовался в экспериментах по химической и биологической маркировке в качестве радиоактивная метка, который стал менее распространенным в последнее время. D-T термоядерная реакция использует тритий в качестве основного реагента, наряду с дейтерий, высвобождая энергию за счет потери массы, когда два ядра сталкиваются и сливаются при высоких температурах.
Водород-4
4 ЧАС (атомная масса является 4.026 43 (11) Да ) содержит в своем ядре один протон и три нейтрона. Это очень неустойчивый изотоп водорода. Он был синтезирован в лаборатории путем бомбардировки тритий с быстро движущимся дейтерий ядра. [12] В этом эксперименте ядро трития захватило нейтрон из быстро движущегося ядра дейтерия. Присутствие водорода-4 было установлено путем регистрации испускаемых протонов. Он разлагается нейтронное излучение в водород-3 (тритий) с период полураспада около 139 ± 10 йоктосекунды (или (1.39 ± 0.10) × 10 −22 секунд). [13]
В сатирическом романе 1955 г. Ревущая мышь, название квадиум был передан изотопу водорода-4, который питал Q-бомба что Герцогство Гранд Фенвик захвачен из США.
Водород-4.1
Водород-5
5 ЧАС является крайне нестабильным изотопом водорода. Ядро состоит из протона и четырех нейтронов. Он был синтезирован в лаборатории путем бомбардировки трития быстро движущимися ядрами трития. [12] [15] В этом эксперименте одно ядро трития захватывает два нейтрона от другого, становясь ядром с одним протоном и четырьмя нейтронами. Оставшийся протон может быть обнаружен, и можно сделать вывод о существовании водорода-5. Он разлагается вдвое нейтронное излучение в водород-3 (тритий) и имеет период полураспада не менее 910 йоктосекунд (9,1 × 10 −22 секунд). [13]
Водород-6
6 ЧАС распадается либо на тройной нейтронное излучение в водород-3 (тритий) или учетверенное излучение нейтронов в водород-2 (дейтерий) и имеет период полураспада 290 йоктосекунд (2,9 × 10 −22 секунд). [13]
Водород-7
7 ЧАС состоит из протон и шесть нейтроны. Впервые он был синтезирован в 2003 году группой российских, японских и французских ученых в г. RIKENс Завод радиоактивных изотопов бомбардировкой водород с участием гелий-8 атомы. В результате реакции все шесть нейтронов гелия-8 были переданы ядру водорода. Два оставшихся протона были обнаружены телескопом RIKEN, устройством, состоящим из нескольких слоев датчиков, расположенным за целью циклотрона RI Beam. [3] Водород-7 имеет период полураспада 23 йоктосекунды ( 2.3 × 10 −23 s ), [16] который является самым коротким периодом полураспада, известным для любого изотопа любого элемента (см. Список радиоактивных нуклидов по периодам полураспада)
Цепи распада
Большинство тяжелых изотопов водорода распадаются непосредственно на 3 H, который затем распадается на стабильный изотоп 3 Он. Однако, 6 Иногда наблюдалось, что H распадается прямо на стабильную 2 ЧАС.
Время распада в йоктосекунды для всех изотопов, кроме 3 H, который выражается в годах.
Водород
(молярная масса)
(первый электрон)
Водород (H, лат. hydrogenium ) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
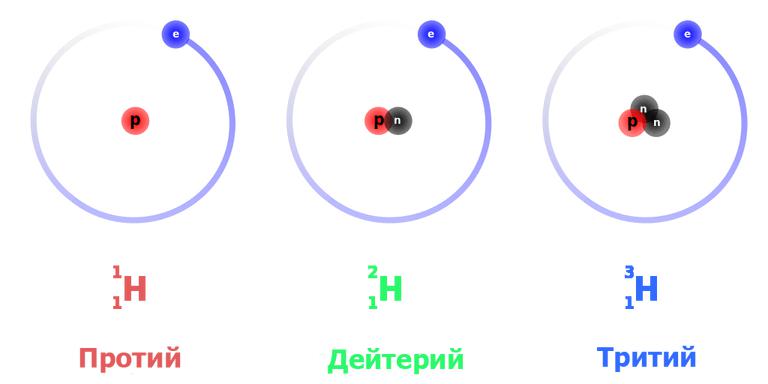
Три изотопа водорода имеют собственные названия: 1 H — протий, 2 H — дейтерий и 3 H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Содержание
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород.
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода.
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость
Во Вселенной
В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца
6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна
52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Получение
В промышленности
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м 3 газа. Почти все остальное получают из угля. Около 0,1 % (
100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает
830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
В лаборатории
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
Стоимость
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением.
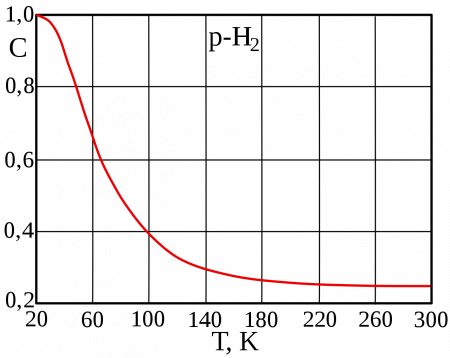
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы
Наиболее известны три изотопа водорода: протий 1 H (атомное ядро — протон), дейтерий 2 H (ядро состоит из одного протона и одного нейтрона) и тритий 3 H (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10 −21 —10 −23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
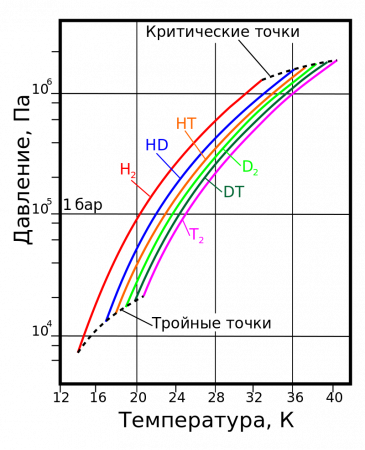
| Температура плавления, K | Температура кипения, K | Тройная точка | Критическая точка | Плотность, кг/м³ | ||||
|---|---|---|---|---|---|---|---|---|
| T, K | P, кПа | T, K | P, МПа | жидкий | газ | |||
| H2 | 13,96 | 20,39 | 13,96 | 7,3 | 32,98 | 1,31 | 70,811 | 1,316 |
| HD | 16,65 | 22,13 | 16,6 | 12,8 | 35,91 | 1,48 | 114,0 | 1,802 |
| HT | 22,92 | 17,63 | 17,7 | 37,13 | 1,57 | 158,62 | 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 | 17,1 | 38,35 | 1,67 | 162,50 | 2,23 |
| DT | 24.38 | 19,71 | 19,4 | 39,42 | 1,77 | 211,54 | 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 | 21,6 | 40,44 | 1,85 | 260,17 | 3,136 |
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице.
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1 H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1 ⁄2 + | 99,9885(70) | ||
| 2 H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1 + | 0,0115(70) | ||
| 3 H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1 ⁄2 + | β − | 18,591(1) кэВ | |
| 4 H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10 −22 с | 2 − | -n | 23,48(10) МэВ | |
| 5 H | 1 | 4 | 5,035 31(11) | более 9,1⋅10 −22 с | ( 1 ⁄2 + ) | -nn | 21,51(11) МэВ | |
| 6 H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10 −22 с | 2 − | −3n | 24,27(26) МэВ | |
| 7 H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10 −23 с | 1 ⁄2 + | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё. Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 гигатонн/год).
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твёрдый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест.
Топливо
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.