Изовалериановая ацидемия что это
Нарушения обмена аминокислот
Дети с так называемой “болезнью мочи кленового сиропа” не могут метаболизировать лейцин, изолейцин и валин. Побочные продукты этих аминокислот накапливаются, вызывая неврологические изменения, включая судороги и умственную отсталость ( задержку психического развития). Эти побочные продукты также приводят к тому, что жидкости организма и такие вещества, как моча, пот и ушная сера, пахнут как кленовый сироп. Есть много форм болезни мочи кленового сиропа. В наиболее тяжелой форме у детей возникает рвота и вялость, а затем развиваются неврологические нарушения, включая судороги и кому, в первые дни жизни, и они могут умереть в течение нескольких дней или недель, если их не лечить. В более легких формах дети вначале кажутся нормальными, но во время инфекции, хирургического вмешательства или других физических нагрузок у них может развиться рвота, спутанность сознания и кома. Некоторые дети с легкими заболеваниями получают пользу от инъекций витамина B 1 После того, как болезнь взята под контроль, дети должны всегда придерживаться специальной искусственной диеты с низким содержанием лейцина, изолейцина и валина. Врачи должны иметь план действий в чрезвычайных ситуациях, чтобы справиться с внезапным приступом, потому что он может привести к накоплению токсичных веществ в крови и низкому уровню сахара в крови (так называемый метаболический кризис). Внезапные приступы чаще всего вызваны распространенными инфекциями.
Когда определенный фермент не функционирует, в организме накапливаются вредные уровни метилмалоновой кислоты. Это расстройство также может быть вызвано дефицитом витамина B12 (кобаламин). Возраст, в котором начинаются симптомы, симптомы и лечение сходны с таковыми при пропионовой ацидемии, за исключением того, что врачи могут давать добавки витамина B 12 вместо биотинаа.
Когда определенный фермент (тип белка), называемый пропионил-СоА-карбоксилазой, не функционирует, в организме накапливаются вредные уровни пропионовой кислоты. У большинства пораженных детей симптомы начинаются в первые дни или недели после рождения и включают плохое питание, рвоту и проблемы с дыханием, когда у детей развивается накопление кислоты в крови ( метаболический ацидоз ) то отмечается низкий уровень сахара в крови ( гипогликемия ) и увеличение аммиака в крови (гипераммонемия).
В Соединенных Штатах новорожденных обычно проверяют на
“Болезнь мочи кленового сиропа”( анализ крови)
Изовалериановая ацидемия у детей
Общая информация
Краткое описание
Союз педиатров России
Согласовано Научным советом Министерства Здравоохранения Российской Федерации
Клинические рекомендации
Изовалериановая ацидемия у детей
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
Изовалериановая ацидемия (ацидурия) – наследственное заболевание из группы органических ацидемий, обусловленное дефицитом изовалерил-КоА дегидрогеназы, участвующей в обмене лейцина.
Автоматизация клиники: быстро и недорого!
– Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Диагностика
Диагностика изовалериановой ацидурии основана на анализе родословной, оценке данных анамнеза, клинических проявлений, результатах анализа содержания в крови изовалерилкарнитина (С5) и глицина, определении почечной экскреции изовалериановой, гидроксиизовалериановой кислот и изовалерилглицина, выявлении мутаций в гене IVD.
– физическая или психо-эмоциональная нагрузка.
Специфические симптомы заболевания отсутствуют. Для неонатальной формы характерны быстрое фульминантное течение, сопровождающееся симптомами угнетения со стороны центральной нервной системы, рвотой, летаргией, быстрым развитием судорог, комой на фоне кетоацидоза. При хронической форме превалируют симптомы отставания в психомоторном развитии, судороги, нарушение функции почек, желудочно-кишечного тракта.
Ранними признаками метаболического криза служат вялость, сонливость или раздражительность, отказ от еды, рвота, нарушение походки. Появляются дыхательные нарушения, тахикардия. Неврологические расстройства прогрессируют вплоть до ступора или комы, обусловливая высокую летальность. Тяжесть состояния, главным образом, определяется выраженным метаболическим кетоацидозом. Часто отмечается гипогликемия (около 50% детей), гипераммониемия, обезвоживание.
Комментарии: В крови выявляются лактатацидоз, кетоацидоз, гипераммонемия.
Дифференциальный диагноз
Лечение
После подтверждения диагноза тактика лечения основана на следующих принципах:
Комментарии: Строгое ограничение белка натуральных пищевых продуктов с целью сведения к необходимому минимуму поступление в организм аминокислоты лейцина. Для детей первого полугодия жизни ограничение распространяется на материнское молоко или детские молочные или соевые смеси, для детей второго полугодия жизни – запрет на введение в качестве прикорма высокобелковых продуктов (мяса, рыбы, творога, яиц, молочных продуктов, бобовых и т.д.), для пациентов старше одного года – строгие ограничения в использовании высокобелковых продуктов.
– с целью компенсации дефицита белка используются специализированные продукты на основе аминокислот без метионина, треонина, валина, изолейцина (Приложение Г3).
Медицинская реабилитация
Профилактика
Дети с изовалериановой ацидемией часто попадают в отделение патологии детей раннего возраста, инфекционное отделение или реанимацию в состоянии метаболического криза, развившегося на фоне метаболического ацидоза, отека мозга, гипогликемии.
Продолжительность госпитализации зависит от скорости верификации диагноза, коррекции метаболических нарушений путем проведения интенсивной терапии и начала патогенетической диетотерапии, а также от сроков появления положительной динамики со стороны центральной нервной системы и других органов, скорости восстановления показателей глюкозы крови и кислотно-щелочного состояния, ответ на лечение отмечается в течение 5-7 дней. Пребывание в стационаре в среднем составляет 21 день.
После выписки из стационара ребенок должен находиться на этапе амбулаторно-поликлинического наблюдения у педиатра, невропатолога, генетика, больные с симптоматической эпилепсией нуждаются в наблюдении эпилептолога. Консультации других специалистов назначаются по показаниям. Ежемесячно необходимо проводить исследования КЩС крови, коррекцию лечебного питания и симптоматической терапии, 1 раз в 6-12 месяцев рекомендуется контролировать содержание патологических метаболитов в сыворотке крови или моче методом тандемной масс-спектрометрии.
Органические ацидемии
Органические ацидемии — это группа редких наследственных болезней обмена, которые в типичных случаях проявляются у новорожденных и грудных детей в форме острого метаболического криза, угрожающего жизни ребенка, после бессимптомного периода продолжительностью несколько дней.
Симптомы болезни
Повышение уровня аммония в плазме до токсичного уровня часто является основным проявлением метаболического криза, может привести к жизнеугрожающим неврологическим осложнениям и поэтому требует интенсивных лечебных мероприятий.
Своевременная постановка диагноза и проведение лечебных мероприятий являются сложной задачей для педиатров без глубоких знаний в области метаболических нарушений. В статье представлены практические рекомендации, которые могут помочь в выборе тактики лечения гипераммониемии в ранний период метаболического криза у новорожденных и детей грудного возраста с ОА.
Описано более 65 различных ОА, c общей частотой 1 на 3 000 новорожденных. Начальные признаки и симптомы метаболической декомпенсации — отказ от еды, рвота, обезвоживание и заторможенность — являются
неспецифичными и могут имитировать другие заболевания, в частности бактериальный сепсис, создавая дополнительные трудности в условиях, когда требуется быстрая диагностика и вмешательство с целью предотвратить
развитие необратимых неврологических осложнений. Повышение уровня аммиака в крови непосредственно влияет на неврологические исходы, а гипераммониемия выше 200 мкмоль/л, как правило, сопровождается сонливостью и летаргией (нарушением сознания).
Три ОА, для которых наиболее характерны метаболические кризы с гипераммониемией: пропионовая ацидемия (ПА), метилмалоновая ацидемия
(ММА) и изовалериановая ацидемия (ИВА) вместе с болезнью «кленового сиропа» часто обозначаются как «классические» ОА. Гипераммониемия — важное клиническое проявление ПА, ММА и ИВА, однако необходимо также принимать во внимание другие метаболические
нарушения, в частности, ацидоз, появление кетоновых тел и лактатацидоз.
Гипераммониемия не всегда сопутствует дебюту ПА, ММА или ИВА, но у большинства детей она возникает в периоде новорожденности и в дальнейшем рецидивирует при метаболических кризах.
Клиническая картина органических ацидемий
Внезапное развитие жизнеугрожающего состояния у ранее здорового новорожденного — основной признак наследственной болезни обмена веществ.
При дебюте в период новорожденности, грудное вскармливание или смесь на фоне процесса катаболизма после родов приводят к возникновению
метаболического криза. У более старших детей провоцирующими факторами метаболических кризов, как правило, являются состояния с повышенным катаболизмом — голодание, рвота или инфекции с фебрильной лихорадкой.
На 2-7 сутки после рождения у новорожденных нарушается аппетит, возникает рвота, обезвоживание, заторможенность, тахикардия и гипотермия, которые при отсутствии лечения могут быстро прогрессировать до дыхательной
недостаточности, коматозного состояния и смерти.
Следует учитывать, что эти симптомы также наблюдаются при более распространенных состояниях, например, инфекциях, о чем врачу также следует помнить. При наличии неврологических расстройств, лабораторная диагностика для исключения ОА (биохимические показатели, уровень аммиака
в крови) и сепсиса должна проводиться одновременно.
После периода новорожденности, у детей с ОА могут наблюдаться: задержка развития, низкая прибавка массы тела, нарушения сознания, мышечная
дистония, судороги и двигательные нарушения. Могут присутствовать другие признаки и симптомы острой или хронической декомпенсации: потеря массы (часто наблюдается у новорожденных), угнетение кроветворения в костном мозге при ПА и ММА, а также характерный запах «потных ног» у пациентов с ИВА.
Диагностика заболевания
Для предотвращения неврологических осложнений, лечение следует начинать незамедлительно, как только возникло подозрение на ОА. Следует
в экстренном порядке проконсультироваться со специалистом в области обменных нарушений, чтобы обеспечить параллельное проведение диагностических и начальных лечебных мероприятий.
При стандартном лабораторном обследовании часто выявляются метаболический ацидоз, увеличение анионной разницы, гипераммониемия, кетоз и лактат-ацидоз. Диагноз ОА ставится по результатам биохимических анализов: уровня органических кислот в моче, ацилкарнитинового профиля и аминокислотного профиля в плазме (это исследование необходимо для исключения нарушений цикла мочевины). Длительность гипераммониемии, нарушение кислотно-щелочного баланса в виде метаболического ацидоза (снижение рН и бикарбоната при увеличенной анионной разнице), а также
длительность пребывания в коме коррелируют с плохим неврологическим
исходом. У детей грудного возраста эти нарушения должны быть скорректированы максимально быстро.
Терапия метаболического криза
Ближайшая задача терапии — остановить процессы эндогенного катаболизма и обеспечить организм достаточным количеством энергии для поддержания анаболических реакций. Поскольку аминокислоты являются основными предшественниками органических кислот, следует временно прервать поступление белка внутрь (максимально на 24–48 часов). С целью ускорения почечной экскреции карнитиновых эфиров органических кислот назначается терапия карнитином (рекомендуемая доза 200 мг/кг/сут).
Согласно рекомендациям действующих руководств, терапия бензоатом
или фенилбутиратом натрия рекомендуется при гипераммониемии неустановленной этиологии (> 150–250 мкмоль/л у новорожденных, 100–250
мкмоль/л у более старших детей), сопровождающейся клинической симптоматикой. Эти препараты следует с осторожностью использовать у пациентов
с органическими ацидемиями, поскольку при ПА и ММА концентрация глутамина может быть снижена вследствие нарушения работы цикла Кребса.
N‑карбамоил-L‑глутамат (карглумовая кислота, Карбаглю®) — стабильный синтетический аналог N‑ацетилглутамата (кофактор первого фермента в цикле синтеза мочевины КФС‑1 ) может стимулировать первую реакцию цикла мочевины и снижает концентрацию аммиака при вторичной гипераммониемии. Результаты двух ретроспективных наблюдательных исследований и сообщения об отдельных случаях свидетельствуют о том, что карглумовая кислота может снижать уровень аммиака в крови у новорожденных и более старших детей с ПА, ММА и ИВА, независимо от применения бензоата
или фенилбутирата натрия. Карглумовая кислота рекомендуется для лечения гипераммониемии неустановленной этиологии, сопровождающейся
клиническими проявлениями, а также включена в европейское руководство
2014 г. по лечению ПА и ММА. У пациентов с гипераммониемией и тяжелой
энцефалопатией при неэффективности медикаментозного лечения возможно применение гемодиализа.
Длительная терапия
Долгосрочные цели лечения пациента с органической ацидемией — предотвращение метаболических кризов, минимизация осложнений, поддержание нормального роста и развития ребенка. Для этого используется
тройной подход: диетотерапия, медикаментозная терапия и постоянное наблюдение с целью выявления и лечения возможных осложнений, в число которых входят панкреатит, почечная недостаточность, кардиомиопатия,
нарушения сердечного ритма и остеопороз.
Диета с низким содержанием белка — основной компонент долгосрочной терапии при всех классических ОА. Пациенты с ПА или ММА также должны дополнительно получать витамины, микроэлементы, жиры и аминокислотные смеси без прекурсоров. В большинстве случаев медикаментозное лечение включает L‑карнитин, витамин В12 (в виде гидроксикобаламина при В12-зависимой форме ММА) и периодические курсы антибактериальной терапии
(например, метронидазолом) для подавления кишечной микрофлоры, продуцирующей пропионовую кислоту. При ПА может быть полезным назначение цитрата ( 7,5 мэкв/кг/сут), который может способствовать достижению
компенсации метаболического ацидоза и пополнению субстратов цикла Кребса. На фоне диеты с низким содержанием белка, пациенты с ИВА также должны постоянно получать дополнительно глицин и карнитин. Диета с достаточным количеством калорий, ограничением белка и перечисленными
выше добавками позволяет достигнуть оптимальной компенсации обменных нарушений при ОА, что выражается в стабильном течении заболевания,
несмотря на сохранение умеренной гипераммониемии у некоторых детей. В ряде случаев для достижения компенсации необходимо наложение гастростомы — это позволяет обеспечить достаточную энергетическую ценность рациона и вводить питательные смеси в ночное время для предотвращения катаболических реакций. Неустойчивое метаболическое равновесие может быть нарушено при упорной рвоте или рецидивирующих инфекциях, когда потребление калорий
снижается, а энергетические потребности возрастают, что в итоге ведет к повышению концентрации аммиака и развитию метаболического ацидоза у некоторых пациентов.
При тяжелых формах ПА и ММА с рецидивами гипераммониемии может быть эффективной длительная терапия карглумовой кислотой. Недавно опубликованы результаты применения карглумовой кислоты 50 мг/кг/сут) продолжительностью 7–16 месяцев у 8 пациентов с ПА или ММА, у которых в течение предшествующего года наблюдалось от 3 до 11 метаболических кризов.
Терапия карглумовой кислотой сопровождалась значительным снижением тяжести и числа метаболических кризов: у трех пациентов кризы прекратились, у остальных пациентов тяжесть кризов не требовала госпитализации.
Опубликован клинический случай пациента, у которого в течение первых 9 лет жизни наблюдалось 78 госпитализаций по поводу кризов — в среднем 7–10 поступлений в стационар в год. В 9-летнем возрасте начата непрерывная
терапия карглумовой кислотой в дозе 100 мг/кг/сут с последующим снижением до 50 мг/кг/сут через 6 месяцев. В интервале от 9 до 15 лет жизни пациент
был всего лишь дважды госпитализирован по поводу метаболического криза, оба раза — на 1 году лечения карглумовой кислотой. Наблюдения доказывают пользу длительной терапии карглумовой кислотой пациентов с тяжелым течением ПА и ММА и рецидивирующими эпизодами гипераммониемии.
При ПА или ММА с рецидивирующими метаболическими кризами или недостаточной эффективности диеты и фармакотерапии, трансплантация
печени может уменьшить количество госпитализаций и улучшить качество жизни. Пересадка печени может снизить риск развития некоторых осложнений, в частности кардиомиопатии; однако это вмешательство не оказывает
никакого влияния на риск неврологических или офтальмологических осложнений и, конечно, связано с риском смертельного исхода. Некоторым взрослым пациентам с терминальной стадией почечной недостаточности, вызванной ММА, может быть показана трансплантация почек.
Изовалериановая ацидемия что это
Болезнь кленового сиропа (БКС), метилмалоновая ацидурия, пропионовая ацидурия, изовалериановая ацидурия и другие вторичные по отношению к метаболизму АКРЦ органические ацидурии в совокупности составляют наиболее часто встречающиеся врожденные дефекты метаболизма аминокислот. Заболевания имеют много общих симптомов и обычно соответствуют одному из трех клинических типов; тяжелой форме у новорожденных, интермиттирующей форме с поздним началом и хронической прогрессирующей форме. Рецидивирующая кома (основное проявление данных заболеваний) связана с непосредственным токсическим воздействием накопившихся метаболитов, в то время как хроническое накопление может препятствовать развитию центральной нервной системы или метаболизму головного мозга, приводя к задержке развития (Morton et al., 2002; Deodato et al., 2006; Vockley и Ensenauer, 2006).
а) Биохимические и генетические изменения. Эти заболевания являются результатом дефекта ферментов, участвующих в метаболизме лейцина, валина и изолейцина. Три нейтральных АКРЦ изначально метаболизируются обычным путем: вслед за транасаминированием происходит тиамин-зависимое декарбоксилирование, дефицит которого отмечается при БКС (этап 1). Дефект декарбоксилирования является причиной накопления АКРЦ и соответствующих кетокислот. В дальнейшем пути катаболизма АКРЦ расходятся. Лейцин метаболизируется до ацетоацетата и ацетил-кофермента А. Специфическая ферментная недостаточность возможна на каждом этапе. Дефицит изовалерил-кофермент А дегидрогеназы является причиной изовалериановой ацидурии (этап 2), изовалерат является высокотоксичным веществом.
Дефицит 3-метилкротонил-кофермент А карбоксилазы, биотин-зависимого фермента, (этап 3) приводит к 3-метил-кротонил-глицинурии в результате мутации декарбоксилазы апофермента или аномального метаболизма биотина. 3-метилглутаконовая ацидурия I типа (этап 4) является другим редким заболеванием, вызванным дефектом катаболизма лейцина (Ly et al., 2003). Катаболизм валина и изолейцина протекает с образованием пропионил-кофермента А и матилмалонил-кофермента А. Метионин и треонин, жирные кислоты с нечетным количеством углеродных остатков и боковая цепью холестеринового радикала, являются другими предшественниками пропионил-кофермента А. Пропионил-кофермент А образует метилмалонил-кофермент А с участием биотин-зависимой декарбоксилазы (этап 5), дефицит которой вызван мутацией декарбоксилазы апофермента (пропионовая ацидурия) или аномальным метаболизмом биотина. Метилмалонил-кофермент А в два последовательных этапа под действием метил-кофермент А эпимеразы (Dobson et al., 2006), а затем под действием В12-зависимой метилмалонил-кофермент А мутазы (этап 6) превращается в сукцинил-кофермент А.
Дефицит активности каждого фермента приводит к метилмалоновой ацидурии. Аномальный метаболизм витамина В12 является причиной различных форм метилмалоновой ацидурии. До соединения пропионил-кофермента А описаны дефекты каждого этапа катаболизма изолейцина и валина, приводящие к ряду метаболических нарушений (Nguyen et al., 2002; Matern et al., 2003; Poll-The et al. 2004b; Salomons et al., 2007). Многие накапливаемые интрамитохондриальные метаболиты кофермента А являются субстратами эстерификации карнитина, процесса, который приводит к накоплению специфических ацилкарнитинов, выявляемых в цельной крови с помощью двойной масс-спектрометрии. Следовательно, большинство описанных заболеваний поддаются массовому неонатальному скринингу (Tarini, 2007).
Почти все заболевания данной группы наследуются аутосомно-рецессивным путем; дефицит 2-ме-тил-3-гидроксибутирил кофермент А дегидрогеназы является сцепленным с Х-хромосомой заболеванием. Антенатальная диагностика может проводиться путем оценки метаболитов в амниотической жидкости, определения активности специфических ферментов в образцах ворсин хориона и амниотических клетках и/или выявления патогенетических мутаций. По результатам программ скрининга новорожденных в сочетании с исследованиями мутаций было выявлено, что у ряда участвовавших в скрининге пациентов с изовалерьяновой ацидурией или 3-метилкротонглицинурией выявлялся слабо выраженный или даже бессимптомный фенотип.
б) Нейропатология. Имеющиеся результаты патологоанатомических исследований свидетельствуют об атрофии и различных гистологических изменениях мозга. Губчатая дегенерация белого вещества является неспецифическим повреждением, выявляемым у новорожденных. Часто описываемая у пациентов с метилмалоновой или пропионовой ацидурией дегенерация базальных ганглиев является заметным признаком среди детей старшего возраста с некрозом бледного шара, губчатыми и кистозными полостями. Серое вещество головного мозга и мозжечка и зубчатое ядро могут быть повреждены за счет диффузной вакуолизации вокруг нейронов и внутри нейтрофилов (Feliz et al., 2003). Субкортикальный отек головного мозга во время острой метаболической декомпенсации часто является причиной смерти у пациентов с БКС. Описано небольшое количество случаев кровоизлияний в мозжечок.
Патогенез поражения мозга при нарушениях обмена АКРЦ изучен плохо. В острой стадии заболевания накопление токсических метаболитов может быть причиной депривации энергии в связи с ингибированием определенных ферментов, участвующих в окислении пирувата в цикле Кребса или в митохондриальной дыхательной цепи. Восприимчивость базальных ганглиев к депривации энергии может объяснять их частичное поражение при таких заболеваниях, в особенности при метилмалоновой и пропионовой ацидуриях. При БКС высокий уровень лейцина может привести к дефекту синтеза катехоламина, вторичного по отношению к дефекту захвата головным мозгом нейтральных аминокислот и триптофана. Таким же образом взаимодействие метилмалоновой кислоты с сукцинатом может приводить к снижению синтеза гамма-аминомасляной кислоты (ГАМК). Необратимые изменения могут быть результатом взаимодействия с синтезом миелина вследствие дефекта транспорта всех нейтральных аминокислот (Schwab et al., 2006). Кроме того, накопленные пропионил-кофермент А и метилмалонил-кофермент А являются предшественниками синтеза жирных кислот с нечетным количеством углеродных остатков и длинноцепочечными жирными кислотами с метиловым радикалом. Их объединение в липидные слои может быть причиной аномального синтеза липидной мембраны в центральной нервной системе.
в) Клинические проявления:
1. Тяжелые формы заболевания у новорожденных. Типичная клиническая картина представлена неуклонной деградацией без явных причин у новорожденных младенцев после бессимптомного периода, продолжающегося несколько дней. Первыми признаками является плохое сосание и трудности при кормлении с последующим развитием необъяснимой и прогрессирующей комы. В коматозном состоянии у большинства пациентов отмечается аксиальная гипотония с периферической дистонией, хореоатетозы, эпизоды опистотонуса и «боксирующих» и «велосипедных» движений конечностей. Судороги могут развиваться на более поздних стадиях заболевания. У больных детей может развиваться отек мозга с выбуханием родничка, что вызывает подозрения в наличии инфекции центральной нервной системы. На ЭЭГ часто отмечается паттерн вспышкаподавление. Биохимические аномалии включают метаболический ацидоз и кетонурию в сочетании с гипераммониемией и гиперлактацидемией. Общий краткосрочный прогноз улучшается. В дальнейшем, несмотря на лечение, часто возникают интеркуррентные эпизоды с клиническими проявлениями, сходными с проявлениями поздних интермиттирующих форм.
2. Интермиттирующие формы заболевания с поздним началом. Приблизительно у трети пациентов нарушения обмена АКДЦ отмечаются в детском и даже в подростковом или взрослом возрасте. Повторяющиеся приступы развиваются часто, хотя в промежутках пациент может казаться практически здоровым. Начало заболевания в большинстве случаев провоцируется состояниями, усиливающими белковый катаболизм (инфекцией, травмой и т.д.), или усиленным потреблением белка, но могут развиваться без явной причины. Рецидивирующие эпизоды комы или летаргии с атаксией являются основными проявлениями. Чаще всего кома не сопровождается другими аномальными неврологическими признаками. Кетоацидоз и различные аномалии уровня глюкозы в крови свидетельствуют о метаболическом характере заболевания. Тем не менее, у небольшого количества пациентов заболевание может проявляться гемиплегией и гемианопсией или признаками и симптомами отека мозга, имитирующими цереброваскулярные события или опухоли центральной нервной системы.
Часто отмечаются аномалии ЭЭГ: медленные дельтаволны, утрата нормального альфа-ритма, легкие неспецифические нарушения ритма или крупные аберрантные паттерны. Очаговая активность (при наличии) обычно локализуется в височной области.
У возрастающего количества пациентов с органическими ацидуриями и, в особенности, метилмалоновой и пропионовой ацидуриями отмечается острый прогрессирующий экстрапирамидный синдром вследствие двустороннего некроза базальных ганглиев. Чаще всего данные повреждения встречаются в бледном шаре, но могут поражать другие базальные ганглии (Chemelli et al., 2000).
3. Хронические прогрессирующие формы. Гипотония, мышечная слабость, неспецифическая задержка развития и припадки в редких случаях являются единственными проявлениями изовалериановой, метилмалоновой или пропионовой ацидурии. Чаще всего данные изменения сочетаются с симптомами со стороны пищеварения и питания и плохой прибавкой веса. С другой стороны, данные хронические неврологические формы могут быть проявлением 3-метилкротонглицинурии, которая характеризуется неподдающимися лечению припадками, гипотонией, микроцефалией и задержкой развития (при рано начинающихся формах) или метаболической лейкодистрофией с эпизодами, подобными болезни Рея (у детей старшего возраста). Кроме того, многие бессимптомные случаи были выявлены с помощью скрининга методом тандемной масс-спектрометрии среди новорожденных. 3-метилглутаконовая ацидурия I типа может проявляться легкими неврологическими нарушениями (Nguyen et al., 2002). Малоновая ацидурия может проявляться изолированной задержкой развития или задержкой развития в сочетании с припадками, мышечной слабостью и кардиомиопатией (Salomons et al., 2007). Описаны редкие случаи 2-метилбутирилглицинурии и изобутирилглицинурии, проявлявшиеся мышечной слабостью и некоторой задержкой умственного развития.
Тем не менее, подавляющее большинство недавно зарегистрированных пациентов выявлено путем систематического скрининга и не имеют симптомов заболевания (Li et al., 2003), несмотря на доказанные мутации соответствующих генов (Matern et al., 2003; Pedersen et al., 2006). Дефицит 2-метил-3-гидроксибутирил-кофермент А дегидрогеназы может быть причиной сцепленного с Х-хромосомой прогрессирующего нейродегенеративного заболевания второго года жизни с признаками, напоминающими последствия гипоксическо-ишемического повреждения головного мозга новорожденных (Poll-The et al., 2004b). Нарушения движений, такие как хорея, в сочетании с расстройствами интеллекта могут быть признаком прогрессирующих форм любой органической ацидурии.
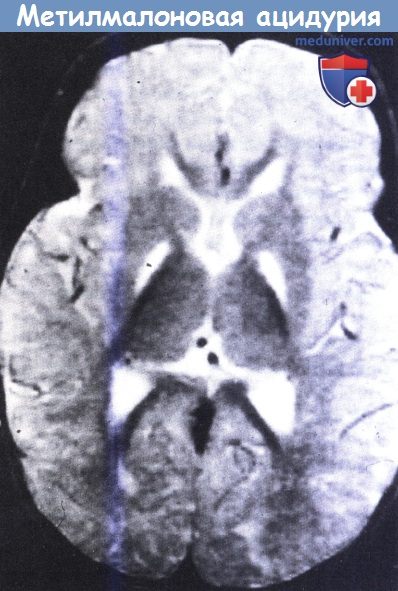
На МРТ в Т2-режиме видны симметричные участки усиления сигнала в области бледного шара у восьмимесячного ребенка.
Также отмечаются признаки отсроченной миелинизации.
г) Биохимическая диагностика. Диагностика основана на выявлении аномальных промежуточных субстратов и сопутствующих веществ, образующихся в результате метаболического блока. У пациентов с БКС хроматография аминокислот характеризуется высоким уровнем лейцина, валина и изолейцина в плазме и моче, а также наличием аллоизолейцина. С другой стороны, все остальные блоки ферментов приводят к накоплению в плазме и экскреции с мочой органических кислот и диагностируются с помощью газожидкостной хроматографии и масс-спектрометрии, в то время как аминокислотная хроматография не позволяет поставить диагноз. Тандемная масс-спектрометрия позволяет диагностировать данные нарушения за счет выявления аномальных параметров ацилкарнитина, формирующихся в результате накопления специфических ацилкарнитинов. Для окончательной диагностики требуется оценка специфической ферментной активности в фибробластах или лейкоцитах и/или идентификация патогенной мутации в пораженных генах.
д) Лечение. Целью лечения является снижение количества токсических метаболитов (Ogier de Baulny et al., 2005). В периоде новорожденности в случае наиболее остро протекающего заболевания детям требуется активное питание, часто в сочетании с экзогенной детоксикацией. Долгосрочная диетотерапия предполагает ограничение потребления белка при сбалансированной по остальным компонентам диете. В связи с тем, что некоторые витамины являются кофакторами специфических ферментных превращений, очень большие дозы данных витаминов должны систематически тестироваться в каждом случае. Данное терапевтическое тестирование позволяет выявить пациентов, реагирующих на применение витаминов, у которых заболевание выражено в меньшей степени и необходима менее строгая диета. При лечении органических ацидурий систематически применяется поддерживающая терапия L-карнитином. При изовалериановой ацидурии и 3-метилкротонилглицинурии применение L-глицина и L-карнитина увеличивает экскрецию метаболитов с мочой и является эффективным средством детоксикации.
Несмотря на раннюю диагностику и лечение, в любом возрасте у таких детей сохраняется риск развития угрожающего жизни метаболического дисбаланса и неврологических последствий. Кроме того, у многих пациентов с метилмалоновой и пропионовой ацидурией отмечается прогрессирующая неврологическая дисфункция с нарушением интеллекта, атаксией, мышечной слабостью и недостаточностью питания. Другие осложнения затрагивают почки, поджелудочную железу и сердце. Учитывая данные долгосрочные осложнения, проводится трансплантация печени и почек. Трансплантация не способна предотвратить острую неврологическую деградацию и некроз базальных ганглиев (Leonard et al., 2001; Chakrapani et al., 2002).
Редактор: Искандер Милевски. Дата публикации: 12.12.2018




