Известно что миопатия дюшенна сопровождающаяся дистрофией мышц наследуется как рецессивный признак а
Прогрессирующая мышечная дистрофия Дюшенна
Прогрессирующая мышечная дистрофия Дюшенна — наследуемая сцеплено с Х-хромосомой патология мышечной системы, проявляющаяся в первые 3-5 лет жизни и характеризующаяся быстро распространяющейся и усугубляющейся мышечной слабостью. Первоначально поражаются мышцы тазового пояса и бедер, затем — плеч и спины, постепенно наступает обездвиженность. Миодистрофия сопровождается скелетными деформациями и поражением сердца. Диагностика дистрофии Дюшенна включает неврологическое и кардиологическое обследование, определение уровня КФК, электромиографию, консультацию генетика, ДНК-анализ, биопсию мышц. Лечение симптоматическое. В связи со слабостью дыхательной мускулатуры на заключительном этапе заболевания требуется ИВЛ.
Общие сведения
Причины
Развитие мышечной дистрофии Дюшенна связано с наличием мутации в 21-ом локусе короткого плеча Х-хромосомы в гене, кодирующем белок дистрофин. Около 70% случаев болезни вызваны дефектным геном дистрофина, полученным от матери — носительницы патологической мутации. Остальные 30% связаны с появлением свежих мутаций в яйцеклетках матери. В отличие от миодистрофии Беккера, при дистрофии Дюшенна генетические аберрации приводят к сдвигу рамки считывания ДНК и полному прекращению синтеза дистрофина, что и обуславливает более тяжелое течение патологии.
В норме входящий в сарколемму миоцитов дистрофин обеспечивает ее целостность и устойчивость к растяжению, возникающему при сократительной активности мышечных волокон. Отсутствие дистрофина влечет за собой нарушение целостности сарколеммы, разрушение миоцитов и их замещение жировой и соединительной тканью. Клинически этот процесс выражается прогрессирующим снижением способности мышц к сокращению, утратой мышечной силы и тонуса, атрофией мышц.
Симптомы
Дебют миодистрофии Дюшенна приходится на период от 1 до 5 лет. Как правило, уже на 1-ом году жизни заметно некоторое отставание моторного развития ребенка. Отмечается задержка сроков начала сидения, самостоятельного вставания и ходьбы. Когда ребенок начинает ходить, он отличается неуклюжестью и большей, по сравнению со сверстниками, неустойчивостью; часто спотыкается.
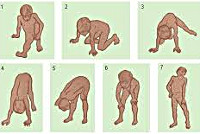
Мышечная слабость возникает на 3-4-ом годах жизни. Первоначально она выражается в патологически повышенной утомляемости при ходьбе по лестнице или на длинные расстояния. Со временем становится заметной типичная для миодистрофий утиная походка. Обращают на себя внимание особенности поведения ребенка — каждый раз, поднимаясь из положения сидя на корточках, он активно опирается руками о собственное тело, как бы взбираясь по нему как по лесенке (симптом Говерса).
Мышечные атрофии начинаются с мышц бедер и тазового пояса. Для дистрофии Дюшенна характерно их быстрое восходящее распространение на плечевой пояс, мускулатуру спины и проксимальных отделов рук. Вследствие мышечных атрофий формируется «осиная» талия и отстоящие от спины «крыловидные» лопатки. Типичным симптомом выступает псевдогипертрофия икроножных мышц. Наблюдается выпадение сухожильных рефлексов: вначале — коленных, затем — рефлексов с трицепса и бицепса плеча. Ахилловы и карпорадиальные рефлексы могут длительное время быть сохранны. Со временем развиваются ретракции сухожилий и мышечные контрактуры.
Прогрессирующая мышечная дистрофия Дюшенна сопровождается нарушениями в костно-суставной системе. Характерны искривление позвоночника (кифоз, усиленный лордоз, сколиоз), деформации грудной клетки (килевидная или седловидная), деформации стоп. Сердечно-сосудистые расстройства обусловлены развитием кардиомиопатии и включают аритмию, лабильность артериального давления, глухость тонов сердца. У 50% больных фиксируются нейроэндокринные расстройства — адипозогенитальная дистрофия, синдром Иценко-Кушинга и др. Около 30% больных страдает олигофренией, как правило, ограничивающейся степенью дебильности. Могут отмечаться СДВГ, расстройства по типу аутизма, дислексия, нарушения краткосрочной памяти.
Осложнения
Уже к 7-10-летнему возрасту дистрофия Дюшенна приводит к выраженным двигательным ограничениям. К 12 годам больные, как правило, утрачивают способность ходить, а к возрасту 15 лет большинство пациентов полностью теряют возможность самостоятельных движений. Распространение дистрофического процесса на дыхательную мускулатуру приводит к прогрессирующему падению жизненной емкости легких (ЖЕЛ) и, в конечном итоге, невозможности совершать дыхательные движения.
Диагностика
Установить диагноз миодистрофии Дюшенна помогает анамнез, неврологическое обследование, результаты электрофизиологического тестирования, определение креатинфосфокиназы (КФК) в биохимическом анализе крови, морфологическое и иммунохимическое исследование образцов мышечной ткани, генетическое консультирование и анализ ДНК:
При этом дифференциальную диагностику следует проводить с другими миопатиями — метаболической, воспалительной, миодистрофией Беккера, мышечной дистрофией Дрейфуса, дистрофией Эрба-Рота, а также с полиневропатиями, полимиозитом, БАС.
Лечение мышечной дистрофии Дюшенна
Стандартная терапия
Терапия, применяемая в клинической практике, включает симптоматическое и патогенетическое направление. В рамках данных направлений применяется медикаментозная терапия, физическая реабилитация, респираторная поддержка:
Экспериментальная терапия
Прогноз и профилактика
Профилактические мероприятия направлены на выявление женщин-носительниц аномального гена дистрофина и предупреждение рождения у них больного ребенка. В рамках профилактических мер проводятся консультации генетика для планирующих беременность супружеских пар, консультации беременных и пренатальная ДНК-диагностика.
Миодистрофия Дюшенна: что это такое?
Время чтения: 10 мин.
Доктор медицинских наук, президент благотворительного фонда “Гордей” и бабушка Гордея, мальчика с диагнозом миодистрофия Дюшенна, Татьяна Андреевна Гремякова рассказывает о том, что это за болезнь, почему ее часто принимают за гепатит, и что необходимо делать, чтобы дети с этим диагнозом как можно дольше сохраняли активность и жили полной жизнью.
Мышечная дистрофия Дюшенна (МДД) — одно из наиболее распространенных среди редких (орфанных) генетических фатальных нейромышечных заболеваний. В большинстве случаев оно встречается только у мальчиков.
Заболевание развивается вследствие мутации гена, который отвечает за синтез белка дистрофина. У детей прогрессирует повреждение и дегенерация мышц. Со временем мышцы слабеют до такой степени, что дети/подростки не могут самостоятельно передвигаться — в возрасте 10-15 лет мальчики садятся в инвалидную коляску. Параллельно у них развиваются кардиореспираторные нарушения — проблемы с сердцем и дыханием. В возрасте 15-20 лет им уже требуется респираторная поддержка: вначале только ночью, а в дальнейшем – круглосуточно.
Сегодня, благодаря профилактике формирования контрактур, сколиоза и кардиомиопатии, применению стероидов, внедрению респираторной поддержки и другим превентивным мерам, удалось существенно продлить функциональную активность пациентов,
качество и продолжительность их жизни.
Ожидаемая продолжительность жизни мальчиков с МДД, рожденных в последние годы в развитых странах (при условии, что им доступна современная реабилитация, терапия и респираторная поддержка), — 30-40 лет.
Болезнь в большинстве случаев передается от матерей, но сами женщины от нее практически не страдают: они бессимптомные или малосимптомные носители дефектного гена. Ген может передаваться по женской линии многие поколения и никак не проявляться, поэтому рождение ребенка с дистрофией Дюшенна для семьи часто становится неожиданностью. В трети случаев болезнь – результат спонтанной мутации плода без семейной истории.
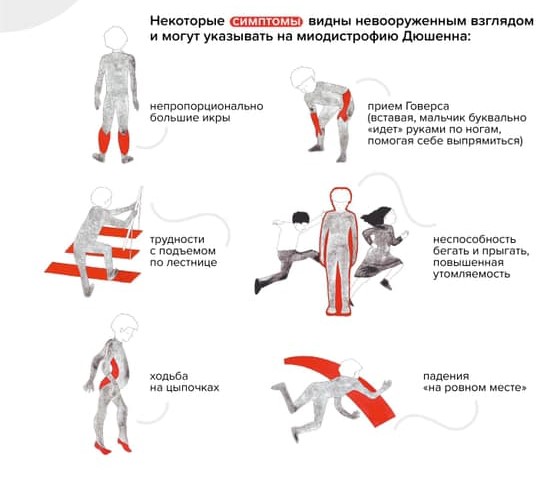
В начале болезнь распознать трудно: симптомы проявляются не сразу и нарастают постепенно. Чаще всего до четырех-пяти лет врачи и родители считают, что малыш здоров. У ребенка могут быть некоторые задержки двигательного и речевого развития, он может быть неуклюжим, часто падать и быстро уставать. Мальчик с МДД не бегает так быстро, как сверстники, не прыгает. Родителям зачастую видны некоторые особенные нюансы взросления, но никаких «красных флагов», которые позволили бы серьезно обеспокоиться, нет довольно долго.
Ребенок растет, со временем меняется его походка и осанка. Можно заметить, что он ходит на носочках. Ему трудно вставать с пола — поднимается, опираясь на руки (прием Говерса).
“Прием Говерса” и другие вероятные признаки наличия у ребенка миодистрофии Дюшенна / Фонд “Гордей”
Обращает на себя внимание увеличение икроножных мышц. Позднее трудности при ходьбе нарастают: ребенок с трудом поднимается по лестнице, у него совсем нет сил. В какой-то момент он вовсе перестает ходить и садится в инвалидную коляску.
Если есть сомнения относительно здоровья мальчика, то первое, что нужно сделать, — анализ крови на активность креатинфосфокиназы (КФК). Это фермент, содержащийся в скелетных мышцах, маркер их распада. Обычно при МДД он бывает выше нормы во много раз — например, несколько десятков тысяч единиц при норме в сотню.
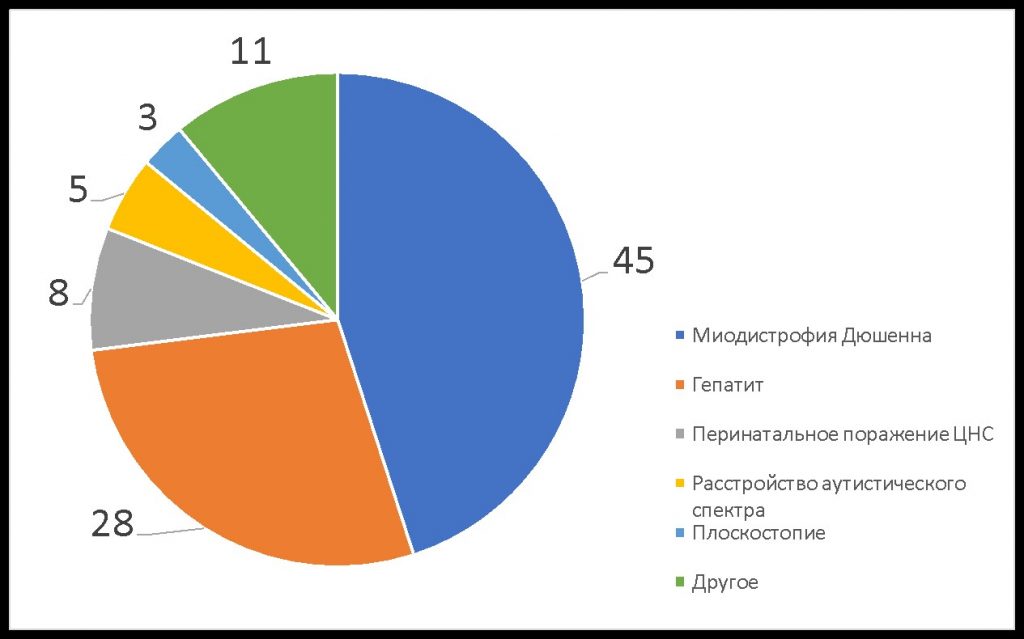
МДД — редкое заболевание. Врачи могут ни разу за свою практику не столкнуться с ним и не знать, что делать. Часто ребенку ошибочно ставят диагноз гепатит, перинатальное поражение ЦНС и/или аутизм и назначают лечение, подчас ускоряющее прогрессирование Дюшенна (Рис. 1).
Рис. 1. Результаты опроса
200 родителей (%): “Какой первый диагноз был поставлен мальчику с миодистрофией Дюшенна в первичном поликлиническом звене?”
Почему гепатит — самый частый из неверных диагнозов? При МДД в крови повышаются уровни трансаминаз, что ошибочно принимается за симптоматику гепатитов. Но эти ферменты в случае МДД мышечного, а не печеночного происхождения.
Если выявлено увеличение уровня КФК выше критического (более 2000 ед), необходимо делать генетический анализ и искать мутацию в гене дистрофина.
Информация для медицинских специалистов
Ген дистрофина — один из самых больших в человеческом организме. Он состоит примерно из 2,5 млн пар нуклеотидов, содержит 79 экзонов, размер гена 2,2 Мб. Уровень мутаций гена относительно высок: в одном из трех случаев МДД вызывается мутацией de novo (впервые возникшее изменение, в отличие от унаследованного – прим.ред). Таким образом, новые случаи возникают даже при наличии хороших инструментов пренатальной диагностики и семейного консультирования для известных случаев.
Высокая частота мутаций также лежит в основе большого разнообразия мутаций, выявленных у пациентов с МДД. Наиболее часто встречаются делеции (
68%), затем по частоте идут дупликации (
11%) одного или нескольких экзонов, реже обнаруживаются небольшие мутации (∼20% пациентов). Мутации могут происходить на любом участке гена, но делеции чаще сконцентрированы между экзонами 45–55, а дупликации — между экзонами 2–10. Тип и расположение мутации определяют ход течения заболевания и то, какое лечение требуется больному.
Сейчас в России применяется специфическая молекулярно-генетическая диагностика повреждения гена дистрофина, определение мутации в каждом конкретном случае.
Генетическое тестирование позволяет точно поставить диагноз. Ранняя и прецизионная диагностика больных МДД необходима для правильного сфокусированного назначения этиопатогенетической терапии. Фактически каждому такому ребенку требуется персонализированная терапия в зависимости от типа и локализации мутации гена.
Бесплатная генетическая диагностика проводится больным с диагнозом МДД, а также бессимптомным пациентам с высокими значениями КФК (более 2000 ЕД\л) с 2019 года. Ограничений по возрасту исследуемых больных нет.
Как попасть на генетическую диагностику?
Диагностику проводят в ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова». Направить на диагностику может только врач. Для этого он должен позвонить на Горячую линию по номеру 8-800-100-17-60 (линия предназначена исключительно для врачей) и зарегистрировать пациента в программе бесплатного генотипирования. В этом случае транспортные услуги по перевозке биоматериалов также будут бесплатны.
Только в 30% случаев больной ребенок рождается в результате спонтанной мутации. В 70% случаев носителем мутации является мама ребенка, которая, как правило, не знает об этом.
При планировании беременности женщинам желательно сделать генетический тест на носительство МДД. В некоторых странах такой тест обязателен.
Оценка функциональной активности ребенка позволяет понять его состояние и спрогнозировать дальнейшее течение заболевания. Для этого заболевания нет биохимических маркеров течения болезни. Изменение функциональной и физической активности у детей с МДД выражается в числовых значениях. Это позволяет понять степень выраженности болезни и динамику ее клинической симптоматики.
Если ребенок ходит, его состояние оценивают по методу The North Star (NSAA). Дополнительно оценивается расстояние, пройденное за 6 минут, и время подъема и спуска с четырех ступеней.
Для тех, кто потерял способность ходить, есть метод оценки работы рук — Performance of Upper Limb (PUL) test.
Физическая терапия и реабилитация — основа ухода за больными с МДД на протяжении всей жизни. Она нужна, чтобы поддерживать физическую активность и функциональность.
Современная реабилитация ориентирована:
На более поздних этапах болезни это:
Тутора для ребенка с миодистрофией Дюшенна / Фонд “Гордей”
Для сохранения способности ходить важно следить за постановкой ног ребенка на полную стопу, а также уделять внимание растяжке, особенно мышц голеностопа. Иначе через некоторое время мальчик сможет ходить только на цыпочках, и тогда ему понадобится коляска.
Занятия в бассейне / Фонд “Гордей”
Если не заниматься физической терапией, ребенок может потерять способность ходить рано и сесть в коляску в 7-8 лет.
В результате начнутся серьезные изменения, в первую очередь, позвоночника: сильный сколиоз, требующий операции на позвоночнике, пострадают сердце и дыхание.
Реабилитация и физическая терапия способны надолго продлить двигательную активность больного.
Позиционирование на стадии коляски фокусируется на том, чтобы сохранить правильное положение тела и ног, не допустить развития сколиоза и контрактур в суставах, сохранить максимальный объем движений рук.
В наиболее тяжелой стадии заболевания важна респираторная реабилитация.
Медицинская помощь
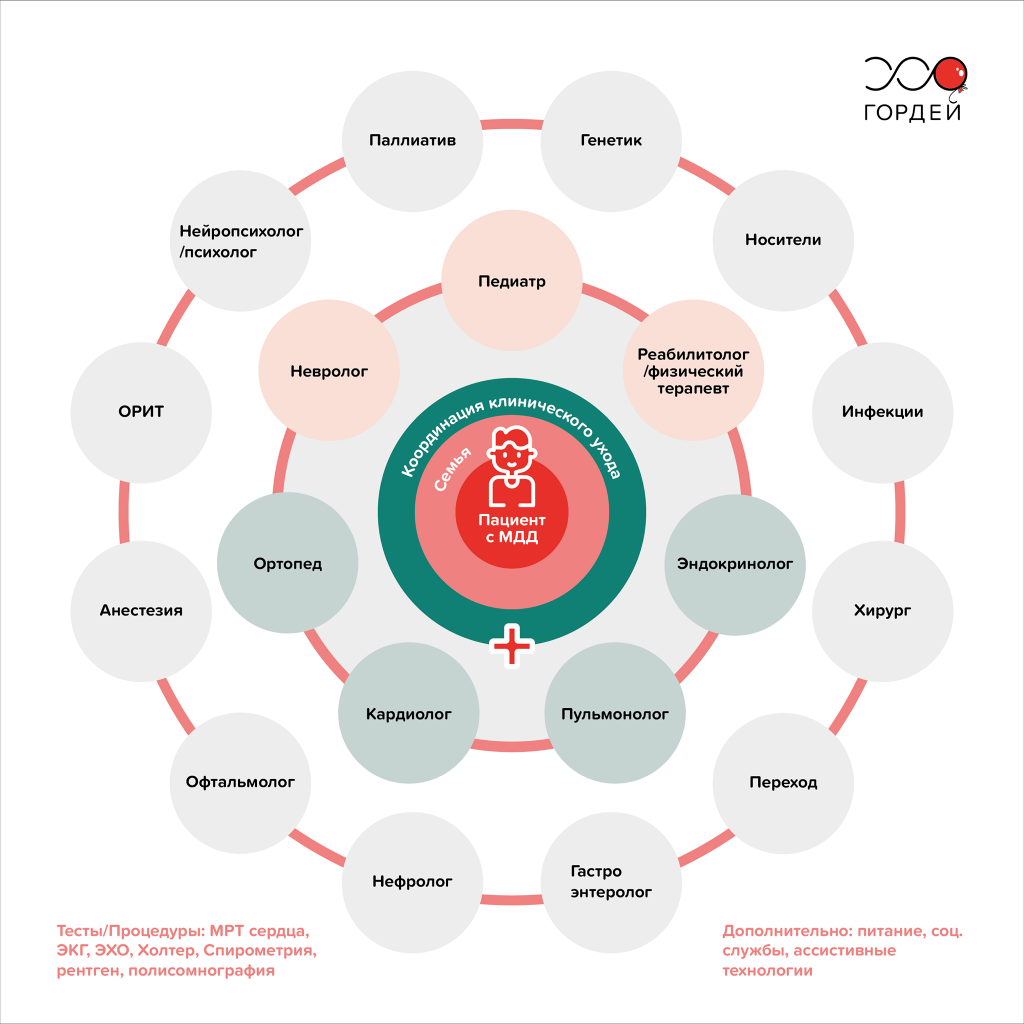
Миодистрофия Дюшенна — прогрессирующее заболевание, которое со временем поражает многие системы и органы человека. А значит, вести пациента с МДД должна мультидисциплинарная команда врачей под руководством специалиста по нервно-мышечным заболеваниям (например, педиатр или детский невролог).
По мере взросления ребенка эта функция переходит к неврологу, работающему со взрослыми пациентами. Следует заранее определить необходимых специалистов, чья помощь понадобится уже взрослому пациенту.
В современной медицинской и паллиативной концепции ведения пациентов с МДД считается важным ориентироваться на его семью: общаться, координировать уход, информировать об ожидаемых изменениях, связанных с болезнью.
Какие врачи ведут пациента с МДД
| Специалист | Сфера ответственности |
|---|---|
| Невролог | Комплексное ведение болезни на протяжении всей жизни. |
| Реабилитолог | Упреждение развития контрактур и деформации, минимизация боли, продление функциональности и способности к передвижению. |
| Ортопед/Хирург | Поддержка двигательных функций как можно дольше, минимизация контрактур суставов, поддержка позвоночника в прямом положении. |
| Эндокринолог (поддержание костного здоровья) | Уменьшение прогрессирования остеопороза, восстановление при ранних признаках остеопороза. |
| Эндокринолог (рост и половое созревание) | Минимизация нарушений роста, коррекция пубертатного развития, развитие и предотвращение опасного для жизни криза надпочечников. |
| Пульмонолог | Уменьшение респираторных осложнений и сохранение функции дыхательных мышц. |
| Кардиолог | Максимальное продление работы сердца, упреждение формирования сердечной недостаточности и других отклонений. |
| Гастроэнтеролог и диетолог | Профилактика недостаточного или плохого питания, избыточного веса и ожирения. |
| Психолог | Психосоциальная поддержка на протяжении всей жизни, помощь в планировании будущего и формировании представлений о том, как пациенты будут активно участвовать в уходе за собой и ежедневной деятельности. |
| Паллиативная помощь | Симптоматическая терапия, предоставление технических средств реабилитации и медицинских изделий, социальная поддержка. |
Рис. 2. Схема организации мультидисциплинарного ухода за пациентами с миодистрофией Дюшенна на протяжении всей жизни / Фонд “Гордей”
Транзит во взрослую медицину и жизнь
Человек с заболеванием, которое начинается в детском возрасте и ведется детскими врачами, взрослея, переходит во взрослую медицинскую и паллиативную службу. Переход обычно происходит в возрасте от 17 лет до 21 года, в зависимости от системы здравоохранения. Однако, чем старше становится больной с МДД, тем больше он нуждается в медицинской помощи и уходе — ведь болезнь прогрессирует. А значит, без поддержки семьи и медиков не обойтись.
К сожалению, не все больные МДД смогут перейти к самостоятельной и долгой взрослой жизни. Первая причина: около трети молодых взрослых с МДД испытывают психосоциальные трудности или страдают когнитивными нарушениями, которые ограничивают самостоятельность и независимость. Вторая причина: различное течение заболевания.
Обе причины зависят от множественности мутаций гена дистрофина: от чрезвычайно злокачественной, когда дети вовсе не научаются ходить, до доброкачественной, похожей по течению и сроку жизни на миодистрофию Беккера (Birnkrant DJ, Bushby KM, Bann CM, и др., Диагностика и ведение пациентов с мышечной дистрофией Дюшенна, часть 3: первичная помощь, неотложная помощь, психосоциальная помощь и преемственность в оказании помощи на протяжении жизни пациента., The Lancet Neurology, 2018; том 17: 445-55′).
И все же для большинства молодых взрослых с МДД следует прогнозировать полноценное участие в планировании будущего и принятии решений.
Есть ли лекарство?
Сделать лекарство для МДД сложно: один препарат не вылечит всех, как при СМА. Больные МДД, как снежинки: нет одинаковых — уже описано около десяти тысяч мутаций гена. Поэтому болезнь по-разному проявляется — даже в одной семье у двух братьев.
Уже есть одобренные патогенетические лекарства, а препарат для коррекции нонсенс-мутаций в ноябре 2020 года зарегистрирован в России. Несколько препаратов находятся в третьей стадии клинических исследований. Одна из самых обнадеживающих перспектив — доставка в мышечную клетку исправленной укороченной копии гена дистрофина с помощью AAV вирусов: именно они могут перенести нужный фрагмент ДНК.
Какие перспективы?
Дети, которым диагноз «миодистрофия Дюшенна» ставится сегодня, будут жить по-другому — лучше и дольше, чем больные, рожденные 10-20 лет назад. Разработаны международные стандарты ухода, накоплен большой опыт, позволяющий предупредить развитие тяжелых осложнений болезни, продлить стадию функциональной активности ребенка, на горизонте — генетическая терапия, которая подойдет многим. Уже сейчас доступны четыре патогенетических препарата для определенных мутаций. В 2020 году в России зарегистрирован первый препарат для лечения миодистрофии Дюшенна — Аталурен.
Кто поможет?
Фонд «Гордей» создала семья, в которой растет Гордей — семилетний мальчик с миодистрофией Дюшенна. Цель фонда – улучшить на системном уровне качество диагностики, ведения, ухода, реабилитации и лекарственного обеспечения больных МДД.
Гордей с мамой, Ольгой Гремяковой. Фото из личного архива / Facebook
Одна из основных задач фонда – информирование и повышение осведомленности о миодистрофии Дюшенна врачебного и родительского сообщества. Чтобы практикующие и будущие педиатры, детские неврологи, медработники детских садов и школ знали о симптомах заболевания, а профильные специалисты имели возможности для обучения, стажировок, обмена опытом и в своей работе опирались на международные стандарты ухода и лучшие мировые практики.
Президент фонда «Гордей», доктор медицинских наук и бабушка Гордея, Татьяна Андреевна Гремякова ежемесячно проводит Школу для родителей вновь диагностированных детей с Дюшенном: отвечает на вопросы, помогает родителям понять, что именно они могут сделать для своего ребенка уже сегодня и что происходит в науке и медицине по данной нозологии.
Учредитель фонда «Гордей», психолог и мама Гордея, Ольга Гремякова два раза в месяц проводит «Передышку» — группу поддержки для мам и пап и вебинары, помогающие родителям развивать жизнестойкость, справляться со стрессом, возвращать себе контроль над своей жизнью. Для родителей вновь диагностированных мальчиков есть индивидуальные консультации с психологом.
Чтобы записаться на ближайшую Школу, «Передышку» или на индивидуальную психологическую консультацию, нужно написать по адресу: go@dmd-russia.ru
Сообщество фонда «Гордей» в Фейсбуке.
Сообщества по таргетной (подходящей для определенных мутаций) терапии:
Для родителей детей с «нонсенс-мутацией».
Для родителей детей с одной из делеций, корректируемых пропуском экзона 45.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 51.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 53.
С МДД также работают следующие организации:
Федеральные центры, работающие с МДД:
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Публикации в СМИ
Дистрофия мышечная Дюшенна
Мышечная дистрофия Дюшенна — наследственная прогрессирующая мышечная дистрофия, характеризующаяся началом в раннем возрасте, симметричной атрофией мышц в сочетании с сердечно-сосудистыми, костно-суставными и психическими нарушениями, злокачественным течением; наследуется по рецессивному X-сцепленному типу. Вариант мышечной дистрофии Дюшенна — мышечная дистрофия Беккера — имеет более доброкачественное течение.
Генетические аспекты • Псевдогипертрофическая прогрессирующая мышечная дистрофия (мышечная дистрофия Дюшенна–Беккера, *310200, Xp21.2, ген DMD дистрофина, À рецессивное) — возникает в результате дефектов гена, кодирующего белок дистрофин • Дистрофин локализован в плазматической мембране скелетных мышечных волокон и кардиомиоцитов • Преобладающий пол — мужской, тем не менее мышечные дистрофии Дюшенна и Беккера могут встречаться у девочек при кариотипе X0, мозаицизмах X0/XX, X0/XXX и структурных аномалиях хромосом.
Патоморфология • Дистрофия мышечных волокон, первично-мышечный тип поражения • Фиброзные изменения в мышечных пучках • Местная воспалительная реакция.
Клиническая картина
• Мышечная дистрофия Дюшенна начинается в первые 1–3 года жизни обычно со слабости мышц тазового пояса.
• Уже на первом году жизни отмечают отставание в психомоторном развитии. Больные дети позднее начинают садиться, вставать, ходить.
• Постепенно развиваются слабость, патологическая мышечная утомляемость при физической нагрузке, изменение походки по типу утиной. Из горизонтального положения дети встают поэтапно с использованием рук (взбирание лесенкой).
• Отмечаются симметричные атрофии проксимальных групп мышц нижних конечностей (мышцы таза и бедра). Атрофия через 1–3 года распространяется на проксимальные группы мышц верхних конечностей.
• Атрофии мышц приводят к развитию лордоза, крыловидных лопаток, осиной талии.
• Характерна псевдогипертрофия икроножных мышц.
• Мышцы при пальпации плотные, безболезненные.
• Мышечный тонус обычно снижен в проксимальных группах мышц.
• Изменения рефлексов •• Коленные рефлексы исчезают на ранних стадиях заболевания •• Позднее исчезают рефлексы с двуглавой и трёхглавой мышц плеча •• Ахилловы рефлексы обычно длительное время остаются сохранными.
• Дистальная мускулатура конечностей поражается на поздних стадиях заболевания.
• Костно-суставные нарушения — деформации позвоночника, стоп, грудной клетки; рентгенологически обнаруживают сужение костномозгового канала, истончение коркового слоя диафизов длинных трубчатых костей.
• Сердечно-сосудистые расстройства — лабильность пульса, АД, приглушение тонов, расширение границ сердца, сердечная недостаточность, изменения на ЭКГ.
• Нейроэндокринные нарушения выявляют у 30–50% больных — синдром Иценко–Кушинга, адипозогенитальная дистрофия.
• Психические нарушения — олигофрения в форме дебильности или имбецильности.
• Клинические проявления мышечной дистрофии Беккера обычно начинаются в 10–15 лет. От мышечной дистрофии Дюшенна отличается доброкачественным течением и более поздним возникновением тяжёлых симптомов. Сухожильные рефлексы долгое время остаются сохранными. Поражения внутренних органов менее выражены, интеллект сохранён.
Лабораторные исследования. Для мышечной дистрофии Дюшенна типично раннее (с 5 дня жизни) увеличение активности КФК в крови (в 30–50 раз выше нормы).
Дифференциальная диагностика. Мышечную дистрофию Дюшенна–Беккера дифференцируют от других мышечных дистрофий, рахита, врождённого вывиха бедра.
ЛЕЧЕНИЕ
Режим амбулаторный с наблюдением у невропатолога, хирурга-ортопеда, терапевта и профпатолога, работника социальной сферы и протезиста.
Мероприятия • Лечение мышечной дистрофии Дюшенна направлено на поддержании физической активности пациента и улучшение качества его жизни; как правило, быстро становится неэффективным • Физические упражнения выполняют систематически и по определённой схеме. Короткие перерывы показаны при возникновении болей в мышцах и мышечной усталости • Использование протезов позволяет больным двигаться и замедляет формирование сколиоза • Поддержание дыхания, ИВЛ во время сна для предотвращения синдрома ночной гиповентиляции • Экспериментальные методы, в особенности генная терапия (гены дистрофина и утрофина), чрезвычайно перспективны, хотя и не получили пока клинического распространения.
Оперативное лечение. Ортопедическое вмешательство необходимо при наличии контрактур и фиксации суставов.
Лекарственная терапия • ГК (преднизолон по 0,75 мг/кг/сут) увеличивают мышечную силу у мальчиков, страдающих мышечной дистрофией Дюшенна, замедляя прогрессирование заболевания • При длительной стероидной терапии необходим тщательный контроль развития побочных эффектов, включающий наблюдение за массой тела, АД, состоянием слизистой оболочки ЖКТ и иммунной системы.
Наблюдение. Ранняя диагностика поражения внутренних органов позволяет увеличить продолжительность жизни пациентов.
Профилактика состоит в генетическом консультировании.
Синонимы • Прогрессирующая мышечная дистрофия Дюшенна • Псевдогипертрофическая мышечная дистрофия Дюшенна • Дистрофия Дюшенна • Болезнь Дюшенна • Миопатия псевдогипертрофическая • Миопатия псевдогипертрофическая Дюшенна.
МКБ-10 • G71.0 Мышечная дистрофия • M62.5 Истощение и атрофия мышц, не классифицированные в других рубриках • M62.8 Другие уточнённые поражения мышц
Примечания • Термин «псевдогипертрофическая прогрессирующая мышечная дистрофия» объединяет мышечные дистрофии Дюшенна и Беккера • Мышечная дистрофия Дюшенна описана в 1853 г. Дюшенном • Мышечная дистрофия Беккера описана в 1955 г. Беккером.