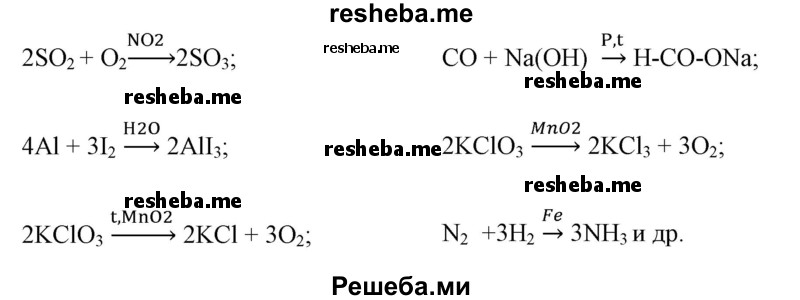Известно что реакции катализируемые неорганическими катализаторами например
Примеры катализаторов
Иногда химические вещества нуждаются в небольшом поощрении, чтобы реагировать. Термин «катализатор» указывает на вещество, которое начинает, ускоряет или облегчает химическую реакцию. Похоже
Содержание:
Иногда химические вещества нуждаются в небольшом поощрении, чтобы реагировать. Термин «катализатор» указывает на вещество, которое начинает, ускоряет или облегчает химическую реакцию. Похоже, катализаторы можно найти только в химической лаборатории, но вы можете быть удивлены, обнаружив примеры катализаторов в своей повседневной жизни! Продолжайте читать, чтобы узнать, что такое катализатор, и увидеть примеры химических катализаторов, а также примеры катализаторов в нехимическом контексте.
Примеры химических катализаторов
Примеры неорганических катализаторов
Примеры органических катализаторов
Органические катализаторы известны как «органокатализаторы». Они состоят из неметаллических элементов, таких как углерод, водород и сера. Биокатализаторы, такие как белки и ферменты, представляют собой еще один тип органических катализаторов, участвующих в биохимических процессах. Подобно неорганическим катализаторам, они все еще существуют в своей первоначальной форме после завершения реакции.
Нехимические катализаторы
Когда термин «катализатор» используется вне химии, он относится к чему-то, что вызывает социальные изменения или реакцию. Это образное определение основано на определении химического катализатора, который запускает большую реакцию. Некоторые примеры образных катализаторов:
Катализаторы вокруг нас
Эти примеры катализаторов показывают, как одно действие или один человек, как в химии, так и в жизни, могут стать началом больших изменений. Важно помнить, что катализатор только запускает реакцию и что для истинного изменения необходимо больше реагентов. Взгляните на эти повседневные примеры химических реакций, чтобы узнать больше о том, как химия влияет на вашу повседневную жизнь.
Задания части 2 ЕГЭ по теме «Строение и функции белков»
1. Почему температура выше 40 °С опасна для жизни?
Из-за высокой температуры происходит денатурация белков организма, нарушается обмен веществ.
2. Найдите ошибки в приведенном тексте, исправьте их. Укажите номера предложений, в которых сделаны ошибки, объясните их. (1) Большое значение в строении и жизнедеятельности организмов имеют белки. (2) Это биополимеры, мономерами которых являются азотистые основания. (3) Белки входят в состав плазматической мембраны. (4) Многие белки выполняют в клетке ферментативную функцию. (5) В молекулах белка зашифрована наследственная информация о признаках организма. (6) Молекулы белка и тРНК входят в состав рибосом.
2) Мономерами белков являются аминокислоты.
5) Наследственная информация зашифрована в нуклеиновых кислотах.
6) В состав рибосом входят молекулы белка и рРНК.
3. Почему ферменты слюны активны в ротовой полости, но теряют свою активность в желудке?
Ферменты слюны расчитаны на работу в щелочной среде (в ротовой полости щелочная среда). Когда ферменты слюны попадают в желудок, где среда кислая, они денатурируют (изменяют свою форму) и перестают подходить к своим субстратам (углеводам пищи) как ключ к замку. Из-за этого реакции, катализируемые ферментами слюны, останавливаются.
4. Замораживание ферментов, в отличие от действия высоких температур, не приводит к потере их активности при возвращении в нормальные условия. Чем это объясняется?
1) ферменты являются белками, поэтому нагревание приводит к их необратимой денатурации и потере активности;
2) низкие температуры вызывают обратимую денатурацию белков, и в нормальных условиях они восстанавливают свою структуру и активность
5. Как называются мономер белка, короткая молекула белка, молекула белка в третичной структуре?
Мономер белка называется аминокислота, короткая молекула белка называется пептид (полипептид), молекула белка в третичной структуре называется глобула.
6. Найдите три ошибки в приведенном тексте «Ферменты». Укажите номера предложений, в которых сделаны ошибки, исправьте их. Дайте правильную формулировку. (1) Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых системах. (2) Большинство ферментов являются полисахаридами. (3) Один фермент может ускорять разные типы биохимических реакций. (4) Ферменты становятся активными и ускоряют реакции в строго определенных химических средах. (5) По окончании биохимических реакций ферменты частично входят в состав образовавшихся веществ. (6) Активность ферментов зависит от температуры. (7) Эффективность ферментов в клетках значительно выше эффективности неорганических катализаторов.
2 – большинство ферментов является белками;
3 – один фермент ускоряет только один тип биохимических реакций (или одну определенную реакцию);
5 – по окончании биохимической реакции фермент освобождается и остается в неизменном виде
7. Найдите три ошибки в приведённом тексте «Белки». Укажите номера предложений, в которых сделаны ошибки, исправьте их. (1) Белки отличаются друг от друга количеством и последовательностью мономеров. (2) Первичная структура белка зашифрована в гене последовательностью аминокислот. (3) Аминокислотные звенья соединяются между собой в единую цепь водородными связями. (4) Первичная структура белка определяет его форму, свойства и функции. (5) Вторичная структура белка имеет вид спирали или сложной, складчатой структуры. (6) Третичная структура имеет вид клубка, или глобулы, при этом образуются дисульфидные, ионные и другие связи, гидрофобные взаимодействия. (7) Четвертичная структура некоторых белков содержит атомы металлов, например магния, в молекуле гемоглобина.
8. Рассмотрите предложенную схему. Запишите в ответе пропущенный термин, обозначенный на схеме знаком вопроса.
9. Чем отличаются ферменты от неорганических катализаторов?
1) Ферменты – вещества белковой природы.
2) Каждый фермент ускоряет только одну химическую реакцию.
3) Ферменты ускоряют химические реакции в сотни тысяч и миллионы раз. Это намного быстрее, чем при использовании неорганического катализатора.
4) Ферменты активны только при определенных условиях – температуре и кислотности среды, не повреждающих структуру белка.
10. Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых они допущены, объясните их. (1) Белки — это нерегулярные биополимеры, мономерами которых являются нуклеотиды. (2) Остатки мономеров соединены между собой пептидными связями. (3) Последовательность мономеров, удерживаемая этими связями, формирует первичную структуру белковой молекулы. (4) Следующая структура — вторичная, удерживается слабыми гидрофобными связями. (5) Третичная структура белка представляет собой скрученную молекулу в виде глобулы (шара). (6) Удерживается такая структура водородными связями.
1) Мономерами белков являются аминокислоты.
4) Вторичная структура удерживается водородными связями.
6) Третичная структура белка удерживается ковалентными дисульфидными, ионными, гидрофобными и другими связями.
11. Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых они допущены, объясните их. (1) Быстрое протекание химических реакций в организме обеспечивают ферменты. (2) Один фермент катализирует несколько разных реакций. (3) Так, например, фермент, расщепляющий белки, может расщеплять и жиры. (4) По химической природе ферменты — это только белковые молекулы. (5) Они не изменяются по своему химическому составу в результате реакции. (6) Каждая молекула фермента может осуществлять несколько тысяч операций в минуту.
2) Один фермент катализирует одну реакцию.
3) Фермент специфичен по отношению к субстрату и взаимодействует только с определённым веществом.
4) Ферменты могут образовывать комплексы с небелковыми компонентами — витаминами, металлами.
Отличие ферментов от неорганических катализаторов
1. Ферменты имеют более высокую каталитическую активность (выше в млн.раз);
2. Каталитическая активность проявляется в очень мягких условиях (умеренные температуры 37-40ºС, нормальное давление, близкие к нейтральным значения рН среды 6,0÷8,0). Например, гидролиз белка в присутствии неорганических кислот и щелочей протекает при 100ºС и выше в течение нескольких десятков часов. При участии ферментов этот процесс протекает за десятки минут при 30÷40ºС;
3. Ферменты обладают высокой специфичностью действия, т.е. каждый фермент катализирует в основном только строго определенную химическую реакцию (например, платина катализирует несколько десятков химических реакций);
4. Активность ферментов в клетках строго контролируется и регулируется;
5. Не вызывают каких-либо побочных реакций;
6. Различия связанные с белковой природой ферментов (термолабильность, зависимость от рН среды, наличие активаторов и ингибиторов и др.).
Строение ферментов
До последнего времени считалось, что абсолютно все ферменты являются веществами белковой природы. Но в 80-е годы была обнаружена каталитическая активность у некоторых низкомолекулярных РНК. Эти ферменты назвали рибозимами. Остальные, свыше 2000 известных в настоящее время ферментов, имеют белковую природу и характеризуются всеми свойствами белков.
По строению ферменты делятся на:
– простые или однокомпонентные;
– сложные или двухкомпонентные (холоферменты).
Простые ферменты представляют собой простые белки и при гидролизе распадаются только на аминокислоты. К числу простых ферментов относятся гидролитические ферменты (пепсин, трипсин, уреаза и др.).
Сложные белки являются сложными белками и, помимо, полипептидных цепей содержат небелковый компонент (кофактор). К сложным белкам относится большинство ферментов.
Белковая часть двухкомпонентного фермента называется апоферментом.
Кофакторы могут иметь различную прочность связи с апоферментом.
Если кофактор прочно связан с полипептидной цепью, он называется простетической группой. Между простетической группой и апоферментом – ковалентная связь.
Если кофактор легко отделяется от апофермента и способен к самостоятельному существованию, то такой кофактор называется коферментом.
Между апоферментом и коферментом связи слабые – водородные, электростатические и др.
Химическая природа кофакторов крайне разнообразна. Роль кофакторов в двухкомпонентных ферментах играют:
1 – большинство витаминов (Е, К, Q, С, Н, В1, В2, В6, В12 и др.);
2- соединения нуклеотидной природы (НАД,НАДФ, АТФ, КоА, ФАД, ФМН), а также целый ряд др. соединений;
3 – липолевая кислота;
Активный центр ферментов.
Ферменты – высокомолекулярные вещества, молекулярный вес которых достигает нескольких млн. Молекулы субстратов, взаимодействующих с ферментами обычно имеют гораздо меньший размер. Поэтому естественно предположить, что с субстратом взаимодействует не вся молекула фермента в целом, а только какая-то ее часть – так называемый “активный центр” фермента.
Активный центр фермента – это часть его молекулы, непосредственно взаимодействующая с субстратами участвующая в акте катализа.
Активный центр фермента формируется на уровне третичной структуры. Поэтому при денатурации, когда третичная структура нарушается, фермент теряет свою каталитическую активность !
Активный центр в свою очередь состоит из:
– каталитического центра, который осуществляет химическое превращение субстрата;
– субстратного центра (“якорной” или контактной площадки), которая обеспечивает присоединение субстрата к ферменту, формирование фермент-субстратного комплекса.
Четкую грань между каталитическим и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются.
Помимо активного центра, в молекуле фермента существует т.н. аллостерический центр. Это участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного вещества (эффектора), изменяется третичная структура фермента. Это приводит к изменению конфигурации активного центра и, следовательно, к изменению активности фермента. Это явление аллостерической регуляции активности фермента.
Многие ферменты являются мультимерами (или олигомерами), т.е. состоят из двух и более субъединиц- протомеров (аналогично четвертичной структуре белка).
Связи между субъединицами, в основном, не ковалентные. Максимальную каталитическую активность фермент проявляет именно в виде мультимера. Диссоциация на протомеры резко снижает активность фермента.
Ферменты – мультимеры содержат обычно четкое число субъединиц (2-4), т.е. являются ди- и тетрамерами. Хотя известны гекса- и октамеры (6-8) и чрезвычайно редко встречаются тримеры и пентамеры (3-5).
Ферменты-мультимеры могут быть построены как из одинаковых, так и из разных субъединиц.
Если ферменты-мультимеры образованы из субъединиц различных типов, они могут существовать в виде нескольких изомеров. Множественные формы фермента называют изоферментами (изоэнзимами или изозимами).
Например, фермент состоит из 4 субъединиц типов А и Б. Он может образовать 5 изомеров: АААА, АААБ, ААББ, АБББ, ББББ. Эти изомерные ферменты являются изоферментами.
Изоферменты катализируют одну и ту же химическую реакцию, обычно воздействуют на один и тот же субстрат, но отличаются по некоторым физико-химическим свойствам (молекулярной массе, аминокислотному составу, электрофоретической подвижности и др.), по локализации в органах и тканях.
Особую группу ферментов составляют т.н. мультимерные комплексы. Это системы ферментов, катализирующих последовательные стадии превращения какого-либо субстрат. Такие системы характеризуются прочностью связи и строгой пространственной организацией ферментов, обеспечивающей минимальный путь прохождения субстрата и максимальную скорость его превращения.
Примером может служить мультиферментный комплекс, осуществляющий окислительное декарбоксилирование пировиноградной кислоты. Комплекс состоит из 3-х видов ферментов (М.в. = 4 500 000).
Механизм действия ферментов
Механизм действия ферментов заключается в следующем. При соединении субстрат с ферментом образуется нестойкий фермент субстратный комплекс. В нем происходит активация молекулы субстрата за счет:
1. поляризации химических связей в молекуле субстрат и перераспределение электронной плотности;
2. деформации связей, вовлекаемых в реакцию;
3. сближения и необходимой взаимной ориентации молекул субстрата (S).
Молекула субстрат фиксируется в активном центре фермента в напряженной конфигурации, в деформированном состоянии, что приводит к ослаблению прочности химических связей и снижает уровень энергетического барьера, т.е. субстрат активизируется.
В процессе ферментативной реакции различают 4 этапа:
1 – присоединение молекулы субстрат к ферменту и образование фермент-субстратного комплекса;
2 – изменение субстрата под действием фермента, делающее его доступным для химической реакции, т.е. активизация субстрата;
3 – химическая реакция;
4 – отделение продуктов реакции от фермента.
Это можно записать в виде схемы:








На 1-ом этапе к субстратному центру присоединяется с помощью слабых взаимодействий та часть молекулы субстрата, которая не подвергается химическим превращениям.
Для образования фермент-субстратного комплекса (ES) необходимо соблюдение трех условий, которые и определяют высокую специфичность действия фермента.
Условия образования фермент-субстратного комплекса:
2 Электростатическое соответствие активного центра фермента и субстрата, которое обусловлено взаимодействием противоположно заряженных групп.
3 Гибкость третичной структуры фермента – «индуцированное соответствие». Согласно теории вынужденного или индуцированного соответствия каталитически активная конфигурация молекулы фермента может возникать лишь в момент присоединения субстрата в результате его деформирующего воздействия по принципу «рука-перчатка».
Механизм действия однокомпонентных и двухкомпонентных ферментов аналогичен.
В образовании фермент-субстратного комплекса у сложных ферментов принимают участие и апофермент и кофермент. При этом субстратный центр располагается обычно на апоферменте, а кофермент принимает участие непосредственно в акте химического превращения субстрата. На последнем этапе реакции апофермент и кофермент выделяются в неизменном виде.
На 2 и 3 этапе превращение молекулы субстрата связано с разрывом и замыканием ковалентных связей.
После осуществления химических реакций фермент переходит в исходное состояние и происходит отделение продуктов реакции.
Специфичность
Способность фермента катализировать определенный тип реакции называют специфичностью.
Специфичность бывает трех видов:
3. – стехиометрическая специфичность – фермент действует только на один из стереоизомеров (например, фермент глюкозидаза сбраживает только D-глюкозу, но не действует на L-глюкозу).
Специфичность фермента обеспечивает упорядоченность протекания реакций обмена веществ.
Известно что реакции катализируемые неорганическими катализаторами например
Подробное решение параграф § 12 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Что такое катализ? Какие катализаторы химических реакций вы знаете?
Катализ — возбуждение химических реакций или изменение их скорости под влиянием веществ — катализаторов, многократно вступающих в химическое взаимодействие с участниками реакции и восстанавливающихся после каждого цикла взаимодействия свой химический состав.
Например, в некоторых химических реакциях применяются следующие катализаторы реакций Al2O3, TiO2, ThO2, MnO2, алюмосиликаты, цеолиты, CaO, BaO, MgO, Ti, Rh, Ni, квант света, повышение температуры и др.
Вопрос 2. Что такое экзо — и эндотермические реакции?
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты в окружающую среду. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ.
Эндотермическая реакция — реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы), восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Вопрос 3. Что такое прямая и обратная химические реакции?
Прямая, или необратимая, химическая реакция — реакция, идущая до конца и не изменяющая своего направления при изменении температуры и давления, а также если один из продуктов реакции выводится из сферы реакции в виде газа, осадка, малодиссоциированного соединения (воды, слабой кислоты или основания, комплексной соли) или выделяется большое количество тепла (реакция горения).
Обратная, или обратимая, химическая реакция, — это такая, в результате которой полученные вещества вновь реагируют между собой с образованием исходных веществ. При одних условиях (P, t, kat) они идут в одном направлении, при других — в обратном, а при некоторых промежуточных — протекают одновременно в двух взаимно противоположных направлениях. Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака.
Вопрос 4. Какова роль катализаторов в протекании химических реакций?
Катализаторы в протекании химических реакций могут увеличивать концентрации активных частиц в реакционной смеси, образовывать промежуточные соединения с обоими из реагентов реакции, осуществлять химическую активацию, значительно ускорять протекание химических реакций.
Вопрос 5. Что лежит в основе работы (механизма действия) любых катализаторов, в том числе ферментов?
Они снижают необходимое количество энергии активации, и за счёт этого ускоряется протекание реакции.
Вопрос 6. Какое строение имеет молекула белка — фермента?
Простые ферменты состоят только из аминокислот — например, пепсин, трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
В составе белка — фермента выделяют области, выполняющие различную функцию:
1. Активный центр — комбинация аминокислотных остатков (обычно 12 — 16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ.
2. Аллостерический центр (allos — чужой) — центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов.
Вопрос 7. Какую роль в составе фермента играют коферменты? Какие вещества в организме являются их предшественниками? Приведите примеры.
Коферменты — органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Коферменты вместе с функциональными группами аминокислотных остатков фермента формируют активный центр фермента, на котором происходит связывание с субстратом и образование активированного фермент — субстратного комплекса.
Витамины, участвующие в биохимических процессах, являются предшественниками коферментов (например, витамин В1) или собственно коферментами (например, липоамид).
Вопрос 8. Как осуществляется регуляция активности фермента?
Так, активность ферментов может регулироваться при связывании низкомолекулярных соединений в специальных регуляторных центрах катализатора или же за счёт взаимодействия ферментов с активаторами или ингибиторами.
Активность многих ферментов зависит от присутствия в среде катионов и анионов. Например, активатором амилазы слюны (фермента, расщепляющего крахмал и гликоген в ротовой полости) являются анионы хлора, активаторами енолазы (фермента, катализирующего одну из реакций гликолиза) являются Mg2+, Мn2+ и К+, каталаза и пероксидаза активируются ионами Fe2+, карбоангидраза и лактатдегидрогеназа — ионами Zn2+, фосфоглюкомутаза и холинэстераза — ионами Мn2+, аскорбатоксидаза и фенолоксидаза — ионами Сu2+. Активатором многих ферментов, например, Са — кальмодулин — зависимой протеинкиназы и многих липаз, являются ионы Са2+.
В качестве активаторов или ингибиторов ферментов могут выступать и другие низкомолекулярные соединения. Так, АТФ и цитрат (лимонная кислота) ингибируют один из ключевых регуляторных ферментов гликолиза — фосфофруктокиназу, тогда как АДФ и АМФ, наоборот, активируют этот фермент.
В активации ещё одного фермента углеводного обмена — гликогенфосфорилазы, расщепляющей гликоген в клетках печени, участвуют как низкомолекулярные соединения, так и многочисленные белки.
Вопрос 9. Приведите примеры химических реакций с участием катализаторов, укажите условия их протекания.
В некоторых случаях выбор катализатора влияет на путь химической реакции и, в конечном итоге, продукты реакции будут разные.
Вопрос 10. Из курса химии вам известно, что реакции, протекающие при участии катализаторов (никель, платина), требуют высоких температур и давления. Ферментативные процессы протекают в узких пределах изменения температуры и давления. Дайте объяснение этому факту.
Вопрос 11. Почему белки редко используются организмами в качестве источника энергии для процессов жизнедеятельности?
Мономеры белков — аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
Это невыгодно, выгоднее использовать липиды. Белки также выполняют много важных функций в организме.
Вопрос 12. Может ли один и тот же белок быть активатором одной, но при этом ингибитором другой реакции?
Может, например, протеинкиназа А одновременно способствует ингибированию синтеза гликогена и активации его распада.
Вопрос 13. Почему в качестве кофермента в активном центре присутствует низкомолекулярное вещество, а не пептидная цепь?
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Вопрос 14. Взрослые люди часто тяжело переносят повышение температуры тела на несколько градусов от нормы, что само по себе является важнейшей защитной реакцией организма против возбудителей целого ряда заболеваний. Как это может повлиять на работу ферментов и других физиологически важных веществ организма человека, имеющих белковую природу?
Активность ферментов зависит от температуры. Та температура, при которой активность фермента наибольшая, называется температурным оптимумом (opt — t°). Для организма человека opt — t° находится в пределах 36,6 — 40°С. Снижение t° приводит к уменьшению активности ферментов, а при очень низких температурах (0° — +4°С) ферментативная активность практически прекращается, т.к. резко изменяются кинетические свойства ферментов. Поэтому снижение активности ферментов имеет обратимый характер: при повышении температуры ферментативная активность полностью восстанавливается.
Так при увеличении температуры тела с 360С до 390С скорость биохимических процессов в организме увеличивается в 1,2 — 1,4 раза. При достижении определенной t для каждого фермента, это приводит к полной инактивации фермента, которая является необратимой. При повышении t, происходит денатурация белка — фермента, разрушение активного центра фермента, образование Е — S — комплекса становится невозможным, и ферментативная реакция прекращается.
Вопрос 15. ЛАБОРАТОРНАЯ РАБОТА № 5 «Каталитическая активность ферментов (на примере амилазы)».
Цель: доказать каталитическое действие белков — ферментов, показать их высокую специфичность, а также зависимость их действия от условий среды.
1. Приготовление раствора слюны, содержащего фермент амилазу.
• Тщательно прополощите рот водой.
• Наберите 2—4 мл слюны в мерный цилиндр.
• Добавьте в цилиндр воды до объёма 10 мл.
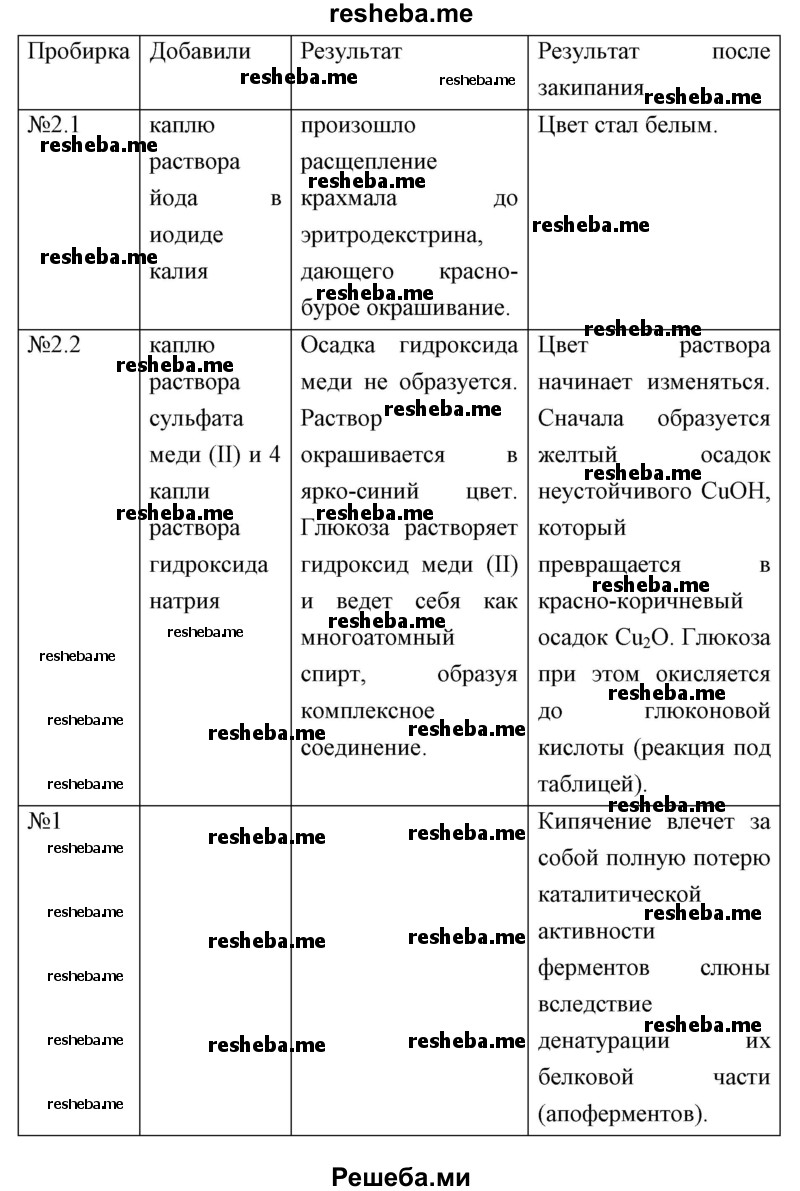
2. В две пронумерованные пробирки налейте по 10 капель раствора крахмала.
3. В пробирку № 1 внесите 4 капли воды (контроль), а в пробирку № 2 — 4 капли раствора слюны.
В пробирке №2 под действием слюны (в которой содержится амилаза) произойдет расщепление крахмала на олигосахариды (сахарозу, а она до глюкозы и фруктозы).
4. Перемешайте и поставьте на водяную баню или в термостат на 15 мин при температуре 37°С.
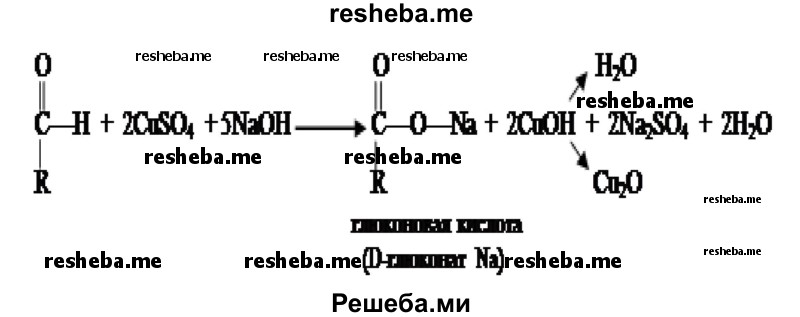
5. Из пробирки № 2 возьмите 4 капли исследуемого вещества и внесите их в две разные пробирки (по две капли в каждую). В одну из них добавьте каплю раствора йода в иодиде калия. В другую — каплю раствора сульфата меди (II) и 4 капли раствора гидроксида натрия и осторожно нагрейте до кипения. Те же действия проделайте с содержимым контрольной пробирки (№ 1).
6. Оформите полученные результаты в виде таблицы.
7. Сделайте вывод на основе проведённого исследования.
В качестве фермента, гидролизующего крахмал на его составные части (мальтозу, глюкозу), выступает амилаза слюны.
Каждый фермент действует только на одно вещество или группу сходных субстратов, что обусловлено соответствием структуры фермента, точнее его активного центра и структуры субстрата. Например, амилаза действует только на крахмал.
Мы также убедились в том, что фермент действует в зависимости от условий среды.