Известно что симпатические нервы сужают кровеносные сосуды кожи а парасимпатические их расширяют
Известно что симпатические нервы сужают кровеносные сосуды кожи а парасимпатические их расширяют
Основными актами ротового пищеварения являются сосание, жевание и глотание, являющиеся двигательными или моторными актами, а также слюноотделение – секреторный акт.
Ротовая полость играет исключительно важную роль в обеспечении начальных этапов пищеварения, а также последующих этапов – желудочного и кишечного.
Пища находится в ротовой полости около 16–18 сек, за это время она механически измельчается, перетирается, смачивается слюной и трансформируется в пищевой комок-болюс. В ротовой полости осуществляется анализ и апробация вкусовых качеств пищи, начинается ее химическая обработка за счет различных ферментов, в частности амилолитических [1, 2, 3, 6, 7, 8].
В процессе ротового пищеварения раздражаются многочисленные рецепторы ротовой полости, что обеспечивает рефлекторную стимуляцию деятельности слюнных желез, пищеварительных желез желудка, поджелудочной железы, печени, двенадцатиперстной кишки, а также моторной и эвакуаторной деятельности желудочно-кишечного тракта. В ротовой полости начинается частично процесс всасывания воды, некоторых лекарственных препаратов [1, 3, 4, 5, 6, 7, 8].
Акт сосания – двигательный акт, соответствующий у новорожденных детей и детей грудного возраста акту жевания. У новорожденного он осуществляется по принципу безусловного рефлекса. Аппарат сосания обеспечивают поперечные складки губ, десны, жировые комочки или подушечки Биша в толще щек и языка. При раздражении тактильных, температурных, вкусовых рецепторов слизистой возникает поток афферентной импульсации, распространяющейся по чувствительным волокнам V пары черепно-мозговых нервов в продолговатый мозг, в частности в комплексный пищеварительный центр, в центр акта сосания. Оттуда импульсация распространяется по эфферентным волокнам в состав V, VII, XII пары черепно-мозговых к аппарату сосания, обеспечивая безусловно-рефлекторное сокращение мышц рта и языка. Язык выполняет функцию поршня в насосе. За счет сокращений его мышц он оттягивается вниз и назад, одновременно опускается нижняя челюсть, в связи с чем создается разрежение в ротовой полости в пределах 100–150 мм рт. ст. Снижение давления в ротовой полости ниже атмосферного обеспечивает присасывающее действие в момент акта сосания, способствует поступлению молока в ротовую полость. Акту сосания способствует также отрицательное внутригрудное давление, которое передается в ротовую полость по тонким стенкам пищевода. Через 7–10 дней после рождения вырабатываются первые условные рефлексы, в том числе и рефлекс сосания [1, 2, 3, 6, 7, 8].
У человека имеется три пары больших слюнных желез; околоушные, подъязычные и подчелюстные и большое количество мелких желез, рассеянных в слизистой оболочке рта, губ, щек. Выводные протоки околоушных желез открываются на уровне верхних вторых моляров в области небольшого бугорка, а выводные протоки двух других пар открываются на дне полости рта, позади нижних вторых резцов по обе стороны от уздечки языка. Значение слюнных желез неодинаково: мелкие железы постоянно выделяют секрет, который увлажняет слизистую и предохраняет ее от высыхания, а крупные железы выделяют свой секрет периодически и принимают участие в процессе пищеварения. Следует отметить, что слюнные железы функционируют как экзо- и эндокринные железы.
Экзокринная функция связана с образованием слюны, а эндокринная с выработкой гормоноподобных веществ, таких как:
а) паротин, обеспечивающий регуляцию фосфорно-кальциевого обмена в костной ткани и ткани зуба;
б) эритропоэтин, регулирующий процессы эритропоэза в костном мозге;
в) фактор роста и регенерации эпителия слизистой полости рта, пищевода, желудка;
г) фактор регенерации симпатических нервов;
д) инсулиноподобное вещество и др. Слюнные железы состоят из слизистых и серозных клеток, которые неравномерно распределены в составе желез [1, 3, 4, 5, 6, 7, 8].
В связи с функциональными особенностями можно выделить три группы желез:
1. Слизистые, или мукоидные, в составе секрета которых содержится много слизи или вязкого мукоидного секрета. К этой группе относятся мелкие железы корня языка, твердого и мягкого нёба.
2. Белковые железы – в их составе преобладают серозные клетки, а слюна содержит в значительном количестве белки-ферменты. К числу этих желез относится околоушная железа, мелкие слюнные железы боковой поверхности языка. Околоушные железы продуцируют жидкую слюну, содержащую большое количество хлоридов натрия, кальция, ферменты амилазу, каталазу, кислую фосфатазу.
3. Смешанные железы. В составе их секрета есть муцин, вода, соли, белок. К числу этих желез относятся подъязычная, подчелюстная слюнные железы,’ мелкие железы губ и кончика языка.
Подъязычная слюнная железа продуцирует слюну, богатую муцином вязкой консистенции, обладающую щелочной реакцией и высокой активностью кислой и щелочной фосфатазы.
Поднижнечелюстная слюнная железа выделяет секрет, содержащий большое количество муцина, амилазы, хлоридов натрия, кальция, фосфатов кальция и магния, незначительное количество роданистого калия.
Ротовая жидкость, чистая и смешанная слюна
Слюна – это смесь секретов трех пар больших и множества мелких слюнных желез. Такую слюну можно рассматривать как смешанную слюну.
Чистая слюна – это слюна, которая получена непосредственно из выводного протока слюнной железы и не успела выделиться в ротовую полость, где быстро смешивается и превращается в ротовую жидкость.
Ротовая жидкость образуется за счет примешивания к слюне клеток слущенного эпителия, частиц пищи, микроорганизмов полости рта, слюнных телец (нейтрофильных лейкоцитов, мигрирующих из кровеносных сосудов в полость рта), слизи, зубного налета. Ротовая жидкость имеет вязкую консистенцию, непрозрачна, состав ротовой жидкости может изменяться в зависимости от состояния ротовой полости, качества пищи, факторов внешней среды [3, 4, 5, 6, 7, 8].
Состав, свойства и функции слюны
Слюна – пищеварительный сок. В течение суток образуется у взрослого человека от 0,5 до 2,0 л слюны, которая имеет вид вязкой опалесцирующей жидкости, несколько мутноватой за счет наличия в ней клеточных элементов; pH смешанной слюны составляет от 5,8 до 8,0.
Смешанная слюна содержит около 99,5 % воды и соответственно около 0,5–0,6 % сухого вещества, включающего органические и неорганические компоненты [3, 4, 5, 6, 7, 8].
Неорганические вещества слюны – ионы натрия, калия, кальция, магния, железа, кальция, хлора, фтора, а также фосфаты, хлориды, сульфаты, бикарбонаты.
Органические вещества слюны:
а) гликопротеиды, трансферрин, церулоплазмин, альбумины, глобулины, свободные аминокислоты, иммуноглобулины;
б) небелковые азотсодержащие соединения – мочевина, аммиак, креатин;
в) вещества с бактерицидным действием – лизоцим, обладающий также и противокариесным эффектом, а также способностью стимулировать регенераторные процессы;
г) в смешанной слюне содержатся до 3 мг % свободных моносахаридов, а также продукты их превращений – лактат, пируват, цитрат;
д) вещества мукоидной природы, в частности муцин. Муцин – важнейший органический компонент слюны, обеспечивает вязкость слюны, способствует склеиванию частичек пищи и формированию пищевого комка, подготовляет его к проглатыванию;
е) гормоны: кортизон; кортизол, эстрогены, тестостерон, саливопаротин, урогастрон, инсулиноподобное вещество, глюкагон, тонин и др.
ё) в смешанной слюне в небольших количествах присутствуют холестерин и его эфиры, жирные кислоты глицерофосфолипиды;
ж) витамины: витамин С, никотиновая, пантотеновая, фолиевая кислота, тиамин, рибофлавин, пиридоксин;
Слюна – активный пищеварительный сок, в ней содержится около 50 различных ферментов, относящихся к гидролазам, оксиредуктазам, трансферазам, липазам, изомеразам. Оптимум действия ферментов слюны – слабощелочная среда. Основным ферментом слюны является альфа-амилаза, гидролитический фермент, обеспечивающий расщепление гликозидных связей в молекуле крахмала и гликогена с образованием декстринов, а затем мальтозы и сахарозы. Мальтаза слюны расщепляет мальтозу и сахарозу до моносахаров. Кроме амилолитических ферментов в слюне обнаружены протеолитические, напоминающие по субстратной специфике трипсин: саливаин, гландулаин, калликреиноподобная пептидаза. Оптимум действия саливаина при pH 9,2–9,9., а для гландулаина оптимальна кислая среда. Протеолитические ферменты слюны, попадая в системный кровоток, оказывают депрессорное действие. Важными ферментами слюны являются кислая и щелочная рибонуклеазы, трансаминазы, пероксидаза, обеспечивающие деградацию нуклеиновых кислот вирусов и соответственно противовирусную защиту слизистой оболочки полости рта, а также альдолаза, малат- и лактатдегидрогеназа. Источниками ферментов слюны могут быть лейкоциты, микробы, эпителий [1, 3, 4, 5, 6, 7, 8].
Слюна содержит комплекс веществ, регулирующих процессы местного гемостаза в полости рта, в частности прокоагулянтные и антикоагулянтные факторы, а также компоненты системы фибринолиза. Так, слюна содержит тромбопластин, антигепариновый фактор, а также факторы, идентичные V, VIII, X плазменным факторам свертывания крови. Естественными антикоагулянтами слюны являются антитромбопластины и антитромбины. Кроме того, в слюне содержатся плазминоген, проактиватор и активатор плазминогена, антиплазмин – соединение, стабилизирующее фибрин, идентичное XIII плазменному фактору [3, 4, 5, 6, 7, 8].
Кровотечение в ротовой полости быстро прекращается на фоне сбалансированного в условиях нормы содержания факторов прокоагулянтной, антикоагулянтной и фибринолитической систем. Факторы системы фибринолиза, содержащиеся в слюне, обладают и выраженным стимулирующим воздействием на процессы физиологической и патологической репарации слизистой рта [5, 7, 8].
Все многообразие функций слюны можно представить в виде трех основных: пищеварительной, защитной и трофической [1, 3, 4, 5, 6, 7, 8].
Пищеварительная функция слюны
1. За счет ферментов амилазы и мальтазы слюна обеспечивает химическую обработку пищи, в частности расщепление углеводов до ди- и моносахаров.
2. Слюна смачивает, увлажняет пищу и связывает ее отдельные частицы за счет муцина, т.е. принимает участие в формировании пищевого комка.
3. В слюне происходит растворение солей, сахаров и других компонентов пищи; в растворенном виде указанные соединения воздействуют на вкусовые рецепторы, и таким образом слюна принимает участие в формировании вкусовых ощущений.
4. Слюна необходима для осуществления физиологического акта – глотания. За счет наличия муцина пищевой комок становится более скользким и подвижным.
5. Слюна способствует рефлекторной секреции желудочного и других пищеварительных соков.
Защитная функция слюны проявляется в следующем:
1. Слюна постоянно увлажняет слизистую оболочку рта, предохраняет ее от высыхания, защищает зубы от воздействия физических и химических факторов.
2. Слюна способствует самоочищению полости рта и зубов, отмыванию налета.
3. Слюна обеспечивает регуляцию температуры полости рта и соответственно принимаемой пищи.
4. При попадании в ротовую полость кислых или отвергаемых веществ образуется большое количество жидкой слюны с высоким содержанием белка, обеспечивающей нейтрализацию кислот, снижение концентрации токсических факторов.
5. Слюна обладает выраженными буферными свойствами, является амфотерным электролитом, регулирует pH полости рта, связывая как излишки кислот, так и оснований.
6. Слюна повышает неспецифическую резистентность полости рта к воздействию инфекционных патогенных факторов за счет наличия в ней лизоцима, миелопероксидазы, лактоферрина, катионных белков, нуклеаз и т. д.
7. Слюна участвует в противовирусной и противобактериальной защите полости рта за счет иммуноглобулинов классов G, А, М, интерферона, комплемента, а также нейтрофилов и моноцитов, мигрирующих в слюну.
8. Защитное действие слюны обеспечивается наличием в ней факторов свертывания крови. При повреждении слизистой оболочки и тканей полости рта происходит быстрая остановка кровотечения, а за счет факторов фибринолитической системы обеспечивается быстрое очищение слизистой от фибриновых налетов, создаются благоприятные условия для регенерации.
9. Постоянная (резидентная) микрофлора слюны и тканей ротовой полости препятствует размножению случайной транзиторной микрофлоры, попадающей в полость рта с пищей, водой.
10. Слюна, являясь основным источником кальция и фосфора для эмали зуба, влияет на формирование резистентности зуба к кариесу.
Трофическая функция слюны
Слюна и ротовая жидкость могут оказывать выраженное влияние на проницаемость эмали зуба практически для всех веществ, которые могут поступать в полость рта с пищевыми продуктами и водой. Различная проницаемость эмали для органических и неорганических веществ, содержащихся в слюне, обусловлена их биологической активностью, способностью связываться с элементами эмали. Слюна является основным источником кальция, фосфора, цинка, используемых для образования эмали и других компонентов зуба, причем интенсивность поступления кальция в эмаль зуба из слюны максимальна при pH 7,0–8,0, когда слюна перенасыщена кальцием. При подкислении слюны и снижении pH ниже 6,5 в ротовой жидкости падает содержание ионов кальция, что способствует его выходу из эмали [1, 3, 4, 5, 6, 7, 8].
Трофическая функция слюны обеспечивается также за счет наличия в ней различных ферментов и гормонов. Такие ферменты, как калликреин и саливаин, регулируют микроциркуляторное кровообращение в тканях слюнных желез и слизистой оболочке полости рта. Между тем избыточное содержание в слюне нуклеаз может приводить к снижению регенеративного потенциала тканей и развитию дистрофии [5, 7, 8].
Из слюнных желез выделен гормон паротин, способствующий обызвествлению зубов и скелета при одновременном снижении содержания кальция в крови.
В слюне содержатся также фосфопротеины, кальцийсвязывающий белок с высоким сродством к гидрооксиапатиту, способствующий образованию зубного камня.
Экскреторная функция слюнных желез
В составе слюны могут выделяться некоторые конечные продукты обмена (мочевина, мочевая кислота, аммиак, креатин), лекарственные препараты, алкоголь, а также ионы металлов экзогенного происхождения, в частности ртути, свинца, висмута. Экскреторная функция слюнных желез заметно усиливается при почечной или печеночной недостаточности, эндокринопатиях, когда в организме человека начинают накапливаться различные токсические продукты эндогенной природы [5, 7, 8].
Кровоснабжение слюнных желез осуществляется от ветвей наружных сонных артерий, оттекает кровь в систему наружной и внутренней яремной вен. Особенностью кровеносной системы слюнных желез является наличие многочисленных анастамозов, по которым кровь из артерий и артериол попадает в венулы и вены, минуя капиллярное русло, что способствует перераспределению крови в железе. Лимфа оттекает в подподбородочные, поднижнечелюстные и глубокие шейные лимфатические узлы [5, 7].
Механизм слюноотделения. Слюноотделение является сложным рефлекторным актом, который осуществляется на базе условных и безусловных рефлексов. Безусловно-рефлекторный механизм осуществляется при непосредственном раздражении различными веществами, в том числе и пищевыми тактильных, температурных, вкусовых, болевых рецепторов полости рта. Афферентная импульсация поступает по чувствительным волокнам V, VII, IX, X пар черепно-мозговых нервов в продолговатый мозг, в частности в центр слюноотделения. Центр слюноотделения представлен верхним и нижним слюноотделительными ядрами, являющимися соответственно ядрами лицевого (VII пара) и языкоглоточного (IX пара) нервов. От этих ядер распространяется эфферентная холинергическая импульсация по парасимпатическим нервным волокнам к слюнным железам. Причем от верхнего слюноотделительного ядра возбуждение распространяется к подъязычной и подчелюстной железам по преганглионарным волокнам в составе барабанной струны (VII пара). Преганглионарные волокна заканчиваются в поднижнечелюстном и подъязычном ганглиях, расположенных в теле соответствующих желез. От нейронов этих ганглиев постганглионарные секреторные нервные волокна идут к секреторным клеткам и сосудам подчелюстной и подъязычной слюнных желез. От нижнего слюноотделительного ядра идут преганглионарные волокна в составе нерва Якобсона (ветвь IX пары) и прерываются в ушном ганглии. Отсюда импульсы идут по постганглионарным волокнам ушновисочного нерва к секреторным клеткам и сосудам околоушной железы [3, 5, 6, 7, 8].
Эфферентная симпатическая иннервация слюнных желез также является двухнейронной. Преганглионарные волокна выходят из боковых рогов II–VI грудных сегментов спинного мозга и заканчиваются в верхнем шейном симпатическом узле, от нейронов которого отходят подстганглионарные симпатические волокна к слюнным железам [7, 8].
Влияние симпатических и парасимпатических эффекторных воздействий на секреторную функцию слюнных желез и их кровоснабжение неодинаково. При усилении парасимпатических нервных влияний на слюнные железы наблюдается обильное выделение жидкой слюны, содержащей много солей, мало органических соединений. Парасимпатические нервы являются для слюнных желез секреторными [3, 5, 6, 7, 8].
Усиление холинергических нервных влияний и процесса слюноотделения сочетается с расширением кровеносных сосудов слюнных желез и интенсификацией в них кровообращения. Эти эффекты обусловлены освобождением ацетилхолина с постганглионарных нервных окончаний, а также воздействием кининов [5, 7, 8, 9].
Усиление адренергических нервных влияний на слюнные железы сопровождается выделением небольшого количества вязкой густой слюны с большим содержанием муцина, органических соединений и малым количеством солей, поэтому симпатические нервы называют трофическими для слюнных желез. Ограничение слюноотделения при усилении адренергических нервных влияний сочетается с сужением кровеносных сосудов слюнных желез и уменьшением в них интенсивности кровотока.
В момент ротового пищеварения при так называемой «пищевой секреции» парасимпатические нервные влияния на слюнные железы выражены в большей степени, чем симпатические [5, 7, 8].
Условно-рефлекторный механизм слюноотделения. Формирование данного механизма имеет место при раздражении зрительных, слуховых, обонятельных рецепторов под влиянием различных раздражителей: вида, запах пищи, разговоров о пище, звуков, связанных с приготовлением пищи, и т. д. При виде или запахе пищи раздражаются зрительные и обонятельные рецепторы, импульсы поступают в мозговые отделы этих сенсорных систем, а оттуда по принципу доминанты возбуждения за счет временных нервных связей поступают в корковое представительство комплексного пищевого центра, затем в продолговатый мозг в комплексный пищевой центр, в частности центр слюноотделения, и, наконец, по эфферентным секреторным волокнам к слюнным железам. У человека условнорефлекторная секреция слюны может начинаться также при воспоминании о вкусной пище [7, 8].
Помимо рефлекторной регуляции слюноотделения существуют и другие виды регуляции, в частности гуморальная регуляция.
Гуморальная регуляция слюноотделения. На секрецию слюны влияют многие гормоны и биологически активные соединения, в частности гормоны гипоталамо-гипофизарной системы, поджелудочной, щитовидной железы, половых желез, а также гистамин, калликреины, кинины, изменения концентрации питательных веществ, СО2 в крови. Так, кровь, богатая питательными веществами, тормозит деятельность центра слюноотделения, наоборот, усиление слюноотделения отмечается при уменьшении в крови уровня питательных веществ [5, 7, 8].
При увеличении концентрации СО2 в крови в случае развития асфиксии происходит повышение возбудимости нейронов комплексного пищевого центра. Интенсивность слюноотделения может изменяться на фоне приема некоторых лекарственных препаратов, например, при использовании холиномиметиков (пилокарпина, физиостигмина) интенсивность слюноотделения возрастает, а при введении холинолитика – атропина возникает гипосаливация. Гуморальные факторы могут двояко влиять на интенсивность слюноотделения: непосредственно на центры головного мозга или действовать на периферический аппарат – синаптические структуры или секреторные клетки [4, 5, 7, 8].
Вегетативные расстройства: в чем отличия и как с этим жить?
Часто мы сталкиваемся с плохим самочувствием и пытаемся понять, в чем причина этого состояния. И когда уже проведено множество лабораторных и инструментальных тестов и ничего не найдено, мы задумываемся: «С чем это может быть связано? Ведь я действительно чувствую себя плохо». Если никаких поражений органов нет, самое время обратиться к неврологу. Синдром вегетативной дистонии, вегетативная недостаточность, вегетативные кризы – неврологические заболевания, которые мы затронем в этой статье.
Синдром вегетативной дистонии
Синдром вегетативной дистонии – это все формы нарушения вегетативной регуляции, чаще это вторичные проявления различных патологий.
Существуют 3 формы СВД:
Вегетативная недостаточность
Вегетативная недостаточность – синдром, связанный с нарушением иннервации внутренних органов, сосудов и эндо- и экзокринных желез.
В большинстве случаев она представляет из себя прогрессирующую вегетативную недостаточность. В свою очередь ПНВ включает в себя первичные нарушения:
Ко вторичным нарушениям можно отнести:
Могут наблюдаться различные симптомы:
Диагностика данного заболевания проводится путем физикального осмотра, проверки неврологического статуса и медикаментозных проб.
Вегетативный криз
Вегетативный криз (паническая атака) – ряд клинических проявлений, характерных для эмоциональных расстройств и расстройств вегетативной нервной системы, в зависимости от преобладания симпатической и/или парасимпатической иннервации. Обязательное присутствие тревоги, ощущение страха (вплоть до страха за свою жизнь), хотя видимой угрозы не существует, страх сойти с ума, нанесение увечья близким или себе.
Вегетативные кризы разделяют на:
Важно проведение дифференциальной диагностики с соматическими заболеваниями: гипо-, гипертиреоз, сахарный диабет, феохромоцитома, нарушение сердечного ритма и проводимости, гастрит, язвенная болезнь, эпилепсия, нейроэндокринные опухоли.
Соматоформные расстройства
Состояния наблюдаются при постоянном наличие клинических симптомов с требованием дообследования, в то время как выявленные симптомы не объясняют характер и тяжести психосоматичекой симптоматики.
Соматоформное расстройство ВНС («органные неврозы»)
Пациент предъявляет жалобы, которые возникают при нарушении функции органов, преимущественно или полностью иннервируемых вегетативной нервной системой. Соматоформные расстройства связаны с нарушением работы нервной системы и психоэмоциональные расстройства.
СРВНС включает в себя:
Диагноз ставится на основании отсутствия соматической патологии и заключения невролога и психиатра.
Лечение данного расстройства включает в себя проведение психотерапии, назначения лекарственных препаратов, иглорефлексотерапию, массаж, лечебную физкультуру, физиотерапию.
Лечение должно быть подобрано специально для каждого пациента после проведения осмотра и беседы. Важно чтобы лечение подходило самому пациенту. В случае, если пациент настроен и готов избавиться от недуга, то лечение займет меньше времени. Сроки лечения не могут быть определены точно, так как каждый случай индивидуален, но мы имеем все возможности добиться стойкой ремиссии.
Для записи к нашему специалисту позвоните по телефону +7 495 221-05-00 или оставьте заявку на сайте. Администратор подробно проконсультирует вас и запишет на осмотр специалиста в любое удобное вам время. Стоимость услуг вы узнаете непосредственно на консультации у врача.
Не стоит стесняться данных расстройств и бояться обращаться к врачу за помощью. Главное справиться с этим состоянием и иметь возможность жить полноценной жизнью.
Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой.
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Молекулярные механизмы болезней и молекулярно-биологические исследования |
| Книга: | Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой. |
Описание
Оглавление
1. Предисловие
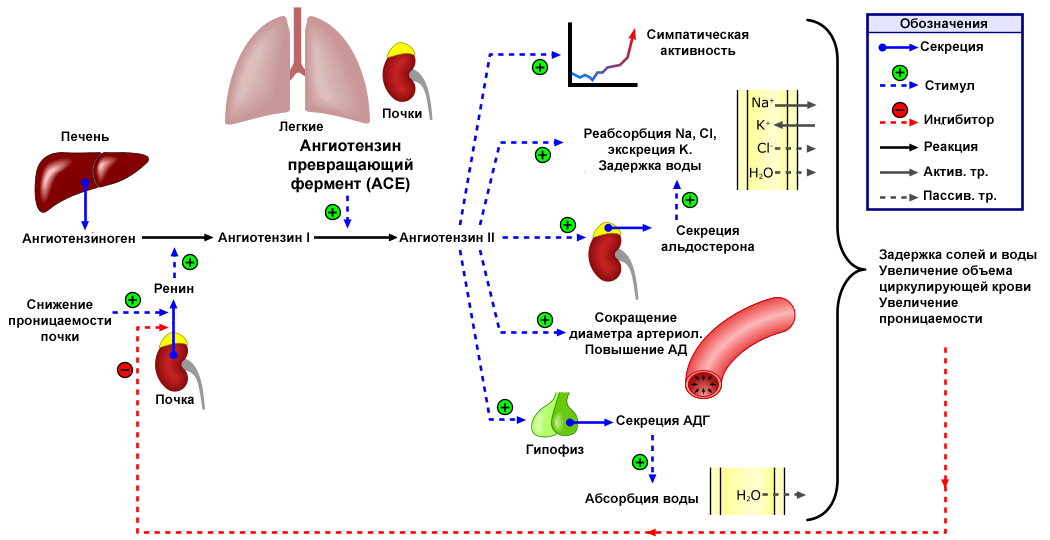
В регуляции артериального давления у человека участвует ренин-ангиотензиновая система (РАС). Работа РАС тесно связана с электролитами, они поддерживают гомеостаз, что необходимо для регуляции сердечной функции, баланса жидкости и многих других процессов. Один из компонентов РАС-системы – гормон ангиотензин II, который вызывает сужение сосудов, повышение артериального давления и является основным регулятором синтеза альдостерона, образующегося в клубочковой зоне коры надпочечников, единственного поступающего в кровь минералокортикоида человека. Конечным результатом такого действия является увеличение объема циркулирующей крови и повышение системного артериального давления.
2. Введение в регуляцию гемодинамики
Регуляция кровяного давления в норме
В соответствии с законами гидравлики АД прямо пропорционально произведению кровотока (сер дечный выброс, СВ) и сопротивления при прохождении крови через прекапиллярные артериолы (периферическое сосудистое сопротивление, или общее периферическое сопротивление — ОПС):
Физиологически как у здорового, так и больного человека АД поддерживается путем регуляции CB и ОПС в трех анатомических областях:
Рис. 1. Анатомические области, участвующие в регуляции кровяного давления
Четвертая анатомическая контрольная область — почки — вносит весомый вклад в поддержание АД, регулируя объем внутрисосудистой жидкости. Барорефлексы, реализуемые через симпатические нервы, совместно с гуморальными механизмами, включая ренин-ангиотензин-альдостероновую систему, координируют функции этих четырех контролирующих зон в под держании нормального АД. АД у больного с гипертензией регулируется теми же механизмами, что и у здорового человека с нормальными значениями АД. Регуляция АД при гипертензии отличается от нормы тем, что барорецепторы и почечный контроль давления, сопряженный с объемом крови, имеют “установочную точку” регуляции на более высоком уровне АД. Все антигипертензивные средства воздействуют на эти нормальные механизмы.
А. Постуральный барорефлекс (рис. 2). Барорефлексы участвуют в быстрой сиюминутной регуляции АД, например при переходе из горизонтального в вертикальное положение. Центральные симпатические нейроны, берущие начало в вазомоторной зоне продолговатого мозга, тонически активны. Каротидные барорецепторы стимулируются при растяжении стенки сосудов, вызванном давлением изнутри (АД). Активация барорецепторов тормозит центральные симпатические импульсы. Напротив, уменьшение растяжения ведет к снижению барорецепторной активности.
Рис. 2. Рефлекторная дуга барорефлекса
Таким образом, при переходе в вертикальное положение давление на барорецепторы снижается вследствие депонирования крови в венах ниже уровня сердца и симпатическая активность растормаживается. Рефлекторно возрастают периферическое сосудистое сопротивление (сокращение артериол) и сердечный выброс (прямая стимуляция сердца и сокращение емкостных сосудов, что ведет к увеличению венозного возврата к сердцу), и в результате восстанавливается нормальное АД. Такой же барорефлекс срабатывает в ответ на любое снижение АД, в том числе на первичное понижение периферического сосудистого сопротивления (например, вызванного сосудорасширяющим веществом) или уменьшение внутрисосудистого объема (например, из-за кровопотери или потери солей и воды через почки).
2.1. Рефлекторная (быстрая) регуляция кровообращения
В первую очередь связана с постуральным барорефлексом, который перераспределяет кровоток при каждом изменении положения тела. Он реализуется в результате взаимодействия симпатической и парасимпатической нервных систем, степень активности которых регулирует сосудодвигательный центр, расположенный на дне 4 желудочка.
2.2. Вегетативная нервная система
Вегетати́вная не́рвная систе́ма (от лат. vegetatio — возбуждение, от лат. vegetativus — растительный), ВНС, автономная нервная система, ганглионарная нервная система (от лат. ganglion — нервный узел), висцеральная нервная система (от лат. viscera — внутренности), органная нервная система, чревная нервная система, systema nervosum autonomicum (PNA) — часть нервной системы организма, комплекс центральных и периферических клеточных структур, регулирующих функциональный уровень организма, необходимый для адекватной реакции всех его систем.
Вегетативная нервная система — отдел нервной системы, регулирующий деятельность внутренних органов, желез внутренней и внешней секреции, кровеносных и лимфатических сосудов. Играет ведущую роль в поддержании постоянства внутренней среды организма и в приспособительных реакциях всех позвоночных.
Анатомически и функционально вегетативная нервная система подразделяется на симпатическую, парасимпатическую и метасимпатическую. Симпатические и парасимпатические центры находятся под контролем коры больших полушарий, гипоталамических центров и центров продолговатого мозга.
Рис.3. Вегетативная нервная система.
В симпатическом и парасимпатическом отделах имеются центральная и периферическая части. Центральную часть образуют тела нейронов, лежащих в спинном и головном мозге. Эти скопления нервных клеток получили название вегетативных ядер. Отходящие от ядер волокна, вегетативные ганглии, лежащие за пределами центральной нервной системы, и нервные сплетения в стенках внутренних органов образуют периферическую часть вегетативной нервной системы.
Симпатические ядра расположены в спинном мозге. Отходящие от него нервные волокна заканчиваются за пределами спинного мозга в симпатических узлах, от которых берут начало нервные волокна. Эти волокна подходят ко всем органам.
Парасимпатические ядра лежат в среднем и продолговатом мозге и в крестцовой части спинного мозга. Нервные волокна от ядер продолговатого мозга входят в состав блуждающих нервов. От ядер крестцовой части нервные волокна идут к кишечнику, органам выделения.
Метасимпатическая нервная система представлена нервными сплетениями и мелкими ганглиями в стенках пищеварительного тракта, мочевого пузыря, сердца и некоторых других органов.
Деятельность вегетативной нервной системы не зависит от воли человека. Это означает, что в обычных условиях человек не может волевым усилием заставить сердце биться реже или мышцы желудка — не сокращаться. Однако достичь сознательного влияния на многие параметры, контролируемые ВНС, можно с помощью специальных методов тренировки — например, с использованием методов биологической обратной связи.
Симпатическая нервная система усиливает обмен веществ, повышает возбуждаемость большинства тканей, мобилизует силы организма на активную деятельность. Парасимпатическая система способствует восстановлению израсходованных запасов энергии, регулирует работу организма во время сна.
Под контролем автономной системы находятся органы кровообращения, дыхания, пищеварения, выделения, размножения, а также обмен веществ и рост. Фактически эфферентный отдел ВНС осуществляет нервную регуляцию функций всех органов и тканей, кроме скелетных мышц, которыми управляет соматическая нервная система.
В отличие от соматической нервной системы, двигательный эффекторный нейрон в автономной нервной системе находится на периферии, и спинной мозг лишь косвенно управляет его импульсами.
Выделение автономной (вегетативной) нервной системы обусловлено некоторыми особенностями её строения. К этим особенностям относятся следующие:
Волокна автономной нервной системы выходят не сегментарно, как в соматической нервной системе, а из трёх отстоящих друг от друга ограниченных участков мозга: черепного, грудинопоясничного и крестцового.
Автономную нервную систему разделяют на симпатическую, парасимпатическую и метасимпатическую части. В симпатической части отростки спинномозговых нейронов короче, ганглионарные длиннее. В парасимпатической системе, наоборот, отростки спинномозговых клеток длиннее, ганглионарных короче. Симпатические волокна иннервируют все без исключения органы, в то время как область иннервации парасимпатических волокон более ограничена.
Автономная (вегетативная) нервная система подразделяется по топографическому признаку делятся на центральный и периферический отделы.
Центральный отдел
Периферический отдел
Симпатический, парасимпатический и метасимпатический отделы
На основании топографии вегетативных ядер и узлов, различий в длине аксонов первого и второго нейронов эфферентного пути, а также особенностей функции вегетативная нервная система подразделяется на симпатическую, парасимпатическую и метасимпатическую.
Расположение ганглиев и строение проводящих путей
Нейроны ядер центрального отдела вегетативной нервной системы — первые эфферентные нейроны на пути от ЦНС (спинной и головной мозг) к иннервируемому органу. Нервные волокна, образованные отростками этих нейронов, носят название предузловых (преганглионарных) волокон, так как они идут до узлов периферической части вегетативной нервной системы и заканчиваются синапсами на клетках этих узлов. Преганглионарные волокна имеют миелиновую оболочку, благодаря чему отличаются беловатым цветом. Они выходят из мозга в составе корешков соответствующих черепных нервов и передних корешков спинномозговых нервов.
Вегетативные узлы (ганглии): входят в состав симпатических стволов (есть у большинства позвоночных, кроме круглоротых и хрящевых рыб), крупных вегетативных сплетений брюшной полости и таза, располагаются в области головы и в толще или возле органов пищеварительной и дыхательной систем, а также мочеполового аппарата, которые иннервируются вегетативной нервной системой. Узлы периферической части вегетативной нервной системы содержат тела вторых (эффекторных) нейронов, лежащих на пути к иннервируемым органам. Отростки этих вторых нейронов эфферентного пути, несущих нервный импульс из вегетативных узлов к рабочим органам (гладкая мускулатура, железы, ткани), являются послеузелковыми (постганглионарными) нервными волокнами. Из-за отсутствия миелиновой оболочки они имеют серый цвет. Постганглионарные волокна автономной нервной системы в большинстве своем тонкие (чаще всего их диаметр не превышает 7 мкм) и не имеют миелиновой оболочки. Поэтому возбуждение по ним распространяется медленно, а нервы автономной нервной системы характеризуются бо́льшим рефрактерным периодом и большей хронаксией.
Рефлекторная дуга
Строение рефлекторных дуг вегетативного отдела отличается от строения рефлекторных дуг соматической части нервной системы. В рефлекторной дуге вегетативной части нервной системы эфферентное звено состоит не из одного нейрона, а из двух, один из которых находится вне ЦНС. В целом простая вегетативная рефлекторная дуга представлена тремя нейронами.
Первое звено рефлекторной дуги — это чувствительный нейрон, тело которого располагается в спинномозговых узлах и в чувствительных узлах черепных нервов. Периферический отросток такого нейрона, имеющий чувствительное окончание — рецептор, берёт начало в органах и тканях. Центральный отросток в составе задних корешков спинномозговых нервов или чувствительных корешков черепных нервов направляется к соответствующим ядрам в спинной или головной мозг.
Второе звено рефлекторной дуги является эфферентным, поскольку несёт импульсы из спинного или головного мозга к рабочему органу. Этот эфферентный путь вегетативной рефлекторной дуги представлен двумя нейронами. Первый из этих нейронов, второй по счёту в простой вегетативной рефлекторной дуге, располагается в вегетативных ядрах ЦНС. Его можно называть вставочным, так как он находится между чувствительным (афферентным) звеном рефлекторной дуги и вторым (эфферентным) нейроном эфферентного пути.
Физиология
Общее значение вегетативной регуляции
Вегетативная нервная система приспосабливает работу внутренних органов к изменениям окружающей среды. ВНС обеспечивает гомеостаз (постоянство внутренней среды организма). ВНС также участвует во многих поведенческих актах, осуществляемых под управлением головного мозга, влияя не только на физическую, но и на психическую деятельность человека.
Роль симпатического и парасимпатического отделов
Симпатическая нервная система активируется при стрессовых реакциях. Для неё характерно генерализованное влияние, при этом симпатические волокна иннервируют подавляющее большинство органов.
Известно, что парасимпатическая стимуляция одних органов оказывает тормозное действие, а других — возбуждающее действие. В большинстве случаев действие парасимпатической и симпатической систем противоположно.
2.3. Нейромедиаторы и клеточные рецепторы
Симпатический и парасимпатический отделы оказывают различное, в ряде случаев противонаправленное влияние на различные органы и ткани, а также перекрёстно влияют друг на друга. Различное воздействие этих отделов на одни и те же клетки связано со спецификой выделяемых ими нейромедиаторов и со спецификой рецепторов, имеющихся на пресинаптических и постсинаптических мембранах нейронов автономной системы и их клеток-мишеней (Рис.).
Преганглионарные нейроны обоих отделов автономной системы в качестве основного нейромедиатора выделяют ацетилхолин, который действует на никотиновые рецепторы ацетилхолина на постсинаптической мембране постганглионарных (эффекторных) нейронов. Постганглионарные нейроны симпатического отдела, как правило, выделяют в качестве медиатора норадреналин, который действует на адренорецепторы клеток-мишеней. На клетках-мишенях симпатических нейронов бета-1 и альфа-1 адренорецепторы в основном сосредоточены на постсинаптических мембранах (это означает, что in vivo на них действует в основном норадреналин), а аль-2 и бета-2 рецепторы — на внесинаптических участках мембраны (на них в основном действует адреналин крови). Лишь некоторые постганглионарные нейроны симпатического отдела (например, действующие на потовые железы) выделяют ацетилхолин.
Постганглионарные нейроны парасимпатического отдела выделяют ацетилхолин, который действует на мускариновые рецепторы клеток-мишеней.
При действии норадреналина и адреналина на бета-2 адренорецепторы выделение норадреналина обычно усиливается. Этот эффект наблюдается при обычном взаимодействии с G s-белком, при котором растёт внутриклеточная концентрация цАМФ. Бета-два рецепторы более чувствительны к адреналину. Поскольку под действием норадреналина симпатических нервов из мозгового слоя надпочечников выделяется адреналин, возникает петля положительной обратной связи.
Однако в некоторых случаях активация бета-2 рецепторов может блокировать выделение норадреналина. Показано, что это может быть следствием взаимодействия бета-2 рецепторов с G i/o белками и связывания (секвестирования) ими G s-белков, которое, в свою очередь, предотвращает взаимодействие G s-белков с другими рецепторами [1].
При действии ацетилхолина на мускариновые рецепторы симпатических нейронов выделение норадреналина в их синапсах блокируется, а при действии на никотиновые рецепторы — стимулируется. Поскольку на пресинаптических мембранах симпатических нейронов преобладают мускариновые рецепторы, обычно активация парасимпатических нервов снижает уровень выделения норадреналина из симпатических нервов.
На пресинаптических мембранах постганглионарных нейронов парасимпатического отдела преобладают альфа-2 адренорецепторы. При действии на них норадреналина выделение ацетилхолина блокируется. Таким образом, симпатические и парасимпатические нервы взаимно ингибируют друг друга.
2.4. Регуляция тонуса гладких мышц сосудов
Схема. Биохимические механизмы сокращения и расслабления гладкомышечного миоцита.
Модификация: Cunningham F., Leveno K., Bloom S., Hauth J., Rouse D., Spong C., Eds. Williams Obstetrics. 23rd ed., McGraw-Hill Professional, 2009, 1404 p., см.: Физиология человека: Литература. Иллюстрации.

2.5. Ненорадренергические и нехолинергические (NANC) вещества в регуляции сосудов
Кроме классических нейротрансмиттеров вегетативной нервной системы ацетилхолина и норадреналина, в литературе описаны многочисленные биологически активные вещества различного строения, модулирующие процессы передачи сигнала. К ним следует отнести серотонин (5-НТ), АТФ, кальцитонин ген связанный пептид (CGRP), допамин, ГАМК, Гонадотропин релизинг гормон (GnRH), нейропептид Y (NPY), вещество Р, вазоактивный кишечный пептид (VIP). Основные сведения о них собраны в таблице
Ганглии вегетативной нервной системы
Некоторые симпатические нервы (например, почки)
Ганглии вегетативной нервной системы
Усиливают вазоконстрикторное действие норадреналина, ингибитор высвобождения норадреналина
NANC иннервация гладких мышц дыхательных путей
парасимпатические ганглии в сфинктерах, желчном пузыре и тонкой кишке
расслабление кишечной гладкой мышцы и сфинктеров
3. Гуморальная регуляция тонуса гладких мышц сосудов и ОЦК
3.1. Ренин, ангиотензин, альдостероновая система (РААС или РАС)
Компоненты системы
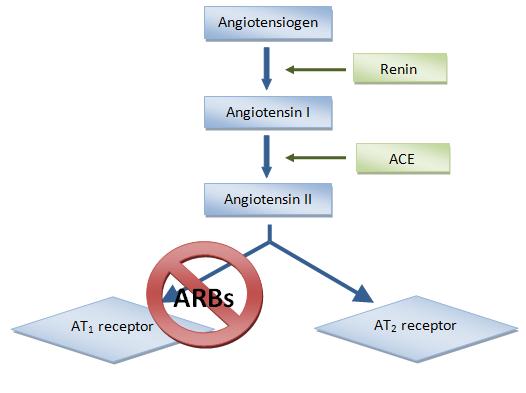
3.2. Продукция и секреция ренина
Контроль секреции ренина
Активная секреция ренина регулируется четырьмя независимыми факторами:
Секрецию ренина активирует снижение перфузионного давления или уровня NaCl и повышение симпатической активности. Ренин также синтезируется и в других тканях, включая мозг, надпочечник, яичники, жировая ткань, сердце и сосудах.
Контроль секреции ренина — определяющий фактор активности РААС.
3.3. Ангиотензиноген, ангиотензины 1,2,3,4 и т.д.
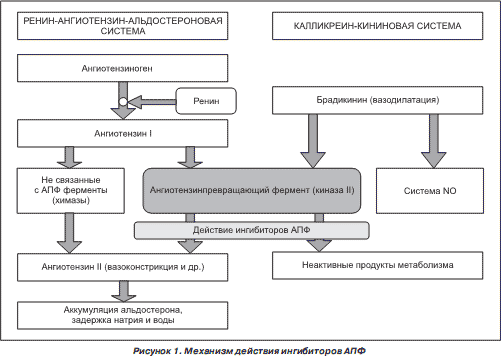
Ренин регулирует начальный, ограничивающий скорость, этап РААС путём отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10). Первичный источник ангиотензиногена — печень. Долговременный подъём уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Иценко-Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина. Неактивный декапептид Ang 1 гидролизуется ангиотензинпревращающим ферментом (АПФ), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АПФ представляет собой экзопептидазу и секретируется главным образом лёгочным и почечным эндотелием, нейроэпителиальными клетками. Ферментативная активность АПФ заключается в повышении вазоконстрикции и снижении вазодилятации.
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путём отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причём этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом АПФ, названным АПФ2) конкретно на Ang2. В отличие от АПФ, АПФ2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определённые рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. АПФ2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
3.4. Реакции, катализируемые АПФ
Превращение неактивного ангиотензина I (представляет собой декапептид – последовательность из 10 аминокислот Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu) в активный октапептид ангиотензин II (путем удаления 2 аминокислот-His-Leu) контролирует ангиотензинпревращающий фермент (АПФ) – циркулирующий во внеклеточном пространстве белок (карбоксипептидаза). Вторая важная функция АПФ – деактивация брадикинина.
Ген ACE порождает два изофермента АПФ — соматический, обнаруживаемый во многих органах и тканях, и герминальный, присутствующий только в сперме.
АПФ типичный секреторный фермент. Кроме регуляции кровяного давления, АПФ участвует в различных процессах, происходящих в организме. Его синтезируют клетки многих тканей, таких как васкулярные эндотелиальные клетки, почечные эпителиальные клетки, тестикулярные клетки Лейдига и т. д.
3.5. Уровень АПФ в крови и особенности генетики человека
В норме у разных людей уровень АПФ в плазме крови может различаться до 5 раз. У конкретного же человека уровень АПФ достаточно стабилен. Такие колебания уровня АПФ между людьми вызваны полиморфизмом гена АСЕ. В 16-м интроне гена выявлен инсерционно-делеционный (I/D) полиморфизм, заключающийся во вставке (инсерции, I) или потере (делеции, D) Alu-повтора, размером в 289 пар нуклеотидов. Делеция Alu-повтора приводит к повышению экспрессии гена ACE и увеличению концентрации АПФ в крови, лимфе и тканях, что является фактором, повышающим риск развития сердечно-сосудистых заболеваний (инфаркта миокарда, гипертрофии левого желудочка, ишемической болезни сердца), болезни почек, атеросклероза, болезни Альцгеймера.
У лиц, гомозиготных по аллелю D (генотип D/D), уровень АПФ повышен в 2 раза по сравнению с I/I генотипом. Ассоциация D/D-генотипа с гипертрофией левого желудочка сильнее у мужчин, чем у женщин, таким образом, инсерционно-делеционный полиморфизм может выступать как маркер риска развития гипертрофии левого желудочка у мужчин среднего возраста.
Выявлена ассоциация полиморфизма с возрастной макулярной дегенерацией (ВМД) – основной причиной потери зрения в пожилом возрасте. Генотип I/I встречается в 4,5 раза чаще у здоровых людей, чем у пациентов, страдающих ВМД, и, по-видимому, защищает от ВМД.
Ассоциации полиморфизма АСЕ с уровнем систолического и диастолического кровяного давления не выявлено, кроме случаев злокачественной формы гипертонической болезни (быстро прогрессирующая и тяжело протекающая, со значительным повреждением сосудов почек и сетчатки), при которой генотип D/D встречается чаще.
Также D-аллель связан с риском развития нефропатии у больных сахарным диабетом.
Аллель I ассоциирован с повышенной устойчивостью организма к физическим нагрузкам. Низкая минеральная плотность костной ткани и мышечная слабость являются основными факторами риска переломов костей у женщин при остеопорозе в постменопаузе. Выявлено, что наличие в генотипе женщины аллеля I положительно влияет на эффективность тренировки мышц (у пациенток с генотипом I/I она оказалась в 2 раза выше, чем у женщин с генотипом D/D) в ответ на физические нагрузки, на фоне гормональной терапии.
Исследования также показывают, что у высококлассных спортсменов-стайеров увеличена частота аллеля I, ассоциированная с выносливостью.
3.6. АПФ как мишень фармакологического воздействия
В 1991 году японские ученые создали первый ингибитор АПФ на молочной основе, в виде ферментированного молочного напитка, с использованием конкретных культур, чтобы освободить трипептид изолейцин-пролин-пролина (IPP) из молочного белка. Валин-пролин-пролин (VPP) также выделяется в этом процессе-другое молоко трипептиде с очень схожей химической структурой в IPP. Вместе эти пептиды теперь часто называют lactotripeptides. В 1996 году первое исследование человеческого подтвердили артериальное давление эффект снижения IPP в ферментированного молока. [57] Хотя в два раза количество VPP необходимо, чтобы достигнуть того же самого АСЕ-ингибирующей активности, как первоначально обнаружена IPP, VPP также предполагается, чтобы добавить к общему эффекту снижения кровяного давления. [58] С момента открытия первых lactotripeptides, более 20 клинических испытаний человека были проведены в разных странах
3.7. Классификация ингибиторов АПФ
Классификация ингибиторов АПФ
Препараты, содержащие сульфгидрильные группы: каптоприл, зофеноприл.
Дикарбоксилат-содержащие препараты: эналаприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл.
Фосфонат-содержащие препараты: фозиноприл.
Природные ингибиторы АПФ.
3.8. Функциональная активность ангиотензина II
Сердечно-сосудистая система
Ангиотензин II — сильный вазоконстриктор прямого действия. Он сужает артерии и вены, что приводит к повышению давления. Сосудосуживающая активность ангиотензина II определяется его взаимодействием с AT1 рецептором. Лиганд-рецепторный комплекс активирует НАДФH-оксидазу, образующую супероксид, который в свою очередь взаимодействует с вазорелаксирующим фактором оксидом азота NO и инактивирует его. Кроме этого, он обладает протромботическим эффектом, регулируя адгезию и агрегацию тромбоцитов и синтез ингибиторов PAI-1 и PAI-2. К отсроченным эффектам АТII гипертрофию мышечного слоя сосудов и гипертрофию левого желудочка миокарда.
Нервная система
Ангиотензин вызывает чувство жажды. Он повышает секрецию антидиуретического гормона в нейросекреторных клетках гипоталамуса и секрецию АКТГ в передней доле гипофиза, а также потенциирует высвобождение норадреналина за счёт прямого действия на постганглионарные симпатические нервные волокна.
Под действием ангиотензина кора надпочечников выделяет гормон альдостерон, вызывающий задержку натрия и потерю калия.
Почки
Ангиотензин обладает прямым эффектом на проксимальные канальцы, что увеличивает задержку натрия. В целом ангиотензин увеличивает скорость гломерулярной фильтрации за счёт сужения эфферентных почечных артериол и повышения давления в почках.
3.9. Ангиотензиновые рецепторы
Рецептор АТ1 является наиболее изученным.
Локализация. АТ1 подтип находится в сердце, кровеносные сосуды, почки, надпочечники коры головного мозга, легкое и головной мозг и опосредует сосудосуживающие эффекты. Молекулярный механизм. Активированный рецептор освобождает Gq/11 и Gi/о и тем самым активирует фосфолипазу С и повышает концентрации цитозольного Ca2+, который, в свою очередь, запускает клеточные ответы, такие как стимуляция протеинкиназы С. Активированный рецептор также ингибирует аденилатциклазу и активирует различные тирозинкиназы.
Эффекты, опосредованные АТ1 рецептора включают вазоконстрикцию, повышение секреции и синтеза альдостерона, повышение секреции вазопрессина, гипертрофию сердца, увеличение периферической норадренергической активности, сосудистой пролиферации клеток гладких мышц, снижение почечного кровотока, ингибирование высвобождения ренина, обратного захвата натрия в почечных канальцах, модуляция центральной активности симпатической нервной системы, сердечной сократимости, центрального контроля за осмотическим давлением и формирования внеклеточного матрикса.
Основные эффекты стимуляции различных типов рецепторов ангиотензина II
Рецепторы 2-го типа
Вазоконстрикция
Стимуляция синтеза и высвобождения альдостерона Повышение реабсорбции натрия в проксимальных канальцах почек
Гипертрофия миокарда и пролиферация гладкомышечных клеток сосудов Повышение центральной и периферической симпатической активности Стимуляция высвобождения вазопрессина
Вазодилатация
Антипролиферативное
действие
Дифференциация и развитие тканей эмбриона
Рост эндотелиальных клеток
Стимуляция апоптоза
АТ3 и АТ4 плохо охарактеризованые подтипы. Рецепторы АТ4 активируются метаболитом ангиотензина II ангиотензином IV, и могут играть роль в регуляции внеклеточного матрикса ЦНС, а также модуляции высвобождения окситоцина
3.10. Ангиотензиновые рецепторы как мишень фармакологического воздействия.
Антагонисты рецепторов ангиотензина (АРА) — относительно новый класс среди гипотензивных препаратов первого ряда, рекомендованных для лечения артериальной гипертензии ВОЗ/МОГ в 1999 году. Первый препарат АРА для перорального применения — лосартан — был синтезирован группой исследователей во главе с P.Timmermans в 1988 году и применяется в клинике с 1994 года. В целом АРА оказывают антигипертензивный эффект, аналогичный другим препаратам первого ряда, но отличаются низкой частотой побочных эффектов и очень хорошей переносимостью.
В 1970-х годах было показано, что повышение уровня Ang II может нанести вред сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта [4]. С введением ингибиторов ангиотензинпревращающего фермента (АПФ) в конце 1970-х годов было подтверждено, что Ang II играет важную роль в регулировании артериального давления, электролитов и баланса жидкости [5].
Ang II связывается с АТ1-рецепторами через различные сайты связывания [1]. Первичный сайт связывания находится во внеклеточной области АТ1-рецептора, где Ang II взаимодействует с остатками в N-конце рецептора AT1 и его первой и третьей внеклеточных петель. Трансмембранные спирали также способствуют связыванию через С-концевую карбоксильную группу, которая взаимодействует с Lys199 в верхней части спирали 5 рецептора, подробности см. На рисунке 1. [8]
Ионный мост, образованный между Lys199 и карбоксильной концевой группой остатка Phe8 Ang II, скорее всего, стабилизирован остатком Trp253. Кроме того, Phe259 и Asp263 в трансмембранной спирали 6 и Lys102 и Ser105 во внешней области трансмембранной спирали 3 также были вовлечены в связывание Ang II. Эта область может, возможно, участвовать в стабилизации ратификации рецептора и в образовании внутримембранного связующего кармана.
Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
3.11. Неприлизин
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы – неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрийуретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) [3, 4]. Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома.
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида.
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате – к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1.
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием – ингибиторы вазопептидаз
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856–1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
4. Эндотелий-зависимые факторы
Эндотелий выполняет ключевую функцию в регуляции тонуса и роста сосудов. Эндотелий сосудов обладает способностью синтезировать и выделять факторы, вызывающие расслабление или сокращение гладких мышц сосудов в ответ на разного рода стимулы (табл). Общая масса эндотелиоцитов, монослойно выстилающих кровеносные сосуды изнутри (интима), у человека приближается к 500 г. Общая масса, высокая секреторная способность эндотелиальных клеток позволяют рассматривать эту «ткань» как своеобразный эндокринный орган (железу). Распределенный по сосудистой системе эндотелий, очевидно, предназначен для паракринной регуляции гладкомышечных образований сосудов. Период полужизни выделяемого эндотелиоцитами инкрета очень мал. Для NO он составляет — 6—25 с (вследствие быстрого перехода его в нитраты и нитриты), но он способен сокращать и расслаблять гладкие мышцы сосудов, не оказывая влияния на эффекторные образования других органов (кишечник, бронхи, матка).
Таблица Некоторые биологические регуляторы, секретируемые эндотелием