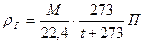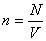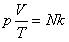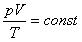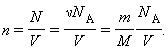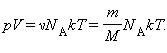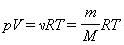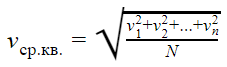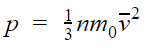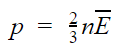Какие параметры характеризуют состояние газа
Идеальный газ. Параметры состояния газа
Основные понятия идеального газа
Реальные газы хорошо описываются моделью идеального газа при достаточно больших разрежениях, т.е. когда среднее расстояние между молекулами газа во много раз больше размеров самих молекул. В этом случае силами притяжения между молекулами можно пренебречь, а силы отталкивания проявляются только при столкновениях молекул друг с другом в течение очень коротких промежутков времени. например, водород, кислород при нормальных условиях хорошо описываются моделью идеального газа.
Под нормальными условиями понимают состояние газа при температуре T=273 K и давлении p=101325 Па.
Состояние газов, удовлетворяющих модели идеального газа, описывается более простыми уравнениями, чем в случае реальных газов, в уравнениях для которых возникают многочисленные поправки, учитывающие взаимодействие между молекулами и их суммарный собственный объем. По сути, в модели идеального газа молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Параметры состояния газа. Макро- и микропараметры
Состояние любой термодинамической системы описывается ее макро- и микропараметрами.
Основными макропараметрами или параметрами состояния идеального газа являются давление, температура и объем.
Давление характеризует силу ударов молекул газа о стенки сосуда. Температура является мерой кинетической энергии поступательного движения молекул газа. Объем – это область пространства, занимаемая газом.
К микропараметрам относятся масса молекулы, ее скорость, импульс, кинетическая энергия.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называютравновесным.
Примеры решения задач
| Задание | Учитель записал на доске три утверждения, относящиеся к молекулам: |
1) размерами молекул можно пренебречь;
2) молекулы при столкновениях взаимодействуют как упругие шары;
3) при любом расстоянии между молекулами между ними действуют силы притяжения.
Какие из этих утверждений можно соотнести с моделью идеального газа?
а) все три утверждения;
б) только первое утверждение;
в) первое и второе утверждения;
г) первое и третье утверждения.
а) молекулы сталкиваются как упругие шарики;
б) размеры молекул пренебрежимо малы;
в) молекулы взаимодействуют с силами притяжения и отталкивания;
г) молекулы сталкиваются со стенками абсолютно упругими ударами.
а) при температурах, близких к абсолютному нулю;
Физические параметры и законы газового состояния
Параметры состояния газа
Основными параметрами, определяющими состояние газа, являются давление, температура и плотность или удельный объем.
Давление газа р обусловлено суммой сил ударов беспорядочно движущихся молекул газа о стенки сосуда, занятого этим газом, и численно равно величине нормальной составляющей силы, действующей на единицу поверхности, с которой соприкасается газ.
где F — нормальная составляющая силы; / — площадь, на которую действует сила.
Воздух земной атмосферы своей массой оказывает на поверхность Земли и окружающие предметы давление, называемое атмосферным, или барометрическим. Величина его в значительной мере зависит от высоты места измерения и температуры воздуха. На уровне моря при температуре 0° С барометрическое давление равно 760 мм рт. ст. Такое давление называют нормальным атмосферным давлением.
Если из сосуда удалять воздух, то в нем создается давление ниже атмосферного — разрежение. При полном удалении воздуха из сосуда давление становится равным нулю. Давление, отсчитываемое от нуля, называется абсолютным (рабс), а давление, превышающее атмосферное (барометрическое), — избыточным (ризб). В уравнениях, связывающих параметры состояния газа, применяют абсолютное давление; манометры показывают избыточное давление.
При измерениях разрежения (вакуума) соотношение (II.2) принимает вид
Абсолютная температура Т, °К, характеризует степень на- гретости тела. Измерение температуры можно производить на основании агрегатных изменений вещества под ее воздействием. В частности, в качестве исходных значений, служащих при построении Международной практической температурной шкалы Цельсия для установления начала отсчета температуры и единицы ее измерения — градуса, приняты температура плавления льда (0° С) и кипения воды (100° С) при нормальном атмосферном давлении. Температуры, лежащие выше 0° С, считают положительными, а лежащие ниже 0° С — отрицательными. В системе единиц СИ расчеты температуры производятся от абсолютного нуля в градусах термодинамической шкалы Кельвина. Абсолютный нуль этой шкалы (0° К) характеризуется прекращением теплового движения молекул вещества и соответствует по шкале Цельсия температуре —273,15° С. Таким образом, обе шкалы различаются лишь начальной точкой отсчета, а цепа деления (градуса) у них одинакова.
Плотность р — количество массы вещества в единице объема.
где т — масса вещества; V — объем вещества.
Удельный объем v — объем единицы массы вещества — величина, обратная плотности.
Критические параметры (табл. 11.1) характеризуют критическое состояние газа, при котором плотность жидкой и паровой фаз газа одинакова. Сжатием и охлаждением до определенной температуры газы могут быть переведены в жидкое состояние. Однако для каждого газа существует определенная критическая температура, выше которой газ никаким давлением не может быть сжижен. Давление, необходимое для сжижения газа при критической температуре, называют критическим давлением. Чем температура газа ниже критической, тем при меньшем давлении этот газ может быть сжижен. Объем газа, занимаемый при критических давлении и температуре, называют критическим объемом.
Тема: Параметры состояния газа



Основными параметрами, определяющими состояние газа, являются давление, температура и плотность или удельный объем.
Давлениегаза р обусловлено суммой сил ударов беспорядочно движущихся молекул газа о стенки сосуда, занятого этим газом, и численно равно величине нормальной составляющей силы, действующей на единицу поверхности, с которой соприкасается газ.
Воздух земной атмосферы своей массой оказывает на поверхность Земли и окружающие предметы давление, называемое атмосферным, или барометрическим. Величина его в значительной мере зависит от высоты места измерения и температуры воздуха. На уровне моря при температуре 0° барометрическое давление равно 760 мм.рт.ст. Такое давление называют нормальным атмосферным давлением.
При измерениях разрежения (вакуума) соотношение (2) принимает вид
Абсолютная температура Т, °К, характеризует степень нагретости тела. Измерение температуры можно производить а основании агрегатных изменений вещества под ее воздействие: В частности, в качестве исходных значений, служащих при построении Международной практической
Плотность ρ – количество массы вещества в единице объема.
где m – масса вещества; V – объем вещества.
Относительная плотность газа (по воздуху) s – отношение плотности газа к плотности воздуха при нормальных условиях.
Если считать газ идеальным, то при Т=273,16 К, Р=0,1 МПа и V=22,414 мл масса т равна молекулярной массе М газа. В тех же условиях масса 22,414 мл воздуха составляет 28,9 г, откуда относительная плотность газа или пара относительно воздуха равна
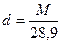
Абсолютную плотность газов и паров (ρ, кг/м 3 ) при нормальных условиях можно найти, зная массу М и объем 1 моль газа (22,414 л)
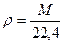
При абсолютной температуре Т (К) и давлении П (10 5 Па) плотность газа (в кг/м 3 ) может быть найдена по формуле
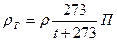
Используя формулу (8), можно написать
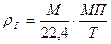
Средняя плотность смеси идеальных газов
где r1, r2,…. rn – объемное (или молярное) содержание каждого компонента в смеси в долях единицы; ρ1, ρ2,…. ρn – плотности компонентов смеси.
Удельный объем υ – объем единицы массы вещества – величина, обратная плотности.
Критические параметры (табл.1) характеризуют критическое состояние газа, при котором плотность жидкой и паровой фаз газа одинакова. Сжатием и охлаждением до определенной температуры газы могут быть переведены в жидкое состояние. Однако для каждого газа существует определенная критическая температурa, выше которой газ никаким давлением не может быть сжижен. Давление, необходимое для сжижения газа при критической температуре, называют критическим давлением. Чем температура газа ниже критической, тем при меньшем давлении этот газ может быть сжижен. Объем газа, занимаемый при критических давлении температуре, называют критическим объемом.
Отношение фактических параметров газа ρ, Т и υ к критическим ρкр, Ткр и υкр называют приведенными параметрами состояния газа, т.е.
Как сказал.
Все знают, что это невозможно. Но вот приходит невежда, которому это неизвестно — он-то и делает открытие.
Альберт Эйнштейн
Вопросы к экзамену
Для всех групп технического профиля

Урок 15. Лекция 15. Идеальный газ
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
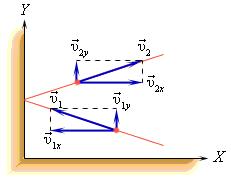
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
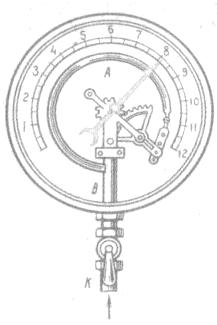
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.

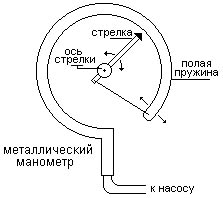
Металлический манометр – для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
n = N/V – число молекул в единице объема, или концентрация молекул;
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v 2 /2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v 2 )/2 = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v 2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим 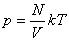
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
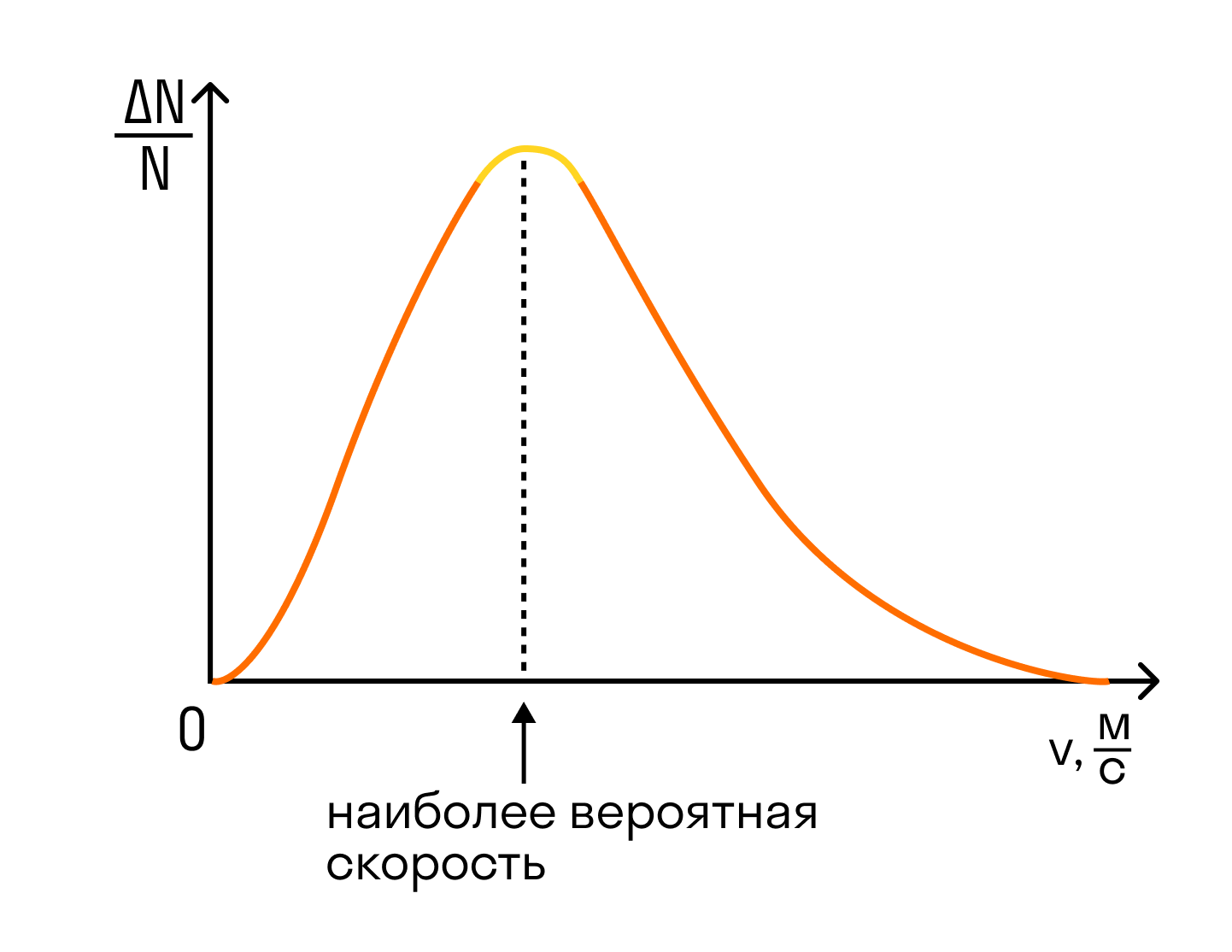
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
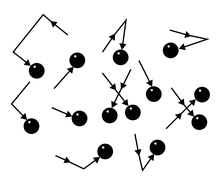
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
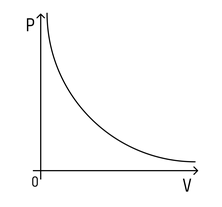
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
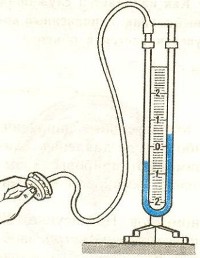
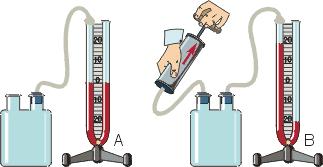
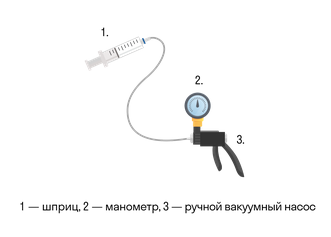
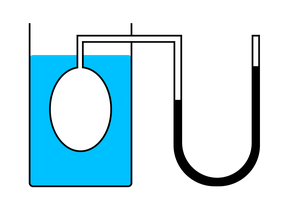
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
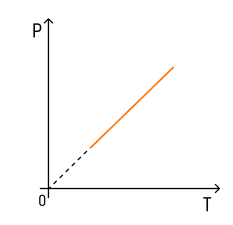
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.