какие виды элементов бывают
Познание мира
10 типов химических элементов
Типы химических элементов
В природе можно найти самые разные вещества. Эти вещества обычно не встречаются в чистом виде, а являются результатом комбинации различных элементов или материалов, которые в результате различных реакций, процессов и периодов времени дали начало всем видам материи. Во Вселенной нет ничего, что не являлось бы результатом комбинации атомов, принадлежащих к разным типам химических элементов, которые мы собираемся изучить более подробно.
Однако, прежде чем рассматривать типы химических элементов, давайте сделаем небольшой обзор школьной науки и вспомним, что такое химические элементы.
Мы называем «химическим элементом» материю, которая состоит из одного и того же типа атома, то есть вещества, которое является атомарно чистым. Химические элементы не могут быть разложены на более простые и классифицируются в периодической таблице элементов как чистые материалы Вселенной.
Мы не должны путать элементы с простыми веществами, поскольку в некоторых случаях два или более атомов одного и того же элемента могут составлять молекулы, сгруппированные по-разному, что приводит к изменению некоторых физических свойств рассматриваемого элемента, в этих случаях изотопов. Например, алмаз и углерод — это вещества, состоящие из химического элемента углерода (C), но который организован по-разному и приводит к образованию двух совершенно разных материалов.
Насколько нам известно, химические элементы образуются внутри звезд в результате сложных процессов синтеза и деления атомов, в результате которых образуются все более тяжелые элементы, результат процесса, называемого нуклеосинтезом.
Большинство известных элементов могут быть получены из природы, спонтанно обнаружены или образуют соединения с другими элементами, такими как уран (U), углерод (C), кремний (Si), серебро (Ag) или золото (Au). Другие, однако, производятся в лабораториях, например, америций (Am), берклий (Bk) или кюрий (Cm). Каким бы ни был метод его получения или присутствует ли он в природе, в зависимости от его свойств, рассматриваемый химический элемент будет иметь то или иное применение.
В настоящее время известно около 118 химических элементов, хотя с учетом того, что люди смогли производить новые элементы, расширение таблицы Менделеева — это вопрос времени.
Основные типы химических элементов
Основные типы химических элементов представлены в периодической таблице, системе классификации, созданной русским химиком Дмитрием Менделеевым (1834–1907), заложившим ее основы в 1869 году. Химические элементы визуально упорядочены в зависимости от их свойств и характеристик.
С течением времени и по мере того, как химия сделала важные научные открытия, эта таблица будет последовательно расширяться, достигнув той формы, которую она имеет сегодня, с 118 известными до сих пор элементами.
В настоящее время в этой таблице мы можем найти следующие типы химических элементов:
Металлы
Металлы — это химические элементы, которые, как правило, содержат от одного до трех электронов на последней орбите своего атома, электроны, которые можно легко переносить, превращая их в проводники тепла и электричества.
Металлы обычно податливы и пластичны, с характерным блеском, интенсивность которого зависит от движения электронов, составляющих их атомы. В большинстве случаев металлы остаются твердыми при комнатной температуре, за исключением ртути.
Среди металлов мы находим золото (Au), серебро (Ag), медь (Cu) и алюминий (Al), физические характеристики которых делают их великолепными проводниками электричества, хотя их присутствие в природе очень разнообразно, что отражается в разнице между их массами.
Считается, что 75% химических элементов, существующих в природе — это металлы, а остальные 25% будут состоять из благородных газов, металлоидов и других типов.
В этой категории есть классификации, обнаруживающие актиниды, лантаноиды, переходные металлы, щелочные металлы, щелочноземельные металлы и другие металлы.
Лантаноиды
Элементы лантаноидов находятся в месторождениях, состоящих из многих минералов. Это металлы белого цвета, которые легко окисляются при контакте с воздухом. Среди них мы находим лантан (La), прометий (Pm), европий (Eu) и иттербий (Yb).
Актиниды
Все изотопы актинидов радиоактивны. Среди них мы находим актиний (Ac), уран (U), плутоний (Pu) и эйнштейний (Es).
Переходные металлы
В этой группе есть вещества всех видов, и, согласно ее самой широкой классификации, она будет соответствовать химическим элементам от 21 до 30, от 39 до 48, от 71 до 80 и от 103 до 112, всего сорок и среди них мы найдем ванадий (V), рутений (Ru), серебро (Ag), тантал (Ta) и лоуренсий (Lr).
Щелочные металлы
Щелочные металлы — это группа из шести элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Это блестящие мягкие металлы, обладающие высокой реакционной способностью при нормальной температуре и давлении и легко теряющие внешний электрон, расположенный на своей «s» орбитали.
Щелочные почвы
Щелочноземельные металлы — это группа элементов, в которых мы находим бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочные почвы тверже щелочей, они блестят и являются хорошими проводниками электричества. Они менее реактивны, чем щелочные, и действуют как хорошие восстановители. Они обладают способностью образовывать ионные соединения, и все они имеют два электрона на внешней оболочке.
Другие металлы
Это металлические элементы, расположенные в периодической таблице вместе с металлоидами внутри p-блока. Они имеют тенденцию быть мягкими с низкими температурами плавления. Среди них алюминий (Al), индий (In), олово (Sn) и висмут (Bi) среди других.
Не металлы
Неметаллы обычно имеют от пяти до семи электронов на последней орбите, свойство, которое заставляет их приобретать электроны, а не отдавать их, и, таким образом, им удается иметь восемь электронов, которые таким образом стабилизируют их как атомы.
Эти элементы очень плохо проводят тепло и электричество. К тому же они не имеют характерного блеска, не очень пластичны и очень хрупки в твердом состоянии. Их нельзя катать или растягивать, в отличие от металлов.
Большинство из них необходимы для биологических систем, поскольку они присутствуют в органических соединениях, таких как сера (S), углерод (C), кислород (O), водород (H) и йод (I).
Металлоиды
Металлоиды представляют собой промежуточную классификацию между металлами и неметаллами, обладающими свойствами обеих групп. Это связано с тем, что на последней орбите у них четыре атома, что является промежуточным количеством по сравнению с металлами и неметаллами.
Эти химические элементы проводят электричество только в одном направлении, но не в обратном, как в металлах. Примером этого является кремний (Si), металлоид, используемый в производстве полупроводниковых элементов для электронной промышленности благодаря этому свойству.
Другие металлоиды: бор (B), мышьяк (As), сурьма (Sb) и полоний (Po).
Галогены
Галогены — это группа из шести элементов, которые имеют тенденцию образовывать молекулы, состоящие из двух (двухатомных) атомов, которые очень химически активны из-за своей электроотрицательности.
Эти вещества обычно появляются в виде ионов, то есть электрически заряженных молекул, которые в данном случае являются однозначными, сильно окисляющими. Это означает, что галогены являются едкими веществами.
Галогены: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и тенезе (Ts).
Благородные газы
Благородные газы — это группа из семи газов, естественное состояние которых — газообразное. Обычно они представляют собой двухатомные молекулы с очень низкой реакционной способностью, то есть они не вступают в реакцию с другими элементами, составляющими другие вещества, и по этой же причине они известны как инертные газы. Это потому, что на его последней орбите находится максимальное количество электронов, возможное для этого уровня, всего восемь.
Эта избранная группа элементов состоит из гелия (He), неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe), радона (Rn) и оганесона (Og), ранее известного как унунокций.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р-элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1)d. Это элементы вставных декад больших периодов, расположенных между s– и p–элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2)f. К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
1. Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
2. Номер периода совпадает с главным квантовым числом внешних электронов атома.
3. s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. Таким образом, подгруппа включает элементы, атомы которых обычно имеют сходное строение не только внешнего, но и предвнешнего слоя (за исключением элементов, в которых имеет место «провал» электрона).
4. Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.
5. Элементы с валентными d– или f–электронами называются переходными.
6. Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
Химическая связь и типы взаимодействия молекул
Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
Основные характеристики связи:
Энергия связи (Е, кДж/моль) – количество энергии, выделяющееся при образовании химической связи. Чем больше энергия связи, тем устойчивее молекулы.
Длина связи – расстояние между ядрами химически связанных атомов.
Кратность связи – определяется количеством электронных пар, связывающих два атома. С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает.
Валентный угол – угол между воображаемыми линиями, которые можно провести через ядра связанных атомов. Валентный угол определяет геометрию молекул.
Дипольный момент возникает, если связь образована между атомами элементов с разной электроотрицательностью и служит мерой полярности молекулы.
Ковалентная связь
Ковалентная связь образуется путем обобществления пары электронов двумя атомами. Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Направленность обусловлена тем, что атомные орбитали имеют определенную конфигурацию и расположение в пространстве. Перекрывание орбиталей при образовании связи осуществляется по соответствующим направлениям. Насыщаемость обусловлена ограниченными валентными возможностями атомов.
Различают ковалентную полярную и неполярную связь. Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью; обобществленные электроны равномерно распределены между ядрами взаимодействующих атомов. Ковалентная полярная связь образуется между атомами с различной электроотрицательностью; общие электронные пары смещены в сторону более электроотрицательного элемента.
Возможны два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их спинов (обменный механизм); 2) донорно-акцепторное взаимодействие, при котором общей становится электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Часто в образовании связи участвуют электроны разных подуровней, а, следовательно, орбитали разных конфигураций. В этом случае может происходить гибридизация (смешение) электронных облаков (орбиталей). Образуются новые, гибридные облака с одинаковой формой и энергией. Число гибридных орбиталей равно числу исходных. В гибридной атомной орбитали (АО) электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, приводящее к повышению энергии связи. Гибридизация АО определяет пространственную конфигурацию молекул.
Возможны также более сложные виды гибридизации с участием d и f-орбиталей атомов.
Ионная связь
Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Ее можно рассматривать как предельный случай ковалентной полярной связи. Такая связь возникает лишь в случае большой разности электроотрицательностей взаимодействующих атомов, например между катионами s-металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, KBr и др.).
Так как электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью. Ей также не свойственна насыщаемость. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в узлах которых каждый ион окружен несколькими ионами противоположного знака. Чисто ионной связи не существует. Можно говорить лишь о доле ионности связи.
Металлическая связь
В отличие от ковалентных и ионных соединений, в металлах небольшое число электронов одновременно связывает большое число ядерных центров, а сами электроны могут перемещаться в металле. Таким образом, в металлах имеет место сильно нелокализованная химическая связь.
Биогенные элементы
Элементы, необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.
Какие виды элементов бывают
На данном уроке дана подробная историческая справка о попытках классификации химических элементов учеными-химиками, формируется представление о структуре периодического закона химических элементов Д.И. Менделеева, подчеркивается значение этого закона для химической науки.
I. Классификация химических элементов
1. Триады Дёберейнера
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
Триады Дёберейнера
В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов.
Например, рассмотрим первую триаду: Li, Na, K.
Их атомные массы соответственно равны 7, 23, 39.
Система классификации И.В.Дёберейнера оказалась несовершенной. Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам.
Ошибка И.В.Дёберейнера заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад.
Но И.В.Дёберейнер был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами.
2. Спираль Шанкурту
В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик А.Э. Шанкуртуа в 1862 году предложил свою классификацию химических элементов.
Рис. 1. Спираль Шанкуртуа
Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45
После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
3. Октавы Ньюлендса
В 1865 году 18 августа английский ученый Дж.А.Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы.Рис.2.Закон октав он сформулировал следующим образом:
Рис. 2. Октавы Ньюлендса
«Номера аналогичных элементов, как правило, отличаются или на целое число семь или на кратное семи; другими словами члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена.
4. Таблица химических элементов Мейера
Рис. 3. Таблица химических элементов Мейера
В 1870 году появилась первая таблица немецкого химика Ю.Л. Мейера под названием « Природа элемента, как функция их атомного веса». В неё были включены 28 элементов, размещенные в 6 столбцов, согласно их валентности. Ю.Л. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерные изменения атомной массы в рядах сходных элементов. Рис. 3.Сходные элементы располагаются в вертикальных рядах таблицы. Некоторые ячейки Ю.Л. Мейер оставил незаполненными.
5. Открытие периодического закона Д.И.Менделеевым
В марте 1869 года русский химик Д. И. Менделеев представил русскому химическому обществу сообщение об открытии им периодического закона химических элементов. В том же году вышло первое издание Менделеевского учебника «Основы химии», в котором была приведена его периодическая таблица.
В конце 1870 года Д. И. Менделеев делает доклад русскому химическому обществу под названием «Естественные системы химических элементов и применение её к указанию свойств еще неизвестных элементов». В этом докладе Д. И. Менделеев предсказывает существование трех еще неизвестных элементов: экасилиций, экабор и экаалюминий. Он утверждает, что свойства химических элементов, стоящих в одной группе, будут нечто средним между свойствами элементов, стоящих сверху и снизу данного элемента. Если рассматривать этот элемент в периоде, то он будет обладать средними свойствами элементов, стоящими слева и справа от него.
Рис. 4. Таблица химических элементов Менделеева
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом., так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
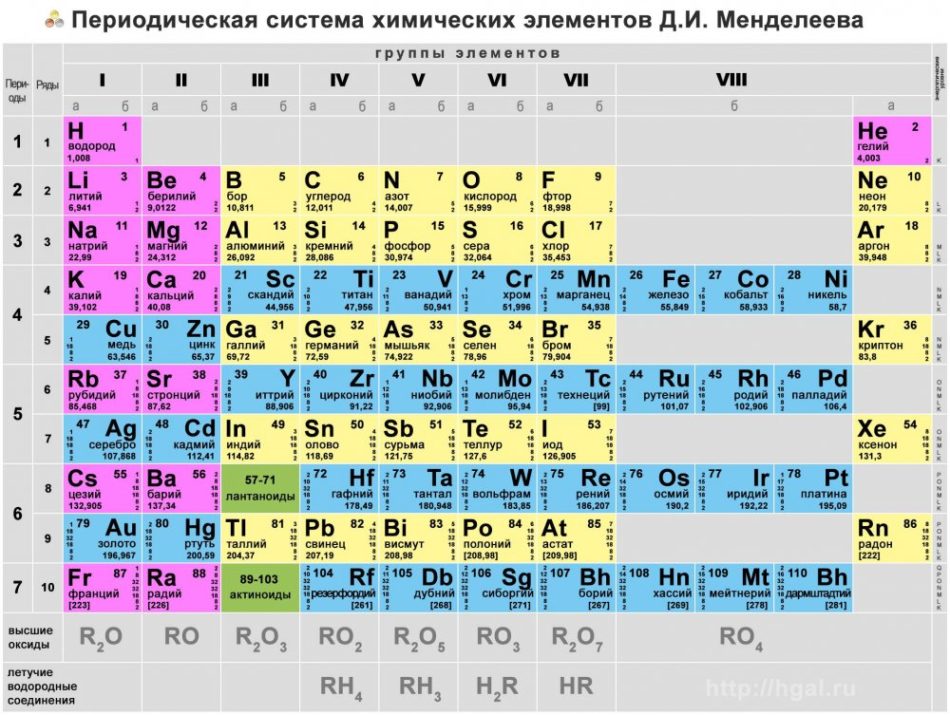
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Основные принципы построения периодической системы
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?)
Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения.
Принцип объединения элементов в группы.
Качественный признак. Сходство свойств простых веществ и однотипных сложных.
Принцип объединения элементов в периоды.
Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого.
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
Рис. Связь свойств элементов и образованных ими соединений
Открытие новых химических элементов
С этого момента периодический закон и периодическая система Д. И. Менделеева становится общепризнанной всем мировым химическим сообществом. Особая заслуга Д. И. Менделеева заключается в том, что он не только расположил химические элементы в определенной последовательности, но и дал описательную характеристику своей периодической системы. При помощи её можно было предсказывать химические свойства различных химических элементов.
Д. И. Менделеев взял на себя смелость оставить пустые клетки в своей таблице и исправить некоторые значения атомных масс химических элементов, предсказать свойства еще неоткрытых целых групп соединений. Таким образом, Д. И. Менделеев является первооткрывателем одного из главных законов природы.