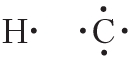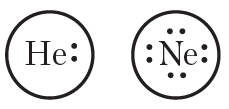какие виды химической связи есть
Химические связи
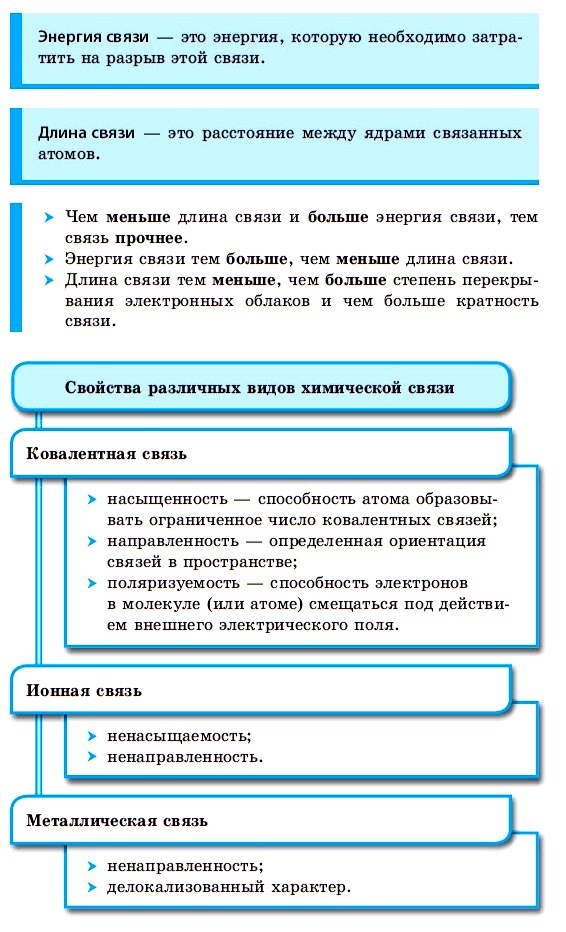
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
“Облако” электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия. 10 класс
§ 3. Типы химической связи
Типы химической связи
Из курса химии 7–9-го классов вы знаете, что при обычных условиях атомы большинства химических элементов в свободном виде (по отдельности) не существуют. Даже в простых веществах атомы связаны друг с другом химическими связями. Исключением являются лишь благородные газы.
Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: 
| Химическая связь — взаимодействие, связывающее отдельные атомы в химические соединения (молекулы или кристаллы). |
Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешнего энергетического уровня. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают символ химического элемента. Такие формулы называются электронными формулами.
электронные формулы атомов водорода и углерода
Окружность вокруг электронной формулы указывает на завершённость внешнего слоя. То есть атом гелия имеет завершённую двухэлектронную, а атом неона — восьмиэлектронную внешнюю оболочку. Отсюда следует важный вывод — атомы будут стремиться сформировать стабильные завершённые электронные оболочки за счёт отдачи, присоединения либо обобществления электронов. При этом образуются химические связи.
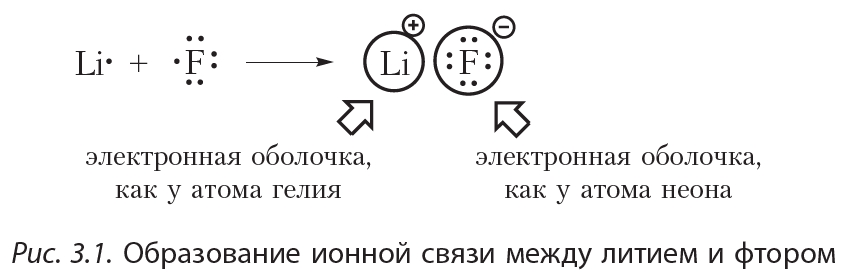
Пример 1. Образование ионной связи между литием и фтором.
На внешнем электронном слое атома лития находится один электрон, поэтому атом лития легко отдаёт этот электрон, приобретая завершённую электронную оболочку, как у ближайшего благородного газа — гелия. На внешнем слое атома фтора располагается семь электронов, поэтому фтор, наоборот, легко присоединяет один электрон, приобретая завершённую восьмиэлектронную внешнюю оболочку, как у атома неона:
Разноимённо заряженные ионы притягиваются друг к другу. Такая связь называется ионной. Ионная связь образуется между атомами металла и неметалла. Ионная связь имеется в солях (NaCl, KF), оксидах металлов (Na2O, K2O), гидроксидах металлов (NaOH, KOH).
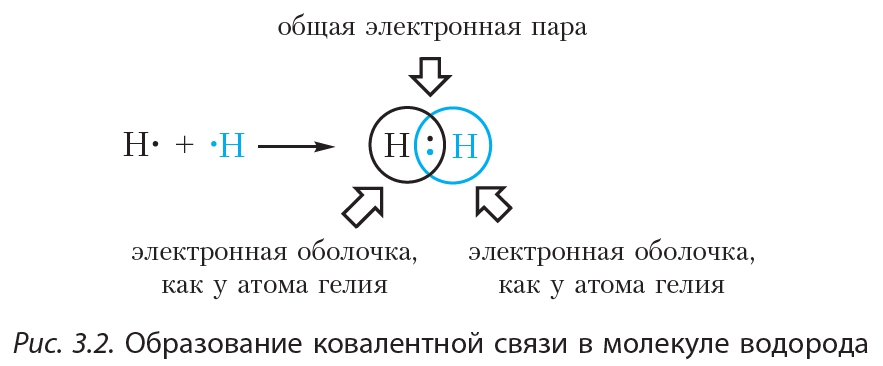
Пример 2. Образование ковалентной связи в молекуле водорода H2.
На внешнем слое атома водорода имеется один неспаренный электрон. Поскольку при образовании молекулы водорода между собой взаимодействуют одинаковые атомы, электрон не будет переходить от одного атома к другому и разноимённо заряженные ионы образовываться не будут. Вместо этого неспаренные электроны двух атомов водорода образуют общую электронную пару. При этом каждый атом водорода приобретает завершённую электронную оболочку, как у атома гелия:
Связь, образованную посредством общих электронных пар, называют ковалентной. В формулах ковалентную связь (общую электронную пару) обозначают чёрточкой. Например, формулу молекулы водорода можно записать 
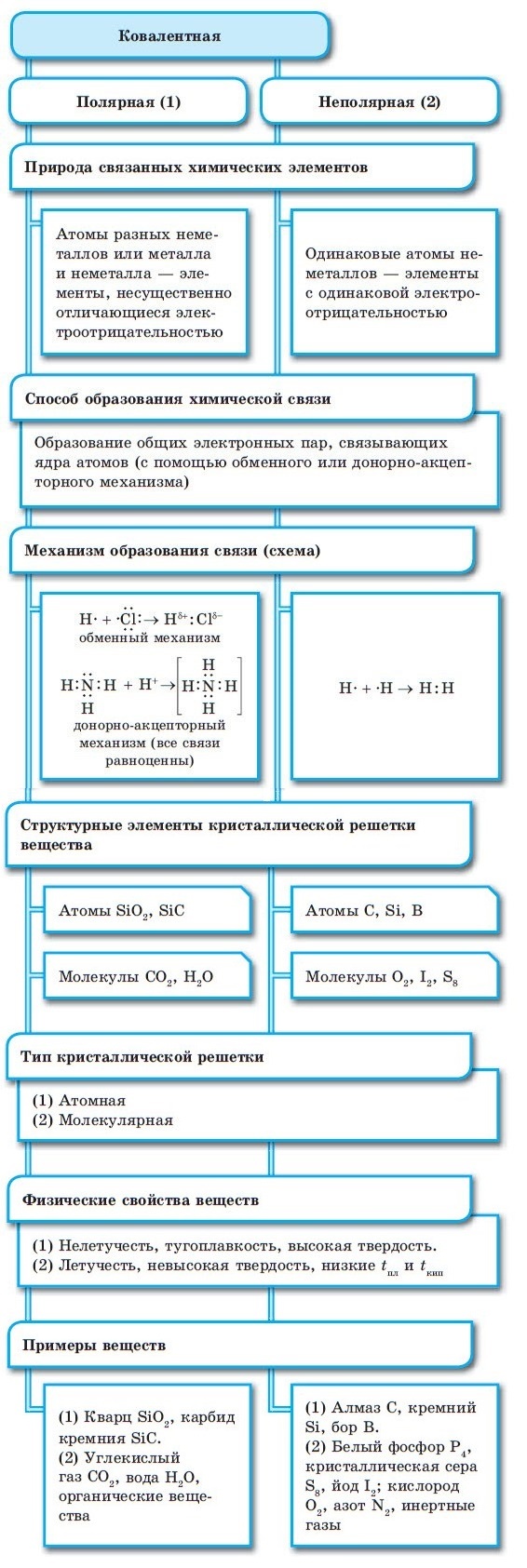
Ковалентная связь образуется между атомами неметаллов. Ковалентная связь имеется в простых веществах неметаллов (H2, Cl2, O2, N2), оксидах неметаллов (CO2, SO2), кислотах (HCl, H2SO4).
Мы рассмотрели два типа химической связи — ковалентную и ионную. Ковалентная связь образуется между атомами неметаллов. Посредством ионной связи соединяются металлы с неметаллами.
При взаимодействии атомов металлов друг с другом возникает третий тип химической связи — металлическая связь. Подробно с этим типом связи вы знакомились в курсе химии 9-го класса. Напомним, что металлическая связь имеется в простых веществах, образованных металлами, например Na, K, Fe, и в металлических сплавах.
Существует три типа химической связи: ковалентная, ионная и металлическая.
Ковалентная связь образуется между атомами неметаллов в простых веществах ( H 2, F2, O 2 ), оксидах неметаллов ( H 2O, CO 2 ), кислотах ( HF, HCl, H 2SO4, HNO 3 ).
Ионная связь образуется между атомами металла и неметалла в солях ( NaCl, KF ), оксидах металлов ( K 2 O, BaO ), гидроксидах металлов ( NaOH, KOH ).
Металлическая связь образуется между атомами металлов в простых веществах ( Na, K, Cu ) и металлических сплавах.
Повторите!
Сущность химической связи. Виды химической связи
I. Сущность химической связи
1. Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов).
2. Завершённый внешний уровень имеют атомы VIII A группы.
3. одиночные атомы связанные атомы
Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
5. Пути завершения внешнего уровня атомов:
· образование общих электронных пар
· отдача или присоединение электронов
II. Виды химической связи
1. Ионная ( ∆ЭО > 1,7) – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов).
Ме щ – О, Г, S; Ме щз – О, Г, S.
· неполярная(∆ЭО = 0) – связь между одинаковыми атомами неметаллов.
· полярная(0 – связь между разными атомами неметаллов, или неметаллом и неактивным металлом (AlCl 3 ).
Свойства ковалентной связи:
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
Одна из трёх связей О→С
по донорно-акцепторному механизму
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в молекуле аммиака NH 3 и четырёхвалентен в ионе аммония NH 4 + (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность – обуславливает форму молекулы в пространстве.
Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. (см. “гибридизация” )
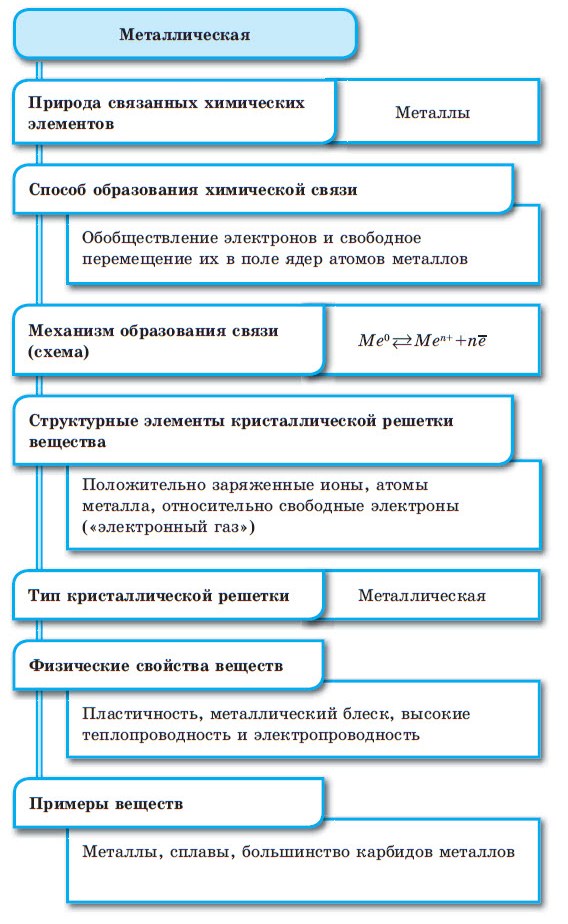
3. Металлическая – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной)
4. Водородная – связь между атомом водорода и сильноэлекроотрицательным элементом F, O, N, Cl. (примерно 15-20 раз слабее ковалентной)
· внутримолекулярная – белки, полипептиды
· межмолекулярная – вода, спирты, аммиак, аминокислоты и др.
Тестовые задания для закрепления:
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
3. Соединение с ионной связью образуется при взаимодействии
4. В каком ряду все вещества имеют ковалентную полярную связь?
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
6. Ковалентная неполярная связь характерна для
7. Веществом с ковалентной полярной связью является
8. Веществом с ковалентной связью является
9. Вещество с ковалентной неполярной связью имеет формулу
10. Веществами с неполярной ковалентной связью являются
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
2) ковалентная полярная
3) ковалентная неполярная
12. Ковалентная полярная связь характерна для
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1) ковалентную полярную
2) ковалентную неполярную
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
16. Водородные связи образуются между молекулами
1) диметилового эфира
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВr
18. Веществами с неполярной ковалентной связью являются
19. Водородная связь не характерна для вещества
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3) брома 4) йода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) йода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
27. Полярность связи наиболее выражена в молекулах
28. В молекуле какого вещества химические связи наиболее прочные?
29. Среди веществ NH 4 Cl, CsCl, NaNO 3, PH 3 , HNO 3 – число соединений с ионной связью равно
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Какие виды химической связи есть
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».