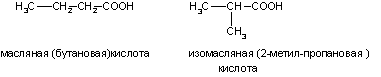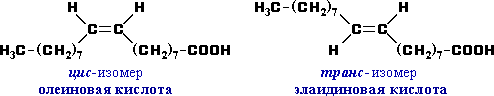какие виды изомерии характерны для карбоновых кислот
Какие виды изомерии характерны для карбоновых кислот
Для карбоновых кислот характерна структурная и пространственная изомерия.
1. Структурная изомерия
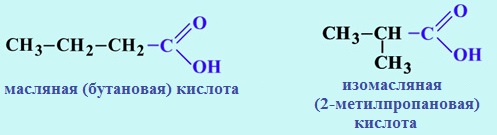
а) Изомерия углеродного скелета (начиная с C4)
Изомерия углеродного скелета начинается с бутановой кислоты С3Н7СООН, которая существует в виде двух изомеров:
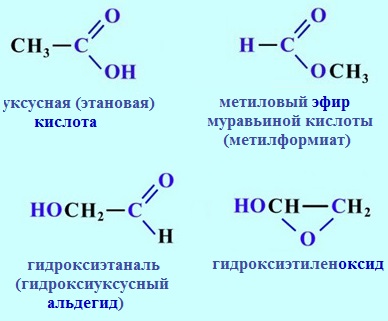
б) Межклассовая изомерия (начиная с C2)
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
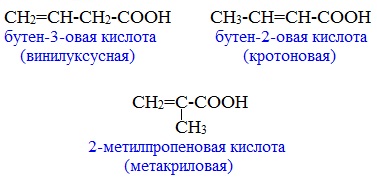
в) Изомерия положения кратной связи
Этот вид изомерии характерен для непредельных карбоновых кислот. Например, кротоновая кислота имеет три изомера:
2. Пространственная изомерия
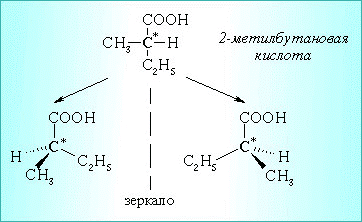
а) Оптическая
Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН существует в виде двух оптических изомеров:
б) Цис- транс – изомерия (геометрическая изомерия)
Этот вид изомерии характерен для непредельных карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН существует два геометрических изомера:
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса “овая” к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Ангидриды
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Карбоновые кислоты: гомологический ряд, номенклатура и изомерия, применение
Урок 27. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока “Карбоновые кислоты: гомологический ряд, номенклатура и изомерия, применение”
Карбоновыми кислотами называются органические соединения, в молекуле которых содержится одна или несколько карбоксильных групп – СООН.
Карбоновые кислоты давно известны человеку, но изучены они относительно недавно. В 70-х гг. 20 века было известно 170 карбоновых кислот, в настоящее время – более 300.
Карбоновые кислоты широко распространены в природе. Например, метановая, или муравьиная кислота, содержится в выделениях муравьёв. Изовалериановая кислота содержится в корнях валерианы лекарственной, бензойная кислота встречается в бруснике, клюкве, чернике, щавелевая кислота содержится в листьях щавеля и ревеня, малоновая кислота есть в соке сахарной свёклы. Янтарная кислоты выделена из продуктов сухой перегонки янтаря. Очень много яблочной кислоты в ягодах и фруктах, а лимонная кислота содержится во многих растениях, в лимонном соке её массовая доля 10 %.
Существует несколько классификаций карбоновых кислот. Так, в зависимости от строения углеводородной цепи различают алифатические карбоновые кислоты, алициклические и ароматические.
Среди алифатических карбоновых кислот различают насыщенные карбоновые кислоты, например, пропановая кислота, и ненасыщенные карбоновые кислоты, например, пропеновая кислота.
К алициклическим карбоновым кислотам относятся кислоты, в молекулах которых есть цикл, например, циклогексанкарбоновая кислота. К ароматическим кислотам относятся кислоты, в молекулах которых есть ароматическое кольцо, например, бензойная кислота.
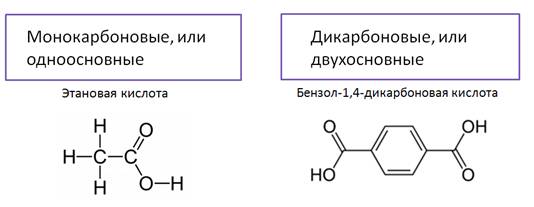
По числу карбоксильных групп различают монокарбоновые кислоты, или одноосновные, которые содержат одну карбоксильную группу, как например, этановая кислота. Кроме монокарбоновых кислот есть ещё и дикарбоновые, или двухосновные, в молекулах которых две карбоксильные группы, например в бензол-1,4-дикарбоновой кислоте.
Карбоновые кислоты содержат в молекуле только одну карбоксильную группу. Их состав выражается общей формулой CnH2n+1COOH, или R – OH, где R – алкильная группа. Кроме этого, можно использовать ещё одну общую формулу, которая отражает молекулярный состав кислот – это CnH2nO2.
Функциональная группа карбоновых кислот – СООН, называется карбоксильной, так как состоит из карбонильной группы – С = О и гидроксильной – ОН группы.
Строение карбоксильной группы определяет свойства карбоновых кислот. В карбоксильной группе электронная плотность смещена к атому кислорода, из-за чего на атоме углерода в этой группе возникает частичный положительный заряд. Компенсация возникающего положительного заряда происходит за счёт смещения электронов неподелённой пары атома кислорода в гидроксильной группе. Поэтому в гидроксильной группе происходит смещение электронной плотности к атому кислорода. Связь между кислородом и водородом в гидроксильной группе становится более полярной, поэтому атом водорода становится ещё более подвижным, чем у спиртов.
Рассмотрим гомологический ряд насыщенных одноосновных карбоновых кислот. Первый представитель этого ряда метановая кислота, или муравьина, вторая кислота в гомологическом ряду – этановая, или уксусная, третья – пропановая, или пропионовая, четвёртая – бутановая, или масляная кислота, пятая кислота – пентановая, или валериановая, шестая – гексановая, или капроновая.
По правилам номенклатуры ИЮПАК названия карбоновых кислот образуются добавлением суффикса -овая- и слова «кислота» к названию соответствующего алкана. Нумерацию начинают с атома углерода при карбоксильной группе. Затем указывают положение заместителей в алфавитном порядке. Назовём кислоты с разветвлённой цепью. В первой кислоте 5 атомов углерода в основной цепи, от второго атома углерода отходит заместитель этил, а от третьего – заместитель метил. Поэтому название кислоты будет 3-метил-2-этилпентановая кислота. У второй кислоты главная цепь состоит из пяти атомов углерода. От второго атома углерода отходит заместитель этил. Поэтому название этой кислоты буде 2-этилпентановая кислота.
Для насыщенных одноосновных карбоновых кислот характерна изомерия углеродного скелета и межклассовая со сложными эфирами. Первые три представителя карбоновых кислот изомеров не имеют. Для кислоты состава С4Н8О2 возможны следующие изомеры: бутановая кислота и 2-метилпропановая кислота. Межклассовыми изомерами будут метиловый эфир пропановой кислоты, этиловый эфир уксусной кислоты, пропиловый эфир муравьиной кислоты, изопропиловый эфир муравьиной кислоты.
Простейшим представителем ненасыщенных одноосновных карбоновых кислот является пропеновая кислота, тривиальное название этой кислоты акриловая:
К высшим ненасыщенным одноосновным карбоновым кислотам относится олеиновая кислота – С17Н33COOH, у которой двойная связь находится между 9 и 10 атомами углерода:
К высшим ненасыщенным кислотам, которые содержат две и более кратные связи, относятся линолевая кислота – С17Н31СООН и линоленовая кислота – С17Н29СООН. В молекуле линолевой кислоты содержится две двойные связи, а в линоленовой кислоте три двойные связи.
Сорбиновая кислота также является ненасыщенной одноосновной кислотой. В составе этой кислоты две двойные связи.
СН3 – СН = СН – СН = СН – СООН
В природе сорбиновая кислота встречается в некоторых растениях, она выделена в середине 19 века.
Среди высших насыщенных карбоновых кислот наиболее распространены пальмитиновая кислота – С15Н31СООН и стеариновая кислоты – С17Н35СООН. Их называют ещё высшими жирными кислотами, так как их природным источником являются жиры. Так, пальмитиновую кислоту получают из пальмового масла, содержащегося в кокосе.
Карбоновые кислоты имеют широкое применение. Муравьиная кислота применяется в текстильной промышленности как протрава при крашении, а также в кожевенной промышленности (дубление кож), для получения щавелевой кислоты, для получения лекарственных средств, средств защиты растений, в качестве растворителя и консерванта.
Уксусная кислота используется в качестве столового уксуса, её используют для получения искусственных волокон, в производстве ацетатов, лекарственных средств (аспирина), а также красителей и лаков. Уксусная кислота – хороший растворитель для многих органических соединений. Её используют для получения ядохимикатов, кино- и фотоплёнок.
Высшие карбоновые кислоты применяются для производства мыла.
Акриловая кислота и её гомологи используется для получения органического стекла, синтетических волокон, как например, нитрон.
Олеиновая кислота применяется в производстве мыла, для обработки шерсти в текстильной промышленности, для изготовления типографических красок.
Сорбиновую кислоту используют в пищевой промышленности, в качестве консервирующего средства.
Таким образом, карбоновые кислоты содержат карбоксильную группу – СООН. Карбоновые кислоты классифицируют в зависимости от строения углеводородной цепи и по числу карбоксильных групп. Химический состав одноосновных кислот выражается общей формулой CnH2n+1COOH. Для карбоновых кислот характерна изомерия углеродного скелета и межклассовая со сложными эфирами. Существуют ненасыщенные одноосновные карбоновые кислоты с одной, двумя и более двойными связями. Карбоновые кислоты находят широкое применение во многих областях промышленности.
Карбоновые кислоты — номенклатура, получение, химические свойства
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН,
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота: HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.
Изомерия карбоновых кислот
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Строение карбоксильной группы:
Электронная плотность π-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
В водном растворе карбоновые кислоты диссоциируют на ионы.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Способы получения карбоновых кислот
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на силу карбоновых кислот
Карбоновые кислоты: классификация, строение, изомерия и номенклатура
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Карбоксильная группа сочетает в себе две функциональные группы — карбонил >C=O и гидроксил —OH, непосредственно связанные друг с другом: —COOH
Общая формула карбоновых кислот с одной карбоксильной группой:
R-COOH
Простейшие карбоновые кислоты:
HCOOH – муравьиная (метановая);
CH3COOH – уксусная (этановая);
CH3CH2COOH – пропионовая (пропановая).
Классификация
Карбоновые кислоты классифицируют по двум структурным признакам.
Изомерия и номенклатура
А) Изомерия углеродного скелета (начиная с C4)
Б) Межклассовая со сложными эфирами R — CO – O — R 1 (начиная с C2)
CH 3— CH 2— COOH пропионовая кислота
С H 3— CO — OCH 3 метиловый эфир уксусной кислоты
Б) Цис- транс – изомерия для непредельных кислот
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота.
Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота. Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения.
Некоторые одноосновные кислоты
Название кислоты R-COOH
Название остатка RCOO —
HOOC-COOH — этандиовая (щавелевая) кислота;
HOOC-CH2-COOH — пропандиовая (малоновая) кислота.
ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ