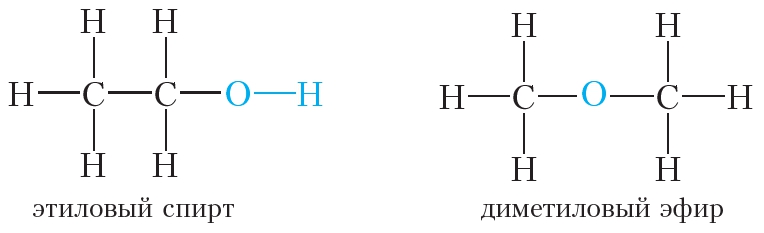какие виды изомерии характерны для одноатомных спиртов
Спирты
Классификация спиртов
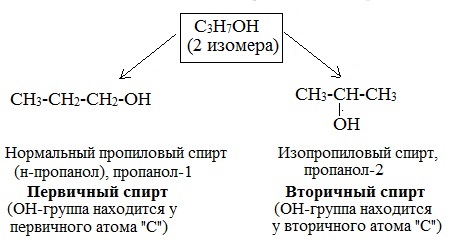
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса “ол” к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
Химические свойства спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия. 10 класс
§ 22. Насыщенные одноатомные спирты. Изомерия, номенклатура, классификация
Насыщенные одноатомные спирты. Изомерия, номенклатура, классификация
В предыдущих параграфах мы изучали углеводороды — органические вещества, состоящие из двух химических элементов — углерода и водорода. В состав органических веществ могут входить и другие элементы. В данном разделе мы будем изучать строение и свойства спиртов. В состав спиртов, кроме углерода и водорода, входят атомы кислорода.
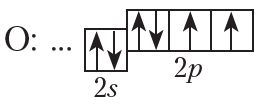
Один из представителей класса спиртов — этиловый спирт — имеет молекулярную формулу C2H6O. Попробуем составить структурную формулу этилового спирта. На внешнем электронном слое атома кислорода имеется два неспаренных электрона:
Следовательно, валентность кислорода равна двум, поэтому от символа O в структурных формулах следует рисовать две чёрточки.
Тогда можно предложить два вещества, имеющие молекулярную формулу C2H6O:
Первое соединение относится к классу спиртов. В молекулах спиртов содержится группа ОН, которая называется гидроксильной группой. Чтобы подчеркнуть, что в молекуле этилового спирта имеется гидроксильная группа, его молекулярную формулу обычно записывают так: C2H5OH. Наличие гидроксильной группы в молекулах спиртов обусловливает их характерные химические свойства, поэтому группу —OH называют функциональной группой. В молекулах спиртов может содержаться не одна, а две и более гидроксильные группы.
Спирты — органические соединения, молекулы которых содержат одну или несколько гидроксильных групп, соединённых с углеводородным радикалом.
Второе соединение относится к классу простых эфиров. В молекулах простых эфиров нет гидроксильной группы. Атом кислорода в молекулах простых эфиров связан с двумя углеводородными радикалами.
Этиловый спирт и диметиловый эфир имеют одинаковую молекулярную формулу, но разное строение. Следовательно, они являются изомерами.
Какие виды изомерии характерны для одноатомных спиртов
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН изомеров не имеют. Для остальных алканолов возможны структурная и пространственная изомерия:
Структурная изомерия
1. Изомерия положения функциональной группы –ОН (начиная с С3):
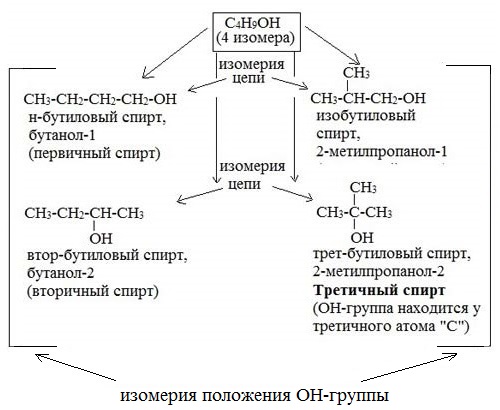
2. Изомерия цепи (углеродного скелета) (начиная с С4)
Например, формуле C4H9OH соответствует 4 структурных изомера:
3. Межклассовая изомерия
Спирты изомерны другому классу соединений – простым эфирам (R-O-R’):
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3 C H (OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
Таким образом, формуле C4H9OH соответствует 5 изомерных спиртов (4 структурных изомера и один из них — бутанол-2 — в виде двух зеркальных изомеров).
Одноатомные спирты.
Одноатомные спирты – это производные углеводородов, в которых один атом водорода замещен на гидрокси- группу. Общая формула спиртов – CnH2n+1OH.
Классификация одноатомных спиртов.
В зависимости от положения, где расположена ОН-группа, различают:

Изомерия одноатомных спиртов.
Для одноатомных спиртов характерна изомерия углеродного скелета и изомерия положения гидрокси-группы.
Физические свойства одноатомных спиртов.
Спирты с количеством атомов углерода меньше 15 представляют собой жидкости, а с большим количеством – твердые вещества.
Получение одноатомных спиртов.
1. Гидратация алкенов (промышленный способ). Реакция протекает под воздействием фосфорнокислого катализатора и при пропускании через пары воды:
Реакция идет по правилу Марковникова, поэтому из первичных алкенов можно получить только певичный спирт.
2. Гидролиз алкилгалогенидов при воздействии водных растворов щелочей:
3. Восстановление карбонильных соединений. При восстановлении альдегидов получаются первичные спирты, кетонов – вторичные:
Реакция протекает в присутствие никелевого катализатора.
4. Этанол можно получить в результате спиртового брожения глюкозы:
Химические свойства одноатомных спиртов.
Химические свойства обуславливают гидроксильные группы. Реакции могут протекать в 2х направлениях:
Реакции с разрывом О-Н связи:
А) действие на спирты минеральных и органических кислот, в результате чего образуются сложные эфиры:
Специфическая особенность одноатомных спиртов: атом водорода отщепляется от спирта, а гидрокси-группа – от кислоты.
Б) Низшие спирты взаимодействуют с щелочными металлами очень бурно, а с щелочами не реагируют. С ростом радикала скорость реакции падает:
В) Под действием перманганата или дихромата калия спирты окисляются, причем первичные – до альдегидов, а вторичные превращаются в кетоны:
Третичные спирты окисляются с разрывом С-С связи.
Реакции с разрывом С-О связи:
А) дегидратация. Реакция идет при нагревании и при участии водоотнимающего агента до образования алкена:
Если нагрев слабый, то происходит внутримолекулярная дегидратация, в результате чего образуются простые эфиры:
Применение одноатомных спиртов.
Спирты используют преимущественно в промышленном органическом синтезе, в пищевой промышленности, в медицине и фармации.
Одноатомные спирты.
Одноатомные спирты – это производные углеводородов, в которых один атом водорода замещен на гидрокси- группу. Общая формула спиртов – CnH2n+1OH.
Классификация одноатомных спиртов.
В зависимости от положения, где расположена ОН-группа, различают:

Изомерия одноатомных спиртов.
Для одноатомных спиртов характерна изомерия углеродного скелета и изомерия положения гидрокси-группы.
Физические свойства одноатомных спиртов.
Спирты с количеством атомов углерода меньше 15 представляют собой жидкости, а с большим количеством – твердые вещества.
Получение одноатомных спиртов.
1. Гидратация алкенов (промышленный способ). Реакция протекает под воздействием фосфорнокислого катализатора и при пропускании через пары воды:
Реакция идет по правилу Марковникова, поэтому из первичных алкенов можно получить только певичный спирт.
2. Гидролиз алкилгалогенидов при воздействии водных растворов щелочей:
3. Восстановление карбонильных соединений. При восстановлении альдегидов получаются первичные спирты, кетонов – вторичные:
Реакция протекает в присутствие никелевого катализатора.
4. Этанол можно получить в результате спиртового брожения глюкозы:
Химические свойства одноатомных спиртов.
Химические свойства обуславливают гидроксильные группы. Реакции могут протекать в 2х направлениях:
Реакции с разрывом О-Н связи:
А) действие на спирты минеральных и органических кислот, в результате чего образуются сложные эфиры:
Специфическая особенность одноатомных спиртов: атом водорода отщепляется от спирта, а гидрокси-группа – от кислоты.
Б) Низшие спирты взаимодействуют с щелочными металлами очень бурно, а с щелочами не реагируют. С ростом радикала скорость реакции падает:
В) Под действием перманганата или дихромата калия спирты окисляются, причем первичные – до альдегидов, а вторичные превращаются в кетоны:
Третичные спирты окисляются с разрывом С-С связи.
Реакции с разрывом С-О связи:
А) дегидратация. Реакция идет при нагревании и при участии водоотнимающего агента до образования алкена:
Если нагрев слабый, то происходит внутримолекулярная дегидратация, в результате чего образуются простые эфиры:
Применение одноатомных спиртов.
Спирты используют преимущественно в промышленном органическом синтезе, в пищевой промышленности, в медицине и фармации.