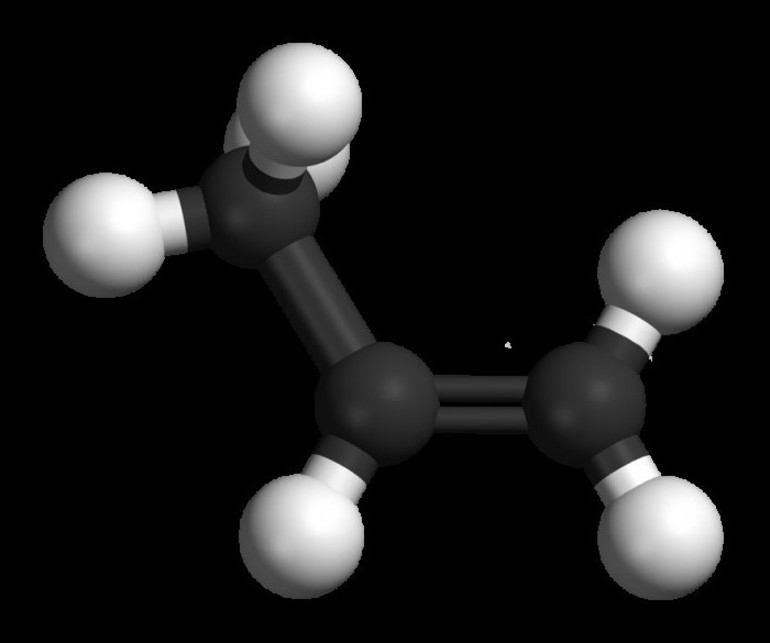
какие виды изомерии характерны для предельных углеводородов
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
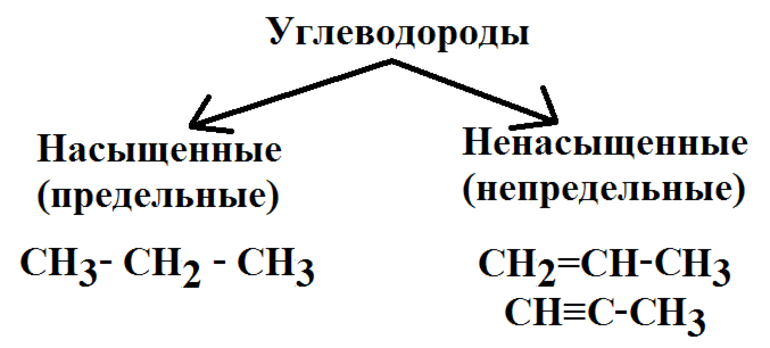
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
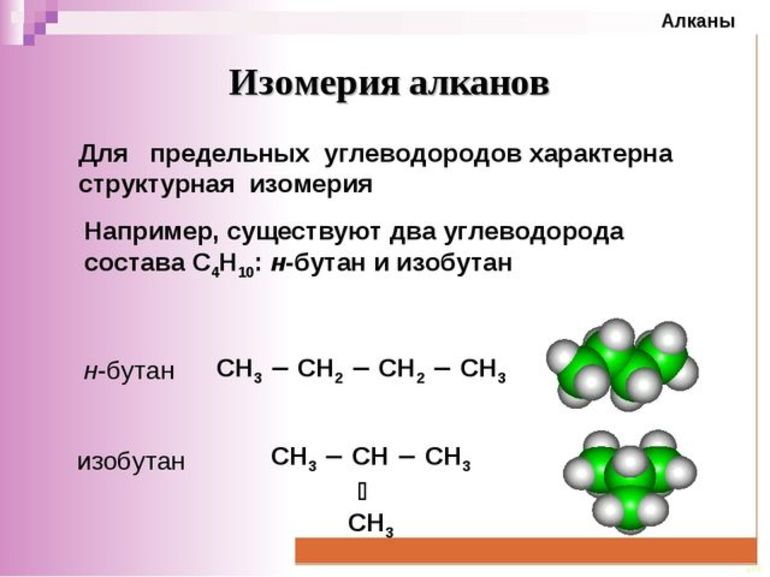
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
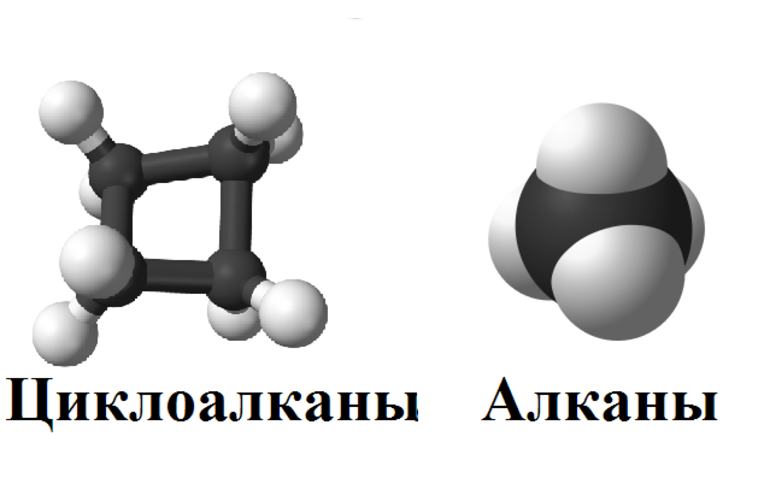
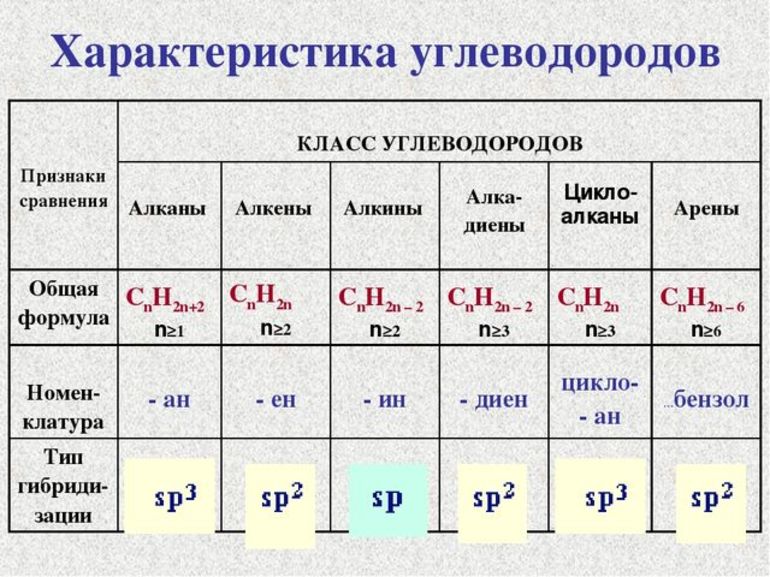
Общая классификация
Общая формула предельных углеводородов — CnH2n+2. Если водород образует всего 1 связь, то у углерода их целых 4. Но это не свидетельствует о том, что между ними имеет место соотношение 1 к 4. Существуют не только одинарные, но и двойные, тройные связи между атомами углерода. По такому показателю выделяют классы углеводородов:
Другая классификация относится к характеристикам молекул. В соответствии с ней выделяют углеводороды:
В первом случае вещества имеют линейную структуру, тогда как во втором они сформированы в виде замкнутой цепи. Карбоциклические подразделяются на ароматические и алициклические. Какие виды изомерии наблюдаются у предельных углеводородов:
В отношении углеводородов имеет место и процесс полимеризации. Это ситуация, когда одинаковые молекулы соединяются. В итоге формируется материал, который совершенно не похож на базовый. Классический пример — полиэтилен. Для его получения используется стандартный этилен. Такое возможно, если приходится говорить о ненасыщенных углеводородах.
Отдельную категорию составляют структуры, относящиеся к непредельным. Новые атомы, непохожие на атомы водорода, притягивают новые атомы, пользуясь для этого свободными радикалами. В итоге формируются различные виды органических веществ. К ним можно отнести:
Наглядные примеры
Углеводороды объединяют обширный список веществ. Их рассматривают в школе на уроках химии за 9 класс. Для нахождения формулы этих соединений составляются специальные уравнения. Несмотря на довольно большую классификацию, следует обозначить основные классы и соединения, относящиеся к ним. Вот их названия:
Ко второму классу причисляют циклопентен и циклопропен. Существуют циклоалкины, которые не встречаются в естественных условиях. Учёные с давних пор пытаются создавать их искусственным путем. Достигнуть цели удалось только в начале прошлого века. В составе молекул циклоалканов присутствует от 8 атомов углерода. Если их будет меньше, соединение будет отличаться нестабильностью. Объясняется это значительным напряжением.
Ароматические углеводороды включают довольно простые соединения наподобие бензола. Также в эту категорию включены индол и нафталин.
Ключевые параметры
Углеводороды способны объединять большое количество различных соединений. Но если говорить об основных характеристиках, приходится отметить, что общего у них почти нет. Единственное, в чём они сходятся, это состав. Строение всегда отличное. Примечательным является их переход от газообразной формы к твёрдой. Они также могут переходить к нему из жидкого состояния. Происходит это сообразно увеличению числа атомов углерода в начале ряда. Другое сходство, которое можно обнаружить, это способность к горению. Одновременно с этим выделяется большое количество тепла, когда образуются вода и углекислый газ.
Структурные особенности
Алканы являются гомологами метана, то есть его производными. Молекулярная формула этого вещества записывается, как CH4. В случае если отнять от него атом водорода, удастся получить радикал (углеводородный остаток) CH3. В большинстве случаев в молекуле присутствует 4-валентный углерод. Соответственно, объединение двух радикалов приводит к формированию дополнительного представителя ряда гомологов этана C2H6. После отщепления атома гидрогена образуется радикал — этил. При объединении его с CH3 удается получить еще один гомолог — пропан.
Рассматривая структуру пропана, можно установить, что его основу составляет 2 разновидности атомов углерода. Это первичные и вторичные соединения. Любой первичный атом имеет связь с 1 атомом углерода. Если атом гидрогена отщепить от первичного атома пропана, будет сформирован первичный пропил. Объединение метила со вторичным пропилом способствует образованию различных вариантов других гомологов. Это может быть изобутан, имеющий широкую ветвь углеродной цепи либо стандартный бутан, у которого карбоновая цепь является прямой.
Метан представляет собой наиболее типичный вариант алканов. Так называемая сигма-связь характерна для этих соединений. Допустим, у метана присутствует 4 ковалентные связи. Отвечает за это 3 p- и 1 s-орбиталь. Атом углерода образует такие связи благодаря s-орбитали.
Изомерия и номенклатура
Чтобы определить формулы гомологов, в том числе бутана с его формулой C4H10, необходимо изучить явление изомерии. Что касается бутана, то за стабильность его формулы отвечают два различных соединения, тогда как в отношении формулы C5H12 их 3. Число изомеров постепенно увеличивается по мере повышения числа атомов углерода в молекулах алкана. 5 структурных формул, соответственно, присутствует в формуле C6H14. Если первые четыре соединения являются газами, то с 5 по 12 представлены жидкости. Вещества с 16 и далее имеют твердую структуру.
Химические свойства
Предельные углеводороды причисляются к группе инертных веществ. Это можно объяснить сигма-связью атома водорода и углерода в алканах. Вот почему они не способны притягивать к себе атомы водорода. Вещества могут вступать в реакции расщепления, дегидрирования, нитрирования. Также они принимают участие в процессе радикального галогенирования. В последнем случае молекулы галогенов с лёгкостью могут замещать таковые у гидрогена в составе алкана. Процесс нитрования приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Несколько сложнее этот процесс проходит в случае с первичными и вторичными атомами.
Предельные углеводороды используются в производстве органических веществ различных видов. Непредельные получаются после отсоединения атома водорода от них.
Естественные источники
Помимо синтетических соединений, встречаются и природные источники углеводородов. Они присутствуют в почве в виде залежей. Большую часть нефти и газа составляют именно углеводороды. При обработке нефти это хорошо прослеживается. Во время такого процесса отмечается выделение большого количества веществ, относящихся к углеводородам. В составе газа и вовсе присутствует до 97% метана. Это вещество формируется при разложении органических отходов. Соответственно, чтобы получить его, не приходится прикладывать значительных усилий.
Получить углеводороды можно и в условиях лаборатории. Есть соединения, которые невозможно увидеть в природе. Их добывают синтетическим путем, проводя специальные химические реакции.
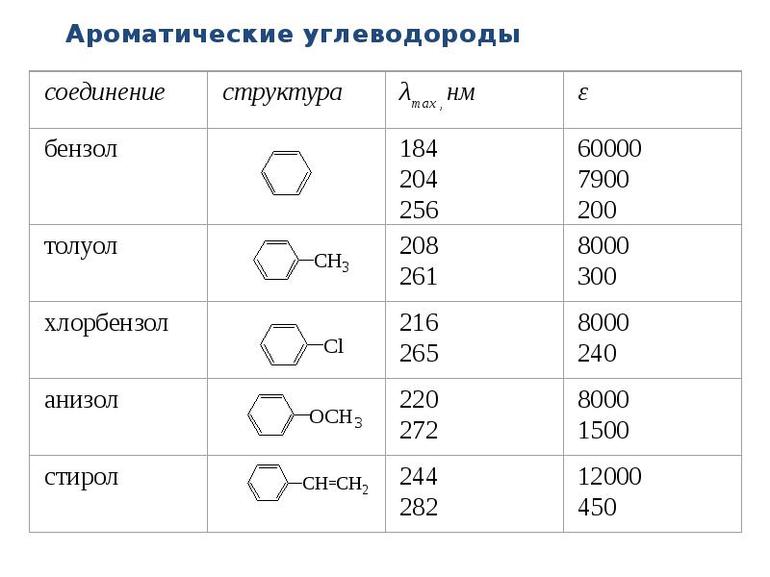
Ароматические соединения
Это отдельный гомологический ряд, который имеет формулу СпН2п-6. Такие углеводороды способны вступать практически в любые реакции присоединения: галогенирование, гибридизация и т. д. Многочисленные эксперименты, проведённые в их отношении, показали небольшую химическую активность бензола — классического представителя этой категории. Он демонстрирует увеличение стойкости к окислению. Присоединение становится возможным для него при доступе к ультрафиолетовым лучам. Пребывание в ср2-гибридном состоянии является характерной особенностью бензола. Углеродные атомы находятся в единой плоскости.
Выделяют чётные и нечётные представителей этого класса. Их нумерация идёт по часовой стрелке, когда выделяют наиболее старших и наиболее младших заместителей. Четные варианты — 2 и 6 обозначают как ортоположения, 3 и 5, то есть нечетное, это метаварианты.
В большинстве случаев это жидкости, обладающие неприятным запахом и запрещённые к использованию без специализированной защиты. Они недостаточно хорошо растворяются в воде, но хорошо реагируют на органические растворители. Мало реагируют они и на кислоты. В смесях с добавлением соли одноосновных кислот органического происхождения вещества распадаются на ионы.
Бензол и другие ароматические углеводороды получают в промышленных условиях. Примером является каменноугольная смола. Ее и другие вещества аналогичного класса получают:
Сфера применения
Углеводороды очень важны для полноценного ведения деятельности человека. Применение предельных углеводородов разнообразно. Наиболее ценными ресурсами считаются газ и нефть. Они применяются в качестве энергоносителей и топлива. Но это далеко не полный список всех способов применения веществ этого класса. Углеводороды окружают человека практически всюду. Посредством полимеризации удаётся формировать новые вещества, служащие основой для различных типов тканей, пластмасс. Также необходимо выделить в особую категорию бензин, прочие продукты нефтепереработки, а также лакокрасочные изделия, асфальт, керосин.
Современное общество не может обойтись как без предельных, так и непредельных углеводородов. Несмотря на то что запасы нефти уменьшаются с каждым годом, отказаться от их применения по-прежнему невозможно. Правда, ученые активно занимаются поисками альтернативных источников углеводородов. С другой стороны, той же универсальности применения и эффективности не смог показать ни один из них.
Химия. 10 класс
Конспект урока
Урок № 2. Предельные углеводороды – алканы
Перечень вопросов, рассматриваемых в теме: урок посвящён предельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока школьники познакомятся с представителями данного класса органических веществ.
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Галогенирование – замещение одного или нескольких атомов водорода на галоген.
Дегидрирование – отщепление атомов водорода за счет отщепления связи С-Н.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Изомеризации реакция – характерна для алканов, протекает под влиянием катализаторов и при нагревании, вещества превращаются в разветвленные, без изменения состава молекулы.
Крекинг – процесс термического или каталитического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул на молекулы с меньшим числом атомов углерода. Чаще всего при этом образуются алкан и алкен.
Парафины – исторически сложившееся название, отражающее их малую химическую активность.
Цепная реакция – реакция, в ходе которой исходные вещества вступают в цепь превращений с участием промежуточных активных частиц и их регенерацией в каждом элементарном акте реакции.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Теоретический материал для самостоятельного изучения
Алканы – это углеводороды, в молекулах которых атомы углерода соединены между собой только простыми (одиночными) ковалентными связями. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,187 нм. При этом оси четырех sр3-гибридных орбиталей оказываются направленными к вершинам тетраэдра, угол равен 109°28′.
Наращивание углеродной цепи на один атом углерода ведёт к увеличению состава на группу СН2 (гомологическая разность). При этом химические свойства и строение веществ одинаковы. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами.
По химическим свойствам алканы – инертные вещества. Они вступают только в реакции замещения, протекающие с разрывом связей C-H. Протекают эти реакции в жестких условиях (высокая температура, освещенность).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Сколько граммов карбида алюминия требуется для получения 5,6 л (н. у.) метана с помощью реакции гидролиза? Ответ округлите до целых.
1.Запишем уравнение реакции
2.Рассчитаем количество вещества метана
ν(СН4) = 5.6 /22.4 = 0.25 (моль)
3.Составим пропорцию, приняв за х количество вещества карбида алюминия:
4. Определяем массу карбида алюминия
Подчеркните формулы алканов, которые должны в итоге образовать линию из трех веществ (она может быть как по прямой, так и по диагонали)
Виды изомерии в органической химии
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формула C 4 H 6 O 6 ) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола ( C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.