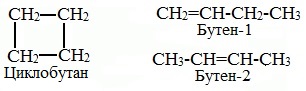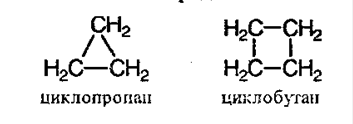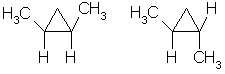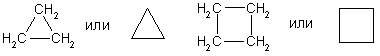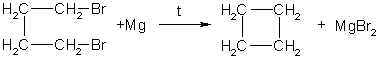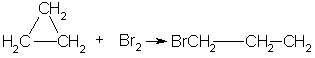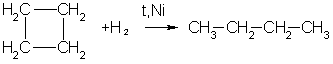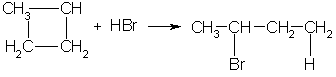какие виды изомерии характерны для циклоалканов
Циклоалканы
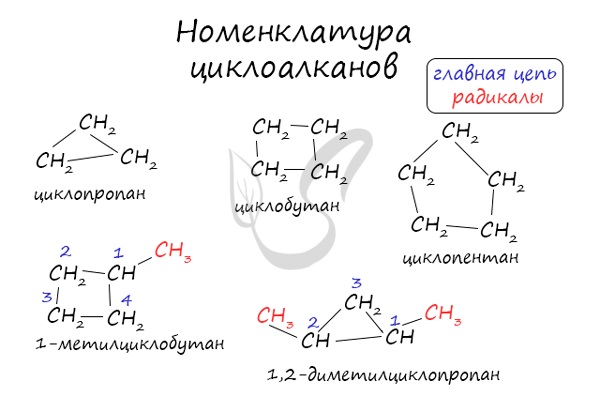
Номенклатура и изомерия циклоалканов
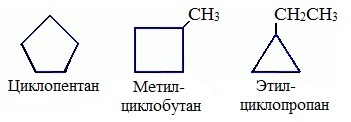
Названия циклоалканов формируются путем добавления приставки “цикло-” к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
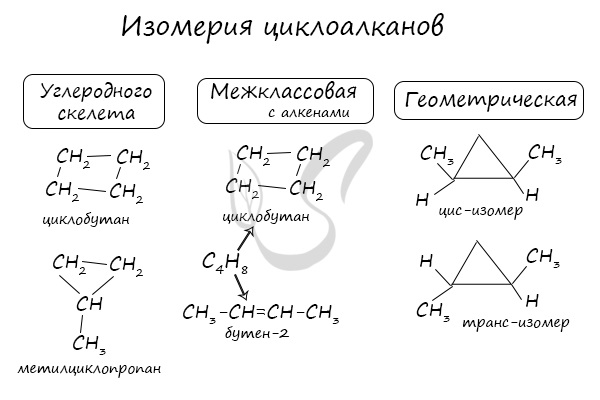
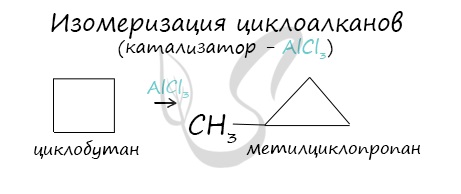
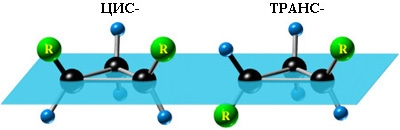
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение циклоалканов
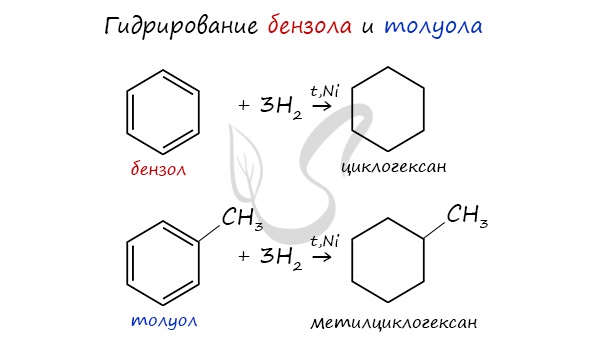
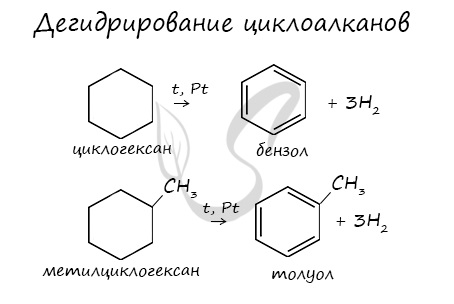
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
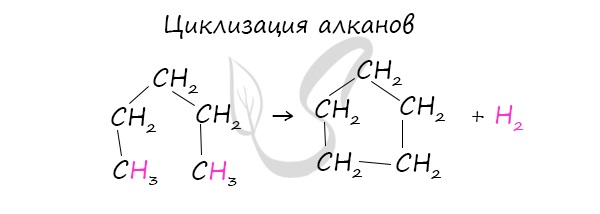
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
Химические свойства циклоалканов
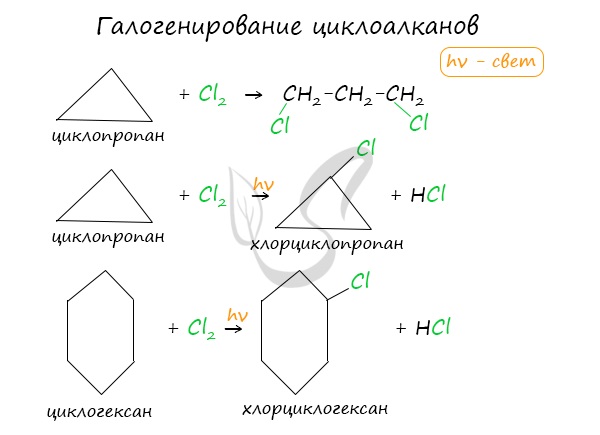
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
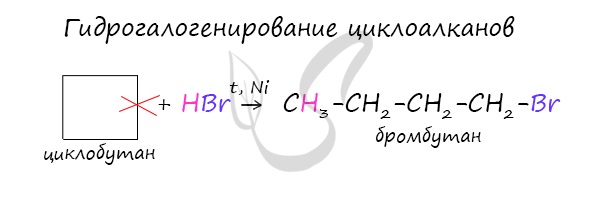
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какие виды изомерии характерны для циклоалканов
Циклоалканы, также нафтены, циклоны или циклопарафины – ациклические насыщенные углеводороды, по химическим свойствам близки к п редельным углеводородам. Входят в состав нефти. Циклоалканы открыты В.В. Марковниковым в 1883 году. ( Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены )

Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления.
Для циклопропана межъядерные углы составляют 60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате, а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода – 109,5º. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане – 1,5º.
Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских “сложенных” конформаций. Циклопентан характеризуется конформацией “конверт”.
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º.
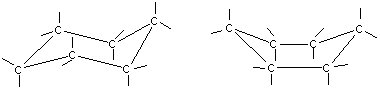
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях “кресла” и “ванны”. Конформация “кресла” менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию с промежуточным образованием конформера II:
ось симметрии II III
I
Какие виды изомерии характерны для циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомерия
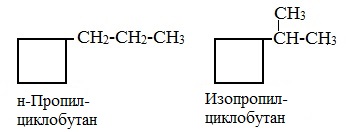
1. Изомерия углеродного скелета:
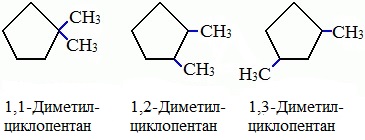
2. Изомерия положения заместителей в кольце:
3. Межклассовая изомерия с алкенами:
Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные.
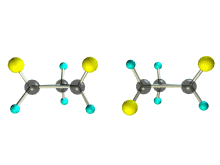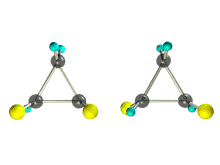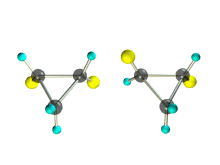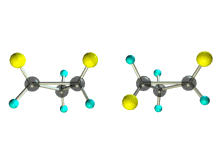
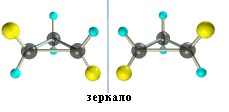
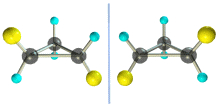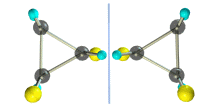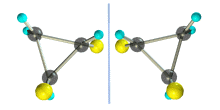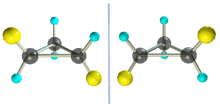
Транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение.
3. Поворотная (конформационная) изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация «кресла».
Циклоалканы. Свойства циклоалканов.
Циклоалканы – предельные циклические углеводороды. Простейшие представители:
Строение циклоалканов.
Атомы углерода находятся в sp 3 – гибридизации. Угол зависит от размера цикла.
Изомерия циклоалканов.
Для циклоалканов характерна изомерия углеродного скелета и пространственная изомерия:
Физические свойства циклоалканов.
При обычных условиях:
С17 и выше – твердые вещества.
Температуры плавления и кипения выше, чем у алканов.
Получение циклоалканов.
1. Отщепление 2х атомов галогена от дигалогенов:
2. Гидрирование ароматических углеводородов:
Химические свойства циклоалканов.
Малые и обычные циклы имеют различные свойства. Например, для циклобутана и циклопропана свойственна реакция присоединения:
Б) водорода (в присутствие никелевого катализатора):
В) галогенводорода (по правилу Марковникова):
Реакция замещения свойственна для обычных циклов, т.к. они более устойчивы:
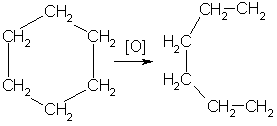
Под воздействием окислителей образуется кислота:
Применение циклоалканов.
Циклоалканы используют для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан выступает в качестве ингаляционного средства.
Chemistry48.Ru
Сайт учителя химии и биологии МБОУ СОШ №2 с.Казаки Елецкого р-на Липецкой обл. Радиной М.В.
Строение. Изомерия и номенклатура
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5-С7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.
Получение. Свойства
C 17 — твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном):
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы.
Присоединение происходит при нагревании в присутствии никелевого катализатора:
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Особенности строения циклоалканов и их химическое поведение. Выше мы продемонстрировали неустойчивость малых циклов и их способность разрываться и вступать в реакции присоединения. Причины этого кроются в строении циклов. Так, циклопропан имеет плоское строение, поэтому атомы водорода у соседних атомов углерода располагаются над и под плоскостью цикла в энергетически невыгодном (“заслоненном”) положении. Это — одна из причин “напряженности” цикла и его неустойчивости.
Исходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60°, т.е. резко отличающимися от величины нормального валентного утла 109,5° для классического случая sp ‘-гибридизации 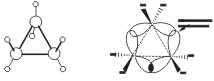
Обычные циклы, наоборот, очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.
Среди неплоских конформаций наиболее энергетически выгодной является конформация кресла, так как в ней все валентные углы между атомами углерода равны 109,5°, а атомы водорода у соседних атомов углерода находятся относительно друг друга в заторможенном положении.
Конформации шестичленного цикла: а — кресло: 6 — ванна.
Другое возможное для циклогексана расположение атомов соответствует конформации ванны, хотя оно менее устойчиво, чем конформация кресла. Следует отметить, что и в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.