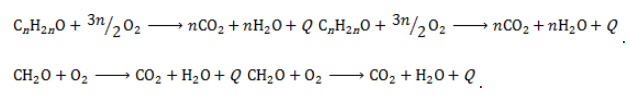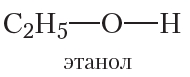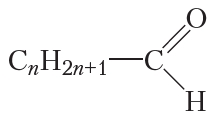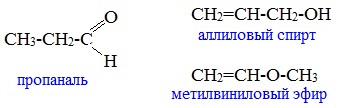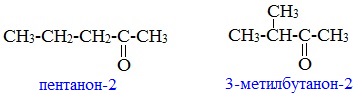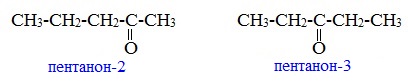какие виды изомерии возможны для альдегидов
Изомерия, строение и гомологический ряд альдегидов и кетонов
К кислородсодержащим производным углеводородов, содержащим в молекуле функциональную группу 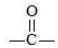
Строение альдегидов и кетонов
Определяющий элемент структуры производных углеводородов – функциональная группа атомов. Она служит критерием для отнесения соединения к тому или иному классу органических веществ.
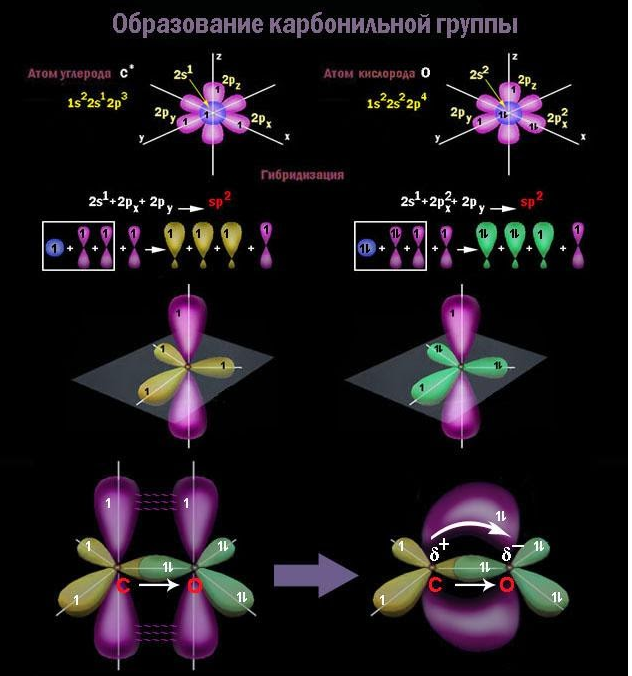
Карбонильная группа
Группа 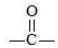
В карбонильной группе атом углерода затрачивает на 


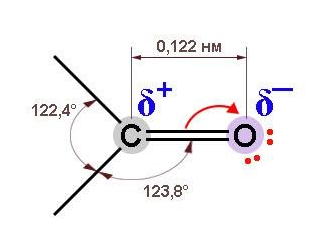
Благодаря высокой электроотрицательности кислород оттягивает в свою сторону электронную плотность по обоим компонентам двойной связи, и она оказывается сильно поляризованной. За счет 
На диполе C=O кислород обладает частичным отрицательным, а углерод – положительным зарядом. Это приводит к поляризации связей С-O у соседнего с карбонилом углеродного атома (отрицательный индуктивный, или I-эффект) и оказывает влияние на химические свойства.
Общая структура молекул альдегидов и кетонов
Состав карбонильных соединений описывается общей формулой 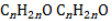
В альдегидах одна из свободных валентностей углерода группы 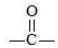
Номенклатура
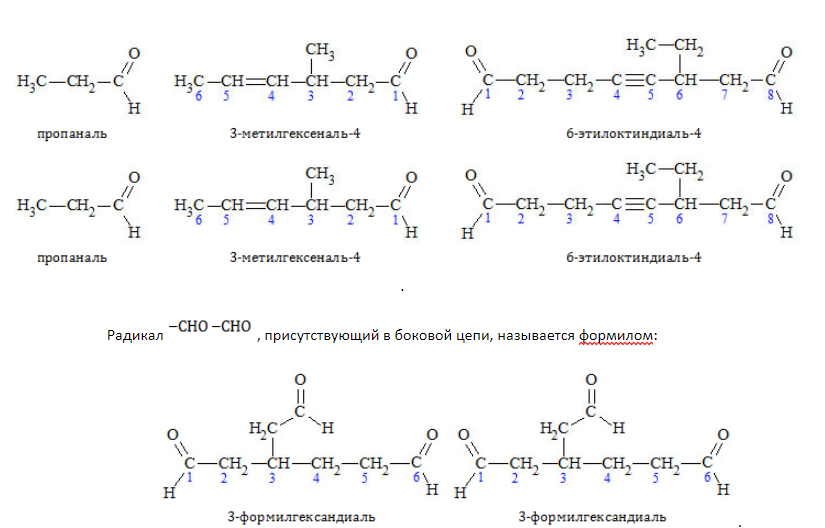
Наименования альдегидов строятся путем прибавления суффикса «-аль» либо «-диаль» к названию углеводорода, представляющего алкильный остаток. Нумерацию цепи начинают от углеродного атома, входящего в состав карбонила, но в наименовании локант «1» не указывается:
Наименования кетонов составляются путем добавления суффикса «-он» либо «-дион» к названию образующего главную цепочку углеводорода:
Гомологические ряды альдегидов и кетонов
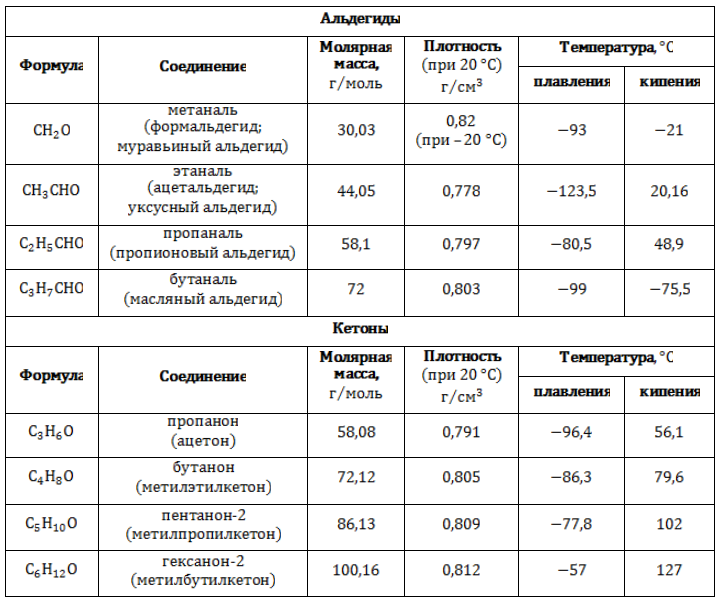
Ряды, образуемые насыщенными карбонильными соединениями, представлены в таблице:
Изомерия кетонов и альдегидов
Соединения состава 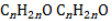
Позиция функциональной группы
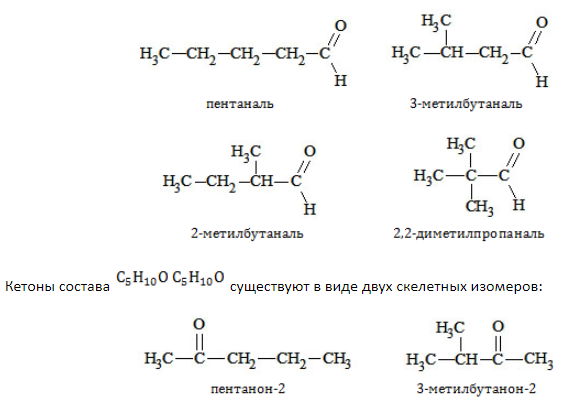
Изомерия данного типа свойственна кетонам с 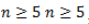
Строение углеродного скелета
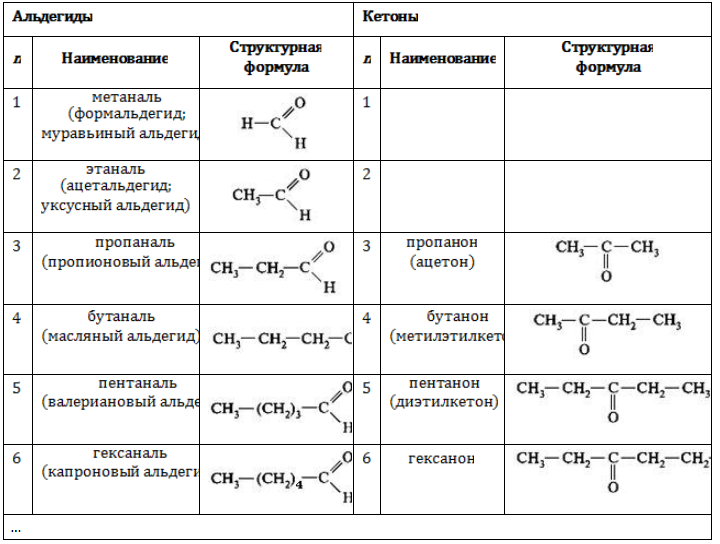
Изомерия по отсутствию либо наличию и характеру ветвления углеродной цепи свойственна всем карбонильным соединениям: альдегидам с 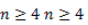
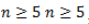
Например, альдегиды состава 
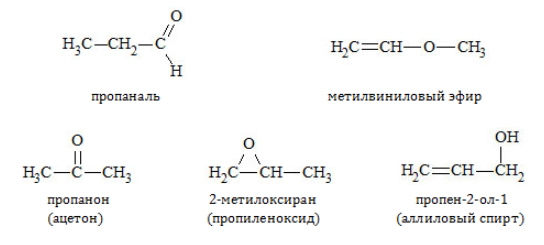
Межклассовая изомерия
Из единой для двух классов соединений общей формулы следует, что альдегиды и кетоны одинакового атомного состава – взаимные изомеры:
Кроме того, они обладают межклассовой изомерией с такими соединениями, как:
Физические свойства
Формальдегид и уксусный альдегид в стандартных условиях – токсичные газы с резким запахом. Альдегиды и кетоны с C3 по C12– жидкости.
Поскольку в группе 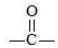
Химические свойства
Химические свойства альдегидов и кетонов определяются в первую очередь группой 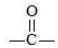
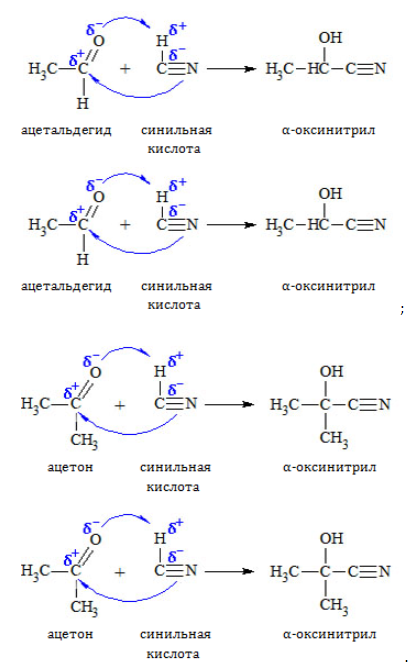
1. Присоединение к карбонилу по месту двойной связи
Синильная кислота присоединяются по нуклеофильному механизму:
Аналогично протекают реакции присоединения солей и спиртов.
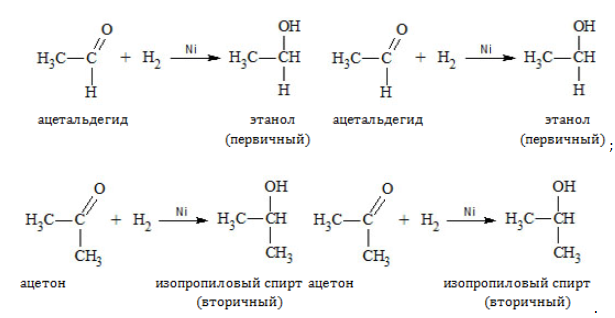
При восстановлении (гидрировании) присоединение водорода идет на катализаторе:
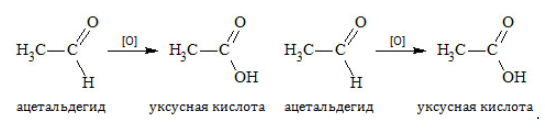
2. Окисление
К действию окислителей альдегиды и кетоны относятся различно. Альдегиды охотно вступают в реакцию и в мягких условиях благодаря наличию водорода при карбонильной группе, которая окисляется до карбоксильной. Продукт реакции – кислота:
Альдегиды дают качественные реакции при окислении свежеприготовленным гидроксидом меди или реактивом Толленса (оксид серебра в аммиачном растворе):
Кетоны ведут себя подобно третичным спиртам и не реагируют со слабыми окислителями. Под действием сильных окислителей происходит распад молекулы кетона.
Карбонильные соединения горят с выделением тепла по схеме:
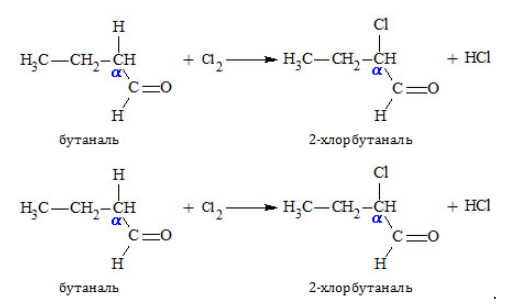
3. Реакции в алкильном радикале
Карбонил оказывает влияние на реакционную активность углеводородного остатка, сообщая особую подвижность водородным атомам, стоящим при α-расположенном (соседнем с группой 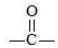
Получение альдегидов и кетонов
Применение карбонильных соединений
Благодаря высокой реакционной активности соединения, содержащие карбонил, широко используются в различных сферах.
Формальдегид лидирует по объемам мирового производства. Он применяется в фармацевтике, производстве полиуретанов, смол, взрывчатых веществ. Используется в качестве консерванта биопрепаратов и в сельском хозяйстве для обработки зерна.
Уксусный альдегид – основа для получения этанола, уксусной кислоты, бутадиена и других востребованных промышленностью веществ.
Альдегиды играют значительную роль в синтезе спиртов и карбоновых кислот, душистых веществ и антиоксидантов.
Ацетон – один из самых распространенных органических растворителей, компонент лаков, красок, клеев. Используется в производстве различных реактивов.
Бутанон (метилэтилкетон) и другие низшие кетоны также являются эффективными растворителями и находят применение в химической промышленности, например, в производстве полимерных материалов.
Химия. 10 класс
§ 29. Альдегиды. Номенклатура. Изомерия. Физические свойства
Строение альдегидной группы
Вы уже знаете, что атомы кислорода в молекулах органических соединений могут выступать в качестве «мостиков» между алкильным радикалом и атомом водорода (спирты):
либо между двумя алкильными группами (простые эфиры):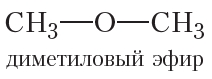
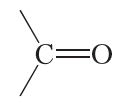
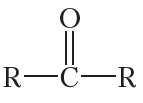
Как видно, атом углерода карбонильной группы образует две связи с атомом кислорода. Две оставшиеся связи атом углерода может образовывать с углеводородными радикалами:
Такие органические соединения относятся к классу кетонов. Углеводородные радикалы в молекулах кетонов могут быть как одинаковыми, так и различными. В молекуле простейшего кетона оба радикала — метильные группы. Этот кетон называется ацетон: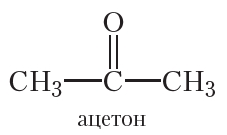
Интересно знать
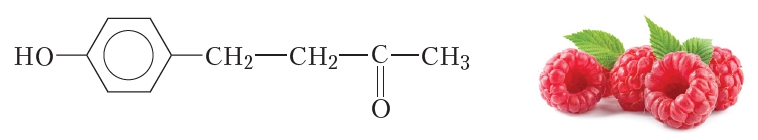
Еще один известный кетон — кетон малины — также имеет в составе молекулы карбонильную группу, это соединение более сложного строения:
Кетон малины содержится, естественно, в малине, обусловливает её характерный запах. Синтетический кетон малины применяется в качестве добавки к пищевым продуктам и косметическим средствам.
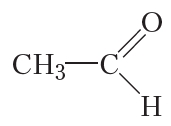
Если соединить карбонильную группу с атомом водорода, то получится альдегидная группа: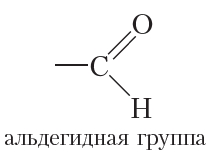
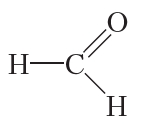
Название этого соединения — уксусный альдегид, или ацетальдегид. Уксусный альдегид при н. у. представляет собой бесцветную жидкость с запахом яблок. Температура кипения уксусного альдегида 21 °С.

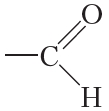
Составим общую формулу гомологов уксусного альдегида. В молекулах таких альдегидов группа —CHO соединена с алкильным радикалом или водородом. Как вы уже знаете, алкильный радикал образуется в результате отрыва от молекулы алкана одного атома водорода. Общая формула алкильных радикалов CnH2n+1. Тогда общая формула гомологов уксусного альдегида:
Обратите внимание, что для муравьиного альдегида n = 0.
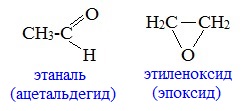
Какие виды изомерии возможны для альдегидов
Для альдегидов и кетонов характерна структурная изомерия.
Изомерия альдегидов
1. Изомерия углеродного скелета, начиная с С 4
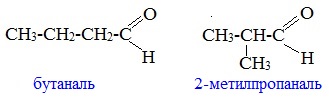
с кетонами, начиная с С3
с циклическими оксидами (с С2)
с непредельными спиртами и простыми эфирами (с С3)
Изомерия кетонов
1. Изомерия углеродного скелета (c C5)
2. Изомерия положения карбонильной группы (c C5)
3. Межклассовая изомерия (аналогично альдегидам).
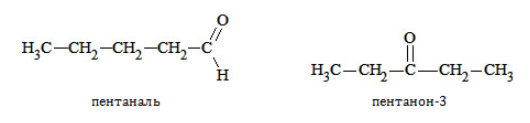
Пример – изомеры масляного альдегида
Альдегиды
Альдегиды содержат в молекуле альдегидную группу –СН=О. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами. Общая формула предельных альдегидов и кетонов CnH2nO.
В названии альдегидов присутствует суффикс –аль, кетонов – он. Если карбонильная группа находится не в главной цепи, то её наличие указывают префиксом – формил.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2=О, ацетальдегид (уксусный альдегид) – СН3-СН=О; кетонов – ацетон (диметилкетон, пропанон-2) – СН3-СО-СН3.
Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Изомерия альдегидов
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
Строение
Физические свойства альдегидов
Карбонильные соединения не образуют водородных связей, поэтому их температуры кипения значительно ниже, чем у соответствующих спиртов. Низшие альдегиды – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Получение
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
— окисление первичных спиртов (реакция протекает при нагревании)
Химические свойства альдегидов
В молекулах карбонильных соединений имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
— спиртов с образованием полуацеталей
— тиолов с образованием дитиоацеталей (в кислой среде)
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
— аминов с образованием N-замещенных иминов (основания Шиффа)
— гидразинов с образованием гидразонов
— циановодородной кислоты с образованием нитрилов
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH=O + Ag2O → R-CO-OH + 2Ag↓
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
Эти реакции являются качественными реакциями на альдегиды
Примеры решения задач
| Задание | Бромированием СnH2n+2 получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag2O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение | Запишем уравнения всех протекающих реакций: |
R-CH=O + Ag2O → R-CO-OH + 2Ag↓
Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра:
v(Ag) = m/M=43,2/108 = 0,4 моль
Количество вещества бромметана:
v(CH3Br) = m/M = 9,5/95 = 0,1 моль
Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH4) = 16 г/моль. Следовательно масса и объем метана:
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н2 → В + [Ag(NH 3)2]OH → С + HCl → D |
| Решение | Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R2O2 (реакция протекает против правила Марковникова): |
При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А):
Бутанол-1 при дегидрировании образует альдегид – бутаналь (В):
Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С):
Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D):
Какие виды изомерии возможны для альдегидов
Систематические названия кетонов производят от названий радикалов (в порядке увеличения) с добавлением слова кетон.
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе.
Физические свойства альдегидов
Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Акролеин СН2 = CH CH = O акриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C 6 H 5 CH = O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
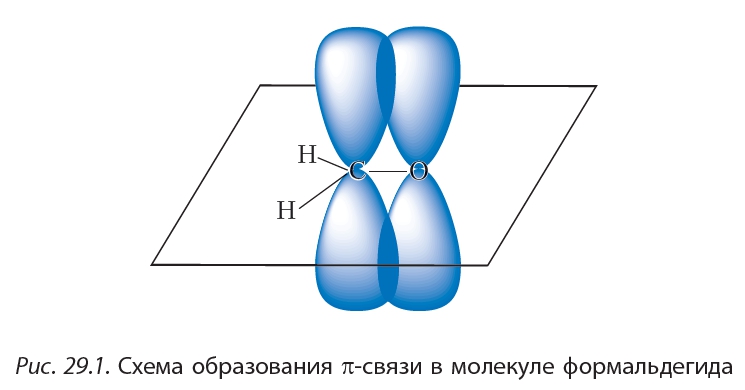
Строение карбонильной группы
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд