какие виды парообразования вы знаете дайте определение удельной теплоты парообразования
Виды изменений жидкости при нагревании
Фазовый переход — превращение вещества из одного агрегатного состояния в другое. Понятие это более общее, чем положение о твёрдой, жидкой и газообразной формах. Различные фазы могут находиться в пределах одного физического положения воды и называются сообразно физике процесса. Определения переходов жидкости под влиянием температуры:
Переход вещества из газообразной формы в жидкость — обратное превращению воды в пар действие, называется конденсацией. При этом всегда выделяется энергия, почему и требуется отводить теплоту от вещества для поддержания процесса. Температура перехода совпадает с точкой кипения.
Процессы парообразования и испарения
Причиной распада жидкости с выветриванием из вещества лёгких фракций считается разница температур на границе фазного перехода: воздух обычно теплее жидкости, что и вызывает испарение. Процесс протекает медленно, когда ему не способствуют внешние факторы, отличается от кипения тем, что отделение пара происходит только с водной поверхности.
Если естественное парообразование с зеркальной глади озера может быть незаметным, то процесс перехода в пар кипением всегда является интенсивным. Наглядный пример бурного природного парообразования — гейзер, выбрасывающий из недр под давлением горячую воду с паром. На способность жидкости испаряться быстрее или медленнее влияют несколько факторов:
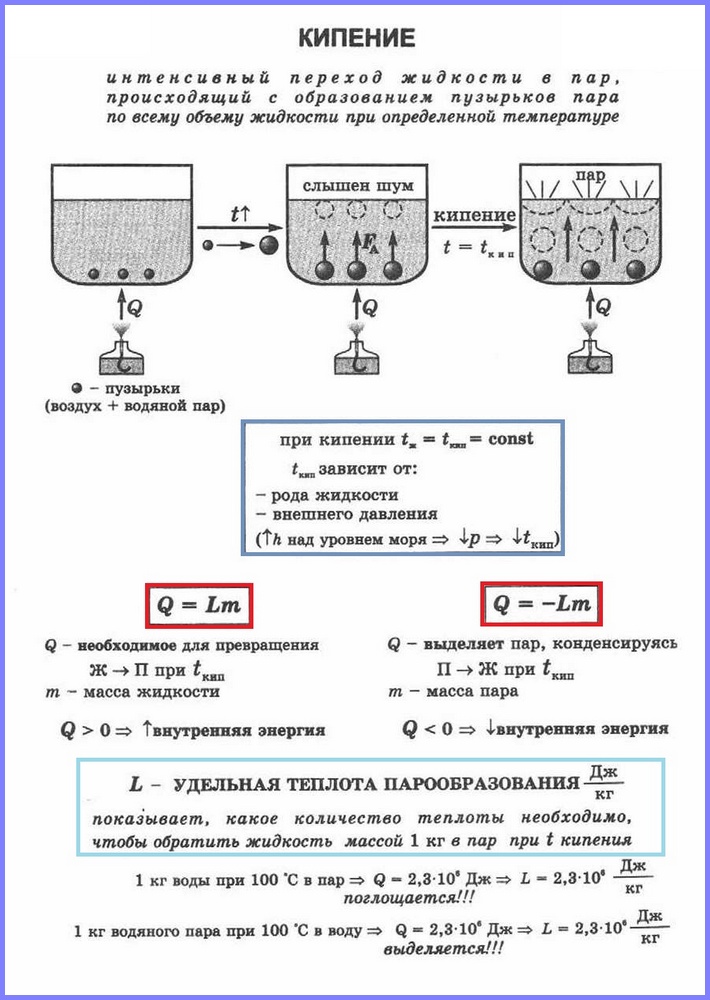
Для определения количества теплоты, необходимого для превращения 1 кг жидкости в пар, используется физическая величина, обозначаемая в физике буквой L. У воды при температуре 0ºС этот показатель равен 2500 кДж/кг, а в стадии кипения удельная теплота парообразования меньше — 2260. Для сравнения: у этилового спирта L =906, у эфира — 356 кДж на кг. Величина L =0 у воды при 374,15ºС.
Рассчитать кипящую жидкость на нужное для перехода в пар количество теплоты можно по формуле Q = L *m.
Образование конденсата как завершение цикла
Одновременно с испарением при температуре кипения вещества происходит его превращение в жидкость. Хаотичное движение молекул над поверхностью воды или другого текучего субстрата приводит к их столкновению, а при совпадении векторов скорости в направлении к жидкости происходит возврат капель в кипящую среду. Конденсация длится на протяжении всего времени кипения, то есть пока температура остаётся равной 100ºС, если это вода. Другая часть испарившихся молекул улетучивается в атмосферу. В разных обстоятельствах взаимодействие парообразования и конденсации отличается:
Парообразование, составляющими которого являются испарение и кипение, всегда завершается конденсацией. В природе благодаря этим процессам непрерывно осуществляется водообмен между морями, реками, сушей, атмосферой.
Круговорот воды обеспечивает окружающий человека мир и его самого полезными веществами, способствует сохранению естественной среды обитания живых организмов.
Какие виды парообразования вы знаете дайте определение удельной теплоты парообразования
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Кипение
Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
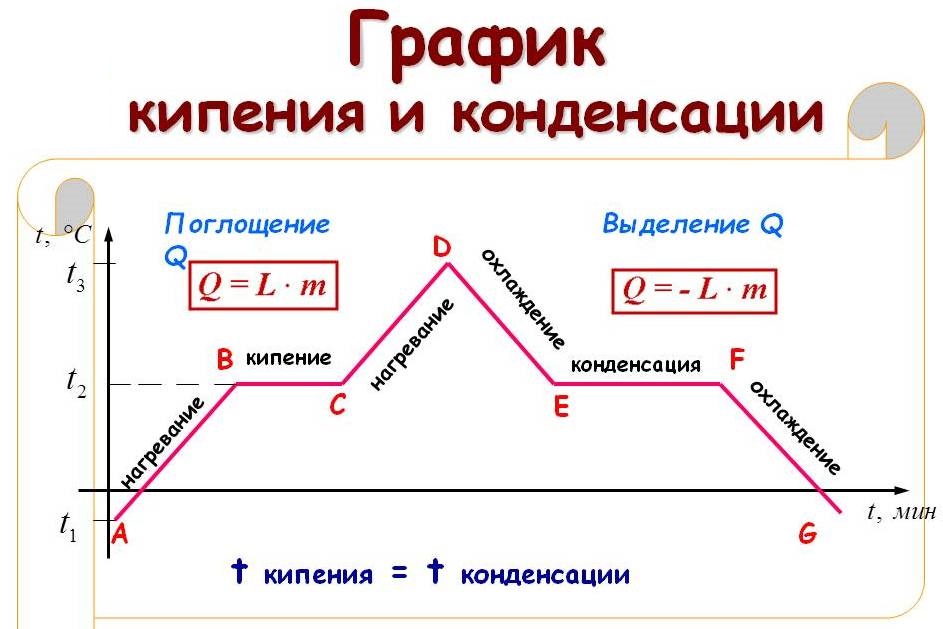
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — [L] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Конспект урока «Кипение. Удельная теплота парообразования».
Удельная теплота парообразования — определение, формулы и способы применения
УТП — численная величина, характеризующая кипение и конденсацию. Она напрямую связана с зависимостью температуры кипения от давления. Необходимо полностью разобраться в особенностях протекания процесса выделения пара, чтобы понять, какой физический смысл имеет удельная теплота парообразования.
Процесс кипения
Кипение — одна из основных разновидностей интенсивного парообразования, происходящего при повышении температуры жидкости. Нагревание происходит не только на поверхности жидкостного вещества, но и внутри него. Выделившаяся теплота распределяется неравномерно:
В результате внутренняя энергия газообразного вещества становится намного больше внутренней энергии жидкости.
Сам процесс кипения представляет собой процедуру перехода жидкостного вещества в пар. Для наглядного описания нагревания вещества и его перехода из первого агрегатного состояния в другое используются графики функций. В течение перехода происходит испарение с преобразованием воздушных пузырьков. Размеры пузырьков определяются их собственной формой и местоположением. Если они образовались на дне сосуда, то их величина и единицы определяются смачиваемостью стенок этой ёмкости. Чем более неоднородна поверхность сосуда, тем больше размер пузырьков воздуха.
При превышении допустимых размеров пузырек начинается лопаться. Во время этого процесса образуются разрывы и завихрения. Жидкость, из которой состоит оболочка воздушного пузырька, направляется внутрь. Столбик жидкости выбрасывается вверх, создавая звуковые волны различной частоты. Они сопровождаются обильным шумом. Этот режим кипения именуется пузырьковым.
А также существует пленочный режим кипения. Он наступает при увеличении тепловых потоков до предельно допустимых значений. Вокруг стенок сосуда образуется сплошной слой пара, представляющий собой непрерывную плёнку. Она не способна проводить большое количество тепла. Вся температура скапливается вокруг неё, из-за чего происходит резкое повышение температуры. Подобный эффект можно наблюдать при попадании капель воды на раскалённую поверхность.
В некоторых случаях жидкость может переходить из одного режима кипения в другой. Это может произойти при резком изменении величины теплового потока, возникающего во время передачи внутренней энергии. Если он превысил критическую отметку, устанавливаемую индивидуально для каждого вещества, то пузырьковый режим образования пара автоматически сменяется на пленочный. Обратный процесс происходит при повторном понижении значений теплового потока. На скорость сменяемости режимов также влияет объём нагреваемой жидкости.
Особенности реакции
Процесс парообразования можно подробно рассмотреть на примере кипения воды. Для проведения опыта понадобится 1 л жидкости комнатной температуры. В самом начале эксперимента вода насыщена кислородом. Нагревание следует производить в чайнике или иной ёмкости похожего строения. Для поддержания кипения воды нужно постоянно подводить теплоту. Выделяют следующие стадии кипения:
Зависимость температуры от давления
Процесс парообразования других жидкостей происходят аналогично кипению воды. Единственным отличием являются разные показатели кипения вещества. Температура кипения прямо пропорциональна давлению (при увеличении давления она становится больше, при уменьшении она автоматически понижается). При решении физических задач градус кипения даётся при стандартном атмосферном давлении.
Зависимость температуры кипения от давления лежит в основе работы скороварок. Это приспособление увеличивает атмосферное давление для более быстрого приготовления. Обратный эффект можно наблюдать в горах. На большой высоте величина давления уменьшается в 2 раза, что затрудняет процедуру приготовления еды для альпинистов.
Различие температур кипения жидкостей активно используется при переработке нефти. В её состав входит огромное количество керосина, бензина, мазута и лигроина. При создании нефтепродуктов необходимо отделить компоненты друг от друга. Для этого сырое вещество начинают нагревать. При достижении температуры кипения одна из жидкостей начинает испаряться. Таким образом, отделив лишние элементы, можно сделать состав нефти однородным.
Процесс конденсации
При конденсации газообразное вещество переходит в жидкое состояние. Это явление возникает при условии, что температура вещества ниже температуры кипения. Во время конденсации выделяется столько же энергии, сколько и во время испарения. Примером этого процесса может служить:
Конденсация также может происходить как в плёночном, так и капельном виде. Она способна осуществляться и во время парообразования жидкости. Частицы пара при перемещении над поверхностью жидкости начинают лопаться и возвращаются в жидкое состояние. Если же молекулы пара не вступают в прямой контакт с жидким веществом, то конденсация происходит в результате охлаждения газа в верхних слоях атмосферы.
Капли конденсата начинают объединяться в небольшие скопления. Примером подобного явления является процесс образования облаков на небе.
Предназначение и применение
Важнейшей характеристикой процесса кипения и конденсации является удельная ТП. Она показывает количество теплоты, необходимое для превращения 1 кг жидкостного вещества в пар. Эта величина рассчитывается без учёта потерь теплоты. Теплоемкость измеряется путём определения количества теплоты, которое было затрачено за период нагревания жидкости до температуры кипения.
В современной физике она обозначается буквой L (лямбда). Измеряется эта характеристика в Дж/кг. В следующей таблице представлены значения удельной теплоты парообразования для основных жидкостей:
| Наименование вещества | Величина удельной теплоты образования пара Дж/кг | |
| Азот | 198000 | |
| Алюминий | 10900000 | |
| Аммиак | 1370000 | |
| Ацетон | 525000 | |
| Бензол | 394000 | |
| Вода | 225 000 | |
| Водород | 454000 | |
| Гелий | 20600 | |
| Двуокись серы | 390000 | |
| Диметилэфир | 467000 | |
| Диэтилэфир | 384000 | |
| Железо чистое | 6340000 | |
| Золото | 1650000 | |
| Кислород | 213000 | |
| Криптон | 108000 | |
| Медь | 4 790000 | |
| Метан | 510000 | |
| Метиловый спирт | 1 100000 | |
| Неон | 86300 | |
| Никель | 6480000 | |
| Олово | 2450000 | |
| Пентан | 360000 | |
| Пропиловый спирт | 750000 | |
| Ртуть | 285000 | |
| Свинец | 8 600000 | |
| Сера | 290000 | |
| Эфир | 4105 | |
| Углерод | 50000000 | |
| Фосфор | 400000 | |
Удельная теплота преобразования применяется в производственных масштабах. С её помощью происходит создание железных материалов и плавление железа. Когда этот металл находится в жидком состоянии, он обладает кристаллической решёткой. При ее помощи мастер определяет количество теплоты, требуемое для нагревания железа, не влияя на состояние её кристаллической решётки.
В нефтяном секторе также применяется теплота парообразования, характеризующая оборудование для переработки нефти.
В теоретической физике УТП используется преимущественно для решения задач на тепловые явления. Если в условии задания указано, что жидкость достигла своей температуры кипения, то можно найти величину количества теплоты. Согласно формуле, удельная теплота парообразования, умноженная на исходную массу вещества, будет равна количеству теплоты, которое выделилось во время кипения жидкости. В математическом виде формула записывается следующим образом: Q = L * m. Q — количество теплоты (Дж), L — удельная ТП (Дж/кг), m — масса жидкого вещества (кг).
Если в задаче рассматривается процесс конденсации, то для нахождения количества теплоты необходимо применить аналогичную формулу. Ответ записывается с противоположным знаком, но очень часто его не учитывают, указывая лишь модуль полученного числа.
Кипение и удельная теплота парообразования
Жидкость может переходить в парообразное состояние двумя способами – испарением и кипением. Испаряются жидкости во всем температурном диапазоне, в то время, как кипение происходит при строго определенной температуре для каждой конкретной жидкости.
Что такое кипение
Образование пара во всем объеме жидкости называют кипением.
Примечание: Интересен тот факт, что перед началом кипения от чайника с водой доносится специфический шум.
Различия между испарением и кипением
Характерным проявлением кипения может служить образование пузырьков пара внутри жидкости (рис. 1):
На следующем рисунке 2 представлены отличия процессов испарения и кипения подробнее:
Испарение происходит при любой температуре с поверхности, а кипение – только при одной конкретной температуре, но во всем объеме жидкости.
Процессы кипения и конденсации на графиках
Пусть небольшое количество воды находится в просторном закупоренном сосуде.
Разберем, как выглядят на температурных графиках процессы кипения и конденсации. Для начала рассмотрим график нагревания и кипения (рис. 3).
Вначале вода имела температуру +20 градусов Цельсия. Будем нагревать эту воду. Поначалу ее температура будет расти. На графике это показано наклонной синей линией, находящейся в левой части рисунка.
До бесконечности температура подниматься не будет. Как только температура достигнет некоторого предела, вода закипит. Из рисунка следует, когда температура воды достигла отметки +100 градусов Цельсия и начался процесс кипения. Этот процесс на рисунке схематично обозначен горизонтальной красной линией.
Горизонтальное положение линии кипения означает, что во время кипения температура воды не изменяется. Температура будет оставаться неизменной до тех пор, пока вся вода не превратится в газообразное состояние — пар. Для компактности рисунка я укоротил эту линию, на самом деле, длину этой линии нужно увеличить.
Уже после того, как вся вода превратилась в пар, температура пара начала повышаться. Это изображено на рисунке наклонной синей линией, находящейся правее красной линии.
Будем теперь отбирать тепловую энергию у молекул. Предположим, что мы охлаждаем горячий водяной пар, находящийся в закупоренном сосуде. Процессы его охлаждения и конденсации представлены на графике (рис. 4). Этот график можно получить, зеркально отразив вокруг вертикальной оси график, связанный с нагреванием, рассмотренный ранее.
Из графика следует:
Вначале температура пара уменьшается от +180 градусов Цельсия до +100 градусов. Это наклонная синяя линия, расположенная в левой части рисунка.
Затем, происходит конденсация пара. Молекулы пара собираются в капли жидкости. При этом, температура пара не изменяется и остается равной +100 градусам Цельсия.
Как только весь пар конденсируется, образовавшаяся жидкая вода начинает охлаждаться до конечной температуры + 20 градусов Цельсия. На графике охлаждение воды – это синяя наклонная линия, находящаяся справа от красной линии конденсации.
Температура кипения и как ее найти на графике
Чтобы жидкость закипела, ее нужно нагреть до температуры кипения.
На рисунке 5 представлен температурный график нагревания воды. Температуру кипения можно определить по горизонтальной линии, обозначающую процесс кипения. Нужно продолжить эту линию пунктиром по направлению к вертикальной оси температур. Точка, в которой пунктир упрется в ось и будет температурой кипения жидкости.
Температура кипения – это температура, при которой пар образуется во всем объеме жидкости. Такая температура у каждой жидкости своя, ее можно найти в справочнике физики.
Температуры кипения некоторых веществ
Сравним для наглядности значения температуры кипения некоторых веществ.
Нам известно, что температура кипения питьевой воды равна 100 градусам на шкале Цельсия.
При комнатной температуре некоторые вещества пребывают в газообразном состоянии, но при более низких температурах они превращаются в жидкости. Например, кислород превращается в кипящую жидкость при минус 183 градусах Цельсия.
В противоположность этому, вещества, которые мы привыкли видеть твердыми при комнатной температуре, в кипящую жидкость превратятся при более высоких температурах. К примеру, медь станет кипящей жидкостью при 2567 град. Цельсия, а железо – при 2500 град. Цельсия
На рисунке 6 представлен список некоторых веществ и указана температура, при которой эти вещества кипят.
Расширенный список жидкостей и их температуру кипения можно найти в справочнике физики.
Почему температура жидкости при кипении не изменяется
Тепловая энергия, которую получает жидкость во время кипения, тратится на образование пара во всем объеме жидкости. Поэтому во время кипения температура жидкости не изменяется.
Разберем подробнее, что происходит, когда мы сообщаем тепловую энергию какой-либо жидкости.
Получаемая от источника тепловая энергия передается молекулам жидкости. Скорость движения молекул увеличивается, а значит, растет их кинетическая энергия. Чем выше температура, тем быстрее будут двигаться молекулы.
Находясь в жидкости, каждая молекула притягиваются к соседним молекулам. То есть, молекулы удерживаются в жидкости силами притяжения соседних молекул. Если есть взаимодействие молекул – их взаимное притяжение, значит, есть потенциальная энергия такого взаимодействия.
По мере нагревания, энергия движения некоторых молекул увеличится настолько, что они преодолеют притяжение соседних молекул и, покинут жидкость. Чем выше температура, тем большее число молекул сможет покинуть жидкость.
Мы помним, что при испарении жидкость покидают молекулы, находящиеся только на ее поверхности. А во время кипения энергию, достаточную для того, чтобы вылететь из жидкости, получают не только молекулы на поверхности, но и молекулы, находящиеся внутри жидкости.
Примечания:
Как давление влияет на температуру кипения
Мы можем влиять на температуру кипения жидкостей, изменяя давление. Если давление воздуха увеличить, то температура кипения, так же, возрастет. К примеру, вода при давлении 220 атмосфер (это 21,6 миллионов Паскалей) закипит только тогда, когда ее температура поднимется до 370 градусов Цельсия.
А уменьшая давление, мы наоборот, температуру кипения жидкостей понизим. Именно из-за пониженного давления, температура кипения воды в высокогорных районах ниже, чем, на равнинной местности, которая ближе к уровню мирового океана. В горах вода закипает при температуре 90 градусов Цельсия. Из-за этого, некоторые продукты высоко в горах сварить не получится.
Чем выше давление, тем выше температура кипения жидкости. Уменьшив давление, мы понизим температуру кипения.
Что такое удельная теплота парообразования
Возьмем какую-либо жидкость массой 1 кг, предварительно нагретую до температуры кипения. Будем сообщать ей тепловую энергию, чтобы испарить эту жидкость полностью.
Та энергия (теплота), которую мы затратим, чтобы испарить с помощью кипения 1 кг жидкости, называется удельной теплотой парообразования. Удельной величиной эту теплоту называют потому, что она приходится на 1 кг жидкости.
Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
\(\large L \left( \frac<\text<Дж>><\text<кг>>\right)\) – удельная теплота парообразования (конденсации).
На рисунке 7 представлена таблица, в которой содержится удельная теплота парообразования (конденсации) при температуре кипения для некоторых жидкостей и металлов в расплавленном состоянии.
Что происходит с энергией во время кипения и конденсации
Кипение: жидкость получает тепловую энергию (количество теплоты), из нее вырываются молекулы. Полученная энергия тратится на преодоление притяжения соседних молекул и на расширение образовавшегося пара.
Конденсация: молекулы пара отдают тепловую энергию в окружающее пространство, собираясь в капельки — превращаясь в жидкость.
Выполняется закон сохранения энергии. Именно поэтому теплота парообразования и теплота конденсации совпадают. Процессы кипения и конденсации протекают при одной и той же температуре. Различие кроется в том, что кипение происходит с поглощением энергии, а конденсация связана с выделением энергии.
Как удельная теплота парообразования связана с количеством теплоты — формула
Пусть жидкость предварительно нагрета до температуры кипения, и нам известны:
Мы можем посчитать общее количество теплоты, требуемое для перевода всей жидкости в пар. Расчеты нужно вести по формуле:
\(\large m \left( \text <кг>\right) \) – масса вещества;
\(\large L \left( \frac<\text<Дж>><\text<кг>> \right) \) – удельная теплота парообразования (конденсации);
\(\large Q \left( \text <Дж>\right) \) – количество теплоты, поглощенное жидкостью во время кипения, т. е. общая тепловая энергия для перевода всей жидкости в пар;
Формулу можно применять так же, чтобы рассчитать количество теплоты, выделяемое в окружающую среду молекулами пара при их конденсации.
Для процесса конденсации величина \(\large Q \) – это количество теплоты, выделенное молекулами пара в окружающую среду;
Чем удельная теплота парообразования отличается от количества теплоты
Отличия удельной теплоты парообразования от количества теплоты, приведены на рисунке 8:
В любом случае, жидкость предварительно нужно нагреть до температуры кипения.
Количество теплоты – это энергия, необходимая для конденсации или образования пара при температуре кипения для нескольких килограммов жидкости.
Удельная теплота парообразования – это энергия, необходимая для перевода в пар 1-го килограмма жидкости.