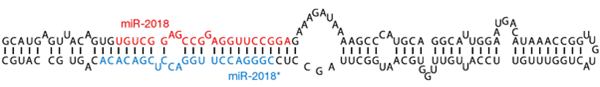какие виды рнк присутствуют в клетках
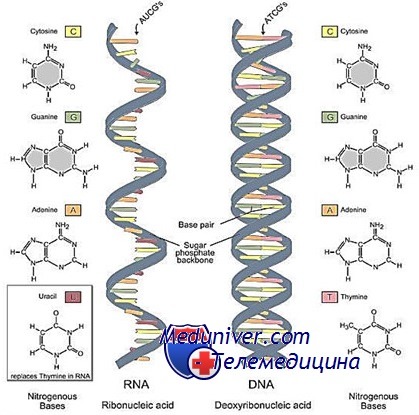
Какие виды рнк присутствуют в клетках
ГяРНК свойственна исключительно эукариотам, её нет у прокариот («доядерные» организмы, например бактерии и вирусы). Некоторые вирусы для хранения и передачи генетической информации следующим поколениям используют РНК вместо ДНК.
ГяРНК и её производное — информационная (или матричная) РНК переносят генетическую информацию от ядерной ДНК к цитоплазме.
Количество видов гяРНК равно количеству генов, так как она служит прямой копией кодирующих последовательностей генома. В процессе транскрипции РНК с ДНК ключевую роль играет фермент РНК-полимераза II. Информационная РНК образуется в результате процессинга гяРНК, при котором происходят вырезание некодирующих участков (интронов) и склеивание кодирующих экзонов. Таким образом, в состав иРНК входят кодирующая информация соответствующих видов гяРНК, а также фланкирующий лидерный и трейлерный участки, по этой причине она значительно короче.
Транспортная РНК
Каждая молекула тРНК состоит примерно из 75 связанных между собой нуклеотидов, образующих длинную цепь. В результате взаимодействия входящих в её состав оснований тРНК имеет конформационную структуру «клеверный лист», который затем скручивается в L-форму. Очень часто в состав тРНК помимо Ц, Г, А и У входит ряд редких оснований, некоторые из которых модифицированы путём метилирования. Важная особенность тРНК: «заряженная» молекула несёт на своём 3′-конце аминокислоту, а посередине конформационной структуры «клеверный лист» находятся три специфических основания, именуемые антикодоном. Последовательность оснований в антикодоне напрямую зависит от вида аминокислоты, прикреплённой к 3′-концу.
Так, например, тРНК, антикодон которой имеет последовательность 5′-ЦЦА-3′, может нести только аминокислоту триптофан. Следует отметить, что данная зависимость лежит в основе передачи генетической информации, носителем которой выступает тРНК.
Транскрипция молекул тРНК происходит с кодирующих её последовательностей в ДНК при участии фермента РНК-полимеразы III. Различают более 40 семейств тРНК, которые, в свою очередь, подразделяют на несколько видов.
Рибосомальная РНК
Существует несколько субъединиц рРНК, которые различаются по коэффициенту седиментации (осаждения), измеряемому в единицах Сведберга (S). Данный коэффициент зависит от скорости осаждения субъединиц при центрифугировании в насыщенной водной среде.
Каждая рибосома состоит из большой и малой субъединиц. Они содержат большое количество белков, синтезированных посредством трансляции иРНК, а также РНК, которая не подвергается трансляции. Термин «рибосомальная РНК» относят именно к нетранслируемому материалу. В малой субъединице находится 18S рРНК, а в большой — 4S, 5,8S и 28S рРНК.
Траскрипция рРНК с ДНК происходит при помощи двух дополнительных РНК-полимераз. РНК-полимераза I транскрибирует 5S, 5,8S и 28S в виде одного длинного 45S-тpaнскрипта, который затем разделяется на необходимые части. Таким образом обеспечивается равное количество молекул. В организме человека в каждом гаплоидном геноме присутствует примерно 250 копий последовательности ДНК, кодирующей 45S-транскрипт. Они расположены в пяти кластерных тандемных повторах в коротких плечах хромосом 13, 14, 15, 21 и 22.
Данные участки известны как ядрышковые организаторы, так как их транскрипция и последующий процессинг 45S-транскрипта происходят внутри ядрышка.
Не менее чем в трёх кластерах хромосомы 1 существует 2000 копий 5S-pPHK гена. Их транскрипция протекает в присутствии РНК-полимеразы III снаружи ядрышка. Затем они доставляются к местам сборки рибосом при помощи рибосомальных белков.
В рРНК насчитывают около 95 псевдоуридиновых участков, образованных посредством изомеризации уридина малой ядрышковой РНК.
Малая ядрышковая РНК. Малая (низкомолекулярная) ядрышковая РНК в основном участвует в направлении или проведении модификаций оснований в рРНК и малой ядерной РНК, таких, как, например, метилирование и псевдоуридинизация. Большинство малых ядрышковых РНК находятся в интронах других генов.
Сигналраспознающая РНК. Сигналраспознающая РНК распознаёт сигнальную последовательность белков, предназначенных для экспрессии, и участвует в их переносе через цитоплазматическую мембрану.
Микро-РНК. Существует примерно 200 микро-РНК человека длиной в 22 основания, производных расщепления рибонуклеазой Н их предшественников (двухцепочечных «зашпиленных» РНК) в соответствии с инвертированными повторами. Они контролируют трансляцию структурных генов путём комплементарного связывания с З’-концами нетранслируемых участков иРНК.
Митохондриальная РНК
Митохондриальная ДНК представляет собой непрерывную петлю и кодирует 13 полипептидов, 22 тРНК и 2 рРНК (16S и 23S). Большинство генов находятся на одной (тяжёлой) цепи, однако некоторое их количество расположено и на комплементарной ей лёгкой. При этом обе цепи транскрибируются в виде непрерывных транскриптов при помощи митохондриоспецифической РНК-полимеразы. Данный фермент кодируется ядерным геном. Длинные молекулы РНК затем расщепляются на 37 отдельных видов, а мРНК, рРНК и тРНК совместно транслируют 13 мРНК. Большое количество дополнительных белков, которые поступают в митохондрию из цитоплазмы, транслируются с ядерных генов.
У пациентов с системной красной волчанкой обнаруживают антитела к снурп-белкам собственного организма. Кроме того, считают, что определённый набор генов малой ядерной РНК хромосомы 15q играет важную роль в патогенезе синдрома Прадера—Вилли (наследственное сочетание олигофрении, низкого роста, ожирения, гипотонии мышц).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биоинформатика в мире РНК-структур
Понимание, как формируется пространственная конфигурация РНК, необходимо для разработки методов предсказания вторичных структур молекул и определения выполняемых ими функций в клетке живых организмов
рисунок А.В. Головина
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Амбициозный проект «Геном человека», завершившийся в 2003 году, был призван расшифровать всю ДНК, содержащуюся в человеческом геноме. Считалось, что проект поможет понять, как функционируют гены, каким образом они определяют состояние клетки и организма человека в целом, а также даст толчок развитию медицины и биологических наук. Однако исследования показали, что вся сложность клетки как целостной системы не сводится к одному лишь геному. Функционирование и роль молекулы РНК в регуляции клеточных процессов во многом зависят от ее пространственной организации, изучение которой — сложная задача, справиться с которой под силу только биоинформатике.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Вторичная структура РНК
У прокариот процесс транскрипции и трансляции обычно сопряжен в пространстве и во времени. — Ред.
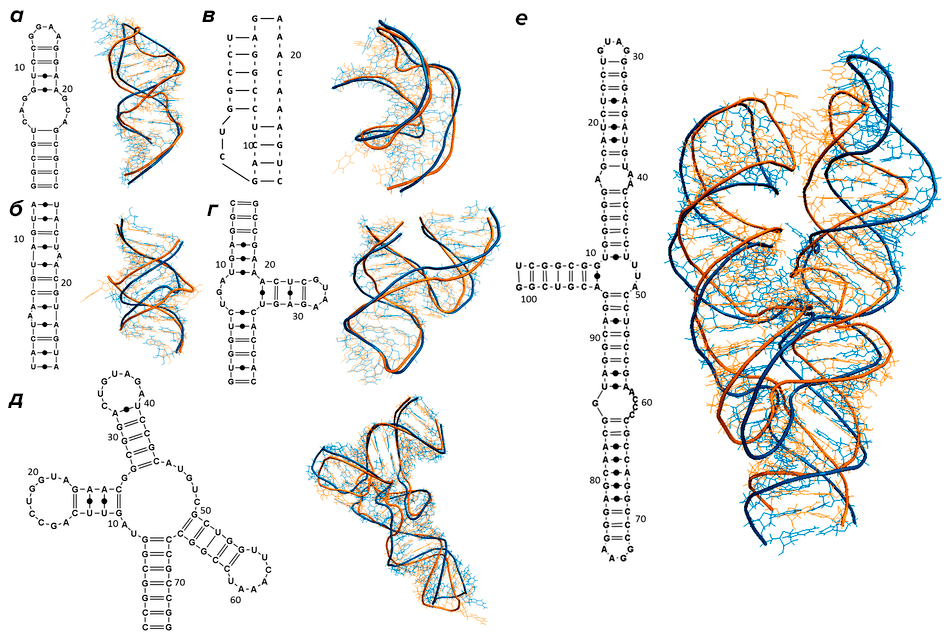
Дело в том, что РНК, подобно белковым молекулам [4], не существуют в виде простой цепочки. Нуклеотиды РНК взаимодействуют друг с другом, объединяясь в пары по принципу комплементарности, в результате чего молекула нуклеиновой кислоты приобретает причудливую конфигурацию: возникают петли, шпильки, псевдоузлы и другие формы (рис. 1). Если первичная структура — это просто последовательность нуклеотидов, то подобные образования относятся к вторичной структуре. И этот уровень организации молекулы также несет информацию, которая используется в регуляции таких процессов, как транскрипция ДНК, сплайсинг РНК, изменение активности генов с помощью микроРНК, а также транспорт транскриптов в определенные области клетки [5].
Рисунок 1. Разнообразие вторичных структур РНК: а — шпилька с внутренней петлей; б — дуплекс с двумя выступами; в — псевдоузел; г — молотовидный рибозим (hammerhead ribozyme) PDB: 1NYI; д — тРНК PDB: 1J1U; е — РНК из белок-РНКовго комплекса, узнающего и осуществляющего доставку на мембрану синтезируемых на рибосоме мембранных белков (SRP RNA) PDB: 1Z43. Справа от каждой структуры показана ее 3D-модель: предсказанные с помощью вычислительных методов (синий цвет) и полученные экспериментально (желтый цвет).
Вторичная структура также влияет на взаимодействие РНК с молекулами, например, со специфическими белками RBP (RNA binding proteins). Они связываются с РНК с образованием рибонуклеопротеиновых комплексов и регулируют сплайсинг, трансляцию и другие процессы. Если участок связывания «закрыт» петлей, белок не сможет провзаимодействовать с молекулой [6]. Роль вторичной структуры можно также проиллюстрировать воздействием мутаций. В работе Мэтью Халворсена (Matthew Halvorsen), опубликованной в журнале PLoS Genetics в 2010 году, изучались мутации, связанные с заболеваниями человека и находящиеся в регуляторных участках РНК, называемых 5′- и 3′-нетранслируемыми областями. Эти области отвечают за регуляцию процесса трансляции, деградацию РНК, участвуют в РНК-интерференции и при этом сильно структурированы. Мутации могут вызвать серьезные структурные перестройки, что становится причиной таких заболеваний, как наследственный синдром гиперферритинемии-катаракты, ретинобластома или гипертензия [7].
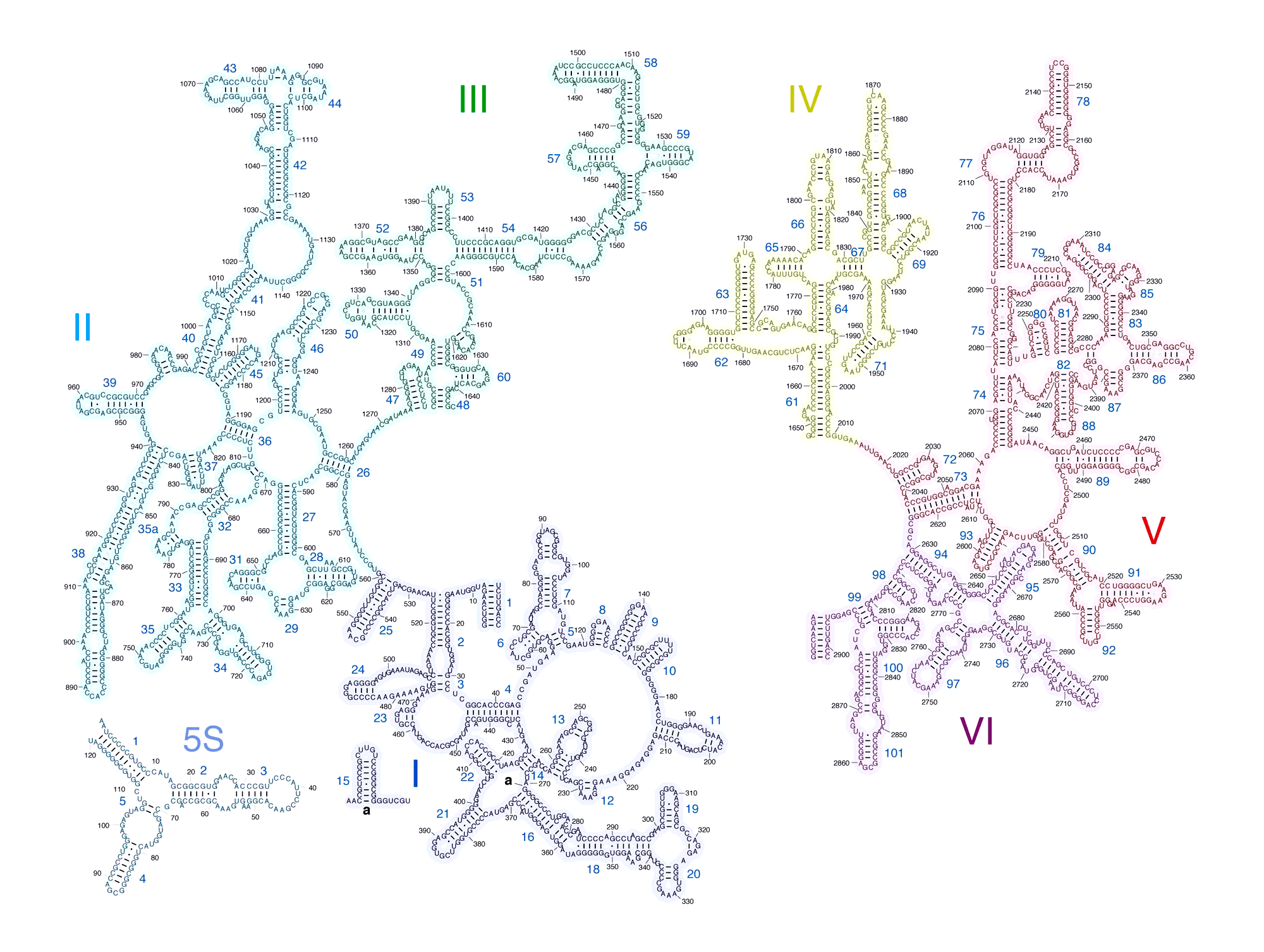
Рисунок 2. Вторичная структура РНК большой рибосомной субъединицы Escherichia coli
При наличии определенных факторов конфигурация РНК может изменяться, что, в свою очередь, влияет на регуляцию генов. Один из лучших примеров специфичности и динамичности вторичной структуры — РНК-переключатели (riboswitch), имеющиеся в клетках бактерий, дрожжей, водорослей и высших растений. Это участки мРНК, которые способны получать информацию о внутриклеточных условиях, связываясь с лигандами. Обычно РНК-переключатели состоят из двух доменов — аптамера, который взаимодействует с лигандами, и домена экспрессии. Как только лиганд (аминокислота, нуклеотиды, ионы металлов) связывается с аптамером, происходят изменения во вторичной структуре примыкающего к аптамеру домена экспрессии, что имеет значение для дальнейшей судьбы мРНК. Например, возникновение шпилек может воспрепятствовать транскрипции или синтезу белка в рибосомах [5]. Структура аптамера, подобно устройству дверного замка, подходит только определенному лиганду, который играет роль ключа
РНК-структуромика
Весь клеточный набор вторичных РНК-структур называется «РНК-струтурóмом» (по аналогии с генóмом или транскриптóмом) [2]. Исследование структурома позволяет ученым понять, как определенные разновидности (мотивы) укладки молекул РНК связаны с участием в различных клеточных процессах, таких как транскрипция, сплайсинг, локализация в клетке, трансляция и регуляция транскриптов. Здесь ученые сталкиваются с определенными проблемами. Недостаточно высокая эффективность методов изучения структуры РНК и сложность получения длинных фрагментов РНК — существенные препятствия на пути к полному описанию структурома. Однако буквально за последние годы технологии секвенирования совершили огромный скачок в развитии. Появились инструменты секвенирования нового поколения, которые позволяют с высокой точностью и относительно быстро определить последовательности ДНК и РНК. Очень важно также использование вычислительных методов, которые сильно продвинулись в своей способности точно предсказывать структуру РНК. При этом все же золотым стандартом определения структуры РНК был и остается эксперимент [5].
Исследования с использованием компьютерных методов привели ко многим открытиям. Например, транспортные РНК обладают структурными особенностями, которые соответствуют их функциям. Для поиска тРНК существуют различные инструменты, например, программа tRNAscan-SE, написанная на популярном среди биоинформатиков языке Perl. Она занимается поиском «подозрительных» участков в геноме, которые могут кодировать тРНК. После тщательного «просеивания» этих участков, остаются гены, которые являются истинными тРНК с вероятностью в 99–100%. Программа ориентируется не только на последовательность нуклеотидов, которая может различаться у разных тРНК, но также на вторичную структуру, являющейся общей для всех тРНК и напоминающей лист клевера. Кроме этого, tRNAscan-SE сравнивает гены-кандидатов с последовательностью, структура которой известна. Если гены-кандидаты формируют такую же структуру, значит они с высокой вероятностью являются тРНК [8].
Естественный отбор имеет значение
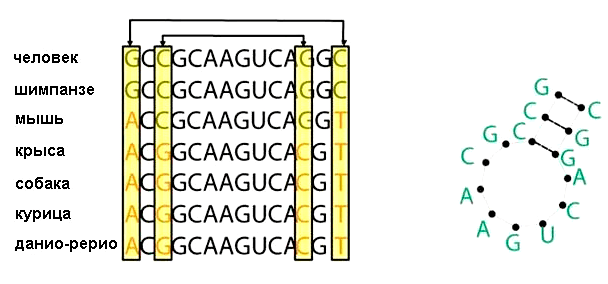
Как узнать, что на данной последовательности образуется структура? Для этого нужно, чтобы замена нуклеотида на одном участке последовательности обязательно сопровождалась компенсаторной заменой нуклеотида на другом участке последовательности [9]. Это значит, что оба нуклеотида участвуют в формировании структуры, к примеру, образуя пару G—C или A—U. Структура сохранится, если пара G—C заменится на пару A—U или наоборот. Когда в распоряжении есть достаточное количество гомологов, то, исходя из расположения многих консервативных пар, можно вывести вторичную структуру РНК (рис. 3).
Рисунок 3. Консервативность пар оснований в гомологичных последовательностях является основой для предсказания вторичной структуры. Стрелочками указаны взаимодействующие друг с другом нуклеотиды, которые могут быть различными в ряду последовательностей, однако сохраняющие конфигурацию молекулы (справа).
Вездесущая термодинамика
Когда в распоряжении исследователя имеется не ряд гомологов, а только одна последовательность, имеет смысл воспользоваться термодинамическим моделированием. Предполагается, что молекула РНК правильной структуры находится в состоянии термодинамического равновесия [10]. На основе энергетических параметров данной молекулы, полученных экспериментально, строятся всевозможные конфигурации вторичной структуры. Среди них ищут наиболее устойчивую, которая и будет правильным решением. Для коротких цепочек, длиной менее 700 пар оснований, данный метод корректно определяет структуру для 70% пар. Однако если цепочка длиннее, точность падает вплоть до 20%. Альтернативный подход — использование алгоритмов, основанных на вероятностном моделировании, — к сожалению, сильно уступает термодинамическим методам. Другая возможная стратегия — объединение термодинамического моделирования и машинного обучения [11]. Также с помощью PARS-метода можно выяснить, какие нуклеотиды являются непарными, чтобы исключить их из алгоритма и улучшить точность предсказания.
В методах предсказания вторичной структуры существуют существенные ограничения. Конформационные изменения РНК-переключателей в результате взаимодействия с лигандом настолько сложно смоделировать, что существующие алгоритмы оказываются бесполезными. Также большие трудности вызывает предсказание псевдоузлов, состоящих из двух совмещенных особым образом шпилек (рис. 1). Псевдоузлы встречаются в рРНК, тРНК, а также в геномах вирусных РНК, где они участвуют в процессах трансляции [12]. Для их поиска разрабатывают специальные методы, которые ориентированы на отдельные типы псевдоузлов. Однако с увеличением длины последовательности экспоненциально растет время, затрачиваемое алгоритмом на решение данной задачи. В этих условиях эксперимент становится необходим, позволяя ученым улучшить существующие алгоритмы и разработать новые стратегии поиска.
В игру вступает параллельное секвенирование
В параллельном анализе структуры РНК (или PARS-методе) применяются инструменты секвенирования нового поколения, которые позволяют получить миллионы расшифрованных последовательностей за один единственный эксперимент. Сначала образцам РНК позволяют свернуться с образованием вторичной структуры, затем их подвергают воздействию рибонуклеаз — ферментов, катализирующих расщепление связи между нуклеотидами. В PARS-методе используют два типа рибонуклеаз — V1 и S1. Первая расщепляет спаренные участки, вторая — простую цепь. Полученные фрагменты конвертируют в ДНК и секвенируют. Те фрагменты, которые были обработаны V1, в большинстве случаев обрываются на том нуклеотиде, который участвовал в образовании вторичной структуры. Сравнение большого числа копий одной РНК, позволяет судить об интенсивности расщепления на определенных участках молекулы и определить, формируется ли на этом участке вторичная структура [5].
С помощью PARS в 2010 году Кертес и его коллеги изучили вторичную структуру транскриптома дрожжей, проанализировав приблизительно 4,2 миллиона нуклеотидов в 3 тысячах транскриптов. Ими были обнаружены регуляторные мотивы, например, участок внутренней посадки рибосомы URE2, который позволяет начать синтез белка не с одного из концов мРНК, а с середины молекулы. Это исследование, опубликованное в журнале Nature [13], показало, что PARS-метод способен пролить свет на глобальную структурную организацию мРНК. Было открыто преимущественное расположение вторичных структур в кодирующих участках по сравнению с нетранслируемыми областями, а также их роль в регуляции процесса трансляции, который протекает тем активнее, чем менее структурирован сайт инициации трансляции. Объединение параллельного анализа с программными средствами предсказания конфигурации, а также термодинамическим моделированием, дает в руки ученых мощный инструмент для более глубокого постижения мира РНК-структур, что способствует появлению новых гипотез и открытий, касающихся регуляции клеточных процессов.
Стóит отметить, что данный метод дает весьма приблизительную и косвенную информацию о вторичной структуре РНК. На данный момент разработаны более «продвинутые» экспериментальные методики, основанные на химической модификации неспаренных нуклеотидов и позволяющие получать данные более высокого разрешения (напр. SHAPE). — Ред.
Самая большая РНК-лаборатория в мире
Моделирование вторичной структуры РНК, несмотря на большое количество методов, до сих пор остается сложной задачей. Не все принципы известны, а экспериментальные данные настолько обширны, что на анализ, который проводят небольшие группы ученых, уходит много труда и времени. Чтобы решить эту проблему, в университете Карнеги-Меллон и Стэнфордском университете разработали краудсорсинговый проект EteRNA.
В последние годы все больше серьезных научных проектов идут «в народ» в форме онлайн-игр. Такое явление получило название «гражданской науки». Примером аналогичной инициативы служит аркадная игра FoldIt, нацеленная на предсказание строения белковых молекул: «Тетрис XXI века» [14]. — Ред.
Концепция «мусорной ДНК» неоднократно сильно менялась: лет 10 назад бытовало мнение, что ДНК «активна лишь на 10%», а всё остальное является бесполезным кладбищем генов. В последнее время эти воззрения сильно модифицировались, в который раз подтверждая, что не все так просто: «Сколько сора в нашей ДНК» [16]. — Ред.
Обо всех РНК на свете, больших и малых
Метафора, лежащая в основе названия явления РНК-интерференции, отсылает к опыту с петунией, когда искусственно введённые в растение гены синтетазы розового и фиолетового пигментов не увеличили интенсивность окраски, а, наоборот, уменьшили её. Аналогично, в «обычной» интерференции наложение двух волн может приводить к взаимному «гашению».
Автор
Редакторы
Ещё двадцать лет назад молекулярная биология не знала такого удивительного феномена, как РНК-интерференция. Сегодня же у учёных не вызывает сомнения, что это явление принимает участие в широчайшем спектре физиологических процессов у всех живых существ, а её молекулярные посредники — короткие РНК — по разнообразию и специфичности не уступают антителам крови. У простейших РНК-интерференция обеспечивает иммунитет, в частности — защиту от вирусов. У более развитых организмов этот механизм включается в борьбу не только (и не столько) с внешними, но и с внутригеномными паразитами, а также становится важнейшим регулятором активности генов. На сегодняшний день идентифицированы уже тысячи коротких регуляторных РНК, а механизм РНК-интерференции изучен очень подробно, однако бесспорно и то, что мы наблюдаем пока только верхушку этого айсберга.
В живой клетке поток информации между ядром и цитоплазмой никогда не иссякает, однако понимание всех его «завихрений» и расшифровка закодированной в нём информации — воистину титаническая задача. Одним из важнейших рывков в биологии прошлого века можно считать открытие молекул информационных (или матричных) РНК (иРНК или мРНК), которые служат посредниками, переносящими информационные «сообщения» из ядра (с хромосом) в цитоплазму. Определяющая роль РНК в синтезе белков была предсказана ещё в 1939 году в работе Торбьёрна Касперссона (Torbjörn Caspersson), Жана Брачета (Jean Brachet) и Джека Шульца (Jack Schultz), а в 1971 году Джордж Марбайс (George Marbaix) запустил синтез гемоглобина в ооцитах лягушки, сделав инъекцию впервые выделенной матричной РНК кролика, кодирующей этот белок [1].
В 1956–1957 годах в Советском Союзе А. Н. Белозерский и А. С. Спирин независимо доказали существование мРНК, а также выяснили, что основную массу РНК в клетке составляет отнюдь не матричная, а рибосомальная РНК (рРНК). Рибосомальная РНК — второй «главный» вид клеточной РНК — образует «скелет» и функциональный центр рибосом у всех организмов; именно рРНК (а не белки) регулирует основные этапы белкового синтеза. Одновременно был описан и изучен и третий «главный» вид РНК — транспортные РНК (тРНК), которые в комплексе с двумя другими — мРНК и рРНК — формируют единый белок-синтезирующий комплекс. Согласно достаточно популярной гипотезе «мира РНК», именно эта нуклеиновая кислота лежала у самых истоков жизни на Земле [2].
В связи с тем, что РНК значительно более гидрофильна по сравнению с ДНК (за счет замены дезоксирибозы на рибозу), она более лабильна и может относительно свободно перемещаться в клетке, а значит и доставлять короткоживущие реплики генетической информации (мРНК) к месту, где начинается белковый синтез. Однако стоит отметить и связанное с этим «неудобство» — РНК очень нестабильна. Она намного хуже, чем ДНК, хранится (даже внутри клетки) и деградирует при малейшей перемене условий (температура, рН). Кроме «собственной» нестабильности, большой вклад принадлежит рибонуклеазам (или РНКазам) — классу расщепляющих РНК ферментов, очень стабильных и «вездесущих» — даже кожа рук экспериментатора содержит достаточное количество этих ферментов, чтобы перечеркнуть весь эксперимент. Из-за этого работать с РНК намного сложнее, чем с белками или ДНК — последняя вообще может храниться сотни тысяч лет практически без повреждений [3].
Фантастическая аккуратность при работе, тридисстилят, стерильные перчатки, одноразовая лабораторная посуда — всё это необходимо для предотвращения деградации РНК, однако соблюдение таких стандартов не всегда было возможным. Поэтому долгое время на короткие «обломки» РНК, неизбежно загрязнявшие растворы, попросту не обращали внимания. Однако со временем стало ясно, что, несмотря на все усилия по поддержанию стерильности рабочей области, «обломки» закономерно продолжали обнаруживаться, а потом выяснилось, что в цитоплазме всегда присутствуют тысячи коротких двуцепочечных РНК, выполняющих вполне определённые функции, и абсолютно необходимых для нормального развития клетки и организма.
Принцип РНК-интерференции
Сегодня изучение малых регуляторных РНК является одной из наиболее бурно развивающихся областей молекулярной биологии. Обнаружено, что все короткие РНК выполняют свои функции на основе явления, названного РНК-интерференцией (суть этого феномена заключается в подавлении экспрессии гена на стадии транскрипции или трансляции при активном участии малых молекул РНК). Очень схематично механизм РНК-интерференции показан на врезке «Основы РНК-интерференции».
Основы РНК-интерференции
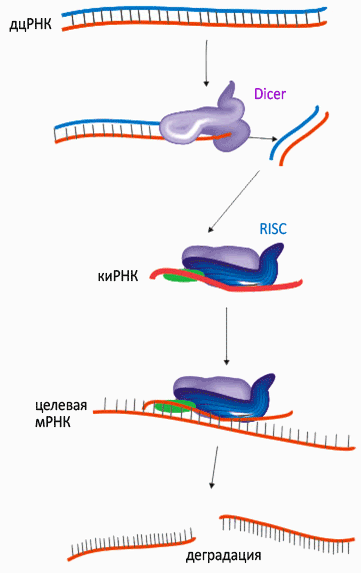
Рисунок 1. РНК-интерференция
Двуцепочечные молекулы РНК (дцРНК) нехарактерны для нормальных клеток, но они являются обязательным этапом жизненного цикла многих вирусов (рис. 1). Специальный белок Dicer, обнаружив в клетке дцРНК, «режет» её на небольшие фрагменты. Антисмысловая цепь такого фрагмента, которую уже можно называть короткой интерферирующей РНК (киРНК, от siRNA — small interference RNA), связывается комплексом белков под названием RISC (RNA-induced silencing complex), центральный элемент которого — эндонуклеаза семейства Argonaute. Связывание с киРНК активирует RISC и запускает в клетке поиск молекул ДНК и РНК, комплементарных «шаблонной» киРНК. Судьба таких молекул — быть уничтоженными или инактивированными комплексом RISC.
Подытоживая, короткие «обрезки» чужеродной (в том числе, введённой намеренно) двуцепочечной РНК служат «шаблоном» для широкомасштабного поиска и уничтожения комплементарных мРНК (а это эквивалентно подавлению экспрессии соответствующего гена), — причем, не только в одной клетке, но и в соседних. Для многих организмов — простейших, моллюсков, червей, насекомых, растений — этот феномен является одним из основных способов иммунной защиты против инфекций.
В 2006 году Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) получают Нобелевскую премию по физиологии и медицине «За открытие явления РНК-интерференции — механизма сайленсинга генов при участии дцРНК». Хотя сам феномен РНК-интерференции был описан задолго до того (ещё в начале 80-х), именно работы Файера и Мелло в общих чертах определили регуляторный механизм малых РНК [4] и обрисовали неведомую до той поры область молекулярных исследований. Вот основные результаты их работ:
Эти результаты заложили фундамент целому направлению современной молекулярной биологии — РНК-интерференции — и определили вектор работы множества исследовательских групп по всему миру не на один десяток лет. К текущему моменту обнаружено три большие группы малых РНК, которые играют на молекулярном поле за «команду РНК-интерференции». Познакомимся с ними подробнее.
Игрок № 1 — короткие интерферирующие РНК
Специфичность РНК-интерференции определяется короткими интерферирующими РНК (киРНК) — небольшими двуцепочечными молекулами РНК с чётко определённой структурой (см. врезку 2). киРНК эволюционно наиболее ранние, и распространены шире всего у растений, одноклеточных организмов и беспозвоночных [5]. У позвоночных в норме киРНК практически не обнаружены, потому что их вытеснили более поздние «модели» коротких РНК (см. далее).
Короткие интерферирующие РНК
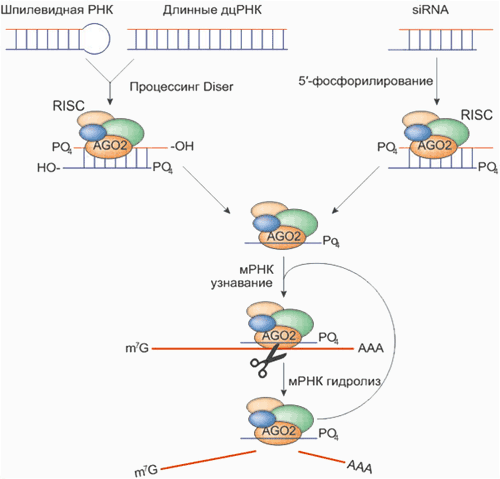
киРНК — «шаблоны» для поиска в цитоплазме и уничтожения молекул мРНК — имеют длину 20–25 нуклеотидов и «особую примету»: по 2 неспаренных нуклеотида на 3′-концах и фосфорилированные 5′-концы. Анти-смысловая киРНК способна (не сама, конечно, а с помощью RISC-комплекса) распознавать мРНК и специфически вызывать её деградацию (рис. 2): разрез целевой мРНК всегда происходит точно в месте, комплементарном 10 и 11 нуклеотидам анти-смысловой цепи киРНК. Пример киРНК (к последовательности гена фермента люциферазы из клеток светлячка):
| Мишень (мРНК) | –AТCGUACGCGG*AAUACUUCGAUU– |
| Смысловая киРНК | CGUACGCGG AAUACUUCGAUU-3′ |
| Анти-смысловая киРНК | 3′-UUGCAUGCGCC*UUAUGAAGCU-5′ |
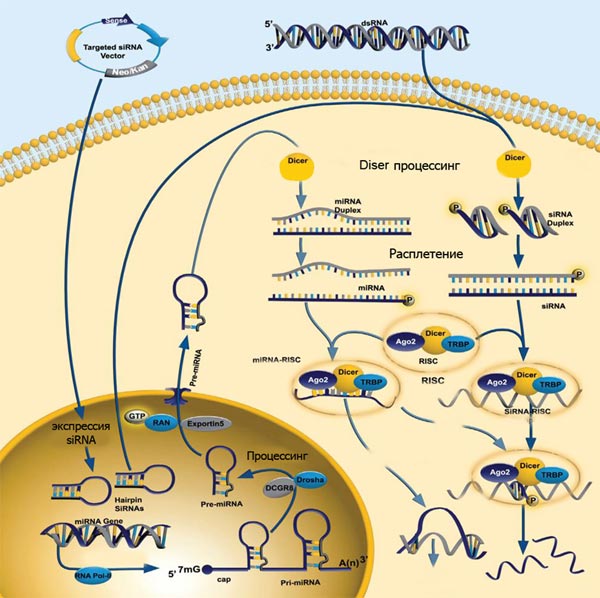
Рисунок 2. Механизм «интерференции» мРНК и киРНК. «Интерферирующие» короткие молекулы РНК могут как попадать в клетку извне, так и «нарезаться» уже на месте из более длинных двуцепочечных РНК. Основной белок, необходимый для «нарезания» дцРНК, — эндонуклеаза Dicer. «Выключение» гена по механизму интерференции осуществляется киРНК совместно с белковым комплексом RISC, который состоит из трёх белков — эндонуклеазы Ago2 и двух вспомогательных белков PACT и TRBP. Позже было обнаружено, что комплексы Dicer и RISC могут использовать в качестве «затравки» не только дцРНК, но и одноцепочечную РНК, формирующую двуцепочечную шпильку, а также готовую киРНК (последняя минует стадию «нарезания» и сразу связывается с RISC).
Функции киРНК в клетках беспозвоночных достаточно разнообразны. Первая и основная — это иммунная защита. «Традиционная» иммунная система (лимфоциты + лейкоциты + макрофаги) присутствует лишь у сложных многоклеточных организмов. У одноклеточных же, беспозвоночных и растений (у которых такой системы либо нет, либо она находится в зачаточном состоянии) иммунная защита строится на основе РНК-интерференции. Иммунитет, основанный на РНК-интерференции, не нуждается в сложных органах «тренировки» предшественников иммунных клеток (селезенка, тимус); в то же время, многообразие теоретически возможных последовательностей коротких РНК (4 21 вариантов) соотносимо с числом возможных белковых антител высших животных. Кроме того, киРНК синтезируются на основе инфицировавшей клетку «враждебной» РНК, а значит, в отличие от антител, они сразу «затачиваются» под конкретный тип инфекции. И хотя вне клетки защита на основе РНК-интерференции не работает (по крайней мере, таких данных пока нет), внутриклеточный иммунитет она обеспечивает более чем удовлетворительно.
Прежде всего, киРНК создаёт антивирусный иммунитет, уничтожая мРНК или геномную РНК инфекционных организмов (например, так киРНК и были открыты у растений [6]). Введение вирусной РНК вызывает мощную амплификацию специфических киРНК на основе молекулы-затравки — самой вирусной РНК. Кроме того, киРНК подавляют экспрессию различных мобильных генетических элементов (МГЭ), а значит, обеспечивает защиту и от эндогенных «инфекций». Мутации в генах RISC-комплекса часто ведут к повышению нестабильности генома из-за высокой активности МГЭ; киРНК может быть ограничителем экспрессии собственных генов, срабатывая в ответ на их гиперэкспрессию. Регуляция работы генов может происходить не только на уровне трансляции, но и во время транскрипции — через метилирование генов по гистону Н3.
В современной экспериментальной биологии значение РНК-интерференции и коротких РНК трудно переоценить. Разработана технология «выключения» (или нокдауна) отдельных генов in vitro (на культурах клеток) и in vivo (на эмбрионах), что уже стало стандартом de facto при изучении любого гена. Иногда даже, чтобы установить роль отдельных генов в каком-нибудь процессе, проводят систематическое «выключение» всех генов по очереди [7].
Возможностью применения киРНК заинтересовались и фармацевты, поскольку способность направленной регуляции работы отдельных генов сулит неслыханные перспективы в лечении массы заболеваний. Небольшой размер и высокая специфичность действия обещают высокую эффективность и низкую токсичность лекарств на основе киРНК; однако решить проблему доставки киРНК к больным клеткам в организме пока не удалось — виной тому хрупкость и недолговечность этих молекул. И хотя сейчас десятки коллективов пытаются найти способ направлять эти «волшебные пули» точно в цель (внутрь больных органов), видимых успехов они пока не достигли. Кроме этого, есть и другие сложности. Например, в случае антивирусной терапии высокая избирательность действия киРНК может оказать «медвежью услугу» — поскольку вирусы быстро мутируют, изменённый штамм очень быстро потеряет чувствительность к киРНК, подобранной в начале терапии: известно, что замена всего лишь одного нуклеотида в киРНК приводит к существенному снижению эффекта интерференции.
В этом месте стоит напомнить ещё раз — киРНК были обнаружены только у растений, беспозвоночных и одноклеточных; хотя гомологи белков для РНК-интерференции (Dicer, RISC-комплекс) присутствуют и у высших животных, киРНК привычными методами не обнаруживались. Каково же было удивление, когда искусственно введённые синтетические аналоги киРНК вызывали сильный специфический дозозависимый эффект в культурах клеток млекопитающих! Это означало, что в клетках позвоночных РНК-интерференция не заместилась более сложными системами иммунитета, а эволюционировала вместе с организмами, превратившись во что-то более «продвинутое». Следовательно, у млекопитающих надо было искать не точные аналоги киРНК, а их эволюционных преемников.
Игрок № 2 — микроРНК
Действительно, на основе эволюционно достаточно древнего механизма РНК-интерференции у более развитых организмов появились две специализированные системы управления работой генов, использующие каждая свою группу малых РНК — микроРНК (microRNA) и пиРНК (piRNA, Piwi-interacting RNA). Обе системы появились ещё у губок и кишечнополостных и эволюционировали вместе с ними, вытеснив киРНК и механизм «голой» РНК-интерференции. Их роль в обеспечении иммунитета снижается, поскольку эту функцию взяли на себя более совершенные механизмы клеточного иммунитета, — в частности, интерфероновая система. Однако эта система настолько чувствительна, что срабатывает и на саму киРНК: появлении в клетке млекопитающих малых двуцепочечных РНК запускает «сигнал тревоги» (активирует секрецию интерферона и вызывает экспрессию интерферон-зависимых генов, что блокирует все процессы трансляции целиком). В этой связи механизм РНК-интерференции у высших животных опосредован в основном микроРНК и пиРНК — одноцепочечными молекулами со специфической структурой, которая не обнаруживаются интерфероновой системой.
По мере усложнения генома микроРНК и пиРНК принимали всё большее участие в регуляции транскрипции и трансляции. Со временем, они превратились в дополнительную, точную и тонкую систему регуляции генома. В отличие от киРНК, микроРНК и пиРНК (открыты в 2001 году, см. врезку 3) не производятся из чужеродных двуцепочечных молекул РНК, а изначально закодированы в геноме организма-хозяина [8].
Встречайте: микроРНК
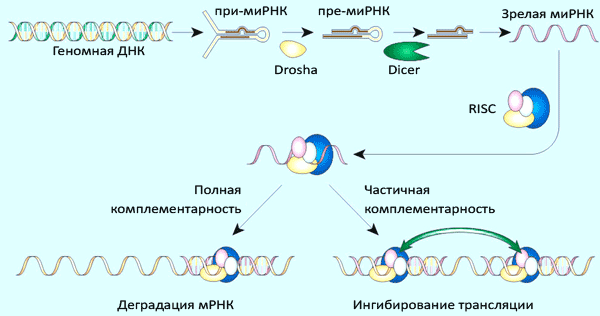
Предшественник микроРНК транскрибируется с обеих цепей геномной ДНК РНК-полимеразой II, в результате чего появляется промежуточная форма — при-микроРНК, — несущая признаки обычной мРНК — m 7 G-кэп и полиА-хвост. В этом предшественнике образуется петля с двумя одноцепочечными «хвостами» и несколькими неспаренными нуклеотидами в центре (рис. 3). Такая петля подвергается двухстадийному процессингу (рис. 4): вначале эндонуклеаза Drosha отрезает от шпильки одноцепочечные «хвосты» РНК, после чего вырезанная шпилька (пре-микроРНК) экспортируется в цитоплазму, где узнается Dicer’ом, вносящим ещё два разреза (вырезается двуцепочечный участок, обозначенный цветом на рис. 3). В таком виде зрелая микроРНК, аналогично киРНК, включается в состав комплекса RISC.
Рисунок 3. Структура двуцепочечной молекулы-предшественника микроРНК. Основные особенности: наличие консервативных последовательностей, которые формируют шпильку; наличие комплементарной копии (микроРНК*) с двумя «лишними» нуклеотидами на 3′-конце; специфическая последовательность (2–8 п. н.), формирующая сайт узнавания для эндонуклеаз. Сама микроРНК выделена красным цветом — именно её и вырезает Dicer.
Рисунок 4. Общий механизм процессинга микроРНК и реализации её активности.
Механизм действия многих микроРНК аналогичен действию киРНК: короткая (21–25 нуклеотидов) одноцепочечная РНК в составе белкового комплекса RISC с высокой специфичностью связывается с комплементарным участком в 3′-нетранслируемой области мРНК-мишени. Связывание приводит к расщеплению мРНК белком Ago. Однако активность микроРНК (по сравнению с киРНК) уже более дифференцирована — если комплементарность не абсолютная, целевая мРНК может не деградировать, а только обратимо блокироваться (трансляции не будет). Тот же RISC-комплекс может использовать и искусственно введённые киРНК. Это объясняет, почему киРНК, сделанные по аналогии с простейшими, активны и у млекопитающих.
Таким образом, мы можем дополнить иллюстрацию механизма действия РНК-интерференции у высших (билатерально-симметричных) организмов, объединив на одном рисунке схему действия микроРНК и биотехнологически введённых киРНК (рис. 5).
Рисунок 5. Обобщённая схема действия искусственных микроРНК и киРНК (искусственные киРНК вводятся в клетку с помощью специализированных плазмид — targeting siRNA vector).
Функции микроРНК
Физиологические функции микроРНК крайне разнообразны — фактически, они выступают основными небелковыми регуляторами онтогенеза. микроРНК не отменяют, а дополняют «классическую» схему регуляцию генов (индукторы, супрессоры, компактизация хроматина и т. д.). Кроме того, синтез самих микроРНК сложным образом регулируются (определенные пулы микроРНК могут включаться интерферонами, интерлейкинами, фактором некроза опухолей α (ФНО-α) и многими другими цитокинами). В результате вырисовывается потрясающая по своей сложности и гибкости многоуровневая сеть настройки «оркестра» из тысяч генов, но и этим дело не заканчивается.
микроРНК более «универсальны», чем киРНК: «подопечные» гены не обязательно должны быть на 100% комплементарны — регуляция осуществляется и при частичном взаимодействии. На сегодня одна из самых горячих тем в молекулярной биологии — поиск микроРНК, которые выступают альтернативными регуляторами известных физиологических процессов. Например, уже описаны микроРНК, участвующие в регуляции клеточного цикла и апоптоза у растений, дрозофилы и нематоды; у человека микроРНК регулируют иммунную систему [9] и развитие гематопоэтических стволовых клеток [10]. Применение технологий на основе биочипов (micro-array screening) показало, что на различных этапах жизни клеток включаются и выключаются целые пулы малых РНК. Для биологических процессов идентифицировали десятки специфичных микроРНК, уровень экспрессии которых в определённых условиях изменяется в тысячи раз, подчёркивая исключительную управляемость этих процессов.
До недавнего времени считалось, что микроРНК только подавляют — полностью или частично — работу генов. Однако недавно оказалось: действие микроРНК может кардинально отличаться в зависимости от состояния клетки! В активно делящейся клетке микроРНК, связавшись с комплементарной последовательностью в 3′-участке мРНК, ингибирует синтез белка (трансляцию). Однако в состоянии покоя или стресса (например, при росте на бедной среде) то же самое событие приводит к прямо противоположному эффекту — усилению синтеза целевого белка [11]!
Эволюция микроРНК
Количество разновидностей микроРНК у высших организмов ещё до конца не установлено — по некоторым данным, оно превосходит 1% от числа белок-кодирующих генов (у человека, например, говорят о 700 микроРНК, и это число постоянно растет). микроРНК регулируют активность около 30% всех генов (мишени для многих из них пока не известны), причём существуют как повсеместно распространённые, так и тканеспецифичные молекулы — например, один такой важный пул микроРНК регулирует созревание стволовых клеток крови.
Широкий профиль экспрессии в разных тканях разных организмов и биологическая распространённость микроРНК говорит об эволюционно древнем происхождении. Впервые микроРНК обнаружили у нематод, и долгое время потом считали, что эти молекулы появляются лишь у губок и кишечнополостных; однако позже их открыли и в одноклеточных водорослях [11]. Интересно, что по мере усложнения организмов увеличивается также количество и гетерогенность пула микроРНК. Это косвенно свидетельствует о том, что сложность этих организмов обеспечивается, в частности, функционированием микроРНК [12]. Возможная эволюция микроРНК показана на рисунке 6.
Рисунок 6. Многообразие микроРНК у разных организмов. Чем выше организация организма, тем больше у него обнаруживается микроРНК (число в скобках). Красным выделены виды, у которых обнаружены единичные микроРНК.
Между киРНК и микроРНК можно провести чёткую эволюционную связь, опираясь на следующие факты:
Эти и другие данные позволяют предположить происхождение обеих систем от общего «предка». Интересно также отметить, что «РНКовый» иммунитет как независимый предшественник белковых антител подтверждает теорию зарождения первых форм жизни на основе РНК, а не белков (напомним, что это любимая теория академика А. С. Спирина [2]).
Чем дальше, тем запутанней. Игрок № 3 — пиРНК
Пока на арене молекулярной биологии было только два «игрока» — киРНК и микроРНК — основное «предназначение» РНК-интерференции казалось совершенно понятным. Действительно: набор гомологичных коротких РНК и белков у разных организмов осуществляет аналогичные действия; по мере усложнения организмов усложняется и функциональность.
Однако в процессе эволюции природа создала ещё одну, эволюционно самую позднюю и узкоспециализированную систему на основе всё того же удачного принципа РНК-интерференции. Речь идет пиРНК (piRNA, от Piwi-interaction RNA).
Чем сложнее организован геном, тем более развит и приспособлен организм (или наоборот? ;-). Однако увеличение сложности генома имеет и оборотную сторону: сложная генетическая система становится нестабильной. Это ведет к необходимости механизмов, отвечающих за поддержание целостности генома — иначе самопроизвольное «перемешивание» ДНК просто выведет её из строя. Мобильные генетические элементы (МГЭ) — один из основных факторов нестабильности генома — представляют собой короткие нестабильные участки, которые могут автономно транскрибироваться и мигрировать по геному. Активация таких мобильных элементов приводит к множественным разрывам ДНК в хромосомах, чреватых летальными последствиями.
Количество МГЭ нелинейно увеличивается с размером генома, и их активность необходимо сдерживать. Для этого животные, уже начиная с кишечнополостных, используют всё тот же феномен РНК-интерференции. Эту функцию также выполняют короткие РНК, однако не те, о которых речь уже шла, а третий их тип — пиРНК.
«Портрет» пиРНК
пиРНК — короткие молекулы длиной в 24–30 нуклеотидов, закодированные в центромерных и теломерных областях хромосомы. Последовательности многих из них комплементарны известным мобильным генетическим элементам, однако есть множество других пиРНК, совпадающих с участками рабочих генов или с фрагментами генома, функции которых неизвестны.
пиРНК (также как и микроРНК) закодированы в обеих цепях геномной ДНК; они весьма изменчивы и разнообразны (до 500 000 (!) видов в одном организме). В отличие от киРНК и микроРНК, они образуются одной цепью с характерной особенностью — урацилом (U) на 5′-конце и метилированным 3′-концом. Есть и другие отличия:
Процессинг и активность пиРНК пока достаточно плохо изучены, но уже ясно, что механизм действия совершенно отличается от других коротких РНК — сегодня предложена пинг-понг модель их работы (рис. 7 и 8).
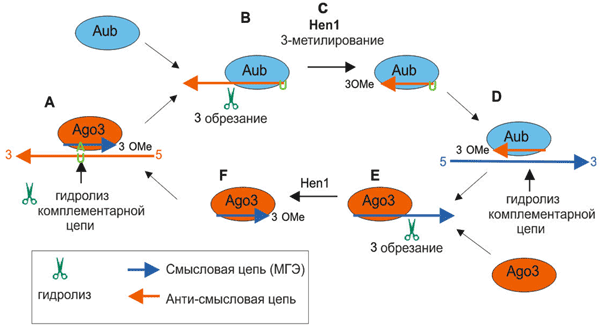
Рисунок 7. Цитоплазматическая часть процессинга пиРНК. Биогенез и активность пиРНК опосредуется семейством эндонуклеаз Piwi (Ago3, Aub, Piwi). Активность пиРНК обеспечивается обеими одноцепочечными молекулами пиРНК — смысловой и анти-смысловой, — каждая из которых ассоциирует со специфической эндонуклеазой Piwi. пиРНК узнает комплементарный участок мРНК транспозона (синяя цепь) и вырезает его. Это не только инактивирует транспозон, но и создает новую пиРНК (связанную с Ago3 с помощью метилирования метилазой Hen1 3′-конца). Такая пиРНК, в свою очередь, узнаёт мРНК с транскриптами кластера предшественников пиРНК (красная цепь) — таким способом цикл замыкается и снова вырабатывается нужная пиРНК.
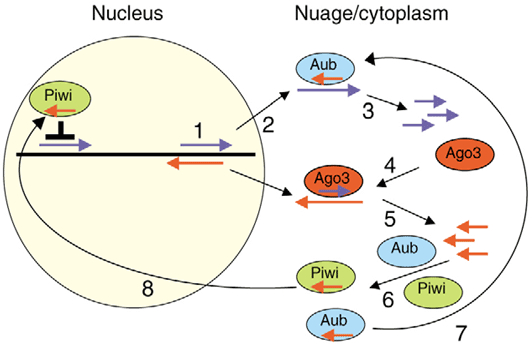
Рисунок 8. пиРНК в ядре. Кроме эндонуклеазы Aub, антисмысловую пиРНК может связывать и эндонуклеаза Piwi. После связывания комплекс мигрирует в ядро, где вызывает деградацию комплементарных транскриптов и перестройку хроматина, вызывающую подавление активности транспозонов.
Функции пиРНК
Главная функция пиРНК — подавление активности МГЭ на уровне транскрипции и трансляции. Считается, что пиРНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша. Это логично — когда иммунная система ещё не заработала, клетки эмбриона нуждаются в какой-нибудь простой, но действенной защите. От внешних патогенов эмбрион надежно защищен плацентой (или оболочкой яйца). Но кроме этого необходима оборона и от эндогенных (внутренних) вирусов, — в первую очередь МГЭ.
Эта роль пиРНК подтверждена опытом — «нокаут» или мутации генов Ago3, Piwi или Aub приводят к серьёзным нарушениям развития (и резкому увеличению числа мутаций в геноме такого организма), а также вызывают бесплодие за счёт нарушения развития половых клеток.
Распространение и эволюция пиРНК
Первые пиРНК обнаруживаются уже у актиний и губок. Растения, видимо, пошли другим путём — белки Piwi у них не обнаружены, а роль «намордника» для транспозонов выполняют эндонуклеаза Ago4 и киРНК.
| киРНК | микроРНК | пиРНК | |
|---|---|---|---|
| Распространение | Растения, Drosophila, C. elegans. Не найдено у позвоночных | Эукариоты | Эмбриональные клетки животных (начиная с кишечнополостных). Нет у простейших и растений |
| Длина | 21–22 нуклеотидов | 19–25 нуклеотидов | 24–30 нуклеотидов |
| Структура | Двуцепочечная, по 19 комплементарных нуклеотидов и два неспаренных нуклеотида на 3′-конце | Одноцепочечная сложная структура | Одноцепочечная сложная структура. U на 5′-конце, 2’-O-метилированный 3′-конец |
| Процессинг | Dicer-зависимый | Dicer-зависимый | Dicer-независимый |
| Эндонуклеазы | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Активность | Деградация комплементарных мРНК, ацетилирование геномной ДНК | Деградация или ингибирование трансляции целевой мРНК | Деградация мРНК, кодирующих МГЭ, регуляция транскрипции МГЭ |
| Биологическая роль | Антивирусная иммунная защита, подавление активности собственных генов | Регуляция активности генов | Подавление активности МГЭ во время эмбриогенеза |
Заключение
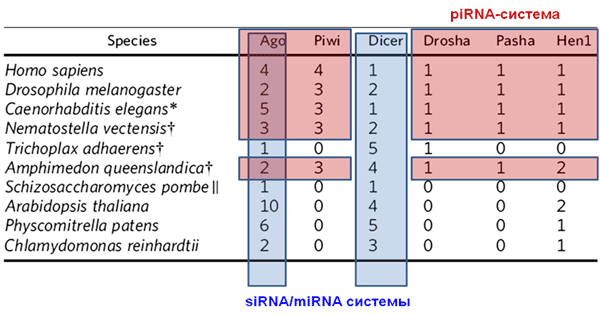
В заключение хочется привести таблицу, иллюстрирующую эволюцию белкового аппарата, участвующего в РНК-интерференции (рис. 9). Видно, что у простейших наиболее развита система киРНК (белковые семейства Ago, Dicer), а с усложнением организмов акцент переносится на более специализированные системы — увеличивается число изоформ белков для микроРНК (Drosha, Pasha) и пиРНК (Piwi, Hen1). При этом разнообразие ферментов, опосредующих действие киРНК, уменьшается.
Рисунок 9. Многообразие белков, участвующих в РНК-интерференции (цифры обозначают количество белков каждой группы). Синим цветом подсвечены элементы, характерные для киРНК и микроРНК, а красным — белки, связанные с пиРНК.
Явление РНК-интерференции начали использовать уже простейшие организмы. На основе этого механизма природа создала прототип иммунной системы, а по мере усложнения организмов РНК-интерференция становится незаменимым регулятором активности генома. Два разных механизма плюс три вида коротких РНК (см. таб. 1) — в результате мы видим тысячи тонких регуляторов различных метаболических и генетических путей. Эта поразительная картина иллюстрирует универсальность и эволюционную адаптацию молекулярных биологических систем. Короткие РНК снова доказывают, что «мелочей» внутри клетки нет — есть только мелкие молекулы, всю значимость роли которых мы только начинаем понимать.
(Правда, такая фантастическая сложность говорит скорее о том, что эволюция «слепа» и действует без наперёд утверждённого «генерального плана» [15].)