какие витамины пить при папилломах
Вирус папилломы человека — какое лечение ВПЧ эффективно?
Что такое вирус папилломы человека?
Группа вирусов ВПЧ входит в семейство папилломавирусов, которое включает 5 родов, порядка 43 разновидностей и почти 170 типов, именно ВПЧ является причиной образования бородавок. Существует его прямая взаимосвязь связь с раком шейки матки: в 92% случаев заболевания раком обнаруживается этот вирус.
Какие анализы сдают на вирус папилломы человека?
Основные направления в исследовании — это определение вирусной нагрузки, то есть количественный показатель и определение типа вируса методом ПЦР.
Папилломы это опасно?
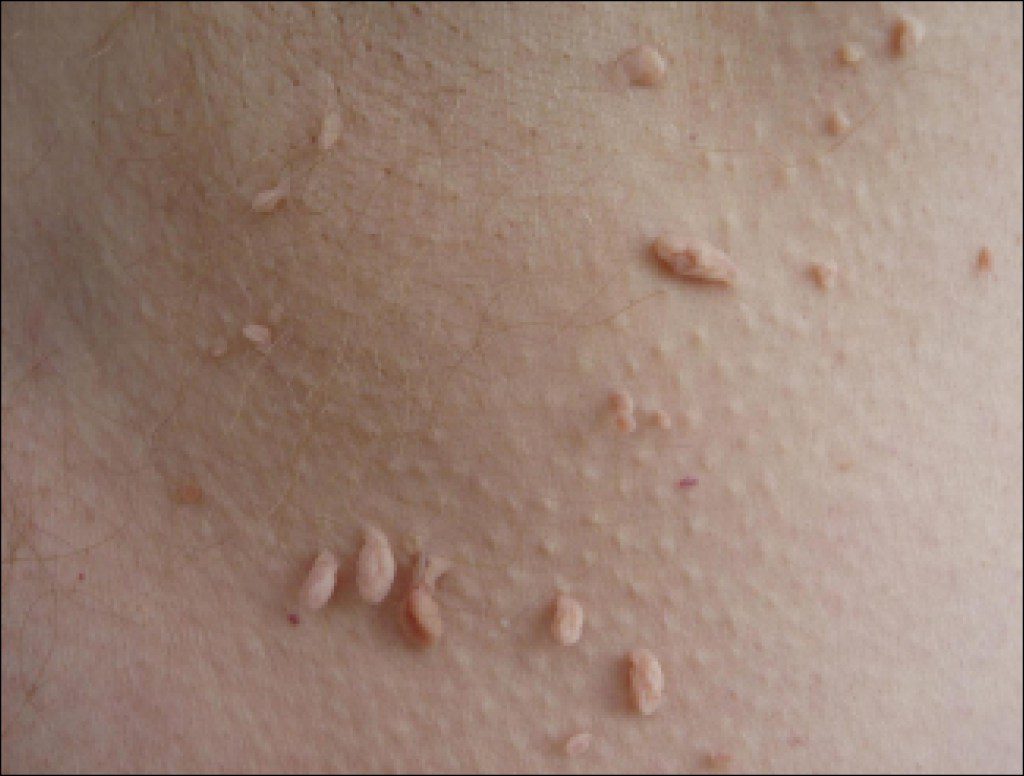
По сути, папиллома — это доброкачественная опухоль, но она таит в себе и опасности. Во-первых, возможно повреждение ее целостности, приводящее к формированию рубцов, редко к заражению крови. Не рекомендуется удалять механически папилломы самостоятельно, это может привести к генерализации процесса и распространению папиллом по всему телу. Самая главная опасность папиллом заключается в том, что они вирусные. Большинство видов ВПЧ не представляют угрозу для здоровья и жизни человека, но ВПЧ 16 и 18 типа могут спровоцировать развитие злокачественных образований. Доброкачественные папилломы, как правило, доставляют много неприятностей человеку. Они могут увеличиваться до больших размеров, могут образовываться в области половых органов. Некоторые виды ВПЧ вызывают предраковые заболевания.
Вирус папилломы человека заразен?
ВПЧ может передаваться различными путями. При контактно-бытовом способе передачи вирус через кожу при рукопожатиях и использовании средств личной гигиены, после примерки чужой одежды и нижнего белья, при посещении общественных бассейнов и саун. Особо опасным считается половой путь передачи вируса, так как при этом существует высокий риск заражения ВПЧ онкогенного типа. Вероятность передачи вируса половым путем намного выше, если у партнера есть остроконечные кондиломы. ВПЧ может передаваться от матери к ребенку во время родов, крайне редко это происходит во время беременности. При этом чаще всего у детей развивается папилломатоз гортани, опасный серьезными нарушениями дыхательной функции. Возможно заражение ребенка от матери при кормлении грудью.
Как лечат вирус папилломы человека?
Медикаментозное лечение вируса проводится с помощью лекарственных препаратов, которые воздействуют на причину заболевания, а также восстанавливают функцию иммунной системы. Существуют различные схемы внутривенного введения лекарств, врачи, как правило, назначают лечение индивидуально, стандартных схем нет. Какие препараты обычно назначают? Циклоферон, Интерферон альфа, Панавир, Ингарон. Таблетированные формы противовирусных препаратов: Изопринозин, Ликопид, Лавомакс, Алпизарин. Свечи: Генферон, Бетадин, Виферон. Мази: Оксолиновая мазь, San Fen Zhong мазь, Стефалин, Салициловая мазь. Витамины: Аевит, Алфавит.
Вакцинация против ВПЧ (Гардасил)
Полностью избавиться от ВПЧ при современном уровне фармацевтической промышленности еще невозможно, но можно предупредить заражение инфекцией и для этого проводится вакцинация таким препаратом, как Гардасил. В некоторых странах эти прививки уже являются обязательными, в России сделать вакцинацию можно добровольно. При выборе такого способа профилактики ВПЧ необходимо пройти предварительное обследование на определение наличия вируса в организме. В состав вакцин входят синтетически модифицированные белки, сходные со структурой вируса. Введение в организм этих белков активизирует работу иммунной системы и приводит к выработке антител, защищающих от развития ВПЧ после проникновения возбудителя в организм. Разработчики вакцины советуют ставить препарат девочкам и мальчикам от 10 до 12 лет. Связано это с тем, что в этом возрасте половых контактов в подавляющем большинстве случаев нет, а иммунная система работает в полную силу, что способствует хорошей ответной реакции на препарат.
Вирус папилломы человека может вызывать рак?
Самым опасным типом ВПЧ, вызывающий злокачественные образования считаются следующие: ВПЧ-16; ВПЧ-18; ВПЧ-31, 33, 45, 56, 58; ВПЧ-51, 59, 68; ВПЧ-35, 39, 52.
Какие разновидности рака вызывает ВПЧ
Наиболее часто рак шейки матки вызывается вирусом папилломы человека 16 и 18 типов, они же вызывают рак половых органов. ВПЧ 16 в 50% случае является причиной рака гортани.
ВПЧ передается половым путем?
ВПЧ передается половым путем, и при этом сами половые контакты становятся основной причиной заражения папиллома вирусом. Расскажем об этом подробнее.
Папилломы, расположенные на половом члене являются признаком папилломавирусной инфекции, следственно заражение половым путем вполне логично. Инкубационный период при ВПЧ длится от 1 до 12 месяцев. При этом сами папилломы могут совсем не вырастать, и только при снижении функции иммунной системы может произойти начало их образования. Поэтому обнаружение ВПЧ в организме на ранних стадиях развития заболевания возможно исключительно с помощью специальных анализов. В настоящее время, ВПЧ является одним из самых распространенных заболеваний и риск заражения партнера при незащищенном половом акте является практически 100%.
Папилломы — это онкологическое заболевание?
Все разновидности ВПЧ по степени риска возникновения злокачественного перерождения можно разделить на следующие: низкой степени риска, средней степени риска и высокой степени онкогенного (канцерогенного) риска.
Остроконечные кондиломы в области гениталий, как правило, не вызываются вирусом с высокой степень онкогенности. Плоскоклеточные папилломы являются злокачественными новообразованиями. Пациенты, у которых диагностируются плоскоклеточные папилломы находятся в группе повышенного риска и требуют незамедлительного лечения.
Если у пациента обнаружен ВПЧ онкогенной группы, для профилактики появления онкологических процессов в организме необходимо уделять внимание иммунной системе, регулярно сдавать анализы и наблюдаться у врача.
Можно ли рожать, если есть вирус папилломы человека?
Если в организме женщины обнаружен ВПЧ, но при этом нет внешних проявлений в виде образования папиллом, то рожать можно спокойно и не волноваться. Если есть остроконечные кондиломы в области гениталий, то существует очень высокий риск заражения ребенка ВПЧ во время прохождения по родовым путям. Первый самостоятельный вдох ребенка может произойти прямо в родовых путях, вирус попав в горло малыша приводит к разрастанию папиллом на его голосовых складках. Поэтому при наличии генитальных папиллом и активной формы ВПЧ показано кесарево сечение.
Может ли вирус папилломы человека пройти без лечения?
По статистическим данным, в 85 % случаев ВПЧ после заражения устраняется организмом самостоятельно, благодаря хорошей работе иммунной системы. Этот процесс может длиться от нескольких месяцев до нескольких лет. Иногда пребывание вируса в организме человека можно не обнаружить даже при медицинском обследовании. Полностью подтвердить наличие ВПЧ можно при наличии образований на коже — папиллом.
Что делать, если обнаружили вирус папилломы человека?
Как удаляют папилломы?
Удалить папиллому можно медикаментозно. Но наиболее эффективным методом принято считать хирургическую методику, лазерную хирургию и электрохирургическое удаление. Обычный хирургический метод удаления применяется не часто, после него часто возникают рецидивы возникновения образований. Удаление с помощью лазера считается самым лучшим в мире, при этом удаление безболезненно и безопасно, не оставляет после себя шрамов и рубцов. Радиохирургическое удаление производят под местной анестезией, результат достаточно хороший и стойкий.
Где чаще всего образуются папилломы?
Чаще всего папилломы локализуются в области подмышек и в паху, рядом с половыми органами. Нередко образования встречаются под молочными железами, на шее, веках.
Что делать, если папилломы обнаружили в гортани?
Папилломатоз гортани — весьма тяжёлое заболевание, при котором нарушается голосообразование и дыхательная функция. В детском возрасте распознают симптомы заболевания в возрасте от одного до пяти лет. Если вы отмечаете хриплый голос у ребенка, кашель, затруднение дыхания или ощущение кома в горле, необходимо сразу показать его врачу.
Что такое вирус папилломы человека и как его лечить
Вирус папилломы человека (ВПЧ) воздействуют на эпителиальные клетки и имеют диаметр частиц 55 нм. Особенностью является пролиферация эпителия кожи, а также слизистых оболочек. На начальной стадии возбудитель обычно поражает базальные клетки эпителия, проникая в них через микротравмы. Локализованные папилломы обычно встречаются на коже шеи, в подмышечных впадинах, в паху и на половых органах (чаще всего), слизистой оболочке рта и в носоглотке.
Этот вирус может существовать на протяжении многих лет бессимптомно. Для обнаружения ВПЧ используют электронно-микроскопические или молекулярные гибридизированные методы.
Типы вируса папилломы человека
У людей различают ВПЧ, который поражает слизистые оболочки и кожный покров. Среди большого количества папилломавирусов выделяют виды с низким и высоким онкогенным риском. Доказано, что онкогенные свойства связаны со способностью интегрировать ДНК в геном клеток человека.
Активируется вирус в 10-20% случаев. В зависимости от его типа, это может привести к доброкачественным или злокачественным поражениям. Некоторые ВПЧ не онкогенны. Они приводят к появлению бородавок и остроконечных кондилом. Наиболее распространенными являются ВПЧ 6 и 11.
Онкогены ВПЧ – это те, у которых высокий риск развития раковых поражений, особенно на шейке матки или анусе. Что касается кожного покрова, чаще встречается ВПЧ 16 и 18, а также 5 и 8, которые могут привести к раку кожи. Наиболее известной формой рака, вызванной ВПЧ, является рак шейки матки. Но мужчины также могут заразиться вирусом папилломы, который в худших случаях вызывает рак пениса или анального отверстия.
Часто женщины сталкиваются с ВПЧ 16 – это форма, при которой наблюдается интросомальное паразитирование, т. е. вне клеточной хромосомы (доброкачественное). ВПЧ 18 отличается высоким риском развития онкологии – сначала образуются доброкачественные опухоли, которые спустя некоторое время перерождаются в рак. Вирионы в данном случае имеют крохотные размеры (до 30 нм).
Особенности заражения
Вирус папилломы человека очень заразен. Он обычно передается через прямой контакт, кожа к коже или слизистая оболочка к слизистой оболочке, с инфицированным человеком. При генитальной инфекции это чаще всего происходит во время вагинального или орального сексуального контакта. Большое количество половых партнеров или других ИППП (инфекции, передающиеся половым путем) повышают риск. Косвенная передача через предметы, загрязненную одежду или постельное белье также возможна, но происходит довольно редко.
В 7% случаев передача вируса от матери к ребенку может произойти во время родов, когда инфекция активна. Риск увеличивается до 40% в случае заражения ВПЧ 16 или 18.
Проникая в эпителий, нарушая целостность, папилломавирусная инфекция способствует росту нижнего слоя эпителиальных клеток в виде кондилом или бородавок. Такая форма болезни заразна и быстро передается другим. Как правило, бородавки и кондиломы не вызывают метастазов и часто спонтанно исчезают.
Симптомы ВПЧ
Инкубационный период длится до 9 месяцев (в среднем 3 месяца). ВПЧ может присутствовать в организме без очевидных симптомов. Вирус может оставаться незамеченным в течение нескольких месяцев или нескольких лет. Даже на этом этапе он является заразным.
Кожные бородавки обычно встречаются группами и при расчесывании их количество увеличивается. У двух наиболее распространенных форм папилломы либо сероватые, твердые, возвышенные с пересеченной поверхностью (обычная бородавка), либо плоские и красноватые (плоская бородавка). Колючие бородавки встречаются на подошвах стоп или на пятках, растут внутрь и поэтому часто болезненны.
Также возможно заражение слизистых оболочек в верхних дыхательных путях. Может быть поражена конъюнктива глаз, что приводит к розовым стеблевым наростам.
Труднее обнаружить бессимптомное течение, которое врач может увидеть только с помощью вспомогательных средств, таких как уксусная кислота (вызывает обесцвечивание бородавок) или микроскоп.
Кроме того, вирус также может поселиться в клетках без каких-либо изменений тканей. Тогда говорят о скрытой инфекции, то есть наличии возбудителей, но без симптомов. После инфицирования эта фаза может длиться от нескольких недель до нескольких месяцев.
Возможные последствия
При заражении вирусы проникают в клетки покровной ткани кожи и слизистой оболочки, оседают в ядрах клеточных структур и размножаются там. Обычно такие ВПЧ-инфекции остаются незамеченными и заживают сами по себе без последствий, т. к. иммунная система успешно борется с возбудителем.
Однако некоторые из типов ВПЧ создают изменения кожи, т. е. наросты. Возможные формы включают генитальные бородавки или кондиломы и папилломы, которые могут поражать, например, лицо, руки или ноги.
Постановка диагноза
Тест на ВПЧ-инфекцию проводится у женщин в рамках профилактических визитов к гинекологу. При гинекологическом осмотре мазок берется из слизистой оболочки шейки матки, это называется тестом Папаниколау (цитологическое исследование). Полученный материал изучается на предмет изменений тканей для определения предраковых состояний.
Кроме того, может быть проведен тест на ВПЧ, в котором клеточный материал из мазка слизистой оболочки или образца ткани тестируется в лаборатории на наличие определенных вирусов. Однако это позволяет доказать только инфицирование пораженного участка, но не сделать никаких заявлений о том, произошли ли изменения тканей. Таким образом, тест на ВПЧ имеет смысл, особенно в сочетании с тестом на Папаниколау, и может помочь обнаружить предшественники рака на ранней стадии.
Если тест положительный, это еще не причина для беспокойства, поскольку инфекция не всегда приводят к раку. Рекомендуется регулярное обследование, чтобы обнаружить изменения тканей на ранней стадии. И наоборот, отрицательный результат теста не позволяет утверждать, существовала ли в прошлом инфекция, с которой успешно боролся организм.
Для мужчин нет профилактического обследования, в рамках которого тест проводился бы регулярно. Если существует соответствующее онкологическое заболевание, исследование опухоли может определить, лежит ли ВПЧ-инфекция в основе рака.
Специализированные методы ДНК также используются в лабораторной диагностике, например ПЦР в режиме «реального времени». Аногенитальные бородавки, вызванные ВПЧ 6 и 11 типа, легко выявляются при проведении гинекологического осмотра.
Как вылечить вирус папилломы человека
В большинстве случаев заболевание не требует лечения, потому что оно проходит само по себе, а затем вирусы больше не обнаруживаются. Однако, если это не так, инфекция может длиться дольше и сохраняться в течение нескольких месяцев или лет.
На сегодняшний день не существует методов системного воздействия на этот вирус, за счет которых можно было бы полностью его уничтожить. Тем не менее, лечение образовавшихся бородавок уменьшает количество вирусов, поэтому во многих случаях иммунная система может бороться с остальными вирусами и таким образом избавляться от них. В некоторых случаях возбудители выживают и могут вызывать симптомы заболевания снова и снова.
В случае рака, вызванного ВПЧ, лечение значительно сложнее. При раке шейки матки часто целесообразно удаление матки, соответственно верхней части влагалища и яичников. Это можно дополнить лучевой терапией, чтобы исключить вероятность рецидивов. Другие раковые заболевания, вызванные ВПЧ, чаще всего лечатся целенаправленной терапией, такой как лучевая или химиотерапия.
Следует помнить, что операция не является кардинальным решением, а только решает косметическую проблему, т. к. после удаления вирус способен оставаться в окружающих тканях и кондиломы могут появляться снова.
Профилактика заражения
Существует две прививки: двухвалентная вакцина против ВПЧ 16 и 18 и четырехвалентная против ВПЧ 6, 11, 16 и 18. Вакцинация рекомендуется для всех молодых девочек в возрасте от 14 лет и старше.
Вакцинация не защищает от всех видов ВПЧ. Поэтому всем женщинам в возрасте от 25 до 65 лет, даже если они вакцинированы, рекомендуется проводить регулярные осмотры через мазок.
Своевременное обнаружение и полное удаление кондилом снижает риск возникновения заболеваний. Эффективность использования презервативов для защиты от передачи инфекции может значительно снизить риск развития этого заболевания. Наиболее перспективным способом профилактики и лечения начальных стадий заболевания, вызванного этой инфекцией, является специфическая поливалентная вакцина.
Противовирусные эффекты витамина D как фактор повышения сопротивляемости папилломавирусной инфекции и опухолевым заболеваниям шейки матки
Помимо ярко выраженного антибактериального эффекта витамин D также оказывает противовирусное действие. Увеличивая экспрессию интерферона альфа, кателицидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного иммунитета. Результаты фундаментальных и клинических исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусных гепатитов, респираторной и папилломавирусной инфекций. Противовирусные эффекты витамина D также важны для повышения эффективности профилактики и терапии опухолевых заболеваний шейки матки.
Помимо ярко выраженного антибактериального эффекта витамин D также оказывает противовирусное действие. Увеличивая экспрессию интерферона альфа, кателицидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного иммунитета. Результаты фундаментальных и клинических исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусных гепатитов, респираторной и папилломавирусной инфекций. Противовирусные эффекты витамина D также важны для повышения эффективности профилактики и терапии опухолевых заболеваний шейки матки.
Витамин D – комплексный регулятор врожденного и приобретенного иммунитета, поэтому недостаточность этого витамина снижает антибактериальный и противовирусный иммунитет, стимулирует развитие патологий, ассоциированных с хроническим системным воспалением (атопического дерматита, ревматоидного артрита, воспалительных заболеваний кишечника, аутоиммунных заболеваний щитовидной железы и сепсиса). Результаты фундаментальных и клинических исследований показали, что возникающие на фоне недостаточности витамина D хроническое воспаление и нарушения врожденного иммунитета значительно снижают резистентность организма к туберкулезу, хроническому бронхиту, вирусным заболеваниям (вирусному гепатиту, острому респираторному заболеванию, папилломавирусной инфекции) [1, 2]. Таким образом, обеспеченность витамином D может существенно влиять на иммунитет, в том числе на противовирусную защиту организма.
Противодействие инфекционным заболеваниям играет важную роль в акушерско-гинекологической практике. В частности, вирусные и бактериальные заболевания на фоне недостаточного уровня витамина D повышают риск развития опухолей эндометрия, яичников и шейки матки [3]. Кроме того, иммуномодулирующее, антипролиферативное, проапоптотическое, антиангиогенное, противовоспалительное и противоопухолевое действие витамина D, обнаруженное в фундаментальных и клинических исследованиях, – еще один аргумент в пользу назначения витамина D для профилактики и терапии различных «гинекологических» опухолей, в том числе рака шейки матки [4].
В настоящей статье последовательно рассмотрены молекулярные основы противовирусного действия витамина D, результаты фундаментальных и клинических исследований, указывающие на действие витамина D против вирусов гепатита, Эпштейна – Барр, папилломы человека (ВПЧ), респираторно-синцитиального вируса и др. Показана целесообразность применения витамина D в профилактике и терапии опухолевых заболеваний шейки матки.
О молекулярных механизмах противовирусного действия витамина D
Витамин-D-индуцированные механизмы, связанные с противовирусной активностью, включают корректировку врожденного иммунного ответа (интерфероны), повышение уровней кателицидина (LL-37) и дефенсина, а также активацию специфических противовирусных микроРНК. Витамин D усиливает эффект интерферона, уменьшая синтез вирусных белков в зараженных вирусами клетках. Например, при инфицировании гепатоцитов в культуре вирусом гепатита С воздействие витамина D в форме 1,25(OH)2D активирует гены, связанные с аутофагией вирусных частиц (рецептор 37 G-белков (GPR37), фактор, индуцируемый гипоксией 1-альфа (HIF-1-альфа), хемокиновый лиганд 20 (CCL20)), и подавляет интенсивность репликации вируса (рис. 1) [5].
Одна из основ противовирусного действия витамина D – повышение экспрессии антимикробных пептидов кателицидина и бета-дефенсина 2 [6], которые проявляют не только микробицидную, но и противогрибковую и противовирусную активность [7].
Антимикробный пептид кателицидин – неотъемлемый компонент витамин-D-зависимого врожденного антимикробного иммунитета. Антимикробные пептиды встраиваются в цитоплазматическую мембрану бактерий и белковые оболочки вирусов и, приводя к образованию пор, нарушают целостность бактерий и вирусов. Кроме того, проникая внутрь бактерий и вирусов, положительно заряженные антимикробные пептиды связываются с отрицательно заряженными ДНК и РНК, что также стимулирует гибель бактерий и вирусов.
Обработка моноцитов в культуре посредством биологически активной формы витамина D (1,25(OH)2D) дозозависимо повышала экспрессию мРНК антимикробного пептида кателицидина в 48–140 раз, причем увеличение экспрессии гена кателицидина коррелировало с повышенной экспрессией белка кателицидина [8]. В клиническом исследовании установлена корреляция между уровнями 25(OH)D и кателицидина в плазме крови (фактор корреляции 0,45, р = 0,05) [9]. Более высокая концентрация кателицидина в плазме существенно (в 3,7 раза) снижала риск смерти от инфекции у пациентов с диализом [10].
Витамин D повышает экспрессию определенных микроРНК, которые проявляют противовирусные и онкопротективные свойства. Напомним, что микроРНК представляют собой короткие специфические фрагменты РНК, которые ассоциируются с матричной РНК для синтеза того или иного белка и осуществляют тонкую настройку экспрессии этого белка. Иначе говоря, посредством микроРНК синтезируется столько молекул белка, сколько нужно для потребностей клетки. Как недостаточный, так и избыточный синтез белков может приводить к развитию опухолей.
Витамин D и активированные им микроРНК (в частности, miR-155 и miR-146) тормозят экспрессию целевых специфических белков, ассоциированных с формированием избыточного воспаления: толл-подобных рецепторов 2 и 4, фактора некроза опухоли альфа, интерлейкинов 1-бета и 6, транскрипционного фактора NF-kB, киназного комплекса IkB (IKK), супрессора сигналинга цитокинов 1 (SOCS1) [11]. Активная форма витамина 1,25(OH)2D потенцирует ингибирующее действие miR-130а при репликации вируса гепатита C [5], повышающего риск опухолевых процессов в печени в десятки раз. Фундаментальные исследования показали, что воздействие витамина D на иммунитет также осуществляется посредством регуляции деления Т-хелперных лимфоцитов, дифференцирования В-клеток, секреции интерферона и других цитокинов, что способствует снижению избыточного воспаления [1].
Витамин D против вирусного гепатита
25(OH)D подавляет продукцию вируса гепатита С. Клетки HuH-7 в культуре были инфицированы вирусом гепатита С в присутствии или в отсутствие витамина D. 25(OH)D дозозависимо уменьшал вне- и внутриклеточный уровни основного антигена вируса гепатита С. Ингибирующее действие 25(OH)D осуществлялось на стадии сборки инфицирующего вирусного комплекса [12].
Витамин D против других вирусов
Респираторно-синцитиальная вирусная инфекция ослабляет противовирусную и противоопухолевую защиту организма путем негативного воздействия на метаболизм витамина D. При заражении клеток респираторно-синцитиальные вирусы уменьшают экспрессию рецептора витамина D (Vitamin D Receptor – VDR) и увеличивают экспрессию фермента 1-бета-гидроксилазы, которая инактивирует витамин D [19].
Витамин D способствует усилению противовирусной защиты бронхиальных эпителиальных клеток при участии противовирусного и антибактериального пептида кателицидина и активации сигнальных путей интерферона [20]. Поддерживая противовирусный иммунитет, витамин D также снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительного фактора NF-kB и соответствующих цитокинов в эпителии дыхательных путей. Витамин D индуцирует белок IkBa, ингибитор фактора NF-kB, и снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительных генов, управляемых NF-kB (интерферон бета, CXCL10 и др.). Ингибирование NF-kB посредством аденовирусных частиц, содержащих IkBa, имитировало эффекты витамина D. Таким образом, витамин D уменьшал воспалительную реакцию в ответ на вирусные инфекции, не снижая при этом противовирусного действия [21].
Метаанализ 25 рандомизированных исследований (n = 10 933), проведенный с использованием данных об индивидуальных пациентах, показал, что дотации витамина D способствовали снижению риска инфицирования острым респираторным заболеванием в среднем на 12% (ОР 0,88, 95% ДИ 0,81–0,96, p 30 нг/мл) [28]. В среднем риск инфицирования ВПЧ увеличивался на 14% при снижении уровня в сыворотке 25(ОН)D на каждые 10 нг/мл (ОР 1,14, 95% ДИ 1,02–1,27) (рис. 2).
Был опубликован клинический случай, который продемонстрировал эффективность местного применения витамина D у пациентки с папилломой на правом указательном пальце [29]. Так, пациентка А., 41 год, с врожденным заболеванием почек перенесла трансплантацию почки от умершего донора и находилась на терапии иммунодепрессантами (такролимус, микофенолата мофетил). Через 19 месяцев после трансплантации у пациентки образовалась папиллома на правом указательном пальце, которая вырастала вновь и вновь, несмотря на многократную криотерапию и электрокоагуляцию. Местное лечение папилломы с использованием раствора 1,25(OH)2D (0,5 мкг/сут) привело к полному излечению через три месяца.
Витамин D как нутриентная основа профилактики и терапии опухолевых заболеваний шейки матки
1,25(OH)2D ингибирует пролиферацию опухолевых клеток шейки матки путем подавления экспрессии онкогена рака шейки матки (HCCR-1) и увеличения экспрессии проапоптотического белка р21. Опухолевые клетки шейки матки (линия HeLaS3) культивировали в средах с различными концентрациями 1,25(OH)2D, которые индуцировали остановку клеточного цикла на фазе G1. 1,25(OH)2D дозозависимо уменьшал экспрессию белка HCCR-1 посредством транскрипционной регуляции экспрессии гена HCCR-1 и повышенной экспрессии белка p21 и промоторной активности [30].
1,25(OH)2D увеличивает экспрессию онкопротективных микроРНК в клетках рака шейки матки (линия SiHa). МикроРНК влияют на экспрессию многочисленных белков деления клетки, поэтому поддержание функции микроРНК играет важную роль в торможении возникновения и развития опухолей. Показано, что 1,25(OH)2D регулирует экспрессию онкозащитных микроРНК miR-22, miR-296-3p и miR-498 [31].
Иммуногистохимический анализ показал, что уровни экспрессии VDR при цервикальной карциноме повышены по сравнению с нормальной тканью шейки матки. Окрашивание на VDR было однородным, без визуальных различий между отдельными опухолевыми клетками. Умеренно-сильное окрашивание на VDR было обнаружено в 16 из 21 биопсии рака шейки матки независимо от того, экспрессировали эти опухоли цитокератин 10 или трансглутаминазу К. Повышенная экспрессия VDR – один из аспектов иммунного ответа организма на ВПЧ [32].
Делеция рецептора витамина D в эксперименте сенсибилизирует эпителий к химически индуцированному опухолегенезу. Данный эффект вполне понятен, так как 1,25(OH)2D – мощный регулятор клеточной пролиферации, дифференцировки и апоптоза в различных типах клеток, включая кератиноциты. У мышей, гомозиготных по делеции рецептора витамина D (VDR(-/-)), пероральное введение канцерогена 7,12-диметилбензатрацена (ДМБА) вызывало развитие папиллом на всех участках тела со средней опухолевой нагрузкой в 5,3 папиллом/мышь. Никаких папиллом или каких-либо других поражений кожи не наблюдалось у мышей соответствующего возраста и пола без делеции рецептора витамина D (VDR (+/+)) [33].
У мышей линии VDR(-/-) начиная с семинедельного возраста отмечалась гиперпролиферация клеток кожи, которая резко усиливалась после воздействия ДМБА. Без воздействия канцерогена у мышей VDR(-/-) образования опухолей не наблюдалось, но имел место прогрессирующий фенотип кожи, характеризующийся утолщенной морщинистой кожей, дермоидными кистами и длинными вьющимися когтями. Усиленная чувствительность мышей VDR(-/-) к химически индуцированному канцерогенезу кожи убедительно доказывает, что нарушение сигнализации VDR предрасполагает к неоплазиям, вызываемым ВПЧ [33].
Согласно гистопатологическому анализу поражений кожи, у мышей VDR(-/-) обнаружены 94 опухоли на коже, которые были классифицированы по гистологическим подтипам (рис. 3). Большинство всех опухолей (40%) были сальными папилломами (рис. 3А) – доброкачественными поражениями, которые связаны с волосяными фолликулами, сальными железами и межфолликулярной дермой. Кроме того, встречались плоскоклеточные папилломы (25% поражений, рис. 3Б) и фолликулярные папилломы (15% поражений, рис. 3В). Такие виды поражений, как базально-клеточная карцинома (рис. 3Г) и гемангиома (рис. 3Д), выявлялись гораздо реже. Пигментированные поражения, классифицированные как меланотические очаги, которые обычно отсутствуют в мышиной коже, наблюдались у мышей с делецией VDR(-/-) (11% поражений). Меланотические очаги (рис. 3Е) состояли из агрегатов сильно пигментированных клеток с плохо выраженными цитоплазматическими признаками [33].
Витамин D оказывает антипролиферативное и продифференцирующее действие на кератиноциты, поэтому были исследованы биопсии кожи мышей VDR(-/-) посредством количественного определения пролиферативного маркера BrdU. Во всех опухолях мышей VDR(-/-) уровни BrdU были выше, чем рядом в здоровой коже (рис. 4 и 5). В большинстве опухолей пролиферация клеток ограничивалась одним слоем. В других случаях (особенно при плоских папилломах) BrdU-положительные клетки были сгруппированы в несколько слоев. Данные показывают, что расширение опухоли связано с дальнейшим усилением пролиферации эпидермальных клеток у мышей с делецией гена рецептора витамина D [33].
В клинико-эпидемиологическом исследовании более высокое потребление кальция и витамина D ассоциировалось с уменьшением риска развития неоплазии шейки матки (n = 2430, в том числе 405 случаев цервикальной неоплазии). По сравнению с самым низким квартилем потребления кальция риск заболевания дозозависимо понижался в двух верхних квартилях на 14% (ОШ 0,86, 95% ДИ 0,63–1,17) и 50% (ОШ 0,50, 95% ДИ 0,34–0,73) соответственно (p = 0,004). Более высокое потребление витамина D независимо снижало риск заболевания на 20% в третьем (ОР 0,80, 95% ДИ 0,56–1,15) и 36% в четвертом квартиле (ОР 0,64, 95% ДИ 0,43–0,94, p = 0,013) [34].
Таким образом, противовирусное и противоопухолевое действие витамина D позволяет предположить, что повышение обеспеченности этим витамином улучшит результаты терапии опухолевых заболеваний шейки матки. Действительно, в рандомизированном плацебоконтролируемом исследовании долгосрочное применение витамина D индуцировало регрессию цервикальной интраэпителиальной неоплазии [35].