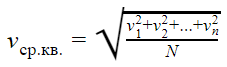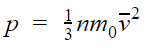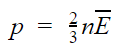Каковы параметры нормального состояния газа
Идеальный газ. Параметры состояния газа
Основные понятия идеального газа
Реальные газы хорошо описываются моделью идеального газа при достаточно больших разрежениях, т.е. когда среднее расстояние между молекулами газа во много раз больше размеров самих молекул. В этом случае силами притяжения между молекулами можно пренебречь, а силы отталкивания проявляются только при столкновениях молекул друг с другом в течение очень коротких промежутков времени. например, водород, кислород при нормальных условиях хорошо описываются моделью идеального газа.
Под нормальными условиями понимают состояние газа при температуре T=273 K и давлении p=101325 Па.
Состояние газов, удовлетворяющих модели идеального газа, описывается более простыми уравнениями, чем в случае реальных газов, в уравнениях для которых возникают многочисленные поправки, учитывающие взаимодействие между молекулами и их суммарный собственный объем. По сути, в модели идеального газа молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Параметры состояния газа. Макро- и микропараметры
Состояние любой термодинамической системы описывается ее макро- и микропараметрами.
Основными макропараметрами или параметрами состояния идеального газа являются давление, температура и объем.
Давление характеризует силу ударов молекул газа о стенки сосуда. Температура является мерой кинетической энергии поступательного движения молекул газа. Объем – это область пространства, занимаемая газом.
К микропараметрам относятся масса молекулы, ее скорость, импульс, кинетическая энергия.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называютравновесным.
Примеры решения задач
| Задание | Учитель записал на доске три утверждения, относящиеся к молекулам: |
1) размерами молекул можно пренебречь;
2) молекулы при столкновениях взаимодействуют как упругие шары;
3) при любом расстоянии между молекулами между ними действуют силы притяжения.
Какие из этих утверждений можно соотнести с моделью идеального газа?
а) все три утверждения;
б) только первое утверждение;
в) первое и второе утверждения;
г) первое и третье утверждения.
а) молекулы сталкиваются как упругие шарики;
б) размеры молекул пренебрежимо малы;
в) молекулы взаимодействуют с силами притяжения и отталкивания;
г) молекулы сталкиваются со стенками абсолютно упругими ударами.
а) при температурах, близких к абсолютному нулю;
§ 5. Параметры состояния газа
Главную роль в поведении газа играет хаотическое движение его молекул. Тепловое движение молекул многоатомного газа представляет собой поступательное и вращательное движение. Внутри молекулы атомы могут совершать еще и колебательное движение, однако при низких и средних температурах его роль незначительна, и только при очень высоких температурах колебательное движение атомов в молекулах газа вносит заметный вклад в тепловое движение.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа.
Основными параметрами состояния газа служат давление, температура и удельный объем. Эти параметры связаны между собой определенной зависимостью, которая называется уравнением состояния газа: давление газа прямо пропорционально средней кинетической энергии поступательного движения молекул газа и их числу в единице объема.
Различают атмосферное, избыточное и абсолютное давления газа.
Атмосферное давление, т. е. давление слоя воздуха, измеряется барометром и поэтому часто называется барометрическим.
Избыточное давление — давление сверх атмосферного — определяется с помощью манометра, отсюда его другое название — манометрическое.
Абсолютным называется действительное давление газа. Оно представляет собой сумму атмосферного и избыточного давлений.
Для того чтобы определить абсолютное давление газа, надо сложить показания двух приборов: барометра и манометра (в одинаковых единицах).
Если абсолютное давление ниже атмосферного, то оно определяется путем вычитания из показания барометра показания вакуумметра: Рабс=Рбар—Рвак.
Основное уравнение молекулярно-кинетической теории для идеального газа устанавливает связь легко измеряемого макроскопического параметра— давления — с такими микроскопическими параметрами газа, как средняя кинетическая энергия и концентрация молекул. Поэтому кроме измерения давления для нахождения микроскопических параметров газа нужны измерения температуры.
Шкалу температур, установленную по водородному термометру, у которой 0°С соответствует температуре таяния льда, а 100 С С — температуре кипения воды, называют шкалой Цельсия. Нуль на шкале Цельсия определен условно, размер градуса — произвольно. Это означает, что с научной точки зрения допустимо иное построение температурной шкалы.
Английский ученый Кельвин в середине прошлого века предложил новую температурную шкалу, которую теперь называют абсолютной термодинамической шкалой температур, иногда — шкалой Кельвина. За начало отсчета по этой шкале принята наименьшая теоретически возможная температура, так называемая температура абсолютного нуля, а размер градуса (Кельвин —К) определяют так, чтобы он по возможности точно совпадал с градусом Цельсия.
Температура 0°С по шкале Цельсия соответствует температуре 273 К по абсолютной шкале. Так как единица температуры по абсолютной шкале 1 К выбрана равной единице температуры по шкале Цельсия 1°Сто при любой температуре t по Цельсию значение абсолютной температуры Т выше на 273 градуса:
Из уравнения следует, что абсолютный нуль соответствует —273°С. 14
Удельным объемом газа называют объем единицы его массы. Определяют его как объем 1 кг газа, выраженный в кубических метрах. Удельный объем — величина, обратная плотности газа: Vуд=l/ρ.
Объем газа так же, как его удельный объем и плотность, зависит от условий, в которых находится газ (давление и температура).
При постоянной массе газа произведение объема V на давление ρ, деленное на абсолютную температуру газа Т, есть величина постоянная для всех состояний этой массы газа:
Параметры газа в нормальном состоянии
Вы будете перенаправлены на Автор24
Что такое внешние параметры
Существуют внешние и внутренние параметры состояния газа.
Внешними параметрами состояния называют параметры, которые зависят только от обобщенных координат внешних тел, с которыми взаимодействует система.
Пример внешнего параметра для газа является объем, который зависит от стенок сосуда.
Внутренними параметрами состояния газа являются параметры, которые определяются не только обобщёнными координатами, внешних тел, но и усредненными значениями координат и скоростей частиц входящих в систему.
К внутренним параметрам, можно отнести температуру.
Что такое давление
\[p=\rho \cdot g\cdot h\ \left(2\right),\]
В таком случае считают, что давление измеряется в м вод. ст. (метр водяного столба) или мм.рт.ст (миллиметр ртутного столба).
Давление иногда разделяют на: атмосферное, избыточное и давление в вакууме (т.е. ниже атмосферного).
Для однородного тела удельный объем:
Молярная масса и молярный объем
Молярной массой химически однородного вещества называют величину:
Иногда вместо массы газа рассматривают число его молекул (N) в заданном объеме:
Температурой (t, или T) называют физическую величину, характеризующую степень нагретости тела. Различают несколько видов температуры (в зависимости от используемой шкалы измерения).
Внутренние параметры газа, который находится в равновесном состоянии, зависят только от ее внешних параметров и температуры:
К примеру, равновесное состояние физически однородной термодинамической системы полностью определяется двумя параметрами. Поэтому состояние системы можно охарактеризовать уравнением:
Внутренняя энергия газа является аддитивной, то есть полная внутренняя энергия системы есть сумма внутренних энергий ее макрочастей. При невысоких температурах часто внутреннюю энергию идеального газа принимают равной суммарной кинетической энергии его молекул. Внутренняя энергия идеального газа зависит от термодинамической температуры T газа:
Для одноатомных газов:
Энтальпия смеси идеальных газов равна сумме энтальпий компонентов.
$
Готовые работы на аналогичную тему
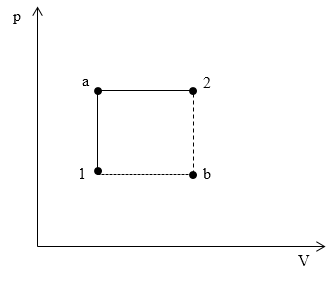
Задание: На графике в осях p(V) изображены обратимые процессы, производимые в идеальном газе. Сравните изменения энтропий идеального газа для процесса 1a2 ($\triangle S_<1a2>)$ и процесса 1b2 ($\triangle S_<1b2>)$.
Задание: Найти изменение энтропии идеального газа в адиабатном процессе, в изобарном процессе.
Запишем определение изменения энтропии для обратимого процесса:
Из уравнения Менделеева–Клайперона:
\[pV=\nu RT,\ при\ p=const,\ \to pdV=\nu RdT\]
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
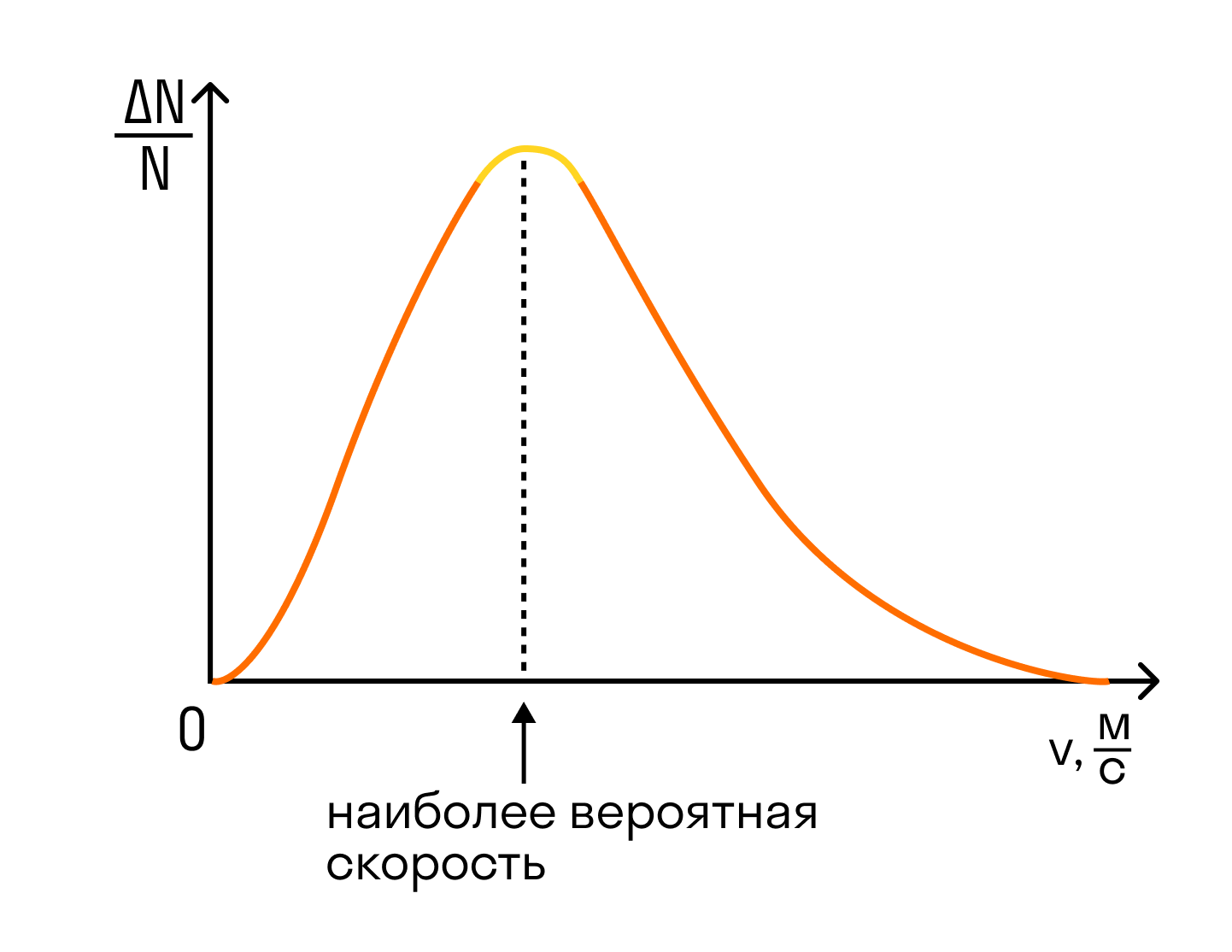
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
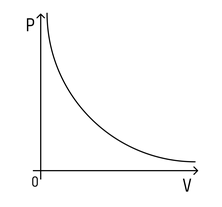
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
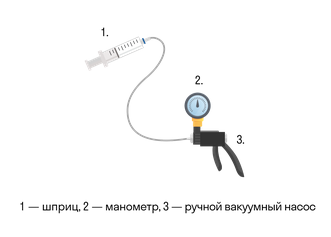
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
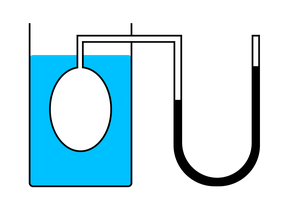
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
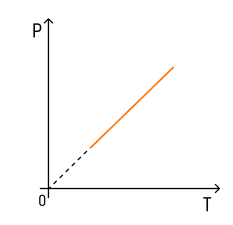
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Физические параметры и законы газового состояния
Параметры состояния газа
Основными параметрами, определяющими состояние газа, являются давление, температура и плотность или удельный объем.
Давление газа р обусловлено суммой сил ударов беспорядочно движущихся молекул газа о стенки сосуда, занятого этим газом, и численно равно величине нормальной составляющей силы, действующей на единицу поверхности, с которой соприкасается газ.
где F — нормальная составляющая силы; / — площадь, на которую действует сила.
Воздух земной атмосферы своей массой оказывает на поверхность Земли и окружающие предметы давление, называемое атмосферным, или барометрическим. Величина его в значительной мере зависит от высоты места измерения и температуры воздуха. На уровне моря при температуре 0° С барометрическое давление равно 760 мм рт. ст. Такое давление называют нормальным атмосферным давлением.
Если из сосуда удалять воздух, то в нем создается давление ниже атмосферного — разрежение. При полном удалении воздуха из сосуда давление становится равным нулю. Давление, отсчитываемое от нуля, называется абсолютным (рабс), а давление, превышающее атмосферное (барометрическое), — избыточным (ризб). В уравнениях, связывающих параметры состояния газа, применяют абсолютное давление; манометры показывают избыточное давление.
При измерениях разрежения (вакуума) соотношение (II.2) принимает вид
Абсолютная температура Т, °К, характеризует степень на- гретости тела. Измерение температуры можно производить на основании агрегатных изменений вещества под ее воздействием. В частности, в качестве исходных значений, служащих при построении Международной практической температурной шкалы Цельсия для установления начала отсчета температуры и единицы ее измерения — градуса, приняты температура плавления льда (0° С) и кипения воды (100° С) при нормальном атмосферном давлении. Температуры, лежащие выше 0° С, считают положительными, а лежащие ниже 0° С — отрицательными. В системе единиц СИ расчеты температуры производятся от абсолютного нуля в градусах термодинамической шкалы Кельвина. Абсолютный нуль этой шкалы (0° К) характеризуется прекращением теплового движения молекул вещества и соответствует по шкале Цельсия температуре —273,15° С. Таким образом, обе шкалы различаются лишь начальной точкой отсчета, а цепа деления (градуса) у них одинакова.
Плотность р — количество массы вещества в единице объема.
где т — масса вещества; V — объем вещества.
Удельный объем v — объем единицы массы вещества — величина, обратная плотности.
Критические параметры (табл. 11.1) характеризуют критическое состояние газа, при котором плотность жидкой и паровой фаз газа одинакова. Сжатием и охлаждением до определенной температуры газы могут быть переведены в жидкое состояние. Однако для каждого газа существует определенная критическая температура, выше которой газ никаким давлением не может быть сжижен. Давление, необходимое для сжижения газа при критической температуре, называют критическим давлением. Чем температура газа ниже критической, тем при меньшем давлении этот газ может быть сжижен. Объем газа, занимаемый при критических давлении и температуре, называют критическим объемом.