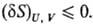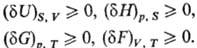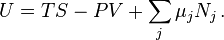Какой макроскопический параметр отвечает за термодинамическое равновесие
Термодинамика
Лекция 1. Предмет технической термодинамики и ее методы
1. Предмет термодинамики
2. Основные параметры состояния тела
3. Понятие о термодинамическом процессе
4. Гомогенные и гетерогенные термодинамические системы
5. Термодинамическое равновесие
1. Предмет термодинамики
Термодинамика наука о превращениях различных видов энергии из одного в другой, и о наиболее общих макроскопических свойствах материи. Она изучает различные как физические, так и химические явления, обусловленные превращениями энергии. Применение закономерностей термодинамики позволяет анализировать свойства веществ, предсказывать их поведение в различных условиях. Термодинамика дает возможность исследовать различные процессы от простых в однородных средах до сложных с физическими и химическими превращениями, биологических и др.
Слово «термодинамика» происходит от греч. «therme» – тепло и «dynamis» – сила. Название науки возникло в период ее основания – в начале XIX в. В настоящее время слово «термодинамика» трактуют так: наука «о силах, связанных с теплотой».
Термодинамика основана на двух, экспериментально установленных законах (началах).
Первый закон (начало) является по существу законом преобразования и сохранения энергии применительно к процессам, изучаемым в термодинамике; невозможен процесс возникновения или исчезновения энергии.
Второй закон (начало) – определяет направление течения реальных (неравновесных) процессов; невозможен процесс, имеющий единственным своим результатом превращение теплоты в работу.
Термодинамический метод исследования основан на законах (началах) термодинамики и представляет собой их логическое и математическое развитие.
Объект исследования в термодинамике называют термодинамической системой или, в простом случае, термодинамическим телом. Одна из особенностей метода термодинамики состоит в том, что система (тело) противопоставляется всем другим телам, которые называют окружающей средой. Термодинамика построена дедуктивно: частные выводы получены из общих законов (начал).
Принято разделять термодинамику на физическую, или общую, химическую и техническую.
Физическая термодинамика разрабатывает метод термодинамики и применяет его для изучения фазовых превращений термоэлектрических и магнитных явлений, излучения, поверхностных явлений и т. п.
Химическая термодинамика изучает процессы с физическими и химическими превращениями с помощью метода термодинамики.
Техническая термодинамика устанавливает закономерности взаимного преобразования теплоты и работы, для чего изучает свойства газов и паров (рабочих тел) и процессы изменения их состояния; устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, протекающими в тепловых двигателях и холодильных установках. Одна из основных ее задач – отыскание наиболее рациональных способов взаимного превращения теплоты, и работы.
Термодинамическое равновесие
На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией. Иными словами, термодинамическое равновесие достигается, если скорость релаксационных процессов достаточно велика (как правило, это характерно для высокотемпературных процессов) либо велико время для достижения равновесия (этот случай имеет место в геологических процессах).
В реальных процессах часто реализуется неполное (относительное, подвижное, динамическое) равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы — локальное равновесие,
неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе — частичное равновесие,
имеют место как локальное, так и частичное равновесие.В неравновесных системах происходят изменения потоков материи или энергии, или, например, фаз.
Связанные понятия
Упоминания в литературе
Связанные понятия (продолжение)
Внутренняя энергия термодинамической системы может изменяться двумя способами: посредством совершения работы над системой и посредством теплообмена с окружающей средой. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой. Теплота — это одна из основных термодинамических величин в классической феноменологической термодинамике. Количество теплоты входит в стандартные математические формулировки первого и второго.
О кинетическом контроле прохождения химической реакции говорят, когда из двух или более возможных продуктов реакции образуется преимущественно продукт более быстрой реакции, как правило, менее энергетически выгодный. В отличие от Термодинамического контроля, продукт кинетического контроля образуется при более низких температурах.
В теории твердого тела, термин геометрическая фрустрация (или просто фрустрация, значению этого термина в психологии посвящена другая статья, см. фрустрация) означает явление, при котором геометрические свойства кристаллической решетки.
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ, состояние термодинамич. системы, не изменяющееся во времени и не сопровождающееся переносом через систему в-ва или энергии. Если состояние системы не изменяется во времени, но есть поток в-ва или энергии через систему, состояние системы наз. стационарным. Изолированная система, не обменивающаяся со средой в-вом и энергией, со временем всегда приходит к термодинамическому равновесию и не может самопроизвольно из него выйти. Постепенный переход системы из неравновесного состояния, вызванного внеш. воздействием, в состояние термодинамического равновесия наз. релаксацией.
Буква d означает бесконечно малую вариацию величины, в т.ч. флуктуацию, в отличие от знака дифференциала, означающего действительно малое изменение величины в реальном процессе. Знак равенства имеет место при протекании в системе обратимых процессов, знак неравенства-необратимых (в случае изолир. системы). Принцип равновесия можно выразить также через термодинамические потен-циалы-внутр. энергию U, энтальпию H, энергию Гиббса G, энергию Гельмгольца F-при условиях, характеризуемых постоянством соответствующих параметров состояния. Термодинамическому равновесию отвечает условный минимум термодинамич. потенциалов:
Переход системы из одного состояния термодинамического равновесия в другое может происходить через последовательность состояний, каждое из к-рых является также состоянием термодинамического равновесия. Это означает, что параметры состояния в течение всего процесса перехода бесконечно мало отличаются от своих значений при термодинамическом равновесии. Это-равновесный (квазистатический) процесс. Реальные процессы перехода всегда неравновесны; они изучаются химической термодинамикой.
Наряду с основным (глобальным) максимумом энтропии и минимумами термодинамич. потенциалов, отвечающими стабильному термодинамическому равновесию, в пространстве параметров состояния возможны локальные максимумы энтропии и минимумы термодинамич. потенциалов. Соответствующие им состояния системы наз. метастабильными равновесиями. Такие состояния, как и состояние стабильного термодинамического равновесия, локально устойчивы, т.е. устойчивы к бесконечно малым изменениям параметров состояния. Но метастабильные состояния термодинамического равновесия могут быть неустойчивыми при нек-рых конечных изменениях параметров.
Под локальным термодинамическим равновесием в термодинамике неравновесных процессов подразумевается равновесие в очень малых (элементарных) объемах среды, содержащих все же достаточное число частиц (атомов, молекул, ионов), чтобы состояние этих объемов можно было характеризовать т-рой, давлением, хим. потенциалом и др. термодинамич. потенциалами, но не постоянными, а зависящими от координат и времени. При локальном термодинамическом равновесии элементарных объемов состояние системы в целом неравновесное.
Равновесие термодинамическое
Термодинамическое равновесие — состояние изолированной термодинамической системы, при котором в каждой точке для всех химических, диффузионных, ядерных, и других процессов скорость прямой реакции равна скорости обратной.
Термодинамическое равновесие можно делить на термическое, механическое и химическое равновесие, выделяя различные типы физических процессов, на которых достигнуто состояние равновесия.
Согласно нулевому началу термодинамики к термодинамическому равновесию стремится термодинамическая система, изолированная от внешних воздействий.
На практике условие изолированности означает, что процессы внутри системы протекают гораздо быстрее, чем обменные процессы с внешней средой.
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
Содержание
Устойчивость термодинамического равновесия
Из нулевого начала термодинамики следует устойчивость состояния термодинамического равновесия. В этом состоянии не меняются интегральные параметры системы (макропараметры) — температура, давление, плотность. Собственно, эти и другие макропараметры строго определяются только для систем, которые находятся в состоянии термодинамического равновесия.
В состоянии термодинамического равновесия не меняются также и различные вероятностные величины, например, функции распределения по энергиям и скоростям для всех составляющих системы (молекул, атомов, электронов, ионов). Для идеального газа, распределение частиц по энергиям в равновесном состоянии описывается функцией распределения Максвелла.
Достижимость термодинамического равновесия
В природе не существуют полного термодинамического равновесия. Всякая система в реальном мире изолирована лишь отчасти, и в каждой системе химические, ядерные процессы или процессы передачи энергии уравновешены лишь с определённой точностью. Невозможно достичь постоянства граничных условий вокруг какой-либо замкнутой области, также как невозможно бесконечно долго ждать момента наступления полного термодинамического равновесия в этой замкнутой области.
Но при этом в жизни есть множество примеров систем, достаточно близких к термодинамическому равновесию, чтобы получать полезные выводы из расчетов, проведённых в предположении термодинамического равновесия.
Примеры
Для герметического сосуда произвольной формы (это может быть закрытая стеклянная бутылка или, камера от велосипеда), наполненного любым газом или жидкостью и помещённым в другой сосуд, наполненный газом или жидкостью с постоянной температурой условия теплового равновесия выполняются.
Плазма, полученная в земных условиях, например, в газоразрядной камере всегда неравновесна. Энергия, поступающая в объём, из электрического разряда, уходит в окружающее пространство, например, с излучением из газа. Заряженные частицы, электроны усваивают энергию электрического поля и отдают её тяжёлым частицам — атомам и ионам в столкновениях. В этом случае говорят о локальном термодинамическом равновесии внутри малых объёмов или о приближённом термодинамическом равновесии внутри ансамблей частиц (электронов, ионов, атомов, фотонов). Поэтому в физике плазмы используют термины: температура электронов, температура ионов, температура атомов, подразумевая, что распределение каждого класса частиц по энергиям приближённо описывается функцией Максвелла, но со своей температурой.
Герметичный цилиндр, разделённый герметичным теплопроводящим поршнем, который перемещается без трения и разделяет объём цилиндра на две части, наполненные газом. Если давления и/или температуры с разных сторон поршня различаются, то он начнёт колебательное движение, которое со временем затухнет и система, ограниченная внутренностью поршня, перейдёт в состояние термодинамического равновесия — поршень неподвижен, давления и температуры с обоих сторон поршня одинаковы.
Критерии термодинамической устойчивости различных систем
См. также
Смотреть что такое «Равновесие термодинамическое» в других словарях:
РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ — состояние термодинамич. системы, в к рое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды. При Р. т. в системе прекращаются все необратимые процессы, связанные с диссипацией энергии … Физическая энциклопедия
РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ — системы характеризуется равенством температуры, давления и других макроскопических параметров всех ее частей и максимумом энтропии системы в целом (в условиях, если система не вращается и на нее не действуют внешние поля гравитационные и др.).… … Большой Энциклопедический словарь
РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ — см. Энтропия. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
равновесие термодинамическое — состояние термодинамической системы, характеризуемое равенством температуры, давления и других макроскопических параметров всех её частей и максимумом энтропии системы в целом (в условиях, если система не вращается и на неё не действуют внешние… … Энциклопедический словарь
Равновесие термодинамическое — состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды, после чего параметры состояния системы уже не меняются со временем. Изоляция… … Большая советская энциклопедия
РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ — статистическое равновесие, равновесное состояние, состояние, в к рое в конце концов приходит термодинамическая система, находящаяся при неизменных внеш. условиях. При этом система находится в состоянии механич. равновесия, темп pa всех её частей… … Большой энциклопедический политехнический словарь
РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ — состояние термодинамич. системы, характеризуемое равенством темп ры, давления и др. макроскопич. параметров всех её частей и максимумом энтропии системы в целом (в условиях, если система не вращается и на неё не действуют внеш. поля… … Естествознание. Энциклопедический словарь
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ — (см. РАВНОВЕСИЕ ТЕРМОДИНАМИЧЕСКОЕ). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ … Физическая энциклопедия
РАВНОВЕСИЕ СТАТИСТИЧЕСКОЕ — состояние замкнутой статистич. системы, в к ром ср. значения всех физ. величин, характеризующих состояние, не зависят от времени. Р. с. одно из осн. понятий статистической физики, играющее такую же роль, как равновесие термодинамическое в… … Физическая энциклопедия
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ — см. Равновесие термодинамическое … Большой Энциклопедический словарь
Какой макроскопический параметр отвечает за термодинамическое равновесие
Термодина́мика (греч. θέρμη — «тепло», δύναμις — «сила») — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц —термодинамические системы. Процессы, происходящие в таких системах, описываются макроскопическими величинами, такими как давление или температура, которые не применимы к отдельным молекулам и атомам.
Современная феноменологическая термодинамика является строгой теорией, развиваемой на основе нескольких постулатов. Однако обоснование этих постулатов и их связь со свойствами и законами взаимодействия частиц, из которых построены термодинамические системы, даётся статистической физикой. Статистическая физика позволяет выяснить также и границы применимости термодинамики.
Законы термодинамики носят общий характер и не зависят от конкретных деталей строения вещества на атомарном уровне. Поэтому термодинамика успешно применяется в широком круге вопросов науки и техники, таких как энергетика, двигатели, фазовые переходы,химические реакции, явления переноса и даже чёрные дыры. Термодинамика имеет важное значение для самых разных областей физики и химии, химической технологии, аэрокосмической техники, машиностроения, клеточной биологии, биомедицинской инженерии,материаловедения и находит своё применение даже в таких областях, как экономика.
Разделы термодинамики
Современную феноменологическую термодинамику принято делить на равновесную (или классическую) термодинамику, изучающую равновесные термодинамические системы и процессы в таких системах, и неравновесную термодинамику, изучающую неравновесные процессы в системах, в которых отклонение от термодинамического равновесия относительно невелико и ещё допускает термодинамическое описание.
В равновесной термодинамике вводятся такие переменные, как внутренняя энергия, температура, энтропия, химический потенциал. Все они носят название термодинамических параметров (величин). Классическая термодинамика изучает связи термодинамических параметров между собой и с физическими величинами, вводимыми в рассмотрение в других разделах физики, например, с гравитационным или электромагнитным полем, действующим на систему. Химические реакции и фазовые переходы также входят в предмет изучения классической термодинамики. Однако изучение термодинамических систем, в которых существенную роль играют химические превращения, составляет предмет химической термодинамики, а техническими приложениями занимается теплотехника.
В системах, не находящихся в состоянии термодинамического равновесия, например, в движущемся газе, может применяться приближение локального равновесия, в котором считается, что соотношения равновесной термодинамики выполняются локально в каждой точке системы. Однако в неравновесной термодинамике переменные рассматриваются как локальные не только в пространстве, но и во времени, то есть в её формулы время может входить в явном виде. Отметим, что посвящённая вопросам теплопроводности классическая работа Фурье «Аналитическая теория тепла» (1822) опередила не только появление неравновесной термодинамики, но и работу Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1824), которую принято считать точкой отсчёта в истории классической термодинамики.
Классическая термодинамика включает в себя следующие разделы:
Кроме этого, современная термодинамика включает также следующие направления:
Основы термодинамики
Термодинамика изучает системы, состоящие из очень большого числа частиц. Описание таких систем методами классической механики не только не представляется возможным, но и фактически лишено смысла. Особенности термодинамического описания возникают вследствие того, что поведение больших ансамблей частиц подчиняется статистическим закономерностям и не может быть сведено к анализу детерминированной эволюции динамических систем. Однако исторически термодинамика развивалась без опоры на представления статистической теории, и основные положения термодинамики могут быть сформулированы на основе ограниченного числа постулатов, являющихся обобщениями опытных фактов. Число этих постулатов варьируется у разных авторов в соответствии с тем, как строится аксиоматика термодинамики, но традиционно считается, что можно выделить четыре начала термодинамики.
Основные понятия термодинамики
Термодинамические системы
Термодинамическое равновесие
Фундаментальным для классической термодинамики является понятие термодинамического равновесия, которое тоже плохо поддаётся логическому определению и формулируется как обобщение экспериментальных фактов. Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы. При этом в системе на микроскопическом уровне могут происходить самые разные процессы, например, химические реакции, которые могут протекать и в прямом, и в обратном направлении, однако в среднем эти процессы компенсируют друг друга, и макроскопические параметры системы остаются неизменными, флуктуируя относительно равновесного значения. Флуктуации изучаются в статистической физике.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами. Если параметр имеет одно и то же значение, не зависящее от размера любой выделенной части равновесной системы, то он называется неаддитивным или интенсивным, если же значение параметра пропорционально размеру части системы, то он называется аддитивным или экстенсивным. Давление и температура — неаддитивные параметры, а внутренняя энергия и энтропия — аддитивные параметры.
Макроскопические параметры могут подразделяться на внутренние, характеризующие состояние системы как таковой, и внешние, описывающие взаимодействие системы с окружающей средой и силовыми полями, воздействующими на систему, однако это разделение достаточно условно. Так, если газ заключен в сосуд с подвижными стенками и его объём определяется положением стенок, то объём является внешним параметром, а давление газа зависит от скоростей теплового движения молекул и является внутренним параметром. Напротив, если задаётся внешнее давление, то его можно считать внешним параметром, а объём газа — внутренним параметром. Постулируется, что в состоянии термодинамического равновесия каждый внутренний параметр может быть выражен через внешние параметры и температуру системы. Такая функциональная связь называется обобщённым уравнением состояния системы.
Термодинамические процессы
Начала термодинамики
Нулевое начало термодинамики
Нулевое начало термодинамики названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными. Оно также называется общим началом. Термодинамическое равновесие предполагает наличие в системе механического, теплового и химического равновесия, а также равновесия фаз. Классическая термодинамика постулирует лишь существование состояния термодинамического равновесия, но ничего не говорит о времени его достижения.
В литературе в нулевое начало также часто включают положения о свойствах теплового равновесия. Тепловое равновесие может существовать между системами, разделёнными неподвижной теплопроницаемой перегородкой, то есть перегородкой, позволяющей системам обмениваться внутренней энергией, но не пропускающей вещество. Постулат о транзитивности теплового равновесия утверждает, что если два тела, разделённые такой перегородкой (диатермической), находятся в тепловом равновесии между собой, то любое третье тело, находящееся в тепловом равновесии с одним из этих тел, будет находиться также и в тепловом равновесии с другим телом.
Иначе говоря, если две замкнутые системы A и B приведены в тепловой контакт друг с другом, то после достижения термодинамического равновесия полной системой A+B системы Aи B будут находиться в состоянии теплового равновесия друг с другом. При этом каждая из систем A и B сама по себе также находится в состоянии термодинамического равновесия. Тогда если системы B и C находятся в тепловом равновесии, то системы A и C также находятся в тепловом равновесии между собой.
В иноязычной и переводной литературе часто нулевым началом называют сам постулат о транзитивности теплового равновесия, а положение о достижении термодинамического равновесия могут называть «минус первым» началом. Важность постулата о транзитивности состоит в том, что он позволяет ввести некоторую функцию состояния системы, обладающую свойствами эмпирической температуры, то есть создавать приборы для измерения температуры. Равенство эмпирических температур, измеренных с помощью такого прибора — термометра, есть условие теплового равновесия систем (или частей одной и той же системы).
Первое начало термодинамики
Первое начало термодинамики выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателяпервого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарнаяработа, совершённая системой. Так как работа и теплота не являются функциями состояния, а зависят от способа перехода системы из одного состояния в другое, применяется запись с символом δ, чтобы подчеркнуть, что δQ и δA — это бесконечно малые величины, которые нельзя считать дифференциалами какой-либо функции.
Знаки при δQ и δA в приведённом выше соотношении выражают соглашение о том, что положительной считают работу, совершаемую системой, и теплоту, получаемую системой, принятое в большинстве современных работ по термодинамике.
Работу, связанную с изменением количества вещества в системе (химическую работу), могут выделять из общего выражения для работы в отдельное слагаемое.
Второе начало термодинамики
Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в термодинамических системах, и исключает возможность создания вечного двигателя второго рода. Фактически к этому результату пришёл уже Сади Карно в сочинении «О движущей силе огня и о машинах, способных развивать эту силу». Однако Карно опирался на представления теории теплорода и не дал ясной формулировки второго начала термодинамики. Это было сделано в 1850—1851 годах независимо Клаузиусом иКельвином. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара». Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен.
Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому». Процесс, при котором не происходит никаких других изменений, кроме передачи теплоты от холодного тела к горячему, называется процессом Клаузиуса. Постулат утверждает, что такой процесс невозможен. Теплота может переходить самопроизвольно только в одном направлении, от более нагретого тела к менее нагретому, и такой процесс является необратимым.
Приняв за постулат невозможность процесса Томсона-Планка, можно доказать, что процесс Клаузиуса невозможен, и наоборот, из невозможности процесса Клаузиуса следует, что процесс Томсона-Планка также невозможен.
Третье начало термодинамики
Нулевые значения температуры и энтропии при абсолютном нуле приняты как удобные соглашения для устранения неоднозначности в построении шкалы для термодинамических величин. Нулевое значение температуры служит реперной точкой для построения термодинамической шкалы температур. Энтропия, обращающаяся в ноль при абсолютном нуле температуры, называется абсолютной энтропией. В справочниках термодинамических величин часто приводятся значения абсолютной энтропии при температуре 298,15 К, которые соответствуют увеличению энтропии при нагреве вещества от 0 К до 298,15 К.
Термодинамическое состояние
Динамическое, микро- и макросостояние
Моделирование всякой физической системы подразумевает указание полного набора параметров, необходимого для описания всех её возможных состояний и наблюдаемых величин. Описание термодинамических систем, состоящих из огромного числа частиц, варьируется в зависимости от того, какая степень детализации принимается для выбора набора параметров. Наиболее подробное описание в классической механике требует указания координат и импульсов всех частиц системы в какой-либо начальный момент времени и законов взаимодействия частиц, определяющих их эволюцию во времени. Описанное таким образом состояние системы называется динамическим. Для практических целей динамическое описание систем большого числа частиц непригодно. Следующим, более огрубленным уровнем описания является статистическое описание, когда динамические состояния усредняются по ячейкам фазового пространства в классической механике. В квантовой механике состояния различаются набором квантовых чисел и могут усредняться, например, по небольшим интервалам на шкале энергии. Такие состояния называются микросостояниями и изучаются в классической или квантовой статистической механике. Выбор способа описания системы зависит от характерных временных масштабов, на которых изучается эволюция системы.
Термодинамика имеет дело с макросостояниями, наиболее общим уровнем описания, где для указания состояния системы требуется минимальное число макроскопических параметров. Вообще говоря, проблема определения микро- и макросостояний и описания их статистических свойств относится к наиболее фундаментальным и пока не получившим окончательного решения вопросам статистической физики.
Функции состояния и уравнение состояния
При описании макросостояний используются функции состояния — это функции, однозначно определённые в состоянии термодинамического равновесия и не зависящие от предыстории системы и способа её перехода в равновесное состояние. Важнейшими функциями состояния при аксиоматическом построении термодинамики являются температура, внутренняя энергия и энтропия, вводимые в началах термодинамики, а также термодинамические потенциалы. Однако функции состояния не являются независимыми, и для однородной изотропной системы любая термодинамическая функция может быть записана как функция двух независимых переменных. Такие функциональные связи называются уравнениями состояния. Различают термическое уравнение состояние, выражающее связь между температурой, давлением и объёмом (или, что тоже самое, плотностью), калорическое уравнение состояние, выражающее внутреннюю энергию как функцию от температуры и объёма, и каноническое уравнение состояние, записываемое как термодинамический потенциал в соответствующих естественных переменных, из которого можно получить и термическое, и калорическое уравнения состояния. Знание уравнения состояния необходимо для применения общих принципов термодинамики к конкретным системам. Для каждой конкретной термодинамической системы её уравнение состояния определяется из опыта или методами статистической механики, и в рамках термодинамики оно считается заданным при определении системы.
Термическое уравнение состояния
Для многокомпонентной системы число термических уравнений состояния равно числу компонентов, например, для смеси идеальных газов эти уравнения состояния выглядят как p iV = ν iRT, где ν i — число молей i-го компонента смеси. Общее давление при этом будет равно сумме парциальных давлений компонентов, p=Σp i. Это соотношение называется законом Дальтона.
Термическое уравнение состояния фотонного газа устанавливает зависимость давления электромагнитного излучения от температуры и не содержит других переменных.
Для пространственно однородного элемента упругой среды при его продольной деформации примером термического уравнения состояния служит закон Гука; в термодинамике деформируемого твёрдого тела термические уравнения состояния, связывающие температуру и компоненты тензоров напряжений и деформаций, входят в число определяющих уравнений; для магнитных сред используют магнитное уравнение состояния M = M(H,T), примером которого может служить закон Кюри; для диэлектриков уравнение состояния имеет вид P = P(E,T); здесь M — магнитный момент вещества, H — напряжённость магнитного поля, P — поляризация, E — напряжённость электрического поля.
Существование термического уравнения состояния вытекает из закона транзитивности термического равновесия, однако сама термодинамика ничего не говорит относительно вида функциональной зависимости между входящими в это уравнение переменными, за исключением того, что уравнение состояния должно удовлетворять определённым условиям устойчивости.
Основные формулы термодинамики
Условные обозначения








Формулы термодинамики идеального газа
| Уравнение состояния идеального газа (уравнение Клапейрона—Менделеева) |  |
| Изменение внутренней энергии газа | 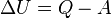 |
| Работа газа |  |
| Средняя энергия молекулы газа |  |
| Средняя кинетическая энергия молекулы газа: | 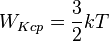 |
| Внутренняя энергия газа |  |
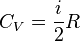

Выражение основных величин через термодинамические потенциалы
Все термодинамические потенциалы имеют свои канонические наборы переменных и используются для анализа процессов при соответствующих условиях. Так, для изотермических изохорических процессов (

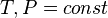
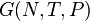


S(N,U,V) (энтропия)
F(N,T,V) (свободная энергия Гельмгольца)
G(N,T,P) (энергия Гиббса)
U(N,S,V) (внутренняя энергия)
Уравнение Гиббса и уравнение Гиббса—Дюгема
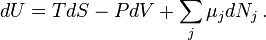
Значимость этого уравнения (и его более общих вариантов) состоит в том, что оно представляет собой тот фундамент, на котором базируется весь математический аппарат современной феноменологической термодинамики, как равновесной, так и неравновесной. По большому счёту, рассмотренные выше законы (начала) термодинамики нужны были именно для обоснования этого соотношения. Всю аксиоматику равновесной термодинамики можно свести к постулированию самого этого уравнения и свойств входящих в него термодинамических переменных.
С использованием других термодинамических потенциалов уравнение Гиббса можно переписать в следующих эквивалентных формах:

Среди термодинамических величин выделяют экстенсивные (внутренняя энергия, энтропия, объём и др.) и интенсивные (давление, температура и др.) величины. Величина называется экстенсивной, если ее значение для системы, сложенной из нескольких частей, равно сумме значений этой величины для каждой части. Предположением об экстенсивности термодинамических величин, однако, можно пользоваться, если рассматриваемые системы достаточно большие и можно пренебречь различными краевыми эффектами при соединении нескольких систем, например, энергией поверхностного натяжения. Пусть U (экстенсивная величина) является однородной функцией первого порядка от своих экстенсивных аргументов (математическое выражение аксиомы экстенсивности): для любого 0″ src=»http://upload.wikimedia.org/math/7/c/5/7c51dee4cd461ebcbbecf8fcee8d236a.png» style=»border:none;vertical-align:middle;margin:0px» />
Для любой дифференцируемой однородной функции первого порядка 
Для энергии 
Отсюда легко следует уравнение Гиббса — Дюгема:
Это уравнение показывает, что между интенсивными переменными существует одна связь, являющаяся следствием предположения об аддитивности свойств системы. В частности, непосредственным следствием соотношений Гиббса-Дюгема является выражение для термодинамического потенциала Гиббса через химические потенциалы 
Термодинамика сплошных сред
Приведённые выше формулировки аксиом термодинамики и соотношения для термодинамических потенциалов имеют место для простых систем — изотропных сред. Для более сложных сред — анизотропных жидкостей и твёрдых тел, сред с электромагнитными свойствами и других, законы термодинамики имеют более сложную формулировку, а термодинамические потенциалы формулируются в обобщенном виде с использованием тензоров. В физике сплошных сред (физике континуума) термодинамика рассматривается как её составная часть, вводящая в рассмотрение переменные, характеризующие тепловые (термические) и химические свойства среды, и их связь с другими физическими величинами, а аксиомы термодинамики включаются в общую систему аксиом.