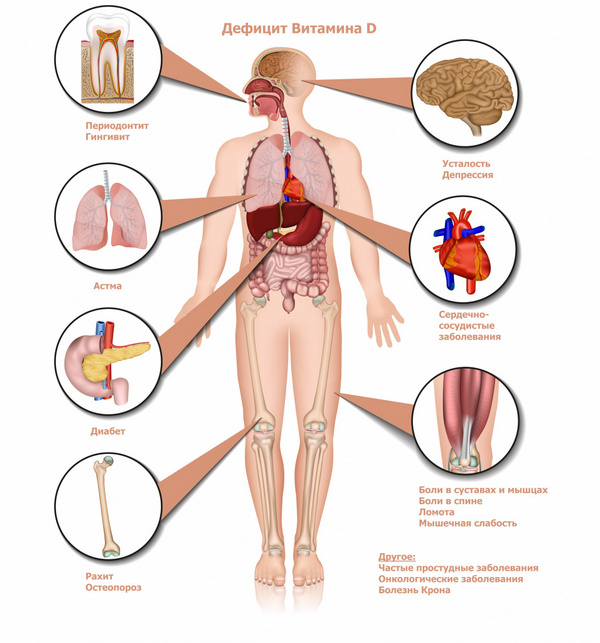
За что отвечает эктоплазма
«Мазок на флору»: о чём расскажет анализ?
Исследование «Мазок на флору» относится к микроскопическому виду анализа. Тест назначают при подозрении на инфекционный процесс репродуктивных органов.
Для проведения анализа необходимо получить мазок. У мужчин биотопом является уретра, у женщин — цервикальный канал, влагалище, уретра. Исходя из места локализации патологического процесса, врач может направить женщину сдать мазок только из влагалища или цервикального канала. Однако чаще требуются все три локуса сразу.
| Взятие мазка — процедура безболезненная и безопасная. Все беременные женщины также сдают мазок минимум три раза: первый визит, 30 и 36 неделя, при условии нормально протекающей беременности. Полученный мазок переносится на стекло, высушивается и окрашивается, после чего врач-лаборант исследует препарат под микроскопом и описывает его. Бланк результата содержит информацию о микрофлоре, лейкоцитах, эпителиальных клетках и патологических агентах. |  |
Микрофлора
В процессе анализа врач описывает её тип, обильность. В норме должна преобладать палочковая флора. Палочки являются представителями лактобактерий, поддерживают определенный уровень pH. Основная роль палочек — защита влагалища от болезнетворных микроорганизмов и стимулирование местных реакций иммунитета. Когда в мазке присутствует иные бактерии, например, кокковые, число палочек снижается. Такое состояние указывает на дисбиоз и требует обязательной коррекции.
Лейкоциты
Лейкоциты в мазке позволяют судить о наличии воспалительной реакции. Число лейкоцитов в графе «результаты» указывается через дефис. Первая и вторая цифры соответствуют минимальному и максимальному числу, обнаруженному в полях зрения микроскопа. Для каждого локуса есть свои референтные показатели. В цервикальном канале допустимо не больше 25 клеток в поле зрения, в уретре — не более 5, во влагалище — не более 10.
Увеличение абсолютного число лейкоцитов говорит о воспалении, поэтому необходимо получить консультацию гинеколога или уролога.
Эпителий
Эпителиальные клетки в препарате располагаются пластами или разрозненно в виде отдельных клеток. В мазке их число должно быть единичным. В случае увеличения количества клеток эпителия, врач указывает: умеренно — означает, что в одном поле зрения находятся до 10 эпителиальных клеток, много — до 20, обильно — свыше 25.
Изменение размера и морфологии клеток эпителия, могут косвенно говорить о воспалительной реакции или о проблемах гормонального характера. Клетки эпителия, покрытые по всей поверхности кокками, носят название «ключевых клеток». Обнаружение их в мазке является морфологическим критерием бактериального вагиноза.
Слизь
Значения «мало», «умеренно», «отсутствует» являются вариантом нормы. Если слизь присутствует в большем количестве, то это признак дисбиотических нарушений во влагалище.
Патологические элементы
В мазке врач может идентифицировать мицелий и споры дрожжеподобных грибков, трихомонады, актиномицетов, сперматозоиды и др. Но определить точную видовую принадлежность возбудителя не сможет из-за ограничений метода. Например, в урогенитальном тракте человека обитают несколько представителей рода Neisseriaceae, которые похожи между собой, поэтому отличить в стандартном микроскопе не представляется возможным.
Диагностическая чувствительность микроскопии при диагностике гонококковой инфекции в России составляет 30%, а трихомонадной инфекции — 44–68%. Микроскопия носит описательный характер, для точного определения вида возбудителя необходимо использовать молекулярно-биологические методы (ПЦР, NASBA) и культуральный метод.
За что отвечает эктоплазма
Кафедра акушерства, гинекологии и репродуктивной медицины, факультет повышения квалификации медицинских работников РУДН, Москва, Россия, 117198; GMS Clinics &
Hospitals, Москва, Россия,127018
Невынашивание беременности: вклад мужского фактора и возможности его преодоления
Журнал: Проблемы репродукции. 2017;23(5): 106-114
Лычагин А. С., Малинина О. Ю. Невынашивание беременности: вклад мужского фактора и возможности его преодоления. Проблемы репродукции. 2017;23(5):106-114.
Lychagin A S, Malinina O Yu. Miscarriage: the role of male factor and the methods of treatment. Russian Journal of Human Reproduction. 2017;23(5):106-114.
https://doi.org/10.17116/repro2017235106-114
Кафедра акушерства, гинекологии и репродуктивной медицины, факультет повышения квалификации медицинских работников РУДН, Москва, Россия, 117198; GMS Clinics &
Роль мужского фактора в невынашивании беременности многие годы была вне поля зрения специалистов репродуктивной медицины. В последнее десятилетие стало известно, что отцовский вклад в сохранение беременности не уступает, а по некоторым параметрам превосходит роль женского фактора. Функция спермы не ограничена лишь передачей генетической информации — она играет важную роль не только в оплодотворении, но и в процессах имплантации и эмбриогенезе. Научные открытия в эндокринологии, эмбриологии, цитологии, андрологии в последние годы позволили сформировать представление о важной роли мужского фактора. Сегодня мы начинаем лучше понимать, что эпигенетические изменения в сперме могут играть инициирующую роль в этиопатогенезе бесплодия и невынашивания. Нарушение целостности хроматина и ДНК сперматозоидов занимает далеко не последнее место в структуре причин репродуктивных потерь, что объясняет важность антиоксидантной и других видов терапии даже при нормоспермии.
Кафедра акушерства, гинекологии и репродуктивной медицины, факультет повышения квалификации медицинских работников РУДН, Москва, Россия, 117198; GMS Clinics &
Hospitals, Москва, Россия,127018
Согласно результатам проспективных когортных исследований, только около 1 /3 желанных зачатий завершается рождением живых детей. Менее 1 /3 зародышей гибнут до имплантации и еще столько же — после нидации плодного яйца, на 3—4-й неделе беременности, но до задержки менструации. Такие концепционные потери называют доклиническими. Частота ранней клинической потери беременности составляет около 15% от числа зачатий и увеличивается с возрастом, а поздние выкидыши (12—22 нед) случаются реже и составляют около 4% [1—6].
Спорадический выкидыш наиболее часто осложняет ранние сроки гестации и обычно свидетельствует о спонтанных мутациях и выраженных аномалиях эмбриона. Принято считать, что случайные потери беременности до 6—8 нед представляют собой «генетический сброс», предотвращающий рождение детей с серьезными аномалиями, несовместимыми с жизнью. Эту идею подтверждают результаты клинических исследований: в 75% случаев абортус имел аномальный кариотип, у 85% зародышей были зарегистрированы мальформации [7].
Хромосомные аберрации у эмбриона могут быть идентифицированы в 29—60% случаев привычной потери беременности, однако вклад генетических мутаций снижается по мере увеличения числа выкидышей у каждой конкретной женщины. Это указывает на наличие других механизмов аборта у пар с привычным невынашиванием [1, 8].
Обычно привычный выкидыш (прерывание 3 беременностей подряд и более) имеет множественную этиологию. Наиболее изученными причинами являются хромосомные аберрации, тромбофилия, иммунная дисфункция и различные эндокринопатии у матери. Однако многие такие случаи (50—60%) врачами оцениваются как идиопатические, когда установить точную причину потери беременности не удается [9].
В 2000-е годы появились новые теории о механизмах спорадического и рецидивирующего выкидыша. В ходе эпидемиологических и генетических исследований было показано, что самопроизвольный аборт может быть связан с изменениями морфологии сперматозоидов и целостности их ДНК. Новые взгляды на этиопатогенез выкидыша и роль мужского фактора открыли перспективное направление для разработки эффективных вмешательств, способных предотвратить часть репродуктивных потерь.
Функция спермы: смена взглядов
Ранее господствовало мнение, что единственная роль сперматозоида — доставка генетического кода в яйцеклетку, потомство наследует от отца только последовательность ДНК, при этом особенности упаковки ДНК сперматозоида не влияют на зиготу. Недавние работы [9] в области эпигенетики и бесплодия по причине мужского фактора пролили свет на эту давнюю, а теперь и спорную догму.
К настоящему времени стало известно, что функция спермы состоит не только в снабжении ооцита отцовскими генами — она вносит вклад в программу дальнейшего развития эмбриона. Помимо ДНК, сперматозоиды доставляют в яйцеклетку регуляторные элементы, необходимые для активации генов или для их «молчания» (фактор активации, центросомы, множественные матричные РНК и микроРНК и т. д.). По современным представлениям, экспрессия отцовских генов стартует на стадии 4—8 бластомеров [10, 11]. На этой ранней стадии эмбриогенеза даже минимальные нарушения в организации хроматина сперматозоида могут негативно сказаться на активации генов отца [12]. К настоящему времени известно как минимум три гена отца (H19-IGF2, RASGRF и DLK1-GTL2), участвующих в развитии зародыша, формировании трофобласта и плаценты [13, 14].
Повреждение ДНК сперматозоидов: роль в невынашивании беременности
Эпигенетические изменения, такие как метилирование ДНК, модификация гистонов, включение протамина в хроматин, оказывают большое влияние на развивающуюся клетку спермы, на зиготу и, как результат, на репродуктивные исходы [9, 15]. Любые сбои в эпигенетических модификациях или в механизмах, защищающих ДНК от фрагментации, приводят либо к повреждению самой ДНК, либо к изменению структуры хроматина. Когда эти изменения затрагивают значительную часть популяции сперматозоидов, формируется мужской фактор репродуктивных потерь. Фрагментация ДНК сперматозоидов и ее эпигенетическая модификация обусловливают появление гамет со сниженной способностью к оплодотворению и/или общей жизнеспособностью.
Однако даже при условии, что поврежденные сперматозоиды все-таки оплодотворяют яйцеклетку, вероятным результатом любого из вышеуказанных сценариев становится снижение протеолитической способности и неудачи имплантации, врожденные пороки развития и снижение общей жизнеспособности зародышевой клетки [9, 16—18]. В экспериментах на животных показано, что получить эмбрионы высокого качества на ранних стадиях развития можно даже при оплодотворении яйцеклетки сперматозоидом с поврежденной ДНК, но в дальнейшем развитие зародыша прекращается [19—22].
Следовательно, «отцовский материал» имеет важнейшее значение не только для возможности оплодотворения, но и для вынашивания беременности и рождения здорового ребенка [15].
Хроматин зрелых сперматозоидов восприимчив к повреждению ДНК внешними факторами. Чтобы избежать этого повреждения, хроматин претерпевает драматические структурные перестройки на поздних стадиях сперматогенеза, чему способствуют различные классы ядерных белков, включая гистоны, переходные белки и протамины 1 (Р1) и 2 (P2). К окончанию гаметогенеза структура хроматина уплотняется, что защищает ДНК от повреждения [15].
Целостность ДНК сперматозоидов имеет важное значение для реализации репродуктивной функции, поэтому измерение фрагментации ДНК спермиев можно считать важным дополнительным инструментом для прогнозирования мужского бесплодия [1, 23]. Зарубежные эксперты [1, 23] считают, что в будущем анализы, обнаруживающие повреждение ДНК спермы, могут быть введены в план обследования супружеских пар с привычным невынашиванием или бесплодием. Фрагментацию ДНК спермы можно обнаружить с помощью проточной цитометрии и/или флюоресцентной микроскопии.
Большинство эякулятов содержат сперматозоиды с фрагментацией ДНК в виде двойных или однонитевых разрывов. Нарушение целостности может произойти как до, так и после после эякуляции.
Подтверждена связь между повреждением ДНК сперматозоидов и выкидышем. В ходе метаанализа, включившего 16 исследований (2969 пар), было показано более чем двукратное повышение риска самопроизвольного аборта в супружеских парах, где у мужчин были обнаружены повышенные уровни повреждения ДНК спермы (ОР=2,16; p 96%). После курса терапии 87,6% мужчин оценили ее эффект как хороший и выраженный [84].
Представляют интерес результаты еще одного отечественного наблюдения. Целью работы была оценка эффективности биологически активного комплекса АндроДоз в лечении идиопатического мужского бесплодия [85]. В исследование были включены 30 инфертильных мужчин 25—45 лет с идиопатической патоспермией (олиго-, астено- или тетразооспермия), подтвержденной по критериям ВОЗ. Кроме того, оценивали состояние хроматина сперматозоидов. Условиями участия в наблюдении, помимо бесплодия, было отсутствие воспалительного процесса в репродуктивной системе, инфекционных факторов (по результатам ПЦР), выраженных аутоиммунных реакций (когда антиспермальные антитела покрывают не более 10% подвижных гамет).
Показатели эякулята анализировали до и во время лечения средством АндроДоз (схема приема — перорально по 2 капсулы утром и вечером).
Средний возраст участников составлял 34 года, а продолжительность инфертильности в среднем — 28,9 мес. Первичная инфертильность была выявлена у 18 (59%) человек.
Через 1,5 мес лечения показатели спермограммы (объем эякулята, концентрация, доли прогрессивно подвижных и морфологически нормальных сперматозоидов) существенно не изменились, но было отмечено снижение доли гамет со смешанной патологией (у 80% пациентов). Снизился и уровень оксидативного стресса (у 70%): продукция активных форм кислорода уменьшилась в 2—5 раз. Одновременно отмечали снижение доли сперматозоидов с фрагментацией ДНК (у 67% участников): индекс фрагментации уменьшился практически на четверть от исходного (в среднем на 4—5% в абсолютных числах) [85]. Полученные результаты вполне логичны, поскольку большинство ведущих экспертов признают взаимосвязь между уровнем активных форм кислорода в сперме, выраженностью окислительного стресса и фрагментацией ДНК сперматозоидов.
Результаты отечественных исследований показали, что прием биологически активной добавки АндроДоз позволяет повысить подвижность сперматозоидов и количество жизнеспособных форм, снизить вязкость семенной жидкости. В этих исследованиях также было отмечено снижение показателей оксидативного стресса, фрагментации ДНК.
Стоит упомянуть, что назначать антиоксидантную терапию суб- и инфертильным мужчинам следует с осторожностью — проверенными в клинической практике и сбалансированными препаратами, поскольку избыток «антиокислителей» может стать причиной деконденсации хроматина сперматозоидов [86, 87]. Нарушение баланса окислительных и антиокислительных агентов с превалированием последних может привести к избыточной элиминации свободных радикалов кислорода, которые необходимы для регуляции нескольких функций сперматозоида, и индуцировать ребаунд-эффект в виде восстановительного стресса [53, 88]. Например, доказано, что сверхдозы витамина С неоднозначно влияют на сперматогенез, могут инициировать денатурацию белков и неправильную упаковку ДНК [89]. По данным F. Absalan [86, 87], все это тоже может обусловить гестационные потери.
В этой связи важен выбор препарата. Средство для антиоксидантной терапии должно быть эффективным, безопасным и доступным для самостоятельного применения пациентами в прегравидарный период. Хороший вариант — комплексные средства, содержащие в своем составе антиоксиданты, минералы и другие микронутриенты, а в идеале — произведенные крупными фармацевтическими компаниями в надлежащих производственных условиях.
Автор заявляет об отсутствии конфликта интересов.
Гормоны в организме человека. За что они отвечают
Гормоны – биологически активные вещества, вырабатывающиеся клетками эндокринных желез (желез внутренней секреции). Оттуда они поступают в кровь и с кровотоком попадают в клетки и ткани-мишени.
Там они связываются со специфическими рецепторами и таким образом регулируют обмен веществ и множество физиологических функций. Так, они отвечают:
Как работает эндокринная система
Разные внешние или внутренние раздражители действуют на чувствительные рецепторы. В результате формируются импульсы, которые действуют на гипоталамус (отдел головного мозга). В ответ на них в гипоталамусе вырабатываются биоактивные вещества, поступающие по локальным сосудам в другой отдел головного мозга – гипофиз.
В ответ на их поступление в гипофизе вырабатываются гормоны гипофиза. Они попадают в кровь и, достигнув с кровотоком конкретной эндокринной железы, стимулируют в ней синтез того или иного гормона. А затем уже этот гормон поступает с кровью к гормональным рецепторам органов-мишеней, как описано выше.
По химическому строению гормоны делят на 4 вида
Стероиды – производные холестерина. Вырабатываются в коре надпочечников (кортикоиды) и половых железах (андрогены, эстрогены). В эту же группу входит кальцитриол.
Производные жирных кислот– эйкозаноиды. К ним относятся простагландины – повышают чувствительность рецепторов к боли и воспалительным процессам, тромбоксаны – участвуют в процессах свертывания крови, лейкотриены – участвуют в патогенезе бронхоспазма.
Производные аминокислот, преимущественно тирозина – гормон стресса адреналин, предшественник адреналина норадреналин и гормоны щитовидной железы.
Белково-пептидные соединения – гормоны поджелудочной железы инсулин и глюкагон, а также гормон роста соматотропин и кортикотропин – стимулятор синтеза гормонов коры надпочечников. В эту же группу входит антидиуретический гормон вазопрессин, «гормон материнства» окситоцин и ТТГ и АКТГ.
По месту образования выделяют гормоны:
По механизму действия различают гормоны:
По биологическим функциям различают гормоны, регулирующие:
Функции основных гормонов в организме
Список по названиям
Тестостерон — вырабатывается и у мужчин, и у женщин. Отвечает:
Эстрогены – женские половые гормоны. Отвечают за формирование первичных половых признаков у женщин. Обеспечивают репродуктивные функции и эмоциональное состояние. У мужчин вырабатываются в жировой ткани живота из тестостерона. Стимулируют синтез коллагена и обеспечивают эластичность кожи. Принимают участие в работе кровеносной системы.
Прогестерон – сохраняет беременность и обеспечивает менструальный цикл у женщин. Кроме этого, и у женщин, и у мужчин он:
Дигидроэпиандростерон – вырабатывается в головном мозге и надпочечниках.
Д-гормон (так называемый витамин Д):
ТТГ — тиреотропный гормон гипофиза. Регулирует выработку гормонов щитовидной железы трийодтиронина Т3 и тироксина Т4. При дисбалансе гормонов щитовидной желез развиваются гипер- и гипотиреоз.
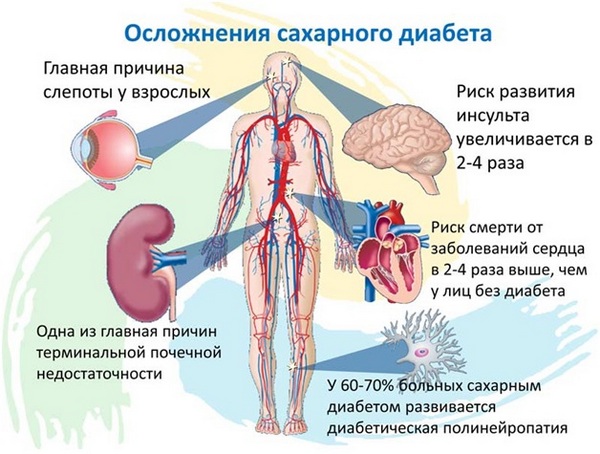
Инсулин – отвечает за усвоение глюкозы клетками. Стимулирует мышечный рост и аппетит. При нехватке инсулина развивается сахарный диабет. Избыток инсулина приводит к инсулинорезистентности (снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки), что ведет к ожирению и развитию сахарного диабета 2 типа.
Дигидротестостерон – влияет на рост волос, образование акне, увеличение простаты у мужчин.
Кортизол – образуется из прогестерона. Адаптирует организм к влиянию стресса, защищает от воспалений, аллергических реакций, поддерживает в норме артериальное давление.
Альдостерон – гормон коры надпочечников; образуется из прогестерона. Отвечает за обмен солей и воды в организме.
СТП (соматотропный гормон) – гормон роста, избыток которого ведет к развитию акромегалии.
В каких случаях нужно сдавать анализы на гормоны
Если баланс эндокринной системы нарушается, в организме развиваются изменения. Нередко достаточно предельно малых отклонений от нормы, чтобы запустить патологический процесс.
Достаточно долго такие патпроцессы могут протекать бессимптомно. Когда же появляется симптоматика, то нередко патогенез уже необратим. Чтобы выявлять бессимптомные гормональные нарушения на ранних стадиях современная доказательная медицина настоятельно рекомендует пакетные проверки. Один раз в 6-12 месяцев достаточно сдать кровь на анализ, чтобы оценить состояние эндокринной системы и не допустить развития гормональных заболеваний.
Кроме этого, о необходимости сдать анализ на гормоны может свидетельствовать ряд признаков:
Также обязательно контролировать уровень гормонов при беременности, чтобы не допустить аномалий развития плода.
При планировании беременности необходимо пройти обследование щитовидной железы: сделать УЗИ щитовидной железы, пройти исследования гормонов ТТГ, Т4 свободный (свободный тироксин) и АТ к ТПО (антитела к тиреопероксидазе)
Во время беременности, если есть нарушение функций щитовидной железы, необходимо 1 раз в триместр проводить скрининг гормона ТТГ и консультироваться у эндокринолога.
Главный «антистрессовый» гормон организма
Дегидроэпиандростерон или ДГЭА — является гормоном с андрогенной активностью. ДГЭА отвечает за развитие вторичных половых признаков, поддержание половой функции, а также обладает анаболическим действием. 90% гормона образуется в коре надпочечников, остальные 10% синтезируется у мужчин в семенниках, у женщин в яичниках.
Предшественником ДГЭА является холестерин. В свою очередь, ДГЭА преобразуется в другие стероидные гормоны. В организме мужчин ДГЭА конвертируется в более сильные андрогены: тестостерон и андростендион; у женщин — эстроген и прогестерон. Производство гормона происходит под контролем АКТГ.
Уровни ДГЭА достигают пика в юношеском возрасте, а затем постепенно снижаются. В 70–80 лет значения ДГЭА составляют лишь 10–20% от пикового значения в пубертатном периоде.
ДГЭА во многом работает как синергетический близнец другого гормона стресса — кортизола. Это помогает организму более эффективно адаптироваться к стрессовому воздействию. Стресс может быть любым: физическим, психическим и эмоциональным, но его воздействие всегда происходит длительно. Например, учеба, которая дается человеку с трудом или изнуряющие условия на работе — могут стать источником серьезных проблем для здоровья.
Исследования показали, что снижение уровня ДГЭА связано с аллергией, воспалением, усталостью, аутоиммунными проблемами, сексуальной дисфункцией, инфекциями, бессонницей, снижением когнитивных функций, сердечно-сосудистыми заболеваниями, потерей массы костной ткани, депрессией и раком.
ДГЭА и кардиоваскулярная патология
ДГЭА оказывает защитное действие по отношению к заболеваниям сердечно-сосудистой системы. Результаты исследования, опубликованные в 2014 г в журнале Американского колледжа кардиологов, показали, что низкий уровень ДГЭА в крови связан с риском развития коронарной болезни сердца у пожилых мужчин. Ученые из Гарвардской школы общественного здравоохранения обнаружили связь между низкими уровнями ДГЭА и высоким риском развития инсульта у пожилых женщин.
ДГЭА и остеопороз
ДГЭА улучшает минеральную плотность костной ткани и тормозит остеопороз. Особенно это важно для женщин, которые находится в постменопаузе и страдают от дефицита женских половых гормонов.
ДГЭА и сексуальное поведение
Здоровые уровни ДГЭА поддерживают здоровую сексуальную жизнь. ДГЭА улучшает либидо у мужчин и женщин в равной степени.
ДГЭА и когнитивные функции
Исследования показали, что ДГЭА поддерживает здоровые когнитивные функции и настроение. Гормон поддерживает производство и функционирование нейротрансмиттеров в мозге — химических веществ, которые влияют на память и настроение.
Было обнаружено, что ДГЭА обладает регенеративной активностью по отношению к тканям мозга. Люди, страдающие от болезни Альцгеймера, имеют низкий уровень факторов роста, жизненно необходимых для нервной ткани. ДГЭА может защитить тонкие ткани мозга, сохранив их.
Люди с низким уровнем ДГЭА более восприимчивы к тревоге и депрессии.
ДГЭА и метаболический ответ на инсулин
ДГЭА предотвращает развитие сахарного диабета. Гормон позволяет клеткам более эффективно усваивать глюкозу, тем самым снижая резистентность тканей к инсулину. Как известно, это ведущая причина развития сахарного диабета 2-го типа.
ДГЭА и здоровье иммунной системы
ДГЭА имеет решающее значение для укрепления иммунной системы. При хроническом стрессе уровень кортизола падает, и иммунная система оказывается подавленной. Но здоровые уровни ДГЭА могут уравновесить это состояние.
Некоторыми исследователями было продемонстрировано, что ДГЭА играет определенную роль в борьбе с аутоиммунными состояниями, особенно с красной волчанкой.
Недостаток ДГЭА способствует ряду заболеваний и состояний, поэтому для поддержания оптимального сердечно-сосудистого здоровья и жизнеспособности на протяжении всей жизни важно следить за уровнем ДГЭА. Возможно определение гормона в образцах крови, а также в образцах слюны.
Поскольку для хорошего здоровья имеет значение правильный баланс гормонов, поэтому уровень ДГЭА сопоставляют с уровнем кортизола.
Тестирование уровня ДГЭА и сохранение гормонального баланса между стресс-гормонами является ключом успеха на пути к долголетию. Хороший уровень ДГЭА поможет почувствовать себя моложе, сильнее и увереннее.