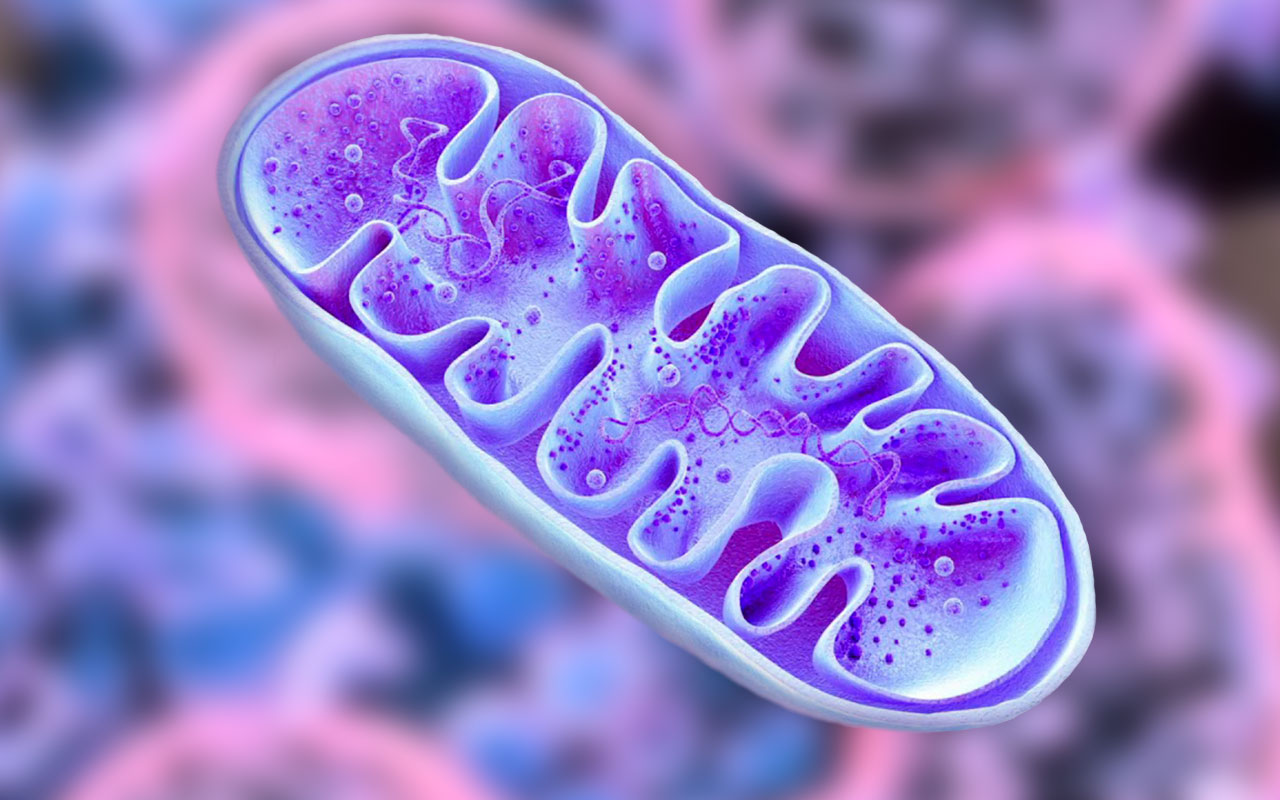
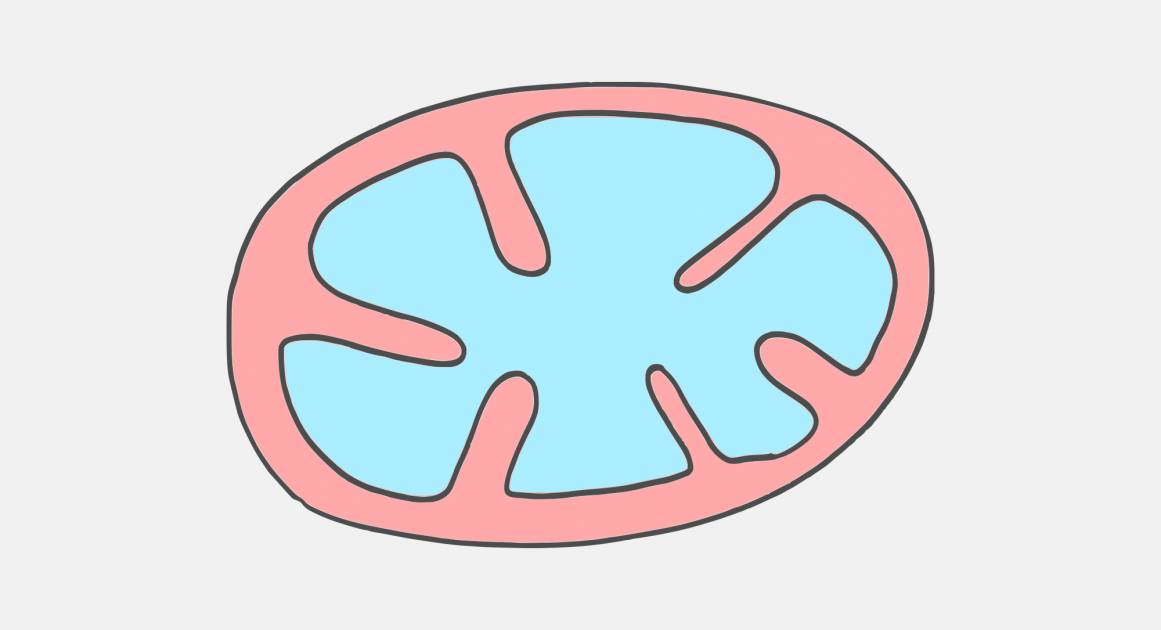
За что отвечает митохондрия в клетке человека
Митохондриальные заболевания
Митохондриальные заболевания (МЗ) — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках.
Историческая справка:
Понятие «митохондриальные болезни» сформировалось в медицине в конце ХХ века. В первую очередь были изучены болезни, связанные с мутациями митохондриальной ДНК, открытой в начале 60-ых годов. Полная первичная структура митохондриальной ДНК человека была опубликована в 1981 го¬ду и уже в конце 80-ых годов была доказана ведущая роль ее мутаций в развитии ряда наследственных заболеваний. К последним относятся: наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонусэпилепсия с «рваными» красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), синдром Кернса-Сейра (пигментный ретинит, наружная офтальмоплегия, блокада сердца, птоз, мозжечковый синдром), синдром Пирсона (поражение костного мозга, панкреатическая и печеночная дисфункции) и многие другие.
В меньшей степени изучены наследственные митохондриальные дефекты, связанные с повреждением ядерного генома.
Патогенез.
Митохондрии отвечают за выработку большей части энергии, необходимой для функционирования клеток. Фактически они являются настолько важным источником энергии, что в каждой клетке их сотни. При МЗ могут «выключиться» как часть митохондрий, так и все они, что приводит к прекращению выработки необходимой энергии
Поскольку наиболее энергоемкими являются нервные и мышечные клетки, при МЗ наиболее распространены мышечные и неврологические проблемы, такие, как мышечная слабость, непереносимость физических нагрузок, потеря слуха, нарушения баланса и координации, эпиприступы.
Когда клетка заполнена дефектными митохондриями, она не только лишена АТФ, но в ней могут накапливаться неиспользуемые молекулы топлива и кислород, что приводит к катастрофическим последствиям. В этом случае избыточные молекулы топлива используются для синтеза АТФ неэффективно, в результате чего могут образовываться потенциально опасные продукты, такие, как молочная кислота (Это также происходит, когда клетки испытывают недостаток кислорода, например – мышечные клетки при усиленных физических нагрузках). Накопление молочной кислоты в крови – лактатацидоз – ассоциировано с мышечной усталостью, и может вызывать повреждение нервной и мышечной тканей.
При этом неиспользуемый в клетке кислород может трансформироваться в разрушительные соединения, именуемые реактивными формами кислорода, включая т. н. свободные радикалы (Они являются мишенью для т. н. антиоксидантных препаратов и витаминов).
Синтезированная в митохондриях АТФ – основной источник энергии для сокращения мышечных и возбуждения нервных клеток (т. к. клетки этих тканей наиболее метаболически активны, энергетически зависимы). Таким образом, нервные и мышечные клетки особенно чувствительны к дефектам митохондрий. Комбинированный эффект от потери энергии и накопления токсинов в этих клетках, надо полагать, и вызывает развитие симптомов митохондриальных миопатий и энцефаломиопатий
Клиника
Характерные признаки митохондриальных цитопатий:
•скелетные мышцы: низкая толерантность к физической нагрузке, гипотония, проксимальная миопатия, включающая фациальные и фарингеальные мышцы, офтальмопарез, птоз
•сердце: нарушения сердечного ритма, гипертрофическая миокардиопатия
•центральная нервная система: атрофия зрительного нерва, пигментная ретинопатия, миоклонус, деменция, инсультоподобные эпизоды, расстройства психики
•периферическая нервная система: аксональная нейропатия, нарушения двигательной функции гастроинтестинального тракта
•эндокринная система: диабет, гипопаратиреоидизм, нарушение экзокринной функции панкреас, низкий рост
Таким образом, типичны для митохондриальных заболеваний вовлеченность разных органов и одновременное проявление внешне не связанных между собой аномалий. Примерами служат:
1. Мигрени с мышечной слабостью
2. Наружная офтальмоплегия с нарушением проводимости сердечной мышцы и мозжечковой атаксией
3. Тошнота, рвота с оптической атрофией и кардиомиопатией
4. Низкорослость с миопатией и инсультоподобным и эпизодами
5. Экзокринная дисфункция поджелудочной железы с сидеробластной анемией
6. Энцефало- миопатия с диабетом
7. Диабет с глухотой
8. Глухота с наружной офтальмоплегией, птозом и ретинопатией
9. Задержка развития или потеря навыков и офтальмоплегия, офтальмопарез
Характер и тяжесть клинических проявлений митохондриальных болезней определяется:
• тяжестью мутации мтДНК;
• процентным содержанием мутантной мтДНК в конкретных органах и тканях;
• энергетической потребностью и функциональным резервом органов и тканей, содержащих мтДНК (их “порогом чувствительности” к дефектам окислительного фосфори лирования).
Миопатия
Основные симптомы митохондриальной миопатии – истощение мышц и их слабость, и непереносимость физических нагрузок.
У некоторых индивидов слабость наиболее выражена в мышцах, контролирующих движения глаз и век. Два наиболее частых следствия такой слабости – это постепенный паралич движения глаз (прогрессирующая наружная офтальмоплегия, ПНО), и опущение верхних век (птоз). Зачастую люди автоматически компенсируют ПНО движениями головы для того, чтобы смотреть в различных направлениях, и могут даже не подозревать о каких либо проблемах. Птоз потенциально более неприятен, поскольку может ухудшить зрение, а также придает лицу апатичное выражение, но он может быть скорректирован хирургическим путем, либо использованием специальных очков с устройством для подъема века
Митохондриальные миопатии могут также вызывать слабость других мышц лица и шеи, что приводит к заплетающейся речи и трудностям с глотанием. В этих случаях могут помочь речевая терапия (занятия с логопедом) или включение в рацион питания таких продуктов, которые легче проглатываются.
Энцефаломиопатия
Митохондриальная энцефаломиопатия, как правило, включает некоторые из вышеупомянутых симптомов миопатии, дополненными одним или несколькими неврологическими симптомами. Также как и при миопатии, наблюдается значительная вариабельность симптомов обоего типа и тяжести течения у разных индивидов.
Среди наиболее частых симптомов митохондриальной энцефаломиопатии – нарушения слуха, мигренеподобные головные боли и эпиприступы. По крайней мере, в одном синдроме головные боли и эпиприступы часто сопровождается инсультоподобными эпизодами
Дополнительно к поражению глазных мышц, митохондриальная энцефаломиопатия может поражать как сами глаза, так и участки головного мозга, ответственные за зрение. Например, потеря зрения вследствие оптической атрофии (дегенерации зрительного нерва) или ретинопатии (дегенерации некоторых клеток, выстилающих глазное дно) – обычные симптомы митохондриальной энцефаломиопатии. По сравнению с мышечными проблемами, эти эффекты с большей вероятностью приводят к серьезным нарушениям зрения
Довольно часто митохондриальная энцефаломиопатия вызывает атаксию, или сложности с балансом и координацией.
Диагностика.
Ни один из отличительных симптомов митохондриального заболевания – мышечная слабость, непереносимость нагрузок, ухудшение слуха, атаксия, эпиприступы, неспособность к обучению, катаракта, диабет и низкорослость – не является уникальным именно для такого заболевания. Однако комбинация трех или более из этих симптомов у одного индивида свидетельствует в пользу митохондриального заболевания, особенно если симптомы затрагивают более одной системы организма
Физикальное обследование обычно включает в себя тесты на силу и выносливость, такие например, как повторяющиеся сжатия-разжатия кулака, или подъем и спуск по небольшой лестнице. Неврологическое обследование может включать в себя проверку рефлексов, зрения, речи и базовых когнитивных способностей.
Существует ряд рутинных клинических методов исследования, которые можно использовать при подозрении на митохондриальную цитопатию:
•лактатный ацидоз является практически постоянным спутником митохондриальных болезней (только этот признак является недостаточным для постановки диагноза, так как он может выявляться и при других патологических состояниях; в этом отношении может быть полезным измерение уровня лактата в венозной крови после умеренной физической нагрузки, например на велоэргометре)
•ЭЭГ – данные ЭЭГ не является достаточно специфическими
Образцы мышечных биоптатов целесообразно делить на три части – одна для микроскопического исследования (гистология, гистохимия и электронная микроскопия), вторая для энзимологического и иммунологического анализа (изучение характеристик компонентов дыхательной цепи) и третья – непосредственно для молекулярно-генетического анализа. Поиск известных мутаций на мышечном материале позволяет в большинстве случаев успешно осуществлять ДНК-диагностику болезни. При отсутствии из вестных мутаций мтДНК в мышечной ткани следующим этапом является развернутый молекулярно-генетический анализ – секвенирование всей цепи мтДНК (или кандидатных генов ядерной ДНК) с целью выявления нового варианта мутации.
Лечение.
Что касается терапии митохондриальных цитопатий, то речь может идти пока только о симптоматической.
Лечение митохондриальных болезней проводится обычно по двум основным направлениям:
•предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, a-липоевая кислота) и мембранопротекторов.
В практику входят всё новые препараты комбинированного действия, такие, например, как идебенон (Нобен) – улучшенный структурный аналог коэнзима Q10, благоприятно влияющий на активность дыхательного пути и обладающий выраженным антиоксидантным, антиапоптотическим и нейротрофическим действием.
Очевидно, что расширение терапевтического арсенала при митохондриальных болезнях диктует настоятельную необходимость того, чтобы практические врачи различных специальностей (неврологи, психиатры, педиатры, генетики, гематологи и др. ) были хорошо знакомы с алгоритмом диагностики этих заболеваний.
Митохондрии: энергостанции нашего организма
На молекулярном уровне наш организм можно рассматривать как своеобразный биологический механизм. Очень сложную, многогранную, но, тем не менее, машину, принципы работы которой мы сегодня начинаем понимать все лучше и лучше. И один из этих принципов является по-настоящему фундаментальным: никакая машина не сможет работать без притока энергии.
Для более простых механизмов этот принцип нам понятен, что называется, на интуитивном уровне. Двигатель автомобиля получает энергию, сжигая топливо в баке, телевизор использует энергию тока в розетке и так далее. Но вот с нашей собственной биологической машиной – нашим телом – все не так очевидно. То есть, наверняка наш читатель знает, что мы берем энергию из пищи (и об этом мы уже рассказывали более подробно). Но вот как именно это происходит? Где и как в нашем теле условные углеводы или жиры превращаются в ту движущую силу, которая необходима для всех без исключения процессов, протекающих в организме?
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Как появились митохондрии?
Один из важных вопросов, который давно беспокоил научную общественность: а откуда вообще взялись митохондрии в наших клетках? Самая современная и достоверная теория предлагает крайне необычный ответ: митохондрии – это потомки бактерий.
Давным-давно одноклеточные организмы, которым предстояло стать нашими предками, научились поглощать крохотные бактерии, присутствующие в окружающей среде. Если попросту – они ими питались. Но в один прекрасный день такая протобактерия не разрушилась, попав во внутриклеточную среду. И более того, она сохранила не только целостность, но и кое-какие свои функции. В частности, способность вырабатывать энергию с помощью кислорода. Каков до этого был механизм получения энергии у тех одноклеточных, которые впоследствии станут нами, известно плохо. Но с уверенностью можно сказать, что аэробный путь, предложенный им проглоченной бактерией, был однозначно более выгодным и эффективным.
Результатом этого удивительного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия упростилась, видоизменилась и стала необходимой клеточной органеллой. Этот союз оказался настолько успешным, что сейчас на нем построено энергоснабжение практически всех эукариотических клеток растений, грибов и животных. В том числе и нас с вами [1].
Как устроены митохондрии?
Многое в строении митохондрий до сих пор напоминает о том, что когда-то они были самостоятельными бактериями. Так, например, они окружены внешней липидной мембраной – такую мембрану имеют и все остальные клетки нашего организма. Основная функция внешней мембраны – защита митохондрии, отграничение ее от окружающей внутриклеточной среды, а также транспортировка необходимых веществ внутрь и выведение результатов ее работы наружу [2].
Внутреннее пространство митохондрии занимает матрикс. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. В матриксе проходит первая стадия кислородного дыхания, то есть, выработки энергии. Кроме того, здесь находится и еще одно свидетельство прошлой самостоятельности митохондрий – митохондриальная ДНК. Да, оказывается, не весь наш генетический материал помещен в клеточное ядро! Эти небольшие кольцевые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые нужны для работы самой митохондрии. В основном это ферменты, участвующие в дыхательной цепи окисления водорода [3].
Что еще интересно: люди наследуют мтДНК исключительно по материнской линии, а мтДНК, полученная от сперматозоида, разрушается сразу после оплодотворения [4]. Эта «женская» мтДНК мутирует по очень четким законам и поэтому можно отследить то, как именно она изменялась с течением времени. Ряд исследований последних лет убедительно доказал, что примерно 200 000 лет назад в Африке жила женщина, от которой свою мтДНК получило все современное человечество. Ученые поэтически назвали эту женщину «митохондриальной Евой» [5].
Наконец, между внешней мембраной и матриксом имеется и вторая, внутренняя мембрана. Она очень неровная и образует кристы – длинные складки, направленные к центру митохондрии. Именно их – как темные полосы – видели первые исследователи XIX века. На внутренней мембране как раз и происходит запасание энергии в виде молекул аденозинтрифосфата (АТФ). В процессе этого потребляется более 80% того кислорода, который попадает в нашу кровь при дыхании [6].
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
Опираясь на данные современных исследований, можно смело утверждать, что митохондрии, во-первых, активно участвуют во внутриклеточных процессах, а во-вторых, влияют и на физиологию всего организма. Такая «широкая специализация» стала причиной того, что нарушения работы митохондрий сегодня рассматривают как одну из важных причин появления множества заболеваний [12].
Что будет при нарушении работы митохондрий?
Очевидно, что самым первым и самым ярким проявлением дисфункции митохондрий будет уменьшение выработки энергии в клетке. На клиническом уровне такое обстоятельство может проявляться по-разному. И больше всего пострадают те ткани, которые работают максимально активно, а значит, требуют наибольшего притока энергии [13]:
Кроме того, учитывая другие функции митохондрий, о которых мы рассказывали выше, их неправильная работа может становиться фактором риска развития многих нарушений [14]:
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом [15]. Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки [16].
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины [17]. Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А [18]. Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения [19]. Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях [20].
Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса [21]. А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью. Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты. Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне [22].
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.
Митохондрии: как позаботиться о них и о своем здоровье?
Крошечные структуры внутри наших клеток связаны с болезнями сердца, старением и депрессией. Вот все, что нужно об этом знать
Примерно 2,5 млрд лет назад на Земле была заключена эпохальная сделка. Как гласит теория симбиогенеза, одноклеточные организмы, тогда еще не умевшие использовать кислород для жизни, приняли в себя бактерии, которые обладали этим ценным навыком, и так обзавелись собственными мини-фабриками по быстрому производству энергии.
Результат этой успешной бизнес-стратегии — наши митохондрии. Хоть эти крошечные органеллы (уменьшительное от «органа») давно живут внутри клеток, занимая около 25% их объема, они, похоже, не забыли о том, что когда-то были бактериями — у них, например, есть собственная ДНК. Стоит помнить об этом и нам, чтобы знать их слабые места и обеспечивать им правильное техобслуживание.
А это важно, потому что митохондрии выполняют много ключевых функций — от снабжения организма энергией до регулирования иммунитета. Именно проблемы с митохондриями многие ученые считают основной причиной старения и развития рака, сердечно-сосудистых заболеваний, диабета и болезней Паркинсона и Альцгеймера. Даже ментальные нарушения, возможно, связаны со сбоями в их работе.
Митохондрии и старение
Главная задача митохондрий — обеспечить организм энергией. Любой фабрике для производства нужно не только оборудование, но и сырье. Для митохондрий это сырье — глюкоза и жиры, которые мы получаем с пищей, и кислород, который мы вдыхаем: митохондрии используют 80% его объема из каждого вдоха.
Клетка перерабатывает сырье (глюкозу и жиры) в понятные для митохондрии метаболиты. Их митохондрия прогоняет с помощью кислорода через восемь последовательных реакций (они называются циклом Кребса) и превращает в топливо для наших клеток — АТФ. Задача этой молекулы — легко распадаться, выделяя максимум энергии, которую клетки направляют на строительные нужды. Синтез белков, запасание углеводов и жиров в организме и просто поддержание жизни — для всего этого нужно много АТФ. Впрочем, абсолютное количество этого вещества в организме не так велико — всего около 60 г, но АТФ постоянно распадается и воссоздается, и общий суточный оборот его примерно равен массе вашего тела.
Ни один механизм не совершенен. Наши внутриклеточные фабрики по производству АТФ — тоже. Когда митохондрия превращает глюкозу и кислород в энергию, образуется побочный продукт — активные формы кислорода. Они нестабильны и могут участвовать в совершенно ненужных реакциях, повреждая при этом клеточные структуры. Их влияние должны компенсировать антиоксиданты — активные формы азота или специальные белки. Они реагируют с активными формами кислорода и превращают их в безопасные соединения.
Вот как, например, описан механизм старения в потрясающем исследовании, опубликованном в Nature. Ученые создали генетически измененных мышей, клетки которых синтезировали и использовали дефектный рабочий белок. Обычно этот белок копирует митохондриальную ДНК перед тем, как митохондрия делится. Но дефектный белок при копировании не повторял ДНК дословно, а вносил случайные ошибки. В результате митохондриальные мутации у мышей накапливались быстрее, чем у обычных. При рождении и в раннем подростковом возрасте мыши-мутанты развивались нормально, но потом быстро приобретали старческие недуги: худели, теряли подкожный жир и лысели, у них развивались кифоз, остеопороз и анемия, фертильность снижалась, а сердце аномально увеличивалось. Такие мыши жили недолго.
Митохондрии и мозг
Основной потребитель энергии митохондрий — мозг: ему нужно в 10 раз больше кислорода и глюкозы, чем другим тканям. Потому дисфункция митохондрий еще и приводит к гибели нейронов, а гибель нейронов — к нейродегенерации и болезням Альцгеймера и Паркинсона, предполагают ученые.
Чтобы понять, как дисфункция митохондрий связана с болезнью Паркинсона, исследователи из Великобритании и Германии проанализировали состояние митохондрий и мозга здоровых пожилых людей и пожилых с болезнью Паркинсона. Сначала они взяли образцы мозга, тонко порезали и опустили в специальный краситель. Этот краситель связывается с одним из белков, который митохондрии используют для синтеза АТФ, — цитохромом С. Потом отмыли ткани мозга. Нейроны покрасились, но особенным образом: чем ярче окрас, тем больше цитохрома С в нейроне и тем здоровее митохондрии.
Яркие нейроны с большим количеством цитохрома С оказались у здоровых пожилых людей. У людей с болезнью Паркинсона нейроны окрасились не так ярко. Их митохондрии страдали от дефицита белка и хуже превращали кислород и глюкозу в энергию: у них попросту не хватало оборудования.
Возник новый вопрос: почему в митохондриях людей с болезнью Паркинсона так мало цитохрома С? Ученые предположили: ген митохондрий повредился так неудачно, что они не производят достаточно этого белка. Так и оказалось: информация потерялась, а почему — неизвестно. Поврежденные нейроны с неполным геномом были и у здоровых, и у больных пожилых людей. При Паркинсоне их просто было намного больше, а у здорового молодого человека — не было вовсе.
Как именно здоровье митохондрий влияет на нейроны? Исследовать мозг живого человека сложно, поэтому обратимся к исследованиям на мышах. Но сначала вспомним важную вещь: чтобы синтезировать АТФ, митохондрии добывают энергию из кислорода и еды. Но не вся эта энергия идет на синтез АТФ. Часть митохондрии тратят на обогрев тела, часть — на образование активных форм кислорода. А чтобы рассеивать энергию в виде тепла и согреть тело, у митохондрий есть специальные белки.
С этими белками и поиграли ученые, создав мышей с дефектами: одни не могли эффективно синтезировать белки для рассеивания тепла, другие — наоборот, синтезировали их больше обычного. Митохондрии мышей с недостатком белков-энергоотводов производили больше активных форм кислорода: энергии просто некуда было деться. У этих мышей еще и было меньше митохондрий в нейронах. То есть нейроны получали и больше вреда, и меньше энергии. Потом ученые использовали на мышах нейротоксин, который вызывает гибель нейронов и Паркинсон. Мыши с недостатком белков заболевали гораздо быстрее.
Митохондрии и иммунитет
Бактерия слилась с клеткой, стала производить для нее энергию — и стала митохондрией. Скорее всего, изначально эта бактерия обеспечивала хозяина еще и защитой. Активные формы кислорода она использовала, чтобы разрушить и переварить захваченные клеткой патогены — бактерии или вирусы. Возможно, именно это сотрудничество стало нашей иммунной системой.
Сейчас митохондрии помогают организму быстро и эффективно реагировать на травмы. Когда клетки повреждаются, высвобождается митохондриальная ДНК — и попадает в кровь. Митохондриальная ДНК похожа на бактериальную, поэтому организм считывает это как сигнал опасности и активирует иммунный ответ.
А еще митохондрии активируют иммунные клетки. Например — макрофаги. Когда макрофаги получают от организма сигнал, что в тело проник патоген, митохондрии макрофагов переквалифицируются из энергостанций в военные сооружения. Они перестают синтезировать АТФ и полностью переходят на синтез активных форм кислорода. Активные формы кислорода, во-первых, говорят организму, что самое время начать сражение с патогеном, а во-вторых, и сами могут его уничтожить.
Митохондрии активны и в Т-клетках. Это спецагенты иммунитета, которые проверяют другие клетки на наличие вирусов, а если находят заболевшие — уничтожают. Как и другие митохондрии, митохондрии Т-клеток сливаются друг с другом и, наоборот, разделяются, меняют форму и размер, чтобы адаптировать процесс производства энергии к состоянию организма. Когда все спокойно, они длинные: это помогает эффективнее работать и производить меньше активных форм кислорода. Но когда организм идентифицирует угрозу (это может быть физическая травма, например), митохондрии Т-клеток фрагментируются — и в крови становится много коротких сегментов митохондриальной ДНК. В таком состоянии митохондрии образуют больше активных форм кислорода и тем самым дают иммунитету понять, что пора действовать.
Митохондрии и психика
Когда мышь испытывает психологический стресс, ее Т-клетки активируются, а митохондрии фрагментируются так же, как если бы ее организм столкнулся с вирусом. Если же создать таких мышей, Т-клетки которых всегда активны, а митохондрии — фрагментированы, они будут тревожными, заторможенными, нелюбопытными и лишенными всякой мотивации. А это уже классическая депрессивная симптоматика. Что ставит перед учеными новый вопрос: что, если митохондрии виноваты в проблемах с настроением у человека?
Чтобы проверить гипотезу, исследователи заставили крыс конкурировать за социальную иерархию. Доминирующие позиции заняли животные с меньшим уровнем тревожности. Потом ученые изучили митохондрии прилежащего ядра мозга крыс — отдела, который регулирует эмоции и поведение что у грызунов, что у людей. Оказалось, у крыс-аутсайдеров митохондрии функционируют хуже. А еще в них меньше белков для превращения кислорода и глюкозы в энергию — то есть не хватает оборудования, чтобы митохондрия работала эффективно. Различие оказалось врожденным.
Неизвестно, делают ли нас, людей, тревожными и депрессивными врожденные особенности митохондрий так же, как и грызунов. Но на стресс митохондрии человека реагируют тем же образом. В одном эксперименте, например, людей подвергли стрессу: обвинили в краже или нарушении ПДД — и заставили за две минуты продумать стратегию защиты. В крови участников увеличилось количество митохондриальной ДНК, которая активировала иммунную реакцию, — совсем как в случае с мышами.
Как оценить состояние митохондрий?
Надежного и доступного не-ученым теста для оценки состояния митохондрий пока нет, хотя изобрести его исследователи пытаются. По словам биолога-физиолога, научного сотрудника Университета 2035 Екатерины Зворыкиной, все же есть два метода, которые позволяют примерно понять, насколько корректно они работают.
I. Эргоспирометрия
Простой способ оценить функциональность митохондрий — эргоспирометрия, которую регулярно делают спортсмены. До и во время выполнения физической нагрузки у человека регистрируют ЭКГ и отслеживают потребление кислорода. Человек бежит по беговой дорожке, а параллельно происходит анализ газообмена. Потом данные сравнивают с состоянием покоя и выводят коэффициент. Если показатель не соответствует норме, это может говорить о перетренированности. А перетренированность — косвенный признак, что митохондрии в плохом состоянии.
Информация полезна тем, кто много и усиленно тренируется. Остальным вряд ли стоит делать тест. Если результат плохой, это может говорить о развитии рака и ряда хронических заболеваний, но для их мониторинга есть и более удобные чекапы.
II. Биохимические тесты
Более точный метод — анализ биохимических маркеров. Помогут следующие тесты.
Но важно помнить: биохимические анализы разработаны для диагностики митохондриальных заболеваний, а не для оценки состояния митохондрий здоровых людей. То же повышение уровня лактата может быть маркером перетренированности, а может говорить о самых разных заболеваниях: от митохондриальной дисфункции до ишемической болезни. Интерпретировать результаты анализов нужно с врачом.
Как помочь митохондриям?
Главная причина нездоровья митохондрий — окислительный стресс, когда активных форм кислорода слишком много. Лекарств для митохондрий пока нет. Но помочь им можно, скорректировав образ жизни. Вот главные интервенции, которые советует биохимик и биохакер Екатерина Щербакова, научный сотрудник ФГБНУ «ЦНИИТ» и автор книги «Питание биохакера».
Ограничить калории
Мы едим, чтобы кормить митохондрии. И для них важно, сколько мы едим. Ограничение калорийности — единственная диета, которая безоговорочно увеличивает продолжительность жизни у лабораторных организмов: от дрожжей и мух до грызунов и обезьян. У них снижается уровень воспаления, а аутофагия, естественный процесс избавления от «клеточного мусора», активируется. В том числе активируется митофагия — аутофагия митохондрий, что позволяет удалять неработающие митохондрии.
Одновременно с этим повышается уровень нейротрофического фактора мозга (BDNF), что способствует формированию новых нейронов и синапсов. В результате ограничение калорий замедляет гибель нейронов у животных с болезнями Хантингтона, Альцгеймера, Паркинсона. А еще — снижает частоту возрастных заболеваний: рака, диабета, болезней сердца.
Почему так? Молекулярных бонусов ограничения калорий несколько. Например, оно приводит к восстановлению одного из главных клеточных антиоксидантов — глутатиона, а также уровня кофермента NAD+, который помогает превращать питательные вещества в энергию. А еще голод активирует сиртуины. Эти белки имеют две функции. Во-первых, выключают гены, использовать которые клетка в режиме голода не должна. Во-вторых, участвуют в устранении повреждений ДНК, в том числе — вызванных активными формами кислорода.
Морить себя голодом ради здоровья митохондрий не нужно. Достаточно урезать суточную калорийность рациона на 25%. Так сделали в одном американском исследовании со здоровыми людьми с лишним весом. Женщины, например, вместо 2200 ккал съедали 1650 ккал — что меньше нормы, но не настолько, чтобы мучиться от голода. Через шесть месяцев у участников эксперимента уменьшилось повреждение митохондриальной ДНК. Митохондрий стало больше, и они стали эффективнее функционировать. Похожие эффекты ученые наблюдают и у мышей при интервальном голодании.
Почему голод помогает митохондриям? С точки зрения организма, клетка в бедственном положении. Она бросает все силы на производство энергии. При этом активируются ферменты антиоксидантной защиты, репарации. В результате увеличивается и количество, и работоспособность митохондрий.
Кормить митохондрии витаминами и антиоксидантами
Просто ограничить калории недостаточно. Митохондрии нуждаются в витаминах, микроэлементах и антиоксидантах.
Подкармливать кишечные бактерии гранатом и орехами
В кишечнике человека живет множество бактерий. Среди них есть союзники, которые помогают иммунной системе распознавать патогены. Эти кишечные бактерии общаются не только с иммунными клетками, но и с митохондриями.
Странно ли это? Вовсе нет, если вспомнить о бактериальном происхождении митохондрий. Общаются митохондрии и бактерии на языке метаболитов. Например, бактерии выделяют короткоцепочечные жирные кислоты, которые нужны митохондриям для синтеза АТФ. Или уролитин А — вещество, которое активирует митофагию — процесс уничтожения дефектных митохондрий, которые уже производят не энергию, а активные формы кислорода.
Уролитин А синтезируют бактерии Eggerthellaceae. Они используют для этого вещества, которые есть во фруктах и ягодах (гранат, малина) и орехах (идеальный вариант — грецкий). А еще для Eggerthellaceae и для других кишечных союзников полезны клетчатка, ферментированная пища, пробиотики и пребиотики.
Больше двигаться
Самый эффективный способ улучшить работу митохондрий — регулярные тренировки: они увеличивают и количество, и качество митохондрий. Так происходит потому, что сокращение мышц — процесс энергозатратный. Сами по себе мышцы не сокращаются. Чтобы их стимулировать, организм использует АТФ. А АТФ синтезируют митохондрии. Потому стоит нам начать двигаться, как клетки адаптируются, чтобы получать больше АТФ: ведь она теперь активнее тратится.
Мышечные клетки ускоряют работу своих митохондрий: синтезируют белки, необходимые для расщепления жирных кислот, — и отправляют их в митохондрии. Митохондрии получают больше белков, расщепляют жиры быстрее, используют больше кислорода и глюкозы — и синтезируют больше АТФ. Параллельно мышечные клетки запускают процесс биогенеза митохондрий. Митохондрий в клетке становится больше — и мы получаем больше АТФ.
Но и это еще не все. Когда мы занимаемся спортом, клетка остро нуждается в АТФ и поднимает планку для митохондрий. Чтобы отсеять плохо работающие органеллы, она активно синтезирует специальные белки, которые проверяют, насколько хорошо те работают. Если белки обнаруживают, что митохондрия работает так себе, клетка ее уничтожает. Иными словами, когда мы активно двигаемся, мы избавляемся от дефектных митохондрий.
Тренироваться разнообразно
Различные типы тренировок воздействуют на различные типы мышечных волокон — и по-разному влияют на митохондрии. Обычно советуют аэробные тренировки: одного упражнения на выносливость уже достаточно, чтобы митохондрии стали работать немного эффективнее. При длительных тренировках объем митохондрий обычно увеличивается на 40–50%, и это происходит параллельно с улучшением работы митохондрий.
Но аэробные тренировки бывают разными — и по-разному влияют на мышцы и митохондрии. Продолжительные кардионагрузки вроде длительного бега, плавания и езды на велосипеде задействуют в первую очередь медленные мышечные волокна и митохондрии в них. Для адаптации митохондрий в красных мышечных и белых мышечных волокнах нужна высокоинтенсивная, но короткая тренировка. Например, интервальная тренировка спринта (SIT) или интервальная тренировка высокой интенсивности (HIIT) — они сочетают и аэробную, и анаэробную нагрузку.
А вот польза чисто анаэробных тренировок для митохондрий — вопрос спорный. Раньше считалось, что силовые тренировки не так хороши, как кардио: они увеличивают объем мышц, но не меняют качество самих мышечных клеток, а значит, не влияют на работу митохондрий. Но появляются новые данные, согласно которым упражнения с отягощениями стимулируют биогенез митохондрий в мышцах и производство митохондриями энергии [1, 2]. Так что самое практичное решение — сочетать разные типы нагрузки: и бегать на длинные дистанции, и делать интервальные тренировки высокой интенсивности, и не забывать про силовые тренировки.
Не забывать отдыхать
Спорт для митохондрий полезен, но не когда его слишком много. Если перестараться, можно повредить мышечные клетки, что приведет к их атрофии и синдрому перетренированности. А еще изнурительные тренировки стимулируют повышенное образование активных форм кислорода, что вредит митохондриям.
Также по теме. Микробиом: как полюбить полчища населяющих нас бактерий. Ссылка.