Заболевание ледда что это
Мальротация
Внутриутробно данная аномалия развития себя никак не проявляет, за исключением тех случаев, когда возникает заворот кишки, что чаще всего приводит к формированию атрезии или развитию внутриутробного перитонита. Существуют единичные публикации о диагностике заворота внутриутробно.
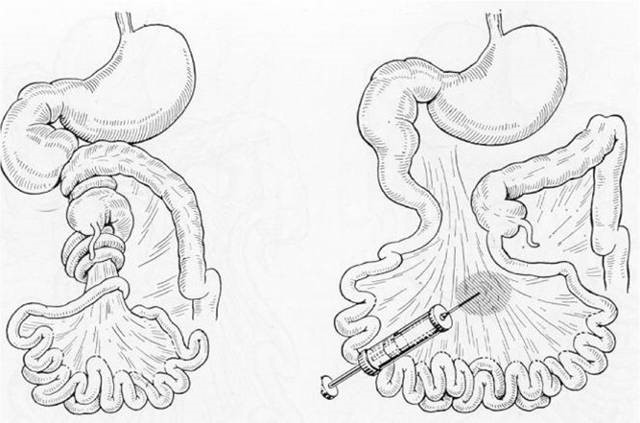
Наиболее часто встречающимся вариантом мальротации среди всего разнообразия патологии ротации и фиксации кишечника у новорожденных детей является синдром Ледда. Полное представительство синдрома Ледда включает в себя: 1) высокое расположение купола слепой кишки; 2) гиперфиксация двенадцатиперстной кишки эмбриональными тяжами Ледда, идущими от купола слепой кишки к двенадцатиперстной кишке; 3) заворот средней кишки.
При подозрении на высокую кишечную непроходимость ребенок должен незамедлительно госпитализирован в специализированное отделение и консультирован хирургом.
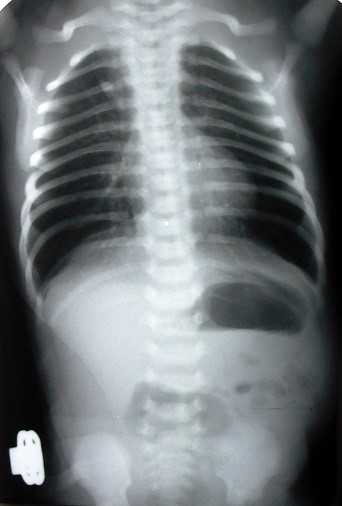
Обзорная рентгенография брюшной полости при данной патологии не информативна. Возможно выявление расширенного желудка со сниженным и неравномерным газонаполнением петель кишечника, или рентгенологическая картина может быть близкой к норме, не вызывая настороженности у обследующего врача.
В настоящее время наиболее информативным и безопасным является УЗИ органов брюшной полости с применением допплерографии сосудов брыжейки. Этот метод позволяет визуализировать собственно заворот и оценить степень нарушения кровотока в стенке кишки.
Длительность предоперационной подготовки в первую очередь зависит от выраженности нарушения кровотока в петлях кишечника формирующих заворот (от необходимости оперировать ребенка незамедлительно, до 2-3 суток).
В случае неосложненного варианта мальротации кишечника операцию возможно выполнить лапароскопическим способом.
Синдром Ледда у новорожденных. Что это такое, клинические рекомендации, последствия
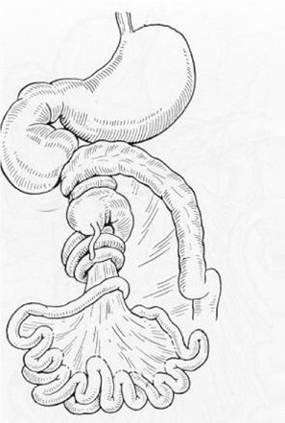
Синдром Ледда – это врожденная аномалия поворота кишечника, формирующаяся у новорожденных вследствие сдавливания двенадцатиперстной кишки слепой кишкой или идущими от нее тяжами с заворотом средней кишки.
Недуг развивается еще в утробе матери на сроке 10-12 недель и представляет собой заворот средней кишки вокруг верхней брыжеечной артерии и фиксации слепой кишки. Патогенез недуга заключается в неправильном положении органов брюшины.
Синдром Ледда у новорожденных в медицине делится на несколько видов:
Стадии и степени
Специалисты выделяют 3 стадии болезни, каждая из которых имеет нарастающую симптоматику.
Первая
Определить ее развитие можно по сильным болям и бурлению. Изначально дискомфорт появляется в месте поражения органа и постепенно распространяется по всему животу. Развиваться симптоматика может довольно быстро. Подобное состояние сохраняется в течение суток.
Вторая
Наблюдается интоксикация организма – к боли в области живота дополнительно присоединяется рвота, метеоризм и сложности с дефекацией. У некоторых малышей в кале наблюдается кровь. Пациент покрывается холодным потом, общее состояние с каждым часом ухудшается, живот ассиметрично вздувается. Подобная симптоматика сохраняется в течение 36 часов.
Третья
На этой стадии у пациента наблюдается перитонит, который требует срочной госпитализации и срочного оперативного вмешательства, так как у малыша диагностируют непроходимость кишечника.
Малейшее промедление может грозить пациенту летальным исходом.
Симптомы и признаки
Синдром Ледда у новорожденных не всегда проявляется устойчивой симптоматикой. Кроме рвотного рефлекса и срыгивания пищи с присутствие желчи, у малышей также наблюдаются сильные боли в области живота. У некоторых младенцев происходят рецидивы, приводящие к острой непроходимости кишечника с серьезными ухудшениями, вплоть до коллаптоидного состояния.
Общая симптоматика проявляется в виде:
Причины
Синдром Ледда у новорожденных может сформироваться по нескольким причинам:
Медики часто отмечают, что причина появления синдрома Ледда может быть спровоцирована наличием новообразования, которое перекрывает просвет между кишечными петлями.
Также причиной нарушения могут быть травматические хирургические вмешательства, проведенные на органах брюшной полости, различные травмы живота, воспалительные процессы органов брюшины, дивертикулярные недуги кишечника.
Диагностика
Если появились первые симптомы заворота кишок, то в первую очередь в срочном порядке вызывают бригаду скорой помощи. Обследование проводится быстро в условиях стационара хирургического отделения.
В первую очередь проводят рентген органов брюшной полости.
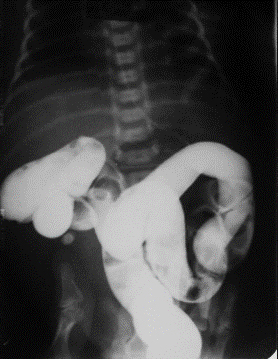
Изначально делают обзорный снимок с последующим введением в организм контрастного вещества. Данная методика дает возможность оценить растяжение двенадцатиперстной кишки и место локализации мальротации. Проводят исследование в кабинете рентгена, который чаще всего находится вблизи отделения хирургии.
Дополнительно хирург может провести и другие методики исследования, позволяющие оценить состояние малыша:
Также хирург рекомендует срочно сдать лабораторные анализы:
Методы лечения
Синдром Ледда у новорожденных лечится хирургическим путем.
Перед операцией проводят подготовительные мероприятия, включающие в себя:
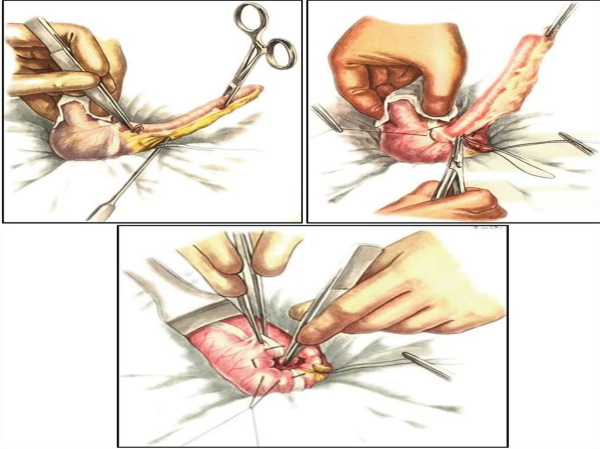
Операция проходит в несколько этапов:
После хирургического вмешательства маленького пациента подсоединяют к аппарату искусственной вентиляции легких и прописывают медикаменты для улучшения состояния здоровья.
Медикаментозная терапия
Пациентам назначают препараты для улучшения сокращений мускулатуры кишечника, за счет чего удается улучшить продвижение пищи по органам пищеварения. Также прописывают антибиотики, витаминный премикс, средства для поддержания сердца.
Чаще прописывают такие медикаменты:
Народная медицина
Рецепты народной медицины помогают предупредить развитие осложнений и предупредить рецидивы недуга.
Популярными и эффективными рецептами считаются:
| Ягоды облепихи | Сок из ягод обладает противовоспалительным эффектом, а масло является наилучшим натуральным слабительным. Чтобы приготовить сок, потребуется взять 1 кг свежих ягод, промыть их и измельчить при помощи блендера, отжать сок с использованием сита с мелкими ячейками или марлю. Масло готовят так: 1 кг ягод перетереть, но только деревянной ложкой, оставить отстаиваться в течение суток, после чего на поверхности ягодной массы образуется масло, которое стоит аккуратно собрать в отдельную емкость. | Принимать по ½ ст. утром за полчаса до еды. Масло принимать по 1 ст. л 3 раза в день перед едой. |
| Сухофрукты | С их помощью удается активизировать перистальтику кишечника, они оказывают мягкое слабительное действие. Для приготовления полезного состава потребуется взять по 200 г кураги, инжира, изюма, чернослива. | Принимают полученную смесь по 1 ст. л. утром натощак. |
| Сливовый отвар | Он обладает мягким слабительным эффектом. Для приготовления потребуется взять 0,5 кг слив, вынуть косточку, залить холодной водой и дать постоять четверть часа. После поставить на медленный огонь томиться в течение полутора часов. | Принимают отвар охлажденным после каждого приема пищи по ½ ст. |
Диетическое питание
В послеоперационный период маленькому пациенту рекомендуют соблюдать несколько правил диетического питания:
Об особенностях диеты обязательно должен рассказать доктор, так как она может отличаться в зависимости от диагноза и сложности течения болезни.
Коррекция питания также считается профилактической мерой, которая помогает предупредить рецидив недуга.
Возможные последствия и осложнения
Синдром Ледда, который у взрослых встречается довольно редко, у новорожденных встречается часто и требует срочной госпитализации и скорейшего решения проблемы.
В противном случае бездействие взрослых может грозить малышу:
Большая часть осложнений может привести к смерти маленького пациента. Синдром Ледда – это серьезное заболевание, требующее срочной госпитализации пациента и хирургического вмешательства.
Новорожденный самостоятельно рассказать о своем недуге не сможет, поэтому родителям нужно присмотреться к своему чаду, быстро распознать симптомы и незамедлительно обратиться за квалифицированной помощью. В противном случае осложнения не заставят себя ждать, и большая часть из них приводит к летальному исходу.
Видео о синдроме Ледда
Спасение ребенка с синдромом Ледда:
Заболевание ледда что это
Ю.Г. Мухина, А.Н. Смирнов, М.И. Дубровская, П.В. Шумилов, Ю.Е. Фатеев, Д.В. Залихин, В.А. Калинцева
РГМУ, ДГКБ № 13 им. Н.Ф. Филатова, Москва
Синдром Ледда (СЛ) – аномалия поворота кишечника, представляющая собой сочетание сдавления двенадцатиперстной кишки слепой кишкой или идущими от нее эмбриональными тяжами с заворотом средней кишки.
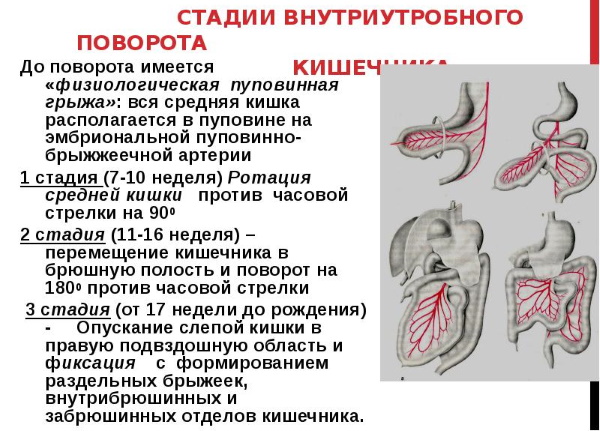
На 10-12-й неделе внутриутробного развития (II период поворота) происходит возвращение петель кишечника из грыжевого мешка с поворотом их против часовой стрелки на 1800. Общая брыжейка тонкой и толстой кишки фиксирована к задней брюшной стенке лишь в месте выхода верхней брыжеечной артерии. Сохранение этого положения носит название незавершенного (неполного) поворота кишечника. Характеризуется тем, что слепая кишка, не достигнув своего обычного места, располагается в эпигастральной области или в правом верхнем квадранте живота (рис. 2). Незавершенный поворот часто сопровождается образованием тяжей между слепой кишкой и задней брюшной стенкой, которые могут сдавливать двенадцатиперстную кишку, изменять ее ход (рис. 3). Узкий корень брыжейки создает условия для возникновения заворота средней кишки с развитием гангрены кишечника.
В норме на 3-4-м месяце внутриутробного развития (III период поворота) слепая кишка постепенно занимает свое место, происходит фиксация кишечника и образование корня брыжейки тонкой и толстой кишки. При нарушении этих процессов формируется подвижная слепая кишка, имеющая длинную собственную брыжейку Caecum mobile.
Частота встречаемости СЛ составляет 0,8 на 1000 рожденных детей, мальчики болеют в два раза чаще, чем девочки [2].
Вышеописанные анатомические аномалии объясняют клиническую картину острого течения СЛ, при котором может наблюдаться кишечная непроходимость, тромбоз верхней брыжеечной артерии с развитием гангрены кишки. Эта острая хирургическая патология не должна представлять особых диагностических трудностей для специалистов.
Однако те же анатомические аномалии могут являться причиной хронического или латентного течения СЛ вследствие неполного сдавления двенадцатиперстной кишки или интермиттирующего заворота кишок (intermittent volvulus). У 25-50 % 18-летних подростков, которым при оперативном вмешательстве был выставлен диагноз СЛ, отсутствовали какие-либо предшествующие жалобы.
Для хронического варианта течения СЛ характерны кратковременные эпизоды ухудшения состояния со светлыми промежутками от нескольких месяцев до нескольких лет. При этом могут отмечаться редкие, но периодически повторяющиеся рвоты, тошнота, диарея, кратковременные боли в животе, болезненная пальпация, вздутие живота (рис. 4).
Клиническая симптоматика хронического течения СЛ обусловлена в основном вторичными нарушениями функций ЖКТ. Вследствие преходящего сдавления двенадцатиперстной кишки нарушается перистальтика кишечника, возникает стаз тонкокишечного содержимого с повреждением эпителия тонкой кишки, развиваются дисбиотические изменения в просвете и пристеночном пространстве тонкой кишки с формированием энтеропатии и мальабсорбции.
При дисбактериозе тонкой кишки уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника. Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчно-каменной болезни. Бактериальные токсины и метаболиты (фенолы и биогенные амины) могут связывать витамин В12, что приводит к развитию анемии. Некоторые микроорганизмы обладают цитотоксическим действием, повреждают эпителий тонкой кишки, что ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети. Разрушение щеточной каймы энтероцитов и снижение активности дисахаридаз приводит к развитию дисахаридазной недостаточности [3].
Стандартными методами обследования при подозрении на СЛ являются обзорная рентгенография брюшной полости, рентгенография верхних отделов ЖКТ с барием, энтероклизма, ирригография и УЗИ органов брюшной полости. При СЛ рентгенография органов брюшной полости с барием выявляет спиралевидный ход тонкой кишки и высокое подпеченочное расположение купола слепой кишки (рис. 2, 3).
При ультразвуковом исследовании органов брюшной полости определяется спиралевидный ход петель тонкой кишки, верхней брыжеечной вены, расширенные вены брыжейки тонкой кишки, нарушение венозного оттока от верхней брыжеечной вены с тенденцией к артериализации, наличие псевдосистолических пиков, повышение индекса резистентности до 0,81-0,88 (норма до 0,7) в верхней брыжеечной артерии (рис. 5-7).
Оперативное лечение СЛ предполагает устранение непроходимости, фиксацию кишок при их аномальной подвижности: толстая кишка укладывается слева, тонкая – справа в брюшной полости, обязательно выполняется аппендэктомия.
За период с октября 2002 по январь 2003 г. через хирургическое отделение № 3 и терапевтическое отделение № 2 ДГКБ № 13 им. Н.Ф. Филатова прошло трое детей в возрасте от 6 до 15 лет с латентным течением СЛ. Во всех трех случаях диагноз был выставлен до оперативного вмешательства [4].
Обращают на себя внимание следующие особенности развития заболевания у детей:
двое детей из двойни, в двух случаях отмечались преждевременные роды. Все дети имели признаки хронической внутриутробной гипоксии, гипотрофии I-II степени, отягощенный антенатальный и ранний неонатальный анамнез. До года двое детей развивались нормально, а у одного ребенка отмечались постоянные срыгивания.
Клиническая картина латентного течения СЛ манифестировала после года рвотами и приступообразными болями в животе (у двоих детей) по типу синдрома повторяющихся рвот и синдромом мальабсорбции (один ребенок). У мальчика с ежедневными рвотами СЛ был диагностирован только в 14 лет, а 8-летняя девочка в течение дух лет наблюдалась педиатрами по поводу лактазной недостаточности, выраженной дискинезии двенадцатиперстной кишки, реактивного панкреатита и перегиба желчного пузыря. Девочка 6 лет с синдромом мальабсорбции, диареей, полифекалией, гипопротеинемическими отеками обследовалась и лечилась до 6 лет, когда на остроте абдоминального синдрома было выполнено ультразвуковое исследование органов брюшной полости и диагностирован СЛ (см. рис 3-5). При этом УЗИ предваряло рентгенологическое исследование.
Клинический вариант с манифестацией по типу синдрома повторяющихся рвот
Надя П. 8 лет. Ребенок от четвертой нормальной беременности, третьих родов, первая из двойни, вес при рождении 2750 г, рост 54 см. С одного года два раза в год отмечались приступы рвоты, боли в животе, которые обычно купировались на фоне приема спазмолитиков, ферментов и регидратационной пероральной терапии. С 6 лет рвоты стали связывать с погрешностями в диете, диагностирован гастродуоденит, реактивный панкреатит, перегиб желчного пузыря.
В 6 лет 11 месяцев поступила в ДГКБ № 13 с жалобами на многократную рвоту, боли в животе, потерю аппетита, задержку стула, запах ацетона изо рта в течение последних 5 дней. Вес 19 кг, рост 125 см. Оральная регидратация и инфузионная терапия привела к быстрому клиническому улучшению состояния девочки, которая после обследования (ФГДС, УЗИ) была выписана с клиническим диагнозом лактазная недостаточность, поверхностный гастродуоденит, перегиб желчного пузыря в теле, холецистохолангит, реактивный панкреатит, обменная нефропатия, МАРС (аномальная хорда левого желудочка), хронический компенсированный тонзиллит, синдром внутричерепной дистензии.
Мать девочки была предупреждена, что при возобновлении подобных симптомов ей необходимо госпитализировать ребенка в хирургическое отделение для исключения аномалии развития ЖКТ. Светлый промежуток составил 16 месяцев.
В 8 лет 3 месяца девочка повторно поступила в педиатрическое отделение ДГКБ № 13 с жалобами на многократную рвоту, боли в животе, вялость, потерю аппетита в течение последних четырех дней. При поступлении состояние средней тяжести, вялая, проявления эксикоза. Кожа сухая. Деформация грудной клетки, ЧСС 108, АД 95/55. Язык густо обложен белым налетом, живот мягкий, болезненный в эпигастрии, пилородуоденальной области. Печень + 2,5 см. Стула не было два дня. В отделении – повторная рвота темно-зеленым застойным содержимым. На следующий день переведена в хирургическое отделение № 3 с подозрением на хроническую дуоденальную непроходимость, где было проведено рентгенологическое исследование ЖКТ с барием и ирригография. Выявлен штопорообразный ход тощей кишки (рис. 8) и высокое стояние купола слепой кишки (рис. 9). Диагностирован незавершенный поворот кишечника, СЛ. Девочка была прооперирована, выписана в удовлетворительном состоянии.
Клинический вариант с манифестацией по типу синдрома мальабсорбции
Кристина З. 6 лет. Ребенок от второй многоплодной беременности, которая на сроке 9-12 недель осложнилась самопроизвольным абортом и оперативным удалением одного плодного яйца, при сохранившемся и развившемся втором плодном яйце. Девочка родилась на 36-й неделе путем экстренного кесарева сечения, вес при рождении 2700 г, рост 45 см. До года росла и развивалась нормально, в 12 месяцев весила 11 кг.
После года девочку перевезли в сельскую местность в Грузии, на фоне изменения диеты появился обильный зловонный стул, боли в животе, метеоризм, постепенно нарастал объем живота. За медицинской помощью родственники обращались по месту жительства, в два года девочка весила 10 кг, отмечались отеки, бледность, адинамия. В два года четыре месяца весила 9,2 кг, не ходила, не сидела, сохранялись жалобы на полифекалию, диарею. Был выставлен диагноз гипотрофия II степени, целиакия, после чего мать забрала девочку в Москву, где обследовала ребенка в различных детских клиниках.
В три года 11 месяцев с жалобами на периодические боли в животе, жидкий стул поступила на плановое обследование (вес 13 кг, рост 90 см). Выписана с клиническим диагнозом синдром мальабсорбции, хронический неспецифический регионарный энтерит (?), вторичное иммунодефицитное состояние, задержка физического развития, асимметрия глазных щелей, дополнительная петля нисходящей кишки, випома (?).
В четыре года четыре месяца поступила в стационар в тяжелом состоянии с сильными болями в животе в области пупка, рвотой, резким снижением аппетита, выраженными признаками токсикоза с эксикозом, задержкой физического развития. Вздут живот, пальпируется вздутый кишечник, эксикоз. При рентгенографическом исследовании ЖКТ с барием выявлена дополнительная петля в нисходящем отделе поперечно-ободочной кишки. Купол слепой кишки расположен на уровне LIII-LIV – незавершенный поворот кишечника (?). Снижена эвакуация бария, тощая кишка расширена до 2 см, складки утолщены. Заключение: Caecum mobile (?). При УЗИ органов брюшной полости выявлено большое количество содержимого в желудке, который расширен в размерах до 105-74-65 мм, значительное расширение толстого кишечника. Эхографические признаки динамической кишечной непроходимости, тонко-тонкокишечной инвагинации (?).
При динамическом наблюдении указанные выше предположительные диагнозы были исключены, при лабораторном исследовании выявлялась анемия смешанного типа, гипопротеинемия, гипокальциемия, стеаторея II типа.
Выписана с клиническим диагнозом хронический энтероколит, вторичное иммунодефицитное состояние, задержка физического развития, мегалокорнеа ОД.
Рекомендовано соблюдать аглиадиновую диету с увеличением квоты белка, ферментные препараты, сорбенты поливитаминные и микроэлементные комплексы.
В пять лет два месяца с жалобами на полифекалию, диарею, метеоризм, боли в животе, повышение аппетита поступила на плановое обследование в другую клинику, откуда была выписана с клиническим диагнозом синдром целиакии (мальабсорбции), лабильный перегиб тела желчного пузыря, холестаз, дисбактериоз, аскаридоз, лямблиоз, хламидиоз, вторичные изменения поджелудочной железы, вульвит, соматический субнанизм, иммунодефицитное состояние.
После выявления аскаридоза, лямблиоза и хламидиоза была проведена соответствующая терапия, на фоне которой девочку перестали вообще беспокоить боли в животе, что существенно осложняло диагностический поиск причин абдоминалгий.
В пять лет 9 месяцев поступила на плановое обследование в педиатрическое отделение ДГКБ № 13 им. Н.Ф. Филатова (вес 13 кг, рост 92 см) с направляющим диагнозом задержка физического развития, энтероколит, синдром нарушенного кишечного всасывания, вторичные изменения поджелудочной железы.
На остроте абдоминального синдрома было выполнено ультразвуковое исследование органов брюшной полости и диагностирован СЛ (рис. 5-7), после чего проведено рентгенологическое обследование (рис. 3), подтвержден незавершенный поворот кишечника, СЛ. Девочка была прооперирована, к моменту выписки из стационара весила 15 кг и подросла на 3 см.
Существенным моментом следует признать тот факт, что во время госпитализаций у девочки не возникало острых приступов болей в животе, что представляло трудность для диагностики и скрывало истинную причину многообразной патологии, наблюдаемой у ребенка.
Таким образом, при повторных сохраняющихся рвотах показано расширенное проведение дифференциального диагноза с такими заболеваниями ЖКТ, как пилоростеноз, ГЭР, панкреатит, холецистит. Диапазон патологии может простираться от глистной инвазии до интермиттирующей дуоденальной инвагинации. Необходимо помнить о метаболических нарушениях, патологии эндокринной и нервной системы. Не меньший интерес представляет и синдром повторных рвот как проявление психосоматического неблагополучия – диагноз, который можно выставить только путем исключения всей возможной органической патологии [5].
Синдром повторных (повторяющихся) рвот (СПР) у детей описан в 1882 г., частота его встречаемости в детской популяции 1,5-10 %. Синонимы: периодический синдром, автономная эпилепсия, абдоминальная мигрень, мигрень или конвульсивный эквивалент.
Для СПР характерны повторяющиеся приступы рвоты, между которыми не выявляются признаки каких-либо заболеваний. В большинстве случаев рвоты начинаются в 2-5 лет и могут продолжаться до взрослого возраста. Приступы могут возникать с различной частотой (от одного раза в месяц до нескольких раз в год), в основном рано утром или ночью. Приступ может продолжаться от нескольких часов до дней, сопровождаться головными болями, болями в животе, учащенными испражнениями, повышением температуры тела, АД, ЧСС. У половины больных в семейном анамнезе зафиксирована мигрень и синдром раздраженного кишечника, тенденция к укачиванию в транспорте.
Триггерными факторами чаще всего служат состояние возбуждения и напряжения, тревожное состояние ребенка. Для детей с СПР характерны такие черты, как стремление к достижениям, соперничество, стремление к целостности, упрямство, нравственность и агрессивность. Для модели семьи ребенка с СПР характерны определенные семейные отношения (чрезмерная близость и защита, сопротивление изменениям в процессе развития, отсутствие преодоления конфликтов и неспособность прийти к их разрешению).
Интересно, что нарушения пищевого поведения, такие как неврогенная анорексия, не описаны при СПР у детей.
Данным сообщением авторы хотели привлечь внимание как педиатров, так и хирургов к группе детей, имеющих клинические проявления рецидивирующих рвот неясной этиологии, диареи, синдрома мальабсорбции, не реагирующих на проводимую терапию. В этих случаях следует исключать врожденные пороки развития кишечника с обязательным проведением расширенного ультразвукового исследования органов брюшной полости с допплерографией мезентериальных сосудов.
Литература