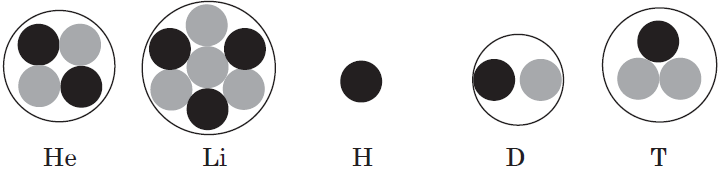
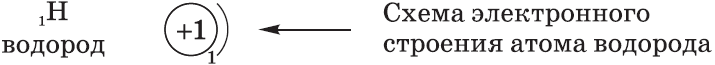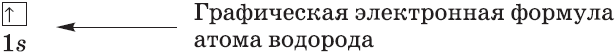Запишите распределение электронов по энергетическим уровням атома железа зная что третий уровень
§ 17. Железо
Строение и свойства атомов. Железо Fe — элемент побочной подгруппы VIII группы (УIIIБ группы) 4-го периода Периодической системы Д. И. Менделеева.
Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково:
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — ещё меньше.
Химически чистое железо содержит менее 0,01% примесей.
Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии. Очевидно, знаменитая Делийская колонна сделана из чистого железа (рис. 68).
Первые образцы железа, попавшего в руки человека, по-видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа.
Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо даёт два ряда соединений. Число электронов, которое атом железа отдаёт при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами (кроме иода) железо образует галогениды, в которых оно имеет степень окисления +3:
а с серой — сульфид железа (II):
При высокой температуре (700—900 °С) железо взаимодействует с парами воды:
В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей, например:
В разбавленных соляной и серной кислотах железо растворяется, окисляясь ионами водорода, при этом образуются соли железа (II) и водород:
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа (III), вода и продукт восстановления азотной кислоты — азот N2, оксид азота (II) NO или аммиак NH3 (нитрат аммония NH4NO3) в зависимости от концентрации кислоты.
Концентрированные серная и азотная кислоты пассивируют железо, образуя на поверхности металла плотную, прочную оксидную плёнку.
Соединения железа. По распространённости в земной коре железо занимает четвёртое место среди всех элементов (после кислорода, кремния и алюминия).
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 • ЗН2O. Все они используются в чёрной металлургии для производства чугуна и стали.
Ещё одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2 — не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа (II) и железа (III).
Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности по следующей цепочке превращений:
Оксид и гидроксид железа (II) имеют ярко выраженные основные свойства.
Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например по цепочке:
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа (II) FeSO4 • 7Н2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины и в других целях.
Хлорид железа (III) FeCl3 используют при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа (III) Fe2(SO4)3 • 9Н2O применяют при очистке воды, в качестве растворителя в гидрометаллургии и в других целях.
Реактивом на ионы железа (III) Fe 3+ является другое комплексное соединение — жёлтая кровяная соль — 
Для обнаружения ионов Fe 3+ также используют взаимодействие солей железа (III) с роданидом калия KSCN или роданидом аммония NH4SCN.
Роль химического элемента железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и тканям.
Соединения железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служит пища. В зелёных овощах, таких как шпинат, салат, капуста, много железа. Розовая черешня содержит наполовину меньше железа, чем чёрная. Светло-зелёный капустный лист в шесть раз беднее железом, чем зелёный. В говядине железа больше, чем в телятине.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
2. Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:
4. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Рассмотрите два превращения (по выбору) с позиций окисления-восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.
5. Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно N2, NO, NH4NO3. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях.
6. Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного.
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
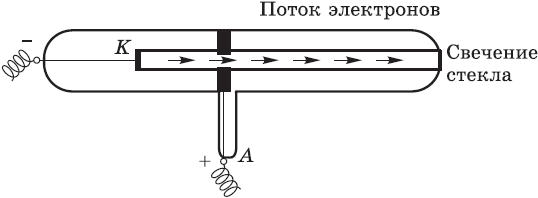
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
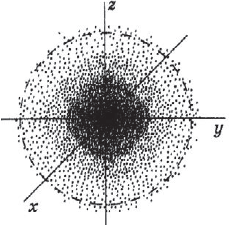
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
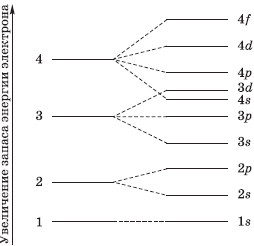
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
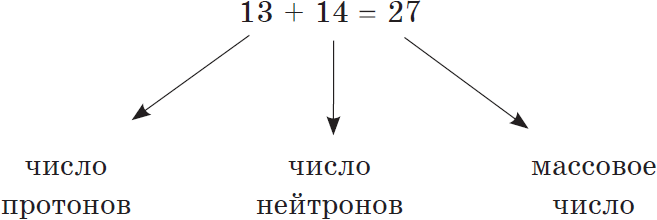
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
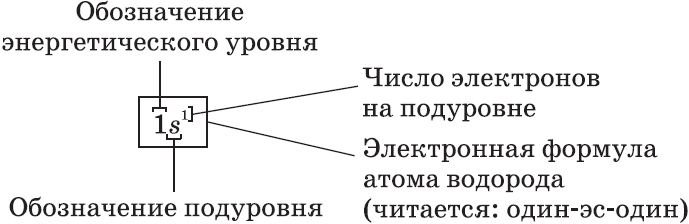
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
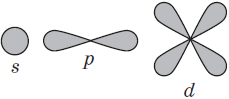
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 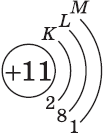 | $1s^2<2>s^2<2>p^6<3>s^1$ | 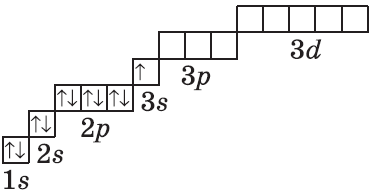 |
| $↙<13> | 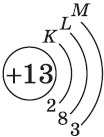 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 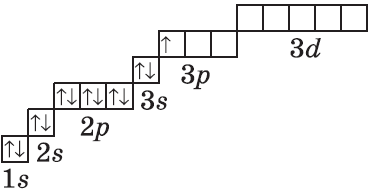 |
| $↙<18> | 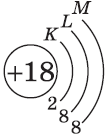 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 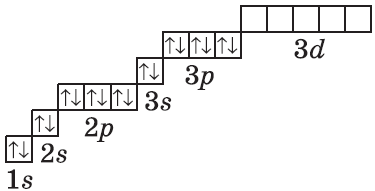 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Запишите распределение электронов по энергетическим уровням атома железа зная что третий уровень
1. Распределение электронов по энергетическим уровням в атоме магния:
Г. 2е, 8е, 2е.
2. Число электронов на внешнем электронном слое у атомов щелочных металлов:
А.1.
3. Тип химической связи в простом веществе литии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Стронций.
5. Радиус атомов элементов 3-го периода с увеличением заряда ядра от щелочного металла к галогену:
Г. Уменьшается.
6. Атом алюминия отличается от иона алюминия:
Б. Радиусом частицы.
7. Наиболее энергично реагирует с водой:
А. Калий.
9. Гидроксид бериллия взаимодействует с веществом, формула которого:
А. КОН (р-р).
10. Ряд, в котором все вещества реагируют с цинком:
А. НСl, NaOH, H2SО4.
11.Предложите три способа получения гидроксида калия. Ответ подтвердите уравнениями реакций.
2К + 2Н2О = 2КОН + Н2
К2О + Н2О = 2КОН
К2СО3 + Са(ОН)2 = СаСО3↓ + 2КОН
12. Определите вещества X, Y, Z, запишите их химические формулы.
Х CuO
Y CuSO4
Z Cu(OH)2
13. Как, используя любые реактивы (вещества) и барий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
13. 2Ba + O2 = 2BaO
Ba + 2H2O = Ba(OH)2 + H2↑
Ba + Cl2 = BaCl2
14. Расположите металлы: железо, олово, вольфрам, свинец в порядке увеличения относительной твердости (рис. 1).
свинец – олово – железо – вольфрам
15. Рассчитайте массу металла, который можно получить из 144 г оксида железа (II).
n (FeO)= 144г/ 72г/моль = 2 моль
n (Fe) = 2 моль
m (Fe) = 2моль*56г/моль = 112г
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме лития:
Б. 2e, 1е.
2. Число электронов на внешнем электронном слое у атомов щелочных металлов:
А. 1.
3. Вид химической связи в простом веществе натрии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Индий.
5. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
В. Увеличивается.
6. Атом кальция отличается от иона кальция:
Б. Числом электронов на внешнем энергетическом уровне.
7. Наиболее энергично реагирует с водой:
А. Барий.
8. С соляной кислотой не взаимодействует:
В. Серебро.
9. Гидроксид алюминия взаимодействует с веществом, формула которого:
Б. NaOH(p-p).
10. Ряд, в котором все вещества реагируют с железом:
Б. Cl2, CuC12, НС1.
11. Предложите три способа получения гидроксида кальция. Ответ подтвердите уравнениями реакций.
Са + 2Н2О = Са(ОН)2 + Н2↑
СаО + Н2О = Са(ОН)2
СаCl2 + 2KOH = Ca(OH)2 + 2KCl
12. Определите вещества X, Y, Z, запишите их химические формулы.
X ZnO
Y ZnCl2
Z Zn(OH)2
13. Как, используя любые реактивы (вещества) и литий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
4Li + O2 = 2Li2O
2Li + 2H2O = 2LiOH + H2↑
2Li + Cl2 = 2LiCl
14. Расположите металлы: алюминий, свинец, золото, медь в порядке увеличения относительной электропроводности (рис. 2).
Свинец, алюминий, золото, медь.
15. Рассчитайте массу металла, который можно получить из 80 г оксида железа (III).
n(Fe2O3) = 80г/160г/моль = 0.5моль
n (Fe) = 2n (Fe2O3) = 1моль
m (Fe) = 1моль*56г/моль = 56г
1. Распределение электронов по энергетическим уровням в атоме натрия:
В. 2е, 8е, 1е.
2. Номер периода в Периодической системе Д. И. Менделеева, в котором нет химических элементов-металлов:
А. 1.
3. Вид химической связи в простом веществе кальции:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г.Натрий.
5. Радиус атомов элементов 2-го периода с увеличением заряда ядра от щелочного металла к галогену:
Г. Уменьшается.
6. Атом магния отличается от иона магния:
Б. Зарядом частицы.
7. Наиболее энергично реагирует с водой:
Г. Рубидий.
8. С разбавленной серной кислотой не взаимодействует:
Г. Ртуть.
9. Гидроксид бериллия не взаимодействует с веществом, формула которого:
Б. NaCl (р-р)
10. Ряд, в котором все вещества реагируют с кальцием:
Б. С12, Н2О, H2SО4.
11. Предложите три способа получения сульфата железа (III). Ответ подтвердите уравнениями реакций.
Fe + H2SO4 = FeSO4 + H2↑
FeO + H2SO4 = FeSO4 + H2O
Fe + CuSO4 = FeSO4 + Cu
12. Определите вещества X, Y, Z, запишите их химические формулы.
X Fe2O3
Y FeCl3
Z Fe(OH)3
13. Как, используя любые реактивы (вещества) и алюминий, получить оксид, амфотерный гидроксид? Составьте уравнения реакций в молекулярном виде.
4Al + 3O2 = 2Al2O3
2Al + 6H2O = 2Al(OH)3 + 3H2
14. Расположите металлы: медь, золото, алюминий, свинец в порядке увеличения плотности (рис. 3).
алюминий, медь, свинец, золото
15. Рассчитайте массу металла, полученного из 160 г оксида меди (II).
n(CuO) = 160г/80г/моль = 2моль
n (Cu) = n (CuO) = 2моль
m (Cu) = 2моль*64г/моль = 128г
1. Распределение электронов по энергетическим уровням в атоме алюминия:
Б. 2е, 8е, 3е.
2. Номер группы в Периодической системе Д. И. Менделеева, состоящей только из химических элементов-металлов:
Б. II.
3. Вид химической связи в простом веществе магнии:
Г. Металлическая.
4. Простое вещество с наиболее ярко выраженными металлическими свойствами:
Г. Рубидий.
5. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
В. Увеличивается.
6. Атом и ион натрия отличаются:
Б. Радиусом частицы.
7. Наиболее энергично реагирует с водой:
Б. Калий.
8. С соляной кислотой не взаимодействует:
В. Медь.
9. Гидроксид алюминия не взаимодействует с веществом, формула которого:
В. KNО3(p-p).
10. Ряд, в котором все вещества реагируют с магнием:
Б. С12, О2, НС1.
11. Предложите три способа получения оксида алюминия. Ответ подтвердите уравнениями реакций.
2Al(OH)3 = Al2O3 + 3H2O
4Al + 3O2 = 2Al2O3
2Al + Cr2О3 = Al2О3 + 2Cr
12. Определите вещества X, Y, Z, запишите их химические формулы.
X CaO
Y Ca(OH)2
Z CaCO3
13. Как, используя любые реактивы (вещества), получить из цинка оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
2Zn + O2 = 2ZnO
Zn + 2H2O = Zn(OH)2 + H2
Zn + Cl2 = ZnCl2
14. Расположите металлы: алюминий, вольфрам, олово, ртуть в порядке уменьшения температуры плавления (рис. 4).
вольфрам, алюминий, олово, ртуть
15. Рассчитайте массу металла, который можно получить алюминотермией из 34 г оксида хрома (II).
n(CrO) = 34г/68г/моль = 0,5моль
n (Cr) = n (CrO) = 0,5моль
m (Cr) = 0,5моль*52г/моль = 26г