Зкт что это в медицине
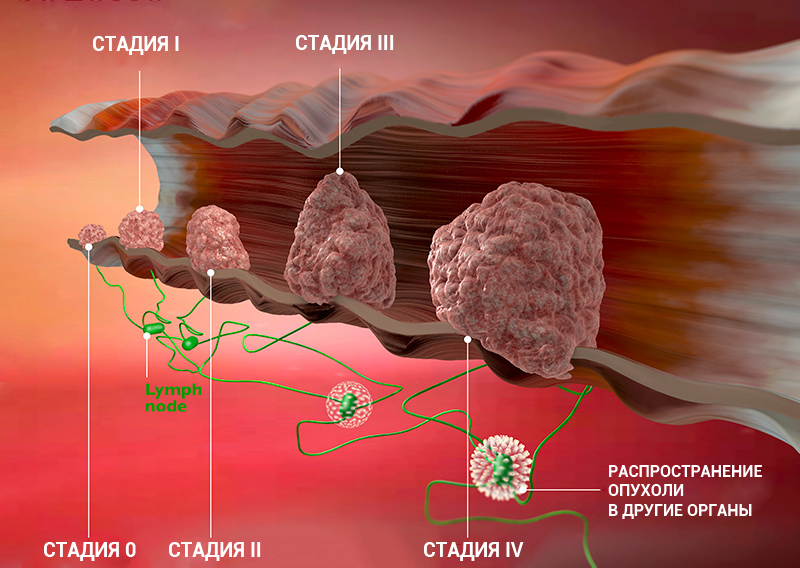
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Гипервентиляционный синдром и дисфункциональное дыхание
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях дыхания, относят 1871 год, когда Да Коста (Da Costa Jacob, 1833–1900), американский врач, принимавший участие в Гражданской войне США, применил термин «гипервентиляционый синдром» (ГВС) у пациентов с так называемым «солдатским сердцем». С тех пор для характеристики дыхательных расстройств предлагались различные альтернативные определения: «дыхательный невроз», «нейрореспираторная дистония», «респираторный синдром», «респираторная дискинезия», «идиопатическая гипервентиляция», «нейрореспираторный синдром», «неустойчивое дыхание» и др. Однако указанные термины не получили широкого признания. Они являются достаточно общими и не отражают особенностей нарушений дыхания у конкретного больного [4]. Перечисленные определения нередко связывают с понятием «непонятная одышка» (unexplained dyspnea).
ГВС встречается в 6–11% от числа пациентов общей практики. Соотношение мужчин и женщин составляет 1:4, 1:5; чаще наблюдается в 30–40 лет, но возможно развитие в других возрастных группах, включая детей и пожилых. L. Lum (1987) подчеркивал, что «каждый врач в течение недели может встретить хотя бы одного больного с ГВС». Врачи различных специальностей — невропатологи, кардиологи, пульмонологи, психиатры — могут наблюдать у своих пациентов явления гипервентиляции. Острое течение ГВС встречается значительно реже, чем хроническое, и составляет лишь 1–2% от общего числа больных [2, 6, 7].
Причины развития ГВС довольно многочисленны. Это неврологические и психические расстройства, вегетативные нарушения, болезни органов дыхания, некоторые заболевания сердечно-сосудистой системы, органов пищеварения, экзогенные и эндогенные интоксикации, лекарственные средства (салицилаты, метилксантины, β-агонисты, прогестерон) и др. Считается, что в 5% случаев ГВС имеет только органическую природу, в 60% случаев — только психогенную, в остальных — комбинации этих причин [6].
Важной особенностью развития ГВС является то обстоятельство, что если причины, являющиеся триггерными, устраняются, то гипервентиляция, которая уже не соответствует требованиям конкретной ситуации, сохраняется, сохраняется и гипокапния. Происходит стабилизация гипокапнических нарушений газообмена и формируется «порочный круг» ГВС, который начинает циркулировать автономно, и симптомы могут персистировать достаточно долго — феномен «махового колеса». Эти изменения реакции дыхания указывают на уязвимую систему контроля дыхания, которая не способна поддержать нормальное парциальное давление углекислого газа в крови (РСО2) и кислотно-щелочной гомеостаз [8, 9, 10, 11].
В основе развития клинических проявлений ГВС лежат гипокапнические нарушения газообмена [2, 3, 10]. Среди множества клинических проявлений ГВС одышка является ведущей жалобой и встречается практически в 100% случаев. Одышка может быть единственным клиническим проявлением, но чаще сочетается с другими симптомами.
Основные клинические проявления ГВС
Респираторные: одышка, вздохи, зевота, сухой кашель.
Общие: снижение трудоспособности, слабость, утомляемость, субфебрилитет.
Кардиальные: кардиалгия, экстрасистолия, тахикардия.
Психоэмоциональные: тревога, беспокойство, бессонница.
Гастроэнтерологические: дисфагия, боли в эпигастрии, сухость во рту, аэрофагия, запоры.
Неврологические: головокружение, обмороки, парестезии, тетания (редко).
Мышечные: мышечная боль, тремор.
Диагностика ГВС в первую очередь опирается на знание врачей самых различных специальностей об особенностях клинической картины ГВС. ГВС должен устанавливаться только после проведения дифференциальной диагностики с другими заболеваниями, протекающими с синдромом одышки. Полиморфизм клинических проявлений ГВС вызывает диагностические проблемы. Назначаются многочисленные обследования, дорогостоящие, ненужные, а иногда и опасные для больного. L. Lum (1987), обсуждая диагностические проблемы, называет среди врачебных ошибок бесполезные абдоминальные операции, операции на позвоночнике и других органах, инвазивные исследования, проводимые не без риска, и, что еще хуже, такие диагнозы, как эпилепсия и инфаркт миокарда. Взаимосвязи гипокапнии и ассоциированных с ней симптомов являются чрезвычайно сложными. Многие врачи при регистрации у больных низких значений РСО2 автоматически устанавливают диагноз ГВС, что является неправильным. Известно, что явления гипокапнии могут быть у больных рестриктивными легочными процессами, при лихорадочных состояниях, сердечной патологии, однако при этом «классических» гипокапнических жалоб может и не быть. И наоборот, так называемые гипокапнические жалобы, например тревога, одышка, парестезии и др., встречаются у пациентов с нормокапнией.
В практической медицине больной с ГВС — это пациент, предъявляющий жалобы на одышку, которая не соответствует данным объективного осмотра, показателям клинико-инструментальных исследований дыхания, с диспропорциональной, непонятной одышкой, субъективное восприятие которой является довольно тягостным. К сожалению, при отсутствии достоверных объяснений одышки больные обычно направляются для консультаций в различные лечебные учреждения. В конечном итоге они и формируют основной контингент альтернативной медицины, различных псевдоспециалистов «по тренировке правильного дыхания».
Исследование функции внешнего дыхания, имеющее важное значение в дифференциальной диагностике одышки, не помогает в верификации функциональных нарушений дыхания. Основным подтверждением ГВС служит выявление гипокапнических нарушений газообмена. Снижение РСО2 — прямое свидетельство альвеолярной гипервентиляции. Однако исходная гипокапния у больных с ГВС встречается не так часто. Поэтому в тех случаях, когда у пациента с предположительным ГВС в условиях покоя определяются нормальные значения углекислоты, рекомендуется определение изменений уровня СО2 при различных провокационных тестах. К «золотому стандарту» диагностики ГВС относят пробу с произвольной гипервентиляцией.
Департаментом пульмонологии университета г. Наймиген (Голландия) разработан Наймигенский опросник (Nijmegen questionnaire) для выявления физиологических показателей дизрегуляции вентиляции, сопоставимых с ГВС (табл.). Анкета содержит 16 пунктов, которые оцениваются по 5-балльной шкале (0 — никогда, 4 — очень часто). Минимальные и максимальные достижимые числа — 0 и 64 соответственно.
Данный опросник нашел свое применение прежде всего для скрининг-диагностики ГВС. Существует положение, согласно которому использование данного опросника позволяет корректно предсказывать ГВС в 90% от всех случаев [2, 12].
В последние годы в клиническую практику начинает внедряться понятие «дисфункциональное дыхание» (ДД). Приоритет внедрения термина принадлежит Ван Диксхорну (J. van Dixhoorn), который привел его в работе Hyperventilation and dysfunctional breathing (1997). Основанием для этого явилось понимание, что при функциональных нарушениях дыхания возможны различные изменения паттерна дыхания и значений РCO2, а не только гипокапнические расстройства, характерные для ГВС. ДД может проявляться также быстрым, аритмичным, поверхностным дыханием, частыми вздохами, преобладанием грудного типа дыхания.
Одной из сложных и дискуссионных проблем в пульмонологии является понимание взаимоотношений ГВС, ДД и бронхиальной астмы (БА) [15–18]. С. И. Овчаренко и др. (2002) у 22 из 80 больных БА выявили нарушения дыхания, соответствующие критериям ГВС. Сведений относительно встречаемости дисфункциональных нарушений дыхания при астме немного. Установлено, что среди лиц с диагнозом БА и по крайней мере с одним предписанием антиастматического препарата 29% имеют клинические признаки ДД [19]. Указывается, что ДД может усиливать симптомы БА и приводить к избыточному назначению лекарств.
Достаточно сложным является понимание механизмов развития дисфункциональных расстройств дыхания при БА; существует ряд предположений. К достаточно обоснованным факторам развития гипервентиляции относят тревожные расстройства. Использование больными бронходилататоров (β-2-агонисты, теофиллин), которые обладают эффектами стимуляции дыхания, также относят к факторам развития гипервентиляции. Обсуждается роль изменений перцепции одышки при БА. Анализ существующих проблем взаимосвязи ДД и БА провел M. Morgan (2002), представив следующие ключевые положения:
В зависимости от установления особенностей ДД должна осуществляться и программа лечения больных. При выявлении ГВС релаксирующие методы дыхательной гимнастики проводятся под руководством опытных инструкторов, назначаются β-адреноблокаторы, бензодиазепины [5, 22, 23]. При явлениях гиповентиляции — массаж дыхательных мышц, использование дыхательных тренажеров. Выявление ГВС при БА указывает на необходимость применения методов коррекции функциональных нарушений дыхания. Релаксирующие дыхательные упражнения за счет неспецифических механизмов дыхательного тренинга улучшают качество жизни у этих больных.
По вопросам литературы обращайтесь в редакцию.
В. Н. Абросимов, доктор медицинских наук, профессор
Рязанский ГМУ им. акад. И. П. Павлова, Рязань
Врач объяснил, как расшифровать свои анализы на антитела к COVID-19
С результатами подобных анализов корреспондент “Российской газеты” обратилась к сертифицированному специалисту по физической реабилитации, члену Европейской ассоциации амбулаторной реабилитации Леониду Дьякову.
Антитела: иммунный ответ
Леонид Леонидович, в лаборатории люди получают результаты исследования, естественно, безо всяких комментариев. Их отправляют к врачам. Но к ним сейчас пробиться нелегко, да и не каждый рискует сидеть в очередях. В итоге человек мучительно вглядывается в непонятные обозначения, думает, плохо это или хорошо. Расскажите, что значит: “Антитела обнаружены”.
Тест на антитела может показать, сталкивался ли человек с коронавирусом, даже если симптомов COVID-19 у него не было. Если антитела обнаружены, значит, организм среагировал на встреченный вирус. Они могут сохраняться, даже если самого вируса в организме уже нет. Этот тест говорит только о том, что произошел некий иммунный ответ.
Таким образом, выявление антител в крови является информативным свидетельством текущего или прошлого инфекционного процесса и помогает выявить стадию развития инфекции.
Обнаружение IgM указывает на недавнее инфицирование SARS-CoV-2. Они появляются непосредственно после контакта с носителем вируса, на третий-четвертый день. Через семь-десять дней они уже точно присутствуют в крови.
Потом они “стареют”?
Леонид Дьяков: Общий период вероятного выявления антител класса M не превышает двух месяцев. В течение этого времени IgM антитела постепенно полностью сменяются на IgG. Последние начинают формироваться в среднем на 21-й день.
Если еще есть IgM, и уже появились иммуноглобулины класса G, то это означает позднюю инфекцию. Просто IgM еще не сошли на нет.
Получается, наличие IgM не обязательно говорит об активной инфекции?
Леонид Дьяков: Да. Эти антитела могут выявляться и на стадии выздоровления.
Когда в крови выявляются только IgG, это говорит о том, что пациент выздоровел, и у него сформировался иммунитет к SARS-CoV-2. Если уровень IgG достаточно высок, то можно стать донором иммунокомпетентной плазмы. Например, IgG больше 40, а IgM больше 1,5, либо IgG больше 80, а IgM равно нулю.
То есть, если в крови выявлены обе группы антител, это означает, что человек уже выздоравливает?
Леонид Дьяков: Совершенно верно. Еще раз повторю: иммуноглобулины М говорят о том, что человек в данный момент болеет коронавирусом. Это не обязательно тяжелые формы, состояние может быть и бессимптомным. А иммуноглобулины G говорят о том, перенес ли он коронавирусную инфекцию в прошлом.
Далее, в графе “Дополнительная информация”, вообще непонятная шифровка. А чем непонятнее, тем ведь страшнее. К примеру, вот передо мной результаты, переданные одним пациентом: “ОПсыв 0,0338; КП 1,45”. Что кроется за этим?
От чего зависит количество антител в организме?
Лучше не болеть
Заразен ли человек, чей анализ мы расшифровываем?
Леонид Дьяков: По данному тесту нельзя определить, заразен ли еще человек. В принципе, с такими показателями, которые вы предоставили, пациент не заразен.
Но чтобы достоверно знать это, следует все же сдать еще мазок. Именно он покажет, выделяется ли вирус во внешнюю среду. Если он будет отрицательный, то человек стопроцентно не заразен. Без этой уверенности я бы рекомендовал соблюдение мер социальной дистанции и индивидуальной защиты даже в случае обнаружения только антител класса IgG.
А вы верите в то, что все должны переболеть, и тогда с эпидемией будет покончено?
Леонид Дьяков: В этом, конечно, есть логика. Но проблема в том, что вирус дает достаточно серьезные осложнения. И не все болеют в легкой или бессимптомной форме.
Люди, узнавшие что у них обнаружены антитела, начинают думать, когда же, где подхватили заразу. Вспоминают, когда болели. Может ли данный тест показывать антитела не только на COVID-19, но и на перенесенные другие ОРЗ или ОРВИ?
Леонид Дьяков: Исключено. Это специфичный тест именно на антитела к коронавирусной инфекции.
Человек припомнил, что сильно болел в феврале, ему было очень плохо. Мог тогда быть коронавирус?
Леонид Дьяков: Иммуноглобулин G с тех пор не сохранился бы.
То есть, носители антител могут, в принципе, радоваться, что переболели коронавирусом, практически не заметив этого?
Леонид Дьяков: Те, кто переболел легко или бессимптомно, вырабатывают низкий уровень иммуноглобулина G и могут заболеть повторно.
Чем тяжелее протекает заболевание, тем больше антител произведет иммунная система, и тем дольше они проживут в крови после болезни.
Однако есть информация, что сохраняются так называемые клетки памяти. Организм запоминает, как вырабатывать эти антитела, при каких условиях и в каком количестве. И в случае повторного контакта с вирусом организм начинает синтезировать IgG-антитела значительно быстрее, не за 21 день, а за три. И они способны “смягчать” течение заболевания, препятствовать развитию тяжелых осложнений.
Дышите глубже
Получается, что в принципе сдавать тест на антитела и не совсем нужно. Какая разница, болел человек или нет, если этого особо и не заметил, а никаких таких преимуществ наличие антител не дает. Все так же нужно предохраняться от заражения…
Леонид Дьяков: Мое личное мнение, если человек чувствует себя хорошо, особой надобности в тестировании нет. Ведь с тем же успехом можно поискать у себя вирус герпеса и другие.
Однако тестирование поможет решить проблему в более глобальном масштабе, выработать стратегию борьбы с коронавирусом, поскольку по количеству иммунных людей можно спрогнозировать, когда случится спад эпидемии.
Что делать тем, у кого обнаружены антитела класса IgM?
Леонид Дьяков: Если нет явных признаков заболевания, нужно побольше двигаться, гулять на свежем воздухе, дышать полной грудью, чтобы работали легкие, а кислород циркулировал в крови.
Все материалы сюжета “COVID-19. Мы справимся!” читайте здесь.
Пасечников В.Д. Современные представления об этиологии, патофизиологии и лечении функционального запора // Клинические перспективы гастроэнтерологии, гепатологии. 2003. № 2. С. 24–30.
Современные представления об этиологии, патофизиологии и лечении функционального запора
(Ставропольская государственная медицинская академия)
В статье приведены современные представления об этиологии, патологической физиологии и лечении функционального запора. Рассмотрены механизмы развития различных вариантов данной патологии и тактика дифференцированной терапии.
Ключевые слова: функциональный запор, лечение, нарушение транзита по кишечнику.
Запор как проявление дисфункции кишечника весьма широко распространен в современном обществе среди всех возрастных и социальных групп пациентов.
Диагноз «функциональный запор» (ФЗ) стал «легитимным» после принятия в 1999 г. по рекомендации группы экспертов согласительного документа «Рим II: Мультинациональный консенсус по функциональным желудочно-кишечным расстройствам».
В разделе С (Расстройства кишечника – Bowel disorders) консенсуса приведены критерии ФЗ (С3), который включает в себя группу функциональных расстройств, проявляющихся персистирующими нарушениями дефекации, редким стулом или чувством неполной эвакуации кишечного содержимого.
В качестве подгрупп ФЗ выделяются нарушения кишечного транзита и преходящая обструкция аноректального отдела кишечника.В свою очередь, нарушения кишечного транзита могут включать инертную толстую и прямую кишку (идиопатические мегаколон и мегаректум), иногда в комбинации с преходящей обструкцией прямой кишки и ануса.
Для объяснения развития ФЗ предлагаются два патофизиологических механизма.
Первый механизм развития ФЗ связан с развитием феномена инертной кишки (рис. 1) – colonic inertia, или замедления транзита кишечного содержимого, slow transit constipation, то есть замедленного кишечного транзита (ЗКТ).
Рис. 1. Патофизиологические механизмы, приводящие к замедленному кишечному транзиту
Многие исследователи указывают на гетерогенность клинических проявлений этой группы больных и сходятся во мнении, что у большинства больных симптомы возникли de novo в раннем детстве, стали хроническими и идиопатическими. У части больных, напротив, труднокурабельное течение болезни развилось во взрослый период жизни.
Лишь небольшая группа больных не может объяснить развитие запора какими-то определенными обстоятельствами, которые могли бы стать триггерами развития этого состояния. Женщины часто связывают развитие запора с гистерэктомией или рождением ребенка.
Таким образом, термин «запоры, обусловленные ЗКТ», вероятно, включает в себя группу расстройств, объединенных хорошо обозначенным измеряемым признаком – временем кишечного транзита. Хотя с клинической точки зрения пациенты практически не различаются, гетерогенность, включая этиологию, им присуща, и совершенно справедливо считать запор, обусловленный медленным транзитом, группой расстройств.
Для больных с ЗКТ характерными признаками нарушения моторики являются снижение амплитуды, количества и продолжительности пропульсивных волн высокой амплитуды – одного из паттернов нормальной деятельности кишечника (рис. 2).
Рис. 2. Нормальная пропульсивная моторика толстой кишки, обусловленная сокращениями высокой амплитуды (сцинтиграфия и манометрия)
Кроме того, у больных отсутствует ранний постпрандиальный гастрокишечный (gastrocolonic) рефлекс и отмечается сниженный моторный ответ на введение в просвет кишки бисакодила или холинергической стимуляции антихолинэстеразными препаратами.
У части больных определяются выраженные и разнообразные нарушения ректосигмоидной моторики: снижение чувствительности слизистой оболочки прямой кишки, гиперсегментация в сочетании со спастическими сокращениями (рис. 3), снижение или отсутствие гастроректального (gastrorectal) постпрандиального рефлекса.
Рис. 3. Гиперсегментация и анормальная моторика сигмовидной ободочной кишки при ЗКТ
Характерно, что нарушения ректосигмоидной моторики при ЗКТ нередко являются вариантом генерализованных расстройств моторики всего желудочно-кишечного тракта и могут сочетаться с парадоксальными сокращениями лобковопрямокишечной мышцы, приводя к обструкции прямой кишки и анального канала.
В целом расстройства моторики толстой кишки и ректосигмоидного отдела при ЗКТ сочетаются с обнаружением дегенеративных процессов во внутренних и внешних нейрональных путях и абнормальным синтезом и высвобождением нейротрансмиттеров. В части случаев с ними сосуществуют и повреждения структур гладких мышц.
Этиология хронического идиопатического запора, связанного с ЗКТ, является также гетерогенной, связанной с дисфункцией внешней и внутренней (энтеральной) нервной системы или миопатией, психогенными расстройствами. Обнаружено снижение плотности интерстициальных клеток Кахаля, действующих как пейсмекерные клетки, задающие внутренний ритм сокращений и участвующие в передаче сигнала, опосредующие влияние нейротрансмиттеров в нейронных сплетениях кишечника у больных с ЗКТ (рис. 4).
Рис. 4. Уменьшение объема и плотности интерстициальных клеток Кахаля (ИКК) – одна из вероятных причин развития запоров, вызванных ЗКТ
Если симптомы возникли de novo у взрослых, в качестве возможной этиологии ЗКТ рассматриваются аутоиммунные процессы, приводящие к аутоиммунным повреждениям нейронов и мышц. У части больных этиологию ЗТК связывают с острой или перманентной хронической инфекциями, приводящими к нарушению моторики в результате повреждения межмышечного сплетения или непосредственно мышц.
В качестве этиологии ЗКТ рассматривается анормальная продукция эндогенных морфинов и морфиноподобных медиаторов. Определение опиоидов в кишечной стенке у больных с ЗКТ показало снижение плотности лейцин-энкефалинсодержащих нейронов и нормальное содержание метэнкефалин- и динорфинсодержащих нервных волокон. Предполагается, что снижение влияния энкефалинов на активность ингибиторных нейронов является одной из причин запоров.
Повреждение нейронных структур экзогенным путем – одна из версий развития приобретенных расстройств моторики. Идея о токсическом влиянии лаксативов на нервные сплетения не новая. Более 50 лет назад описано повреждение кишки лаксативами – catarrhtic colon.
Меланоз кишечника при развитии запоров также рассматривается как следствие токсического воздействия лаксативов, хотя и не является специфичным для этого класса препаратов. Термин «меланоз» получил название от цвета пигмента меланина, захватываемого макрофагами, фагоцитирующими погибшие вследствие апоптоза клетки кишечника. Подобно антрахинонам полифенольные лаксативы также увеличивают апоптоз клеток кишечника, стимулируя последующую макрофагальную активность.
Психологические расстройства могут ассоциироваться с развитием ЗКТ, хотя и при нормальном транзите кишечного содержимого, но при наличии запоров также могут обнаруживаться подобные нарушения.
Существуют три возможных объяснения этой взаимосвязи:
Итак, нарушение перистальтики кишечника приводит к замедленному транзиту кишечных масс. В результате задержки транзита увеличиваются абсорбция воды и электролитов, деградация твердого компонента кишечных масс бактериями. В результате этих двух процессов уменьшаются частота стула и масса кала. Количество воды и твердый остаток испражнений при запорах уменьшаются пропорционально.
Поскольку тяжелый идиопатический запор наиболее чаще встречается у женщин, сочетается с расстройствами менструального цикла или развивается после гинекологических операций, то логично связать его этиологию с влиянием женских половых гормонов или гинекологических расстройств.
Однако, несмотря на то что абнормальная продукция стероидных гормонов обнаруживается у женщин с выраженным идиопатическим запором, остаются невыясненными несколько проблем.
В т о р о й механизм развития ФЗ обусловлен функциональной преходящей обструкцией прямой кишки и анального канала – обструктивной дефекацией (рис. 5).
Рис. 5. Исследование кишечного транзита с помощью рентгеноконтрастных маркеров – метод дифференциальной диагностики между ЗКТ и функциональной обструкцией эвакуации
Со времени первого упоминания о функциональной преходящей обструкции прямой кишки и анального канала накоплено множество сведений, раскрывающих различные вопросы его патогенеза, важность обструктивной дефекации как одной из причин ФЗ и доказывающих восстановление утраченной функции методом психологического воздействия (biofeedback).
Установлено, что у больных с обструктивной дефекацией страдают и сенсорная, и моторная функции прямой кишки и анального канала. В частности, у таких больных, особенно у женщин, нарушается гастроректальный рефлекс.
В то же время у больных с обструктивной дефекацией и ЗКТ отсутствует увеличение ректального тонуса в ответ на прием пищи. В обеих группах больных отмечены нарушение восприятия кишечного содержимого и тонический ответ прямой кишки на позывы к немедленной дефекации.
В норме же во время дефекации или при натуживании лобково-прямо-кишечная мышца и наружный сфинктер расслабляются (рис. 6). Это наглядно демонстрируют результаты электромиографического исследования мышц тазового дна одновременно с аноректальной манометрией. Пациента просят натужиться, имитируя попытку к дефекации. Во время натуживания у здоровых людей давление на уровне наружного сфинктера падает и снижается электромиографическая активность (рис. 7, 8).
Рис. 6. Расслабление лобково-прямокишечной мышцы и наружного анального сфинктера во время нормального акта дефекации
Рис. 7. Манометрические признаки нормальной дефекации и нарушенной при диссинергии мышц тазового дна
Рис. 8. Электромиографические показатели при нормальной и обструктивной дефекации
Напротив, у пациентов с диссинергией мышц тазового дна парадоксально возрастает давление на наружном сфинктере, сходное с увеличением давления при волевом сжатии, и парадоксально возрастает электромиографическая активность, в связи с чем дефекация становится невозможной (рис. 7, 8).
При анизмусе тазовое дно не опускается и не выпрямляется аноректальный угол (последний остается острым), что также нарушает процесс дефекации (рис. 9).
Рис. 9. Дефекография нормального акта дефекации (слева) и обструктивной дефекации (справа)
Впервые анизмус диагностировали Preston и Lennard-Jones, описавшие парадоксальную контракцию мышц тазового дна у больных с идиопатическим запором. Авторы ввели термин «анизмус» по аналогии с понятием «вагинизм» для описания парадоксального сокращения лобково-прямокишечной мышцы, возникающего иногда во время натуживания при запоре.
Однако международная рабочая группа экспертов по функциональным заболеваниям ануса и прямой кишки, разрабатывая критерии диагностики этих расстройств, пришла к выводу о необходимости замены этого термина как неудачного, отражающего некую «психогенную этиологию», на общий термин «диссинергия тазового дна» как варианта дисшезии.
Дисшезия определяется как затрудненная дефекация при минимум 25% от числа всех актов в течение не менее 3 мес. Затруднение дефекации описывается пациентами как чрезмерное натуживание, ощущение неполной эвакуации или вспоможение путем надавливания пальцами в области ануса.
Диагноз дисшезии устанавливается на основании адекватного описания клинического ее течения при исключении механической причины симптомов. Дисшезия может ассоциироваться с различными патологическими состояниями, включая неадекватное продвижение, ассоциированное с мегаректумом или ректоцеле, отсутствие на внутреннем анальном сфинктере ингибиторного рефлекса, и с наличием гипертензии в анальном канале или без нее.
Иногда симптомы дисшезии обнаруживаются без объективных причин. К функциональным видам дисшезии относят диссинергию мышц тазового дна и дисфункцию внутреннего анального сфинктера.
Обструктивная дефекация является также группой гетерогенных расстройств. Так, на основе вычисления индекса дефекации (соотношение между уровнем давления в прямой кишке и анальном канале во время натуживания) выделяется «спастический» вариант, характеризующийся основным механизмом – спазмом лобково-прямокишечной мышцы и (или) отсутствием расслабления наружного сфинктера.
Второй вариант обструктивной дефекации именуется «вялым», поскольку характеризуется слабым внутриректальным давлением.
Поскольку внутриректальное давление является результирующим от интраабдоминального компонента и градиента, развиваемого ректальными мышцами, то выяснить точный механизм нарушений, приводящий к обструктивной дефекации, не всегда возможно.
Результаты исследований свидетельствуют, что подавляющее большинство больных с обструктивной дефекацией представлено категорией пациентов с нарушенным сенсорным восприятием и со сниженным тоническим ответом прямой кишки при попытке его стимуляции проведением баллонной пробы.
Таким образом, нарушения свойств стенки прямой кишки имеет важное значение в развитии обструктивной дефекации. Примечательно, что при этом растяжимость стенки прямой кишки не страдает.
Еще один вариант обструктивной дефекации связан с дисфункцией внутреннего анального сфинктера. Этот диагноз ставится тогда, когда у пациента имеются симптомы дисшезии и наблюдается манометрическая картина дисфункции внутреннего анального сфинктера.
К дисфункции внутреннего анального сфинктера относят отсутствие или уменьшение ингибиторного рефлекса внутреннего анального сфинктера, или повышение давления в анальном канале, или оба нарушения внутреннего анального сфинктера одновременно. При этом должен объективно отсутствовать такой структурный дефект, как аганглиоз (болезнь Гиршспрунга).
Проблема коррекции нарушений моторной функции желудочно-кишечного тракта при хронических функциональных заболеваниях органов пищеварительной системы по-прежнему остается актуальной. Следует отметить необходимость дифференцированного подхода к терапии ФЗ.
В качестве «золотого» стандарта используется лактулоза (рис. 10).
Рис. 10. Механизм действия лактулозы при терапии функционального запора
Особый интерес вызывает применение нейромышечных средств (холинергические агонисты, колхицин, антагонисты опиатов, простагландины, агонисты 5-гидрокситриптамина). У больных с запорами, вызванными функциональной преходящей обструкцией аноректального отдела кишечника, препаратами выбора являются блокаторы кальциевого входа.
ЗКТ проявляется значительной вариабельностью нарушений моторной активности. В основном это касается снижения количества, амплитуды и продолжительности основного паттерна сократительной деятельности кишечника – перистальтических волн высокой амплитуды. К другим вариантам следует отнести вариабельные нарушения ректосигмоидной моторики, в части случаев как частное проявление общих расстройств моторики желудочно-кишечного тракта.
Большинство исследователей указывает на первичные нарушения нейрональной регуляции, хотя в определенной пропорции они могут сосуществовать с первичными миопатиями. Проверяемые гипотезы возможной этиологии этих расстройств (лаксативы, эндогенные опиоиды, абсорбция, гормоны, психологические расстройства и др.) не дали определенного вывода или заключения.
Принимая во внимание вариабельность исследований, физиологические и патологические доказательства фокусируют основные факторы патогенеза ЗКТ – нервные (внутренние и внешние) и (или) гладкомышечные расстройства.
Этиология ЗКТ остается невыясненной. Вероятными ключами к пониманию сути этих расстройств являются взаимодействия между нервами и мышцами.
Существует множество противоположных версий о первопричинах дисфункции нервов или мышц. Мы считаем, что функциональная и структурная интеграция гладких мышц кишечника зависит от нейрального (химической или электрической) трофического компонента, а функциональное состояние нервов, в свою очередь, поддерживается гомеостазом органа.
Баланс структуры и функции определяется взаимной зависимостью этих категорий. При дисбалансе развиваются расстройства, по мере накопления которых появляются признаки клинических заболеваний.
ЗКТ пока еще является тем состоянием, в котором до сих пор еще не определены тонкие механизмы дисбаланса.
Дискутабельным остается вопрос: являются ли оба варианта ФЗ одним и тем же процессом?
Многие авторы признают полную самостоятельность как синдрома ЗКТ, так и функциональной обструкции прямой кишки и анального канала, то есть обструктивной дефекации. Другие отмечают частое сочетание этих вариантов у одного и того же больного. В частности, подавляющее количество больных с нарушенным кишечным транзитом имеет признаки обструктивной дефекации. В свою очередь, у больных с обструктивной дефекацией (с нормальным или нарушенным кишечным транзитом) имеются признаки расстройств чувствительности и восприятия, ректального тонуса.
Как и при любых других состояниях, успех терапии ФЗ определяется правильностью диагностики, точным подбором препаратов, адекватностью их дозы и продолжительности лечения.