Злокачественное новообразование самостоятельных первичных множественных локализаций что это
Программы лечения рака
Виды рака могут классифицироваться в зависимости от местонахождения опухоли, её размеров, причины возникновения и др. На развитие опухолевого процесса в организме могут влиять различные факторы, от неправильного питания до генетической наследственности. Все виды рака требуют определенной схемы лечения, что позволяет сохранить нормальное течение жизни.
Виды рака характеризуются отличием клеточного строения опухоли, динамикой развития, а также уровнем выживания во время лечения.
Онкологические заболевания могут возникать во всех системах и органах организма. Классификация видов онкологических заболеваний происходит в зависимости от места локализации опухоли и множества других факторов. Так процесс развития злокачественной опухоли может происходить в желудочно-кишечном тракте, мочеполовой системе, верхних дыхательных путях и грудной клетке, коже, скелете и мягких тканях, кровеносной и лимфатической системе, головном и спинном мозге. Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Многие виды рака легко диагностируются на ранних стадиях, что позволяет победить онкологическое заболевание результативно и эффективно. В латентный период, когда симптомы и признаки рака еще не проявились у больного, но размножение раковых клеток уже происходит, выявляется форма и вид онкологического заболевания.
Все виды рака проявляются симптоматикой в зависимости от местонахождения опухоли и ее стадии. Болевые синдромы проявляется в месте роста онкологии, а также ухудшается общее состояние организма, незначительно повышается температура, снижается аппетит. Важным условием в эффективном лечении является ее выявление на ранних стадиях, когда раковые клетки еще не попали в кровь и лимфу.
Стадии развития онкологического заболевания
Что же такое метастазы?
Диагностика заболевания методом компьютерной томографии помогает обнаружить вид онкологического заболевания и образование метастазов в организме и подобрать эффективное лечение для улучшения картины заболевания.
Виды раковых заболеваний
Виды рака определяются в зависимости от множества факторов. Онкологическое заболевание классифицируется по нескольким критериям:
Виды рака разделяются по месту нахождения опухоли. То есть органе или системе, где он развивается.
Также виды онкологических заболеваний разделяются по типу ткани. Раковые клетки активно размножаются в мышечной, эпителиальной, костной, сосудистой, нервной и соединительной ткани. Развитие злокачественного образования в нескольких видах тканей называется сложным.
По строению клеток опухоли различают:
По принципу деления раковых клеток разделяют виды клинического, морфологического и гистологического рака.
Факторы риска
Все виды рака возникают в организме под действием определенных факторов. Развитие онкологического заболевания в основном зависит от образа жизни. Неправильное питание некачественными продуктами с большим содержанием канцерогенов вызывают развитие злокачественных опухолей. Чрезмерное употребление алкоголя и курение также является фактором возникновения рака, а также работа на вредных производствах и предприятиях, где происходит накопление организмом ядовитых веществ.
Также на наличие в организме раковых клеток влияет наследственность. Патологические процессы в клетках могут происходить после их мутации во внутриутробном периоде и во время развития организма. Так некоторые виды рака развиваются у новорожденных детей вместе с ростом тканей организма.
Плохая экология и высокий уровень радиации также являются причинами возникновения рака.
Диагностика онкологических заболеваний
Раннее диагностирование заболевания позволяет подобрать эффективное лечение и повысить шансы на выздоровление и сохранение нормального течения жизни больного. Успешный метод лечения возможен только после обнаружения раковой опухоли и определения вида онкологического заболевания.
Диагностика лечения начинается с консультации специалиста и оценки симптомов заболевания, после чего назначается ряд исследований. Виды рака определяются после ультразвукового исследования и взятия биопсии. Полноценный подход к диагностике заболевания с учетом возраста, сопутствующих недугов и факторов риска помогает исключить ложные симптомы.
Методы лечения онкологических заболеваний
В зависимости от вида онкологического заболевания подбираются методы лечения. Наиболее эффективным является комбинированный или комплексный подход к избавлению от недуга.
От вида онкологического заболевания назначается дополнительное лечение, такое как, лучевая терапия и прием химиопрепаратов.
Успешный исход лечения, может быть достигнут, если пациент настроен на лечение и соблюдение врачебных рекомендаций, профилактическим мерам и наблюдению у врача-онколога. Ранняя диагностика онкологического заболевания позволяет избежать усугубления состояния, восстановлению нормального течения жизни, а также избежанию возможности рецидива.
Профилактика онкологических заболеваний
Виды рака должны контролироваться на протяжении всей жизни с использованием скрининговых исследований. Из-за скрытого течения онкологического заболевания симптомы могут проявиться уже в запущенной стадии, когда лечение может быть малоэффективно. Поэтому профилактические обследования и внимательный подход к опасным симптомам помогут сохранить здоровье на долгие годы, а если болезнь все-таки наступила, особенно, если учтены все факторы риска, то это позволит подобрать правильный метод лечения для любого вида онкологического заболевания.
Успешное лечение первично-множественного
метахронного рака желудка и ободочной кишки
Скоропад В.Ю., Рагулин Ю.А., Рухадзе Г.О., Неборак Ю.Т.
ФГБУ Медицинский Радиологический научный центр Минздрава России, Обнинск, Россия
Первое описание первично-множественных опухолей было дано в 1793 г. английским хирургом Джоном Пирсоном, наблюдавшим больную раком обеих молочных желез и раком тела матки. Первично-множественными злокачественными новообразованиями принято считать опухоли двух и более локализаций, развившиеся в одном организме.
Критерии, сформулированные S. Warren, O. Gates еще в 1932 г., следующие: (1) злокачественный характер каждой опухоли должен быть подтвержден морфологически; (2) опухоли должны быть расположены раздельно; (3) возможность того, что вторая опухоль является метастазом первой, должна быть исключена. По времени возникновения опухоли делятся на синхронные (выявленные одновременно или в срок до 6 мес.) и метахронные.
В настоящее время первично-множественные опухоли не являются казуистической редкостью. Их частота постоянно возрастает, что связано с достижениями хирургии и развитием комбинированных методов лечения, внедрением новейших диагностических технологий, увеличением продолжительности жизни больных, а также влиянием неблагоприятных факторов окружающей среды.
По данным В.И. Чиссова и соавт. [1], число больных с первично-множественными опухолями среди больных с впервые в жизни установленным диагнозом злокачественного новообразования в России имеет неуклонную тенденцию к росту. Так, в 2011 г. были впервые выявлены 24774 первично-множественные опухоли (17,5 на 100000 населения), что составило 4,7% от всех впервые выявленных злокачественных новообразований (в 2010 г. – 2,8%, в 2000 г. – 1,9%).
В то же время, авторы отметили, что в хорошо сбалансированных отчетах данный показатель достигает 10% и подчеркнули, что этот раздел онкологии приобретает все большую актуальность и остроту. В структуре первично-множественных опухолей, новообразования желудочно-кишечного тракта занимают одно из ведущих мест [2, 3].
Б-ая В., 1953 г.р., жительница города Обнинска, по профессии экономист. Онкологические заболевания у ближайших родственников отрицает. Вредные привычки и вредные производственные факторы отсутствуют. Поступила в МРНЦ 22.11.2004 с жалобами на тупую боль в эпигастрии, тошноту, снижение аппетита.
Считает себя больной в течение последнего месяца. При эзофагогастродуоденоскопии в теле желудка выявлена блюдцеобразная опухоль, исходящая из передней стенки и малой кривизны. Проксимальный край опухоли расположен в 3 см от кардии. Взята биопсия, морфологическое заключение: аденокарцинома G1.
По данным СКТ: опухоль нижней трети тела и антрального отдела желудка с признаками изъязвления; данных за поражение регионарных лимфатических узлов не получено.
03.12.2004 выполнено оперативное вмешательство в объеме гастрэктомии D2. При ревизии выявлена опухоль тела желудка, прорастающая серозную оболочку, к ней подпаян большой сальник. Гистологическое исследование №29144-64: макроскопически на малой кривизне желудка изъязвленная блюдцеобразная опухоль 6 см в диаметре, прорастающая в малый сальник.
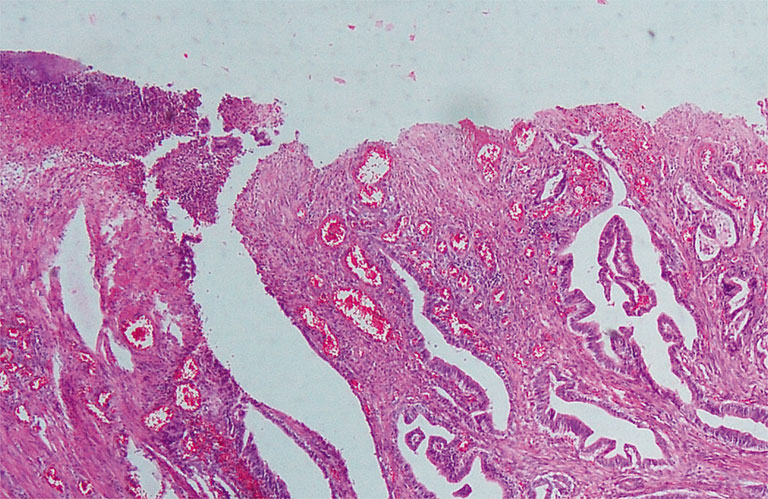
Микроскопически: аденокарцинома G2 (Рисунок 1), прорастающая все слои стенки желудка и жировую клетчатку. В краях резекции и исследованных 10 лимфатических узлах признаков опухоли не обнаружено. Заключительный диагноз: рак тела желудка T4аN0M0G2 – 2B стадия. Послеоперационный период без осложнений. Выписана в удовлетворительном состоянии на 13-е сутки после операции.
В последующем больная проходила регулярные обследования в МРНЦ амбулаторно и в стационарных условиях. Производились физикальный осмотр, ФГС, УЗИ брюшной полости и малого таза, рентгенологическое исследование легких, общий и биохимический анализы крови, анализ крови на опухолевые маркеры (CA19-9, CEA, CA125). Данных за рецидив заболевания получено не было.
19.02.2006 была госпитализирована в МРНЦ с жалобами на наличие образования внизу живота, которое больная отмечала у себя в течение последнего месяца с тенденцией к росту. При пальпации над лоном, преимущественно слева, определяется болезненное объемное опухолевидное образование.
Проведено обследование: при ФГС данных за рецидив рака желудка не получено; по данным рентгенологического исследования легких патологических изменений не выявлено. При УЗИ обнаружено образование левого яичника, преимущественно кистозной структуры, размерами 11х12х13 см, с инвазией в тело матки и аналогичное по структуре образование правого яичника 2,6х3,3 см.
В малом тазу умеренное количество свободной жидкости. Больная консультирована гинекологом. Случай расценен как метастатическое поражение яичников (метастазы Крукенберга).
28.02.2006 выполнена операция: надвлагалищная ампутация матки с придатками. При ревизии в брюшной полости до 500,0 мл серозной асцитической жидкости. Брюшина не изменена. Левый яичник кистозно изменен, увеличен в размерах до 12 см, правый яичник также кистозно изменен, увеличен до 5 см, инфильтрация распространяется на боковую поверхность матки.
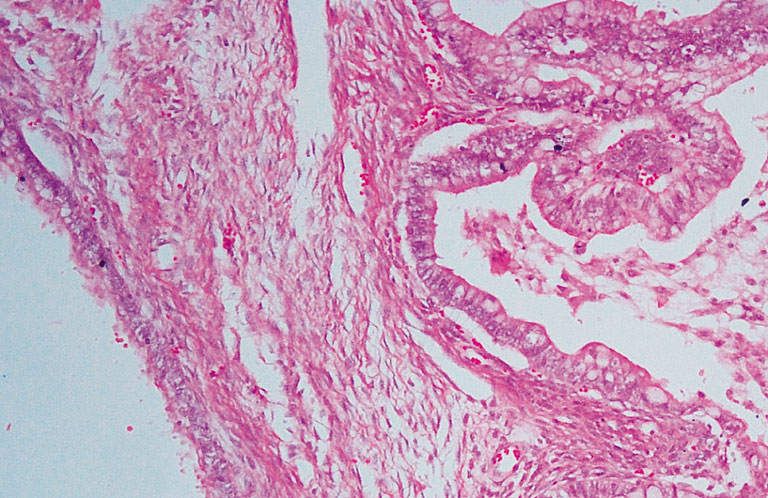
Гистологическое исследование: в обоих яичниках на фоне пограничной муцинозной цистаденомы высокодифференцированная муцинозная аденокарцинома (Рисунок 2). В матке на серозной оболочке с инвазией в миометрий инфильтративный рост высокодифференцированной аденокарциномы.
Высказаться однозначно о гистогенезе рака не представляется возможным, вероятнее всего, это муцинозный рак яичников, однако возможно и метастатическое поражение.
Для уточнения характера поражения яичников проведено иммуногистохимическое исследование с антителами фирмы DAKO на парафиновых срезах операционных препаратов опухоли желудка (1) и яичников (2). Результаты: Выявлена диффузная яркая экспрессия СК7, СК20, СЕА; очаговая экспрессия muc5AC, слабая очаговая экспрессия CDX2, виллин; негативная экспрессия muc2.
Заключение: первичный иммунофенотип аденокарциномы желудка. Выявлена диффузная экспрессия СК7, СК20, СЕА, CDX2; виллин; незначительная очаговая экспрессия СА125, СА19-9. Выявлена негативная экспрессия рецепторов ER, PR, Wilms tumor, виментин. Заключение: иммунофенотип метастаза аденокарциномы желудка в яичнике.
В послеоперационном периоде проведено 4 курса химиотерапии по схеме FOLFOX 4. Перенесла тяжело, с токсическими явлениями 3 степени, от продолжения химиотерапии отказалась.
В конце января 2007 г. проведено очередное амбулаторное обследование в МРНЦ. При СКТ брюшной полости с контрастным усилением (Ультравист 300-50,0) в 4 сегменте печени выявлен округлый участок пониженной плотности с четкими контурами, не накапливающий РКВ, до 8 мм в диаметре.
Увеличенных лимфатических узлов в брюшной полости и забрюшинном пространстве не определяется. Заключение: КТ-картина солитарного очагового образования печени, рекомендован КТ-контроль в динамике.
В течение февраля 2007 г. обследована в различных специализированных онкологических учреждениях г. Москвы. По данным УЗИ: структура печени неоднородна. По нижнему краю 4-5 сегментов определяются метастатические узлы до 2,5 см, сливающиеся в конгломерат до 6,5х4,0х4,7 см. В поддиафрагмальных отделах правой доли узел до 2,0 см.
По данным МРТ: печень не увеличена. В паренхиме (в обеих долях) определяются метастазы 0,4-3,5 см в диаметре. В правой доле печени конгломерат узлов достигает 7,6х3,7 см. Метастатические узлы определяются также на брюшине. Асцита нет. Заключение: Метастатическое поражение печени, брюшины.
В течение марта 2007 г. больная за лечебной помощью не обращалась.
В начале апреля 2007 г. выполнены УЗИ и МРТ печени. УЗИ: печень умеренно увеличена, с неровными контурами. В обеих долях лоцируется несколько изоэхогенных узловых образований различного диаметра, с нечеткими границами, плохо выраженными анэхогенными венчиками, неправильной округлой формы. В 4 и 5 сегментах – большой опухолевый конгломерат аналогичной эхоструктуры, наибольший размер которого превышает 7,0 см.
В правой мезогастральной области – опухолевидное образование диаметром до 4,0 см, прорастающее прилежащий участок передней брюшной стенки. Заключение: множественные метастазы в печени, образования брюшной полости (вероятно, метастатического характера). Выполнена чрескожная пункционная биопсия образования брюшной полости. Гистологическое заключение: в биоптате на фоне выраженного фиброза фокусы клеток недифференцированного рака.
МРТ печени: печень увеличена в размерах. В правой доле печени на границе 5 и 6 сегментов определяется неправильной формы участок с нечеткими, неровными контурами, повышенной интенсивности сигнала на Т2-взвешенных изображениях и пониженной интенсивности сигнала на Т1-взвешенных изображениях, размерами 30х57х34 мм.
Справа от него определяется аналогичный участок размерами 27х23х23 мм. В 6 и 7 сегментах печени – аналогичные участки размерами 34х23х30 мм, 15х13х16 мм и 30х31х38 мм. Два аналогичных более мелких (1-15 мм) участка определяются в 7 сегменте печени. Заключение: МР картина множественных метастазов в печени.
С апреля по декабрь 2007 г. в различных специализированных медицинских учреждениях Москвы, Калуги и Обнинска проведено 9 курсов системной и регионарной внутриартериальной химиотерапии по схеме: кампто 400 мг, гемзар 1400 мг, карбоплатин 450 мг (в последних курсах заменен на элоксатин 100 мг); митомицин 10 мг – эмболизация печеночной артерии в 12 мг липойодола (первые два курса). Отмечалась лихорадка до 38,6о и лейкопения 3 ст., проводили стимуляцию нейпогеном.
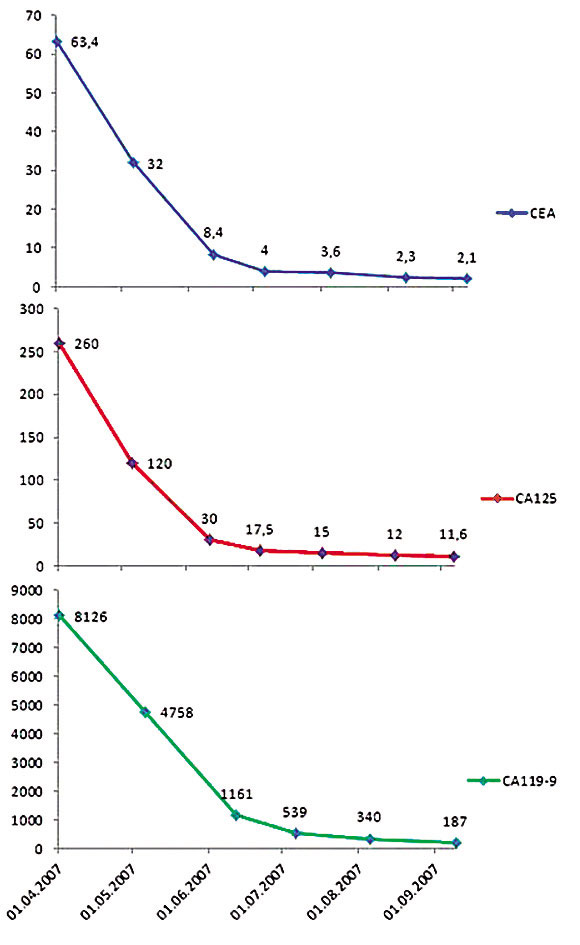
В течение периода лечения отмечалась постоянная положительная динамика как по данным опухолевых маркеров (Рисунок 3), так и по данным УЗИ печени. В сентябре 2007 г. по данным УЗИ: в правой и левой долях печени с большим трудом лоцируется несколько очагов с нечеткими границами, без анэхогенных венчиков. В декабре 2007 г. по данным УЗИ очаговых образований в печени не выявлено.
В апреле 2009 г. получала лечение по поводу лекарственного гепатита препаратом гептрал (5,0 внутривенно №15).
С 2009 по 2011 г. больная регулярно наблюдалась в МРНЦ, проводили физикальное обследование, УЗИ брюшной полости и малого таза, анализы на опухолевые маркеры. Данных за рецидив получено не было.
В начале февраля 2012 г. больная обратилась в МРНЦ с жалобами на схваткообразные боли в эпигастрии, периодическую задержку стула и газов. При обследовании (УЗИ, СКТ брюшной полости, колоноскопия) выявлена стенозирующая опухоль восходящего отдела ободочной кишки. На СКТ органов грудной полости обнаружено очаговое образование в S3 правого легкого с неровными, нечеткими контурами, размером 15х13мм. Заключение: очаговое образование в S3 правого легкого.
Необходимо дифференцировать между метастатическим очагом и периферическим раком легкого. 14.02.2012 на фоне нарастающей клиники толстокишечной непроходимости выполнена операция: правосторонняя гемиколэктомия. При ревизии: в брюшной полости – выраженный спаечный процесс; данных за отдаленные метастазы не получено; после разделения спаек выявлена стенозирующая опухоль восходящего отдела ободочной кишки. Послеоперационный период без осложнений.
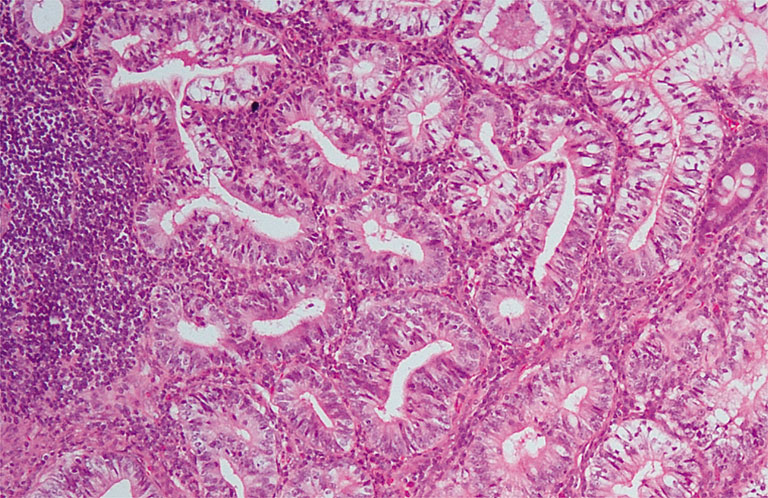
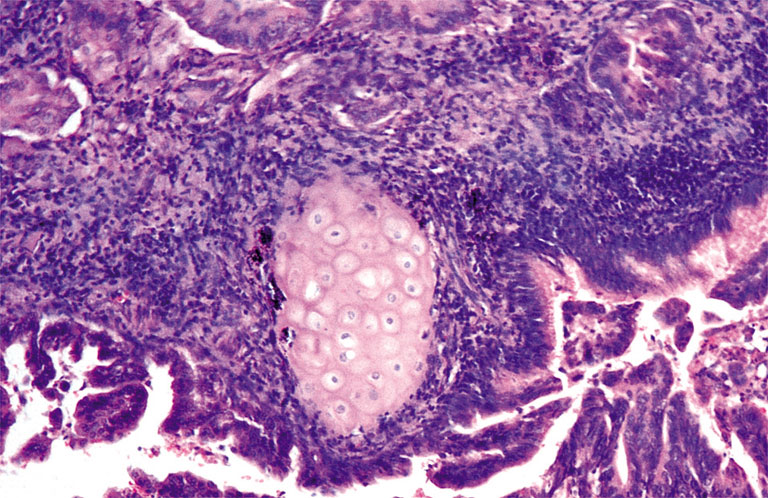
Гистологическое заключение: аденокарцинома G1, прорастающая в мышечный слой (Рисунок 4) и врастающая в прилежащую жировую клетчатку. В жировой клетчатке в проекции опухоли – одиночный раковый депозит. Лимфатические узлы и края отсечения без признаков опухоли. Заключительный диагноз: рак восходящего отдела ободочной кишки T3N0M0G1. Больная выписана в удовлетворительном состоянии 24 февраля 2012 г., рекомендована явка для дообследования и оперативного лечения опухоли легкого.
07.03.2012 была госпитализирована в торакальное отделение МРНЦ. При поступлении общее состояние удовлетворительное, жалобы на умеренную слабость. 20.03.2012 выполнена видеоторакоскопическая резекция опухоли верхней доли правого легкого. При ревизии – опухоль размером 2х1,5 см., прорастающая висцеральную плевру. Гистологическое заключение: сосочковая аденокарцинома G2 из эпителия сегментарного бронха с перибронхиальным ростом и множественными отсевами в ткань легкого – вероятно, первичный рак легкого (Рисунок 5).
Учитывая мультицентричность поражения, наличие опухолевых сателлитов в удаленной ткани легкого, вероятность опухолевой диссеминации в оставшейся части резецированной доли решено выполнить верхнюю лобэктомию справа. Проведение оперативного вмешательства данного объема позволяло уточнить распространенность процесса и обеспечить радикализм в случае выявления первичного рака легкого. 03.04.2012 выполнена операция: торакотомия, верхняя лобэктомия справа, медиастинальная лимфаденэктомия.
Гистологическое заключение: ткань легкого обычного строения, обнаружен единичный опухолевый эмбол в лимфатическом сосуде; 13 лимфатических узлов и край резекции долевого бронха без признаков опухолевого роста. Послеоперационный период без осложнений. Выписана на 10 сутки после операции в удовлетворительном состоянии.
Для уточнения характера поражения легкого проведено иммуногистохимическое исследование с антителами фирмы DAKO на парафиновых срезах операционных препаратов опухоли толстой кишки (1) и легкого (2). Результаты: (1) Выявлена диффузная яркая экспрессия СК20, CDX2; muc5AC; диффузная менее выраженная экспрессия СЕА, СК7; слабо выраженная экспрессия виллин. Выявлена негативная экспрессия muc2. Заключение: первичный иммунофенотип аденокарциномы толстой кишки.
(2) Выявлена диффузная экспрессия СЕА, CKLMW, CKHMW, CD2, CK7, CK20, виллин, muc5AC. Выявлена негативная экспрессия рецепторов ER, PR; TTF1, VEGF, muc2. Заключение: иммунофенотип метастаза аденокарциномы толстой кишки в легком.
Данное наблюдение представляет интерес в связи с успешным лечением больной первично-множественным раком желудка и ободочной кишки, имевшим метахронные (в первом случае) и синхронные (во втором случае) метастазы. Безусловно, дифференциальная диагностика между полинеоплазиями и метастазами представляет значительные трудности. Особенно она сложна, если новообразования имеют характерные для метастазов локализации – яичники, печень, легкие. В этих случаях даже наличие операционного/биопсийного материала и стандартного морфологического исследования является недостаточным для постановки истинного диагноза.
В таких случаях необходимо проведение иммуногистохимического исследования, поскольку характер опухоли – первичный либо метастатический – определяет дальнейшую тактику лечения. К сожалению, очень высок процент выявления вторых опухолей на поздних стадиях заболевания, что говорит о необходимости применения активного диагностического алгоритма, для чего, в свою очередь, необходимы соответствующие исследования с целью более полного понимания закономерностей развития полинеоплазий.
Представленное наблюдение обосновывает необходимость придерживаться активной тактики лечения больных первично-множественными злокачественными опухолями даже при наличии отдаленных метастазов.
Рисунок 1. Изъязвленная умереннодифференцированная аденокарцинома желудка.
Окраска гематоксилином и эозином, х40.
Рисунок 2. Метастаз рака желудка в яичнике. Окраска гематоксилином и эозином, х100.
Рисунок 3. Динамика опухолевых маркеров в процессе проведения химиотерапии.
Рисунок 4. Высокодифференцированная ааденокарцинома восходящего отдела ободочной кишки.
Окраска гематоксилином и эозином, Х100.
Рисунок 5. Метастаз рака толстой кишки в легкое. Окраска гематоксилином и эозином, Х100.
Ключевые слова: первично-множественный рак; рак желудка; рак ободочной кишки; хирургическое лечение; комбинированное лечение.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Злокачественное новообразование самостоятельных первичных множественных локализаций что это
Ростовский научно-исследовательский онкологический институт Минздрава РФ
Ростовский научно-исследовательский онкологический институт, Ростов-на-Дону, Россия
Ростовский научно-исследовательский онкологический институт Минздрава РФ
ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, Ростов-на-Дону, Россия
Первично-множественный колоректальный рак: клинические аспекты
Журнал: Терапевтический архив. 2016;88(8): 53-58
Солдаткина Н. В., Кит О. И., Геворкян Ю. А., Милакин А. Г. Первично-множественный колоректальный рак: клинические аспекты. Терапевтический архив. 2016;88(8):53-58.
Soldatkina N V, Kit O I, Gevorkian Iu A, Milakin A G. Multiple primary colorectal cancer: Clinical aspects. Terapevticheskii Arkhiv. 2016;88(8):53-58.
https://doi.org/10.17116/terarkh201688853-58
Ростовский научно-исследовательский онкологический институт Минздрава РФ
Резюме Цель исследования. Определить некоторые клинические особенности синхронного и метахронного колоректального рака (КРР). Материалы и методы. Объектом исследования послужили данные о 150 больных первично-множественным КРР T1-4N0-2M0-1. Проведен анализ клинических, биологических, морфологических особенностей синхронных и метахронных опухолей. Результаты. Первично-множественные опухоли составили 6,01% от всех форм КРР. Преобладал синхронный КРР (63,75%) с локализацией опухоли в сигмовидной и прямой кишке. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы, метахронные выявлялись после лечения опухолей половых органов. У мужчин синхронные колоректальные опухоли чаще сочетались с раком почки, метахронные выявлялись после лечения рака желудка. Заключение. Выявленные особенности первично-множественных колоректальных опухолей возможно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения онкологических больных.
Ростовский научно-исследовательский онкологический институт Минздрава РФ
Ростовский научно-исследовательский онкологический институт, Ростов-на-Дону, Россия
Ростовский научно-исследовательский онкологический институт Минздрава РФ
ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, Ростов-на-Дону, Россия
Проблема колоректального рака (КРР) на протяжении нескольких десятилетий продолжает оставаться актуальной, что обусловлено как ростом заболеваемости, так и прогрессивными достижениями в лечении [1]. Наряду с увеличением общей онкологической заболеваемости наблюдается увеличение заболеваемости первично-множественными опухолями толстой и прямой кишки [2], которые в настоящее время составляют 17% от всех первично-множественных злокачественных новообразований и являются одной из наиболее частых локализаций первично-множественных злокачественных опухолей после первично-множественного рака кожи [3, 4].
В настоящее время проводится изучение как клинических, так и онкобиологических аспектов первичной множественности опухолей толстой и прямой кишки 6, тем не менее многие аспекты в этой проблеме остаются открытыми, что и побудило нас коснуться некоторых вопросов первично-множественного КРР.
Цель исследования: определить некоторые клинические особенности синхронного и метахронного КРР.
Материалы и методы
Таким образом, синхронные опухоли составили 34% от всего первично-множественного КРР. Средний возраст больных достигал 62,9 года. Среди заболевших преобладали мужчины (62,75%). Синхронные опухоли преимущественно локализовались в сигмовидной (62,75%) и прямой кишке (56,86%), представлены в основном умереннодифференцированными аденокарциномами (49,02%), без регионарных и отдаленных метастазов (66,67%).
Метахронный КРР среди первично-множественного рака с локализацией опухолей только в толстой и прямой кишке выявлен у 29 (36,25%) больных (средний возраст 64,7 года). В этой группе было 16 (55,17%) женщин (средний возраст 66,9 года). Метахронная колоректальная опухоль (МКО) выявлена у них в среднем через 8,3 года после выявления первой опухоли. Среди больных метахронным первично-множественным КРР было 13 (44,83%) мужчин (средний возраст 62,5 года), метахронная опухоль выявлена у них в среднем через 4,5 года после первой опухоли.


У 65,4% больных опухоль была местно-распространенной, с наличием регионарных метастазов у одной из опухолей. Статистически значимых половых различий по стадии TNM синхронных колоректальных опухолей и других локализаций рака мы не наблюдали.
Распределение синхронных колоректальных опухолей при наличии и другой локализации рака по гистологической структуре свидетельствует о значительном преобладании синхронных умереннодифференцированных аденокарцином (80,8%) у мужчин и женщин.
Итак, синхронный КРР с другими локализациями опухолей составил лишь 17,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 67,1 года, женщины были на 7 лет моложе мужчин. Среди заболевших было одинаковое число женщин и мужчин. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы. У мужчин синхронный КРР чаще сочетался с раком почки. Синхронные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (80,8%), местно-распространенными, с наличием регионарных метастазов (65,4%).

28 (63,6%) больных имели местно-распространенную форму МКО и других локализаций рака, без отдаленных метастазов. Половые различия при этом отсутствовали.
Заключение
Клиническая картина первично-множественного КРР характеризуется наличием симптомов, не свойственных только одной локализации рака. Это обусловливает необходимость расширения диагностического поиска для исключения синхронной опухоли. При этом более выраженное клиническое проявление симптомов первично-множественного заболевания приводит к уменьшению до 3 мес сроков от появления клинической картины недуга до обращения за специализированной помощью у большинства больных (50% больных синхронным и 70% больных метахронным раком). В этот срок при одиночном КРР обращаются лишь 30% больных.
Диагностика метахронных опухолей облегчается наличием диспансеризации и регулярного обследования больных после излечения первой опухоли.
Все первично-множественные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (как наиболее распространенного гистологического типа колоректальной опухоли), местно-распространенными, без отдаленных метастазов (возможно, в связи с тем что больные отобраны для хирургического лечения). Преобладание при первично-множественном КРР, сочетающемся с опухолями других органов, регионарных метастазов, возможно, свидетельствует о его более агрессивном течении по сравнению с другими видами первично-множественных колоректальных опухолей.
Выявленные особенности первично-множественных колоректальных опухолей можно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения больных с первично-множественными опухолями.