Зона бдс что это значит
Зона бдс что это значит
Рак большого дуоденального сосочка может быть представлен двумя формами: интрамуральной и полипозной. При интрамуральной форме, представляющей собой первую стадию развития опухоли, ее размеры наименьшие. Полипозный рак (вторая стадия развития опухоли) встречается наиболее часто. Микроскопически рак БСДК представлен различными гистологическими типами аденокарциномы. Наиболее часто отмечены структуры дифференцированной аденокарциномы, которая в зонах экзофитного роста имеет папиллярное строение.
В участках эндофитного роста выявляются структуры менее дифференцированного железистого рака: скиррозной и тубулярной аденокарциномы, солидного и мелкоклеточного недифференцированного рака. Редкой формой является слизистый рак. Среди эпителиальных клеток некоторых опухолей, имеющих строение сосочковой и тубулярной аденокарциномы, отмечается резкое увеличение числа эндокринных клеток; они имеют цилиндрическую, треугольную, округлую и вытянутую форму. Некоторые авторы считают это проявлением кишечной дифференцировки опухоли.
Помимо структурной атипии, в раковом эпителии определяются признаки функциональной атипии, нарастающей по мере снижения дифференцировки опухолевых структур. Она проявляется уменьшением или полным прекращением выработки слизи раковыми клетками, изменением химического состава слизи. Если в дифференцированной аденокарциноме секреторная способность сохраняется во многих клетках и железах, то в солидной аденокарциноме слизь определяется только в единичных клетках, а в клетках недифференцированного рака вовсе отсутствует. В составе слизистого секрета, вырабатываемого раковыми клетками, преобладают кислые гликозаминогликаны.
Изучение относительно ранних стадий развития рака большого дуоденального сосочка позволяет установить некоторые особенности роста и гистогенеза этой опухоли. Фоновым состоянием для рака являются гиперпластические изменения складок слизистой оболочки и папиллярных желез. При микроскопическом исследовании периферической зоны раковой опухоли выявлены два вида роста: инфильтративный (инвазивный) и мультицентрический. Для первого характерна инвазия преимущественно в глубину тканей БСДК по ходу стенок общего желчного протока и главного протока поджелудочной железы. При мультицентрическом росте опухоли вблизи основного опухолевого узла, но вне связи с ним располагаются фокусы карциномы. В одних участках они ограничиваются пределами эпителиального пласта, в других представляют собой микроскопические очаги инвазивного рака.
Подобного рода изменения захватывают покровный эпителий слизистой оболочки большого дуоденального сосочка, эпителий гиперпластических полипов, а также эпителий папиллярных желез и происходящих из них аденомиозных структур.
В таких случаях вся картина соответствует «опухолевому полю» с его зонами, последовательно вовлекающимися в опухолевый процесс.
Еще одна особенность рака большого дуоденального сосочка, не привлекавшая ранее внимания исследователей, состоит в том, что рак этой локализации часто развивается на фоне определенного варианта строения БСДК. Речь идет о раздельном впадении общего желчного протока и главного протока поджелудочной железы в двенадцатиперстную кишку на верхушке сосочка. Этот фон для развития рака не является случайным.
Как было показано, раздельное впадение протоков на верхушке большого дуоденального сосочка создает условия для формирования гиперпластических полипов, выступающих из его устья в просвет двенадцатиперстной кишки. Вследствие такого необычного расположения полипы подвергаются постоянным воздействиям неадекватных механических и химических раздражителей, что создает оптимальные условия для их малигнизапии. Это дает основания отнести гиперпластические полипы БСДК к группе предраковых образований и не позволяет согласиться с имением К. Tasaka (1977), который считает, что только аденомы БСДК являются предшественниками карциномы.
Принято считать, что в гистогенетическом отношении рак этой локализации является сборной группой и может возникать из покровного эпителия слизистой оболочки двенадцатиперстной кишки, ампулы БСДК, общего желчного протока и главного протока поджелудочной железы, а также из бруннеровых желез. Некоторые авторы полагают, что типичный рак БСДК исходит из кишечного эпителия. Особенности гистологического строения и характер роста рака, выявленные нами, свидетельствуют в пользу происхождения этих опухолей из эпителия слизистой оболочки БСДК.
Это подтверждают также морфологические картины, отражающие разные стадии малигнизапии эпителия слизистой оболочки БСДК и исходящих из нее гиперпластических образований, а также очаги мультицентрического роста рака в слизистой оболочке ампулы БСДК и интрапапиллярных отделов общего желчного протока и главного протока поджелудочной железы.
Приведенные данные свидетельствуют о гистогенетической связи рака большого дуоденального сосочка с эпителиальными элементами слизистой оболочки БСДК, а не с эпителием двенадцатиперстной кишки. С нашей точки зрения, гистогенез рака БСДК может объяснить общеизвестный факт избирательного развития этой опухоли в области сосочка по сравнению с другими отделами двенадцатиперстной кишки.
– Вернуться в оглавление раздела “гистология”
Комплексное лечение дисфункций большого дуоденального сосочка
Рассмотрены классификация, клиническая картина и клинические типы дисфункции большого дуоденального сосочка (БДС), методы диагностики, включая дифференциальную диагностику функциональных и органических поражений сфинктера БДС, и подходы к лечению.
An examination was provided on classification, clinical picture and clinical types of dysfunction of major duodenal papilla (MDP), the methods of diagnostics, including differential diagnostics of the functional and organic failures of sphincter MDP, and approaches to the treatment.
Дисфункции большого дуоденального сосочка (БДС) — функциональные заболевания, проявляющиеся нарушением механизмов расслабления и сокращения сфинктера Одди с преобладанием повышения тонуса и спазма (гипермоторная, гиперкинетическая) или расслабления и атонии (гипомоторная, гипокинетическая), без органических и воспалительных изменений, вызывающие нарушение поступления желчи и панкреатического сока в двенадцатиперстную кишку.
Дискинезия желчных протоков обычно возникает в результате нарушения нейрогуморальной регуляции механизмов расслабления и сокращения сфинктеров Одди, Мартынова–Люткенса и Мирицци. В одних случаях преобладают атония общего желчного протока и спазм сфинктера Одди вследствие повышения тонуса симпатического отдела вегетативной нервной системы, в других — гипертония и гиперкинезия общего желчного протока при расслаблении упомянутого выше сфинктера, что связано с возбуждением блуждающего нерва. В клинической практике чаще встречается гипермоторная дискинезия. Причина — психогенное воздействие (эмоциональные перенапряжения, стрессы), нейроэндокринные расстройства, воспалительные заболевания желчного пузыря, поджелудочной железы, двенадцатиперстной кишки. Дисфункции БДС часто сочетаются с гипермоторными и гипомоторными дискинезиями желчного пузыря.
Классификация:
1. Дисфункция по гипертоническому типу:
2. Дисфункция по гипотоническому типу (недостаточность сфинктера Одди):
Клиника:
Клинические типы дисфункции БДС:
1. Билиарный (встречается чаще): характерны боли в эпигастрии и правом подреберье, иррадиирующие в спину, правую лопатку:
2. Панкреатический — боли в левом подреберье, иррадиируют в спину, уменьшаются при наклоне вперед, не отличаются от болей при остром панкреатите, могут сопровождаться повышением активности панкреатических ферментов при отсутствии причин (алкоголь, желчнокаменная болезнь):
3. Смешанный — боли в эпигастрии или опоясывающие, могут сочетаться с признаками как билиарного, так и панкреатического типа дисфункции.
Диагноз «гипертония сфинктера Одди» ставят в случаях, когда фаза закрытого сфинктера длится дольше 6 мин, а выделение желчи из общего желчного протока замедлено, прерывисто, иногда сопровождается сильной коликообразной болью в правом подреберье.
Недостаточность БДС — чаще всего бывает вторичной, у больных желчнокаменной болезнью, хроническим калькулезным холециститом, вследствие прохождения конкремента, воспаления поджелудочной железы, слизистой двенадцатиперстной кишки, при дуоденальной непроходимости. При дуоденальном зондировании сокращается фаза закрытого сфинктера Одди менее 1 мин или отмечается отсутствие фазы закрытия сфинктера, отсутствие тени желчного пузыря и протоков при холецистохолангиографии, заброс контрастного вещества в желчные протоки при рентгеноскопии желудка, наличие газа в желчных протоках, снижение показателей остаточного давления при холангиоманометрии, уменьшение времени поступления радиофармпрепарата в кишку менее 15–20 мин при гепатобилисцинтиграфии.
Диагностика
1. Трансабдоминальная ультрасонография. Ультразвуковой скрининговый метод обследования занимает ведущее место в диагностике дискинезий (табл.), позволяет с высокой точностью выявить:
Ультразвуковые признаки дискинезий:
2. Ультразвуковая холецистография. Дает возможность исследовать моторно-эвакуаторную функцию желчного пузыря в течение 1,5–2 часов от момента приема желчегонного завтрака до достижения первоначального объема. В норме через 30–40 мин после стимуляции желчный пузырь должен сократиться на 1/3–1/2 объема. Удлинение латентной фазы более 6 мин свидетельствует об усилении тонуса сфинктера Одди.
3. Динамическая гепатобилисцинтиграфия. Основана на регистрации временных показателей пассажа короткоживущих радионуклидов по билиарному тракту. Позволяет оценить поглотительно-выделительную функцию печени, накопительно-эвакуаторную функцию желчного пузыря (гипермоторная, гипомоторная), проходимость терминального отдела общего желчного протока, выявить обструкцию желчных путей, недостаточность, гипертонус, спазм сфинктера Одди, стеноз БДС, дифференцировать органические и функциональные нарушения при помощи пробы с Нитроглицерином или Церукалом. При гипертонусе сфинктера Одди отмечается замедление поступления препарата в двенадцатиперстную кишку после желчегонного завтрака. Этот метод наиболее точно позволяет установить тип дискинезии и степень функциональных нарушений.
4. Фракционное хроматическое дуоденальное зондирование. Дает информацию о:
5. Гастродуоденоскопия. Позволяет исключить органические поражения верхних отделов желудочно-кишечного тракта, оценить состояние БДС, поступление желчи.
6. Эндоскопическая ультрасонография. Позволяет более четко визуализировать терминальный отдел общего желчного протока, БДС, головку поджелудочной железы, место впадения вирсунгова протока с целью диагностики конкрементов, дифференциальной диагностики органических поражений БДС и гипертонуса.
7. Эндоскопическая ретроградная холангиопанкреатография. Метод прямого контрастирования желчных путей, позволяет выявить наличие конкрементов, стеноз БДС, расширение желчных путей, произвести прямую манометрию сфинктера Одди, играет большое значение в дифференциальной диагностике органических и функциональных заболеваний.
8. Компьютерная томография. Позволяет выявить органическое поражение печени и поджелудочной железы.
9. Лабораторная диагностика. При первичных дисфункциях лабораторные анализы не имеют отклонений от нормы, что имеет значение для дифференциальной диагностики. Транзиторное повышение уровня трансаминаз и панкреатических ферментов может отмечаться после приступа при дисфункции сфинктера Одди.
Лечение
Основная цель — восстановление нормального оттока желчи и панкреатического сока в двенадцатиперстную кишку.
Основные принципы лечения:
1) нормализация процессов нейрогуморальной регуляции механизмов желчевыделения — лечение неврозов, психотерапия, устранение гормональных расстройств, конфликтных ситуаций, отдых, правильный режим питания;
2) лечение заболеваний органов брюшной полости, которые являются источником патологических рефлексов на мускулатуру желчного пузыря и желчных протоков;
3) лечение дискинезии, которое определяется ее формой;
4) устранение диспептических проявлений.
Лечение при гипертонической форме дискинезии
1. Устранение невротических расстройств, коррекция вегетативных нарушений:
4. Прокинетики: Церукал (метоклопрамид) — 10 мг 3 раза в сутки за 1 час до еды.
5. Одестон (гимекромон) — обладает спазмолитическим действием, расслабляет сфинктер желчного пузыря, желчных протоков и сфинктер Одди, не влияя на моторику желчного пузыря — 200–400 мг 3 раза в сутки в течение 2–3 недель.
Лечение при гипотонической форме дискинезии
2. Холеретики — стимулируют желчеобразовательную функцию печени:
3. Оказывающие спазмолитическое и желчегонное действие:
4. Холекинетики — повышают тонус желчного пузыря, снижают тонус желчных путей:
6. «Слепой тюбаж» — дуоденальное зондирование и дуоденальное промывание с теплой минеральной водой, введение 20% раствора сорбита, что уменьшает или устраняет спазм сфинктеров, усиливает отток желчи — 2 раза в неделю.
Одестон эффективен в случаях одновременного наличия гипомоторной дисфункции желчного пузыря и гипермоторной дисфункции сфинктера Одди. При сочетании гиперкинетической, нормокинетической дисфункции желчного пузыря и гиперкинетической дисфункции сфинктера Одди эффективность терапии Но-шпой достигает 70–100%. При сочетании гипокинетической дисфункции желчного пузыря и гиперкинетической сфинктера Одди показано назначение Церукала или Мотилиума, возможно в сочетании с Но-шпой. При сочетании гипермоторной дисфункции желчного пузыря и гипомоторной сфинктера Одди эффективно назначение экстракта артишоков 300 мг 3 раза в сутки.
Спазмолитики являются основным медикаментозным средством для лечения гипертонических, гиперкинетических дисфункций желчного пузыря и сфинктера Одди при остром болевом приступе и болях в межприступный период. Миотропные спазмолитики оказывают целенаправленное воздействие на гладкую мускулатуру всей желчевыводящей системы. Результаты многочисленных исследований показали, что дротаверин (Но-шпа) является препаратом выбора из группы миотропных спазмолитиков, позволяет купировать болевой синдром, восстановить проходимость пузырного протока и нормальный отток желчи в двенадцатиперстную кишку, устранить диспептические нарушения. Механизм действия — ингибирование фосфодиэстеразы, блокирование Ca2+-каналов и кальмодулина, блокирование Na+-каналов, в результате снижение тонуса гладкой мускулатуры желчного пузыря и желчных протоков. Лекарственные формы: для парентерального применения — ампулы 2 мл (40 мг) дротаверина, для приема внутрь — 1 таблетка препарата Но-Шпа (40 мг дротаверина), 1 таблетка препарата Но-Шпа форте (80 мг дротаверина).
Преимущества препарата Но-Шпа:
Таким образом, обзор результатов многочисленных клинических исследований свидетельствует, что Но-шпа является эффективным препаратом для быстрого купирования спазмов и болей при гипертонических, гиперкинетических формах дискинезии желчного пузыря и сфинктера Одди.
Литература
А. С. Воротынцев, кандидат медицинских наук, доцент
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Эндоскопическая диагностика и лечение опухолей большого дуоденального сосочка
А. С. Балалыкин, Оноприев А. В., Муцуров Х. С., Катрич А. Н., Вербовский А. Н.
Москва, Краснодар
Актуальность
В настоящее время число воспалительных и опухолевых заболеваний поджелудочной железы, желчного протока и большого дуоденального сосочка (БДС), вызывающих непроходимость внепеченочных желчных протоков, продолжает увеличиваться и удельный вес рака БДС среди опухолей билиопанкреатодуоденальной зоны составляет 10,1–18,3 % (Русаков В. И. с соавт., 1986; Frosali D. et al., 1990).
Чрезвычайная злокачественность рака панкреато-биллиарной области и его поздняя диагностика приводят к тому, что хирургическое лечение больных сопровождается высоким операционным риском и невозможностью выполнения радикальных операций. Их частота составляет только 4–27 %, послеоперационная летальность достигает 8–22 %, а пятилетняя выживаемость — всего 4–6 % [М. В. Данилов соавт., 1995; А. А. Мовчун с соавт., 1994; В. А. Кубышкин с соавт., 2003].
Благодаря ранним клиническим проявлениям (механическая желтуха) опухоли БДС диагностируются на более ранней стадии, чем опухоли другой локализации. Существующие инструментальные методы исследования (эндоскопические, лучевые, лапароскопические) далеко не всегда позволяют сформулировать наиболее рациональную тактику и вид лечения, и главное, имеют существенные ограничения в оценке стадии болезни.
К 80-м годам прошлого столетия был разработан принципиально новый диагностический прибор — эхо-эндоскоп, соединивший в себе возможности гибковолоконной эндоскопии и ультразвукового исследования.
Отличительной особенностью и неоспоримым преимуществом метода перед другими является то, что ультразвуковой датчик под контролем зрения размещается в непосредственной близости от зоны исследования, что позволяет повысить разрешающую способность ультразвукового сканирования. Учитывая короткую дистанцию исследования, и доказанную корреляцию между получаемым ультразвуковым изображением и анатомическим строением стенки полых органов желудочно-кишечного тракта (ЖКТ), эндо-УЗИ позволяет произвести послойную структурную оценку БДС, окружающих его органов и тканей, сосудистых и протоковых образований в зоне исследования. Полученные данные позволяют установить диагноз и обосновать план лечения.
Материалы и методы исследования. Нами проанализированы результаты лечения 39 пациентов с подозрением на злокачественные новообразования диагностированные при обследовании 421 больных в 2004–2009 гг. в возрасте 35–77 лет.
Нами применен следующий инструментальный диагностический алгоритм: ТАУЗИ, фиброгастродуоденоскопия (ФГДС), эндо-УЗИ, эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ), фистулография, компьютерная томография (КТ) — по показаниям.
Несомненным преимуществом ТАУЗИ перед другими методами исследования является отсутствие противопоказаний и возможность использовать его в качестве экспресс-диагностического метода.
Перед ФГДС ставились следующие задачи: оценить проходимость верхнего отдела ЖКТ, выявить специфические изменения слизистой желудка и ДПК, характерные для сопутствующих заболеваний желудка и ДПК, определить доступность и состояние БДС и периампулярной области, оценить технические возможности проведения лечебных эндоскопических мероприятий на БДС.
Эндоскопическое ультразвуковое исследование.
Мы использовали видеоэндоскопический комплекс, EVIS EUS EXERA, «Olympus», Япония, включающий: видеоэндоскопический центр CV-160, осветитель CLV-160, ультразвуковой эндоскопический центр UM-60, радиальный ультразвуковой гастровидеоскоп GF-UM 160.
Подготовка больных к эндо-УЗИ панкреатобилиарной системы не отличается от таковой при обычной эндоскопии.
Проведению эндо-УЗИ обязательно должно предшествовать эндоскопическое или рентгенологическое исследование пищевода или желудка (для исключения стенозов, дивертикулов), поскольку введение эхоэндоскопа производится практически без визуального контроля.
Стандартные позиции проведения эндоскопического ультразвукового исследования различных органов были предложены M. Sivak (1982 г), и W. Strohm и M. Classen (1982) и утверждены Международной конференцией по эндоскопической эхографии (Стокгольм). В последствии методика была дополнена K. Inui et al. (2004).
Большой дуоденальный сосочек — осмотренный в поперечном сечении, представляется как дополнительное округлое (овальное) многослойное образование стенки нисходящего отдела ДПК. При идентификации структур БДС определяются поочередно мышечный слой ДПК (слой сниженной эхогенности), подслизистый слой ДПК (слой повышенной эхогенности), мышечный аппарат сфинктера (тонкий гипоэхогенный слой) и внутренний гиперэхогенный слой, соответствующий слизистому и подслизистому слою ампулы сосочка.
Для исследования БДС в продольном направлении необходимо смещение УЗ-датчика в проксимальном направлении, путем подтягивая эндоскопа. Основными ориентирами являются протоковые структуры; в этом случае ультразвуковая картина меняется индивидуально: соответственно анатомическим взаимоотношениям терминальных отделов желчного и панкреатического протоков, относительно друг друга и стенки ДПК.
Увеличение БДС в размерах более 1 см, выявление в просвете сосочка дополнительных образований, исходящих из его стенок, изменение эхографических характеристик многослойной структуры данного анатомического образования интерпретируется как патологическое изменение БДС.
Ультразвуковая семиотика заболеваний БДС. Эндоскопическими ультразвуковыми диагностическими критериями опухоли БДС являются: нарушение нормальной многослойной эхоструктуры БДС, солидное образование в проекции БДС, сниженная или смешанная эхо-генность образования, нечеткие контуры образования.
Опухоль может иметь экзофитную (в просвет ДПК) и эндофитную или инвертированную (в просвет дистальных отделов протоков) формы роста. На начальных стадиях роста и небольших размерах образования и при отсутствии инфильтративного роста надежных дифференциально-диагностических критериев карциномы и аденомы, не существует.
Эндоскопическими ультразвуковыми диагностическими критериями карциномы сосочка являются: распространение гипоэхогенных тканевых масс на мышечный слой стенки ДПК, в просвет холедоха и ГПП или на стенки протоков, в паренхиму поджелудочной железы, и/или обнаружение рядом с БДС лимфатических узлов подозрительных на их метастатическое поражение (Панцырев Ю. М. и соавт. 2002). Это- важные дифференциально-диагностические признаки, т. к. обнаружение хотя бы одного из них определяет тактику лечения и ставит под сомнение радикальность эндоскопической резекции опухоли. Недооценка указанных фактов приводит к неудовлетворительным результатам эндоскопических методов лечения.
Наиболее важными лимфатическими коллекторами, требующими детальной оценки для точного определения лимфогенного метастазирования опухоли БДС в процессе выполнения эндосонографии, являются лимфоузлы печеночно-двенадцатиперстной связки, задние поджелудочно-двенадцатиперстные лимфоузлы и верхнебрыжеечные лимфоузлы.
Так как опухоли БДС, которые инфильтрировали поджелудочную железу или периампулярную область, невозможно отличить от первичных панкреатических карцином, большинство авторов описывают их как «опухоли БДС» или «периампулярные раки». Так как оба типа в одинаковой степени склонны к метастазированию, нет необходимости в их дооперационной дифференцировке их локализации. Дооперационное определение стадии ампулярной карциномы базируется на основании Международной классификации по факторам TNM принятой европейской организацией «Union International Control Cancer».
Результаты
После комплексного применения диагностических методик у 36 из 421 обследованных пациента был установлен предварительный диагноз опухоли БДС, причем у 34 пациентов была заподозрена злокачественная природа процесса в стадии Т1 — у 7 (20,6 %), Т2 — у 16 (47 %), в стадии Т3 — у 11 (32,4 %) пациентов.
Нами была проанализирована диагностическая ценность инструментальных методов в диагностике опухолей БДС и установлено, что эндо-УЗИ имеет более высокую чувствительность, специфичность и диагностическую эффективность.
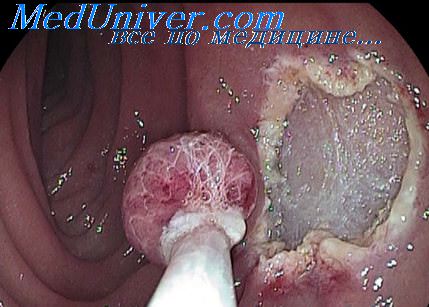
Показания к эндоскопическим методам лечения были выставлены у 7 пациентов. После применения комплекса диагностических методик, по макроскопической картине выявленные неоплазии были разделены на экзофитную и эндофитную (инвертированную) форму опухоли БДС. Размеры выявленных образований колебались в пределах от 8 до 32 мм. Морфологическая характеристика опухолей распределилась следующим образом: высокодифференцированная аденокарцинома, аденома с дисплазией III ст., аденома с дисплазией II ст.
Возможность выполнения эндоскопической эксцизии опухолей БДС (Балалыкин А. С. и соавт. 2008, Катрич А. Н. и соавт., 2008) обосновывалась данными эндо-УЗИ (тип роста образования, наличие измененных лимфатических узлов, состояние мышечного слоя стенки ДПК, терминальных отделов желчного и панкреатического протока). Всем пациентам был применен последовательный комплекс эндохирургических вмешательств, включавший атипичную «послойную» ЭПТ с помощью торцевого папиллотома, дополненная канюляционной ЭПТ у 6 больных, петельную электроэксцизию опухоли, электро — или аргоноплазменную деструкцию, а также вмешательства, направленные на обеспечение адекватного пассажа желчи и панкреатического сока (стент, НБД). Всем пациентам в послеоперационном периоде выполнялось желудочное и дуоденальное зондирование, проводился курс консервативной терапии. Контрольные обследования выполнялись в сроках от 3 до 6 месяцев.
Успех и безопасность эндоскопического вмешательства определяется правильным набрасыванием петли и рациональным сочетанием режимов резания и коагуляции, поэтому в зависимости от формы роста опухоли менялись технические аспекты выполнения данного этапа операции. В случае эндофитной формы роста опухоли после выполнения атипичной «послойной» ЭПТ, с помощью торцевого папиллотома выполнялись «полулунные» окаймляющие разрезы слизистой оболочки в пределах здоровых тканей, в 3 случаях дополненные введением с помощью инъектора, раствора в подслизистый слой, для создания «подушки» под тканью опухоли. С нашей точки зрения эти приемы обеспечивают:
1) адекватное набрасывание эндоскопической петли на опухоль;
2) снижают риск «сползания» петли;
3)резекцию «in block». С целью профилактики кровотечения и повышения абластичности операции выполнялась электро или аргоноплазменная деструкция зоны новообразования БДС. Обеспечение свободного пассажа желчи и панкреатического сока достигалось за счет выполнения билиопанкреатического стентирования.
Осложнениями оперативных вмешательств являлись: интраоперационное кровотечение, остановленное эндоскопически, микроперфорация ДПК, которая была излечена консервативно.
В одном случае, через 3 месяца после выполнения операции, при контрольном эндо-УЗИ, был выявлен продолжающийся рост опухоли. Пациенту была выполнена панкреатодуоденальная резекция.
Выводы
1. Методика эндоскопического ультразвукового исследования является наиболее эффективным методом диагностики заболеваний БДС, стадии злокачественного процесса и позволяет планировать объем и вид лечения больных. 2. Успех, радикальность и безопасность эндоскопической папиллэктомии определяется комплексностью эндоскопических методик и четким соблюдением этапности их выполнения. Включение в лечебный алгоритм стентирования протоков обеспечивает свободный пассаж желчи и панкреатического сока, и позволяет избежать послеоперационных осложнений.
_500.gif)