Иммунный ответ на коронавирус что это значит
Врач объяснил, как расшифровать свои анализы на антитела к COVID-19
С результатами подобных анализов корреспондент “Российской газеты” обратилась к сертифицированному специалисту по физической реабилитации, члену Европейской ассоциации амбулаторной реабилитации Леониду Дьякову.
Антитела: иммунный ответ
Леонид Леонидович, в лаборатории люди получают результаты исследования, естественно, безо всяких комментариев. Их отправляют к врачам. Но к ним сейчас пробиться нелегко, да и не каждый рискует сидеть в очередях. В итоге человек мучительно вглядывается в непонятные обозначения, думает, плохо это или хорошо. Расскажите, что значит: “Антитела обнаружены”.
Тест на антитела может показать, сталкивался ли человек с коронавирусом, даже если симптомов COVID-19 у него не было. Если антитела обнаружены, значит, организм среагировал на встреченный вирус. Они могут сохраняться, даже если самого вируса в организме уже нет. Этот тест говорит только о том, что произошел некий иммунный ответ.
Таким образом, выявление антител в крови является информативным свидетельством текущего или прошлого инфекционного процесса и помогает выявить стадию развития инфекции.
Обнаружение IgM указывает на недавнее инфицирование SARS-CoV-2. Они появляются непосредственно после контакта с носителем вируса, на третий-четвертый день. Через семь-десять дней они уже точно присутствуют в крови.
Потом они “стареют”?
Леонид Дьяков: Общий период вероятного выявления антител класса M не превышает двух месяцев. В течение этого времени IgM антитела постепенно полностью сменяются на IgG. Последние начинают формироваться в среднем на 21-й день.
Если еще есть IgM, и уже появились иммуноглобулины класса G, то это означает позднюю инфекцию. Просто IgM еще не сошли на нет.
Получается, наличие IgM не обязательно говорит об активной инфекции?
Леонид Дьяков: Да. Эти антитела могут выявляться и на стадии выздоровления.
Когда в крови выявляются только IgG, это говорит о том, что пациент выздоровел, и у него сформировался иммунитет к SARS-CoV-2. Если уровень IgG достаточно высок, то можно стать донором иммунокомпетентной плазмы. Например, IgG больше 40, а IgM больше 1,5, либо IgG больше 80, а IgM равно нулю.
То есть, если в крови выявлены обе группы антител, это означает, что человек уже выздоравливает?
Леонид Дьяков: Совершенно верно. Еще раз повторю: иммуноглобулины М говорят о том, что человек в данный момент болеет коронавирусом. Это не обязательно тяжелые формы, состояние может быть и бессимптомным. А иммуноглобулины G говорят о том, перенес ли он коронавирусную инфекцию в прошлом.
Далее, в графе “Дополнительная информация”, вообще непонятная шифровка. А чем непонятнее, тем ведь страшнее. К примеру, вот передо мной результаты, переданные одним пациентом: “ОПсыв 0,0338; КП 1,45”. Что кроется за этим?
От чего зависит количество антител в организме?
Лучше не болеть
Заразен ли человек, чей анализ мы расшифровываем?
Леонид Дьяков: По данному тесту нельзя определить, заразен ли еще человек. В принципе, с такими показателями, которые вы предоставили, пациент не заразен.
Но чтобы достоверно знать это, следует все же сдать еще мазок. Именно он покажет, выделяется ли вирус во внешнюю среду. Если он будет отрицательный, то человек стопроцентно не заразен. Без этой уверенности я бы рекомендовал соблюдение мер социальной дистанции и индивидуальной защиты даже в случае обнаружения только антител класса IgG.
А вы верите в то, что все должны переболеть, и тогда с эпидемией будет покончено?
Леонид Дьяков: В этом, конечно, есть логика. Но проблема в том, что вирус дает достаточно серьезные осложнения. И не все болеют в легкой или бессимптомной форме.
Люди, узнавшие что у них обнаружены антитела, начинают думать, когда же, где подхватили заразу. Вспоминают, когда болели. Может ли данный тест показывать антитела не только на COVID-19, но и на перенесенные другие ОРЗ или ОРВИ?
Леонид Дьяков: Исключено. Это специфичный тест именно на антитела к коронавирусной инфекции.
Человек припомнил, что сильно болел в феврале, ему было очень плохо. Мог тогда быть коронавирус?
Леонид Дьяков: Иммуноглобулин G с тех пор не сохранился бы.
То есть, носители антител могут, в принципе, радоваться, что переболели коронавирусом, практически не заметив этого?
Леонид Дьяков: Те, кто переболел легко или бессимптомно, вырабатывают низкий уровень иммуноглобулина G и могут заболеть повторно.
Чем тяжелее протекает заболевание, тем больше антител произведет иммунная система, и тем дольше они проживут в крови после болезни.
Однако есть информация, что сохраняются так называемые клетки памяти. Организм запоминает, как вырабатывать эти антитела, при каких условиях и в каком количестве. И в случае повторного контакта с вирусом организм начинает синтезировать IgG-антитела значительно быстрее, не за 21 день, а за три. И они способны “смягчать” течение заболевания, препятствовать развитию тяжелых осложнений.
Дышите глубже
Получается, что в принципе сдавать тест на антитела и не совсем нужно. Какая разница, болел человек или нет, если этого особо и не заметил, а никаких таких преимуществ наличие антител не дает. Все так же нужно предохраняться от заражения…
Леонид Дьяков: Мое личное мнение, если человек чувствует себя хорошо, особой надобности в тестировании нет. Ведь с тем же успехом можно поискать у себя вирус герпеса и другие.
Однако тестирование поможет решить проблему в более глобальном масштабе, выработать стратегию борьбы с коронавирусом, поскольку по количеству иммунных людей можно спрогнозировать, когда случится спад эпидемии.
Что делать тем, у кого обнаружены антитела класса IgM?
Леонид Дьяков: Если нет явных признаков заболевания, нужно побольше двигаться, гулять на свежем воздухе, дышать полной грудью, чтобы работали легкие, а кислород циркулировал в крови.
Все материалы сюжета “COVID-19. Мы справимся!” читайте здесь.
Иммунный ответ в контексте коронавируса SARS-CoV-2
Сильный иммунитет, слабый иммунитет, риски тяжёлой формы болезни COVID-19.
Люди по всему миру болеют новой коронавирусной инфекцией. Одни переносят легко, другие тяжело, с угрозой для жизни — какие тут факторы важны и какова роль иммунитета? Есть накапливающаяся статистика: все уже запомнили, что риски тяжёлого течения COVID-19 сильно растут с возрастом пациента, значительно выше для мужчин, чем для женщин, выше для людей с астмой, заболеваниями сердца и почек, для тех, кто принимает сартаны (распространённое лекарство для лечения артериальной гипертензии) и т.д. Но эти разрозненные факты не особо помогают понять патогенез, т.е. как развивается болезнь, и выделить важные факторы выздоровления или наоборот, проявления тяжёлой формы COVID-19.
Есть основания полагать, что большинство смертей от коронавируса связаны с чрезмерной и разрушительной реакцией иммунной системы, а не с прямыми повреждениями, которые организму наносит размножающийся вирус.
Как определить риск такой реакции, и что, собственно, происходит с иммунитетом?
Иммунная реакция на вирус отличается у разных людей уже с первых часов заражения, она зависит и от наследственных факторов, факторов среды (например, загрязнённый городской воздух) и от привычек (например, курения или занятий спортом), влияющих на состояние иммунитета слизистых оболочек дыхательных путей. У кого-то быстро вырабатываются интерфероны — первые сигналы для организма о необходимости противовирусной защиты. В идеальной ситуации сигнал интерферонов I типа приводит к тому, что эпителий сам защищается от репликации вируса, и вдобавок иммунные клетки приходят и уничтожают заражённые клетки, которых на первой стадии немного. Если выработка интерферонов происходит с задержкой, вирус успевает размножиться, и для борьбы с ним требуется больше активирующих сигналов иммунитету, воспаление развивается интенсивнее/стремительнее, что приводит к — бóльшему повреждению ткани (эпителия альвеол лёгких).
У вируса Эболы, например, есть белок VP35, ответственный за подавление выработки интерферона, поэтому Эбола сразу переходит на второй тип динамики вирусного иммунного ответа. Из других респираторных вирусов пандемический штамм гриппа 1918 года тоже отличался нехарактерным для большинства сезонных штаммов гриппа эффективным подавлением продукции интерферонов I типа и параллельно повышал, как считается, уровень воспалительных сигналов (цитокинов) в системном кровотоке, что приводило к тяжёлому устойчивому воспалению ткани лёгких.
Параллельно и чуть позже выработки интерферонов, происходит реакция клеток врождённого иммунитета [1], в первую очередь, нейтрофилов и макрофагов. Цели этой фазы иммунного ответа (будем считать второй фазой после интерферонов): заблокировать синтез вирусных белков, распознать вирус, слепить/связать в удобные для транспортировки комки, доставить в лимфоузлы, а также позвать побольше клеток иммунитета в зону «военных действий» — первую локацию инфекции в организме. После этого в ближайших лимфоузлах при распознавании вирусных белков начинается фаза ответа адаптивного иммунитета, специфичного для конкретного вируса. Цели этой, третьей, фазы:
Реакция адаптивного иммунитета точнее и безопаснее, на этой фазе организм стремится уменьшить мощности врождённого иммунитета и быстро ответить с помощью адаптивных иммунных клеток. Если нашлись специфичные к вирусу Т-клетки и В-клетки (способные узнать белковые фрагменты вируса своими Т- и В-клеточными рецепторами), они получают лицензию на работу и размножение, это значит, что в организме формируется клон клеток — множество одинаковых специфичных к вирусу клеток. Из этого множества одинаковых потомков часть клеток скорее всего выживет и сформирует иммунную память, чтобы повторно человек не заразился.
Самая важная часть противовирусного адаптивного иммунного ответа — это специфичные Т-киллеры (CD8+ Т-клетки), которые уничтожают заражённые клетки респираторного/кишечного эпителия. При этом тоже повреждается ткань альвеол, но иначе мы не можем избавиться от вируса, уютно и спокойно размножающегося внутри наших клеток. Т-клеточный иммунный ответ на новые инфекции сильно ослабляется с возрастом, особенно после 60 лет. Специфичную Т-клетку к совершенно новой инфекции сложно подобрать, скорее всего, у пожилого пациента в организме вообще нет таких подходящих клеток: почти все Т-клетки представляют собой клоны иммунной памяти на старые прошедшие инфекции, а тимус (вилочковая железа) уже не производит новые Т-клетки [2].
Что делать иммунитету, если не хватает подходящих Т-клеток?
Важны ли антитела [3], которые производят В-клетки, начиная со второй недели инфекции?
Очень многие эксперты сейчас говорят и пишут, что как только ваш организм начинает вырабатывать нейтрализующие коронавирус антитела, вы точно выздоровеете, это дело времени. Это не совсем так. Кроме того, что можно не успеть обогнать вирус, сейчас всё больше данных говорит о том, что антитела усиливают повреждение лёгких и ускоряют кровоизлияние в них, от которого человек погибает. Например, здесь показано, что титр (концентрация, уровень в плазме крови) IgG-антител скоррелирован с возрастом, тяжёлыми симптомами и лимфопенией (снижением количества клеток адаптивного иммунитета). Это же показывает и модель, в которой макак заражали предыдущим вирусом SARS (высокий титр эффективных нейтрализующих антител IgG к spike-белку оболочки коронавируса коррелировал с сильным повреждением ткани лёгких). Почему так происходит, что от антител ухудшается течение COVID-19, интуитивно же должно же быть наоборот?
Дело в том, что кроме последовательности
врождённый иммунитет → доставка вируса или его обломков в лимфоузел → подбор, поиск и активация адаптивного иммунитета
Как же тогда сработают терапевтические антитела к коронавирусу?
Возможно, при производстве терапевтических антител подойдёт применяющийся сейчас подход с оптимизацией по максимальной прочности связывания антител с вирусом. При этом может возникнуть необходимость поменять изотип гуманизованных антител, например, с IgG1 на IgG4, т.к. IgG4 будут мешать вирусу проникать в клетку, но не будут активировать макрофаги. Возможно, подход к подбору терапевтических антител придётся поменять и это вообще будет антитело не на spike-гликопротен вируса, а на другой антиген. Относительно лечения пациентов с COVID-19 сывороткой, полученной от переболевших этим заболеванием людей, что-то определённое сказать сложно, т.к. подобный препарат будет содержать смесь антител с разными свойствами и функциями, и прогнозировать результат терапии на современном этапе весьма затруднительно. Об этом проще будет говорить по результатам, которые мы увидим в течение следующих двух-трёх месяцев.
Есть ли у SARS-CoV-2 особенные механизмы подавления иммунитета, неправильной активации иммунитета?
За последние недели я видела довольно много противоречивых данных о лимфопении (снижении количества клеток адаптивного иммунитета) у пациентов COVID-19. Пока непонятно, это все клетки ушли на войну в лёгкие/кишечник и поэтому снижена численность в крови? Или иммунные клетки активно погибают? Вопрос остаётся открытым, но и не все исследования подтверждают этот факт. В некоторых когортах не было разницы по общей численности лимфоидных клеток между пациентами с лёгким и тяжёлым протеканием болезни, то есть лимфопения под вопросом.
Кажется, есть возможность для более сложной регуляции работы В-клеток и выработки антител, но это на данный момент не до конца изучено. В геноме SARS-CoV-2 (у первого SARS такого не было) есть участок, комплементарный продукту гена BLNK, который важен для развития В-лимфоцитов. Теоретически, коронавирус может с помощью этой РНК влиять на дифференцировку новых наивных В-клеток и в селекции активированных В-клеток, пока идёт отбор оптимальных антител, тем самым меняя адаптивный иммунный ответ.
Прививка BCG: проще ли протекает COVID-19 у вакцинированных?
Сейчас есть только нечёткие эпидемиологические данные, и понимание молекулярных механизмов появится нескоро. В целом известно, что БЦЖ снижает частоту тяжёлых осложнений не только в случае туберкулёза, а при различных респираторных инфекциях (особенно если вакцинируют в юном возрасте, по-видимому). Этот положительный эффект обусловлен не специфичным адаптивным иммунитетом, а зависит от феномена «тренированного врождённого иммунитета» и работы иммунных клеток, занимающих промежуточное положение между врождённым и адаптивным иммунитетом. Другими словами, выигрыш, заключающийся в уменьшении частоты осложнений, объясняется через «тренированное» состояние иммунных клеток, живущих в респираторном эпителии. Если преимущество вакцинации БЦЖ подтвердится и для нового коронавируса, то это не будет чем-то удивительным.
P.S. Пруфы по каждому предложению, на чём я основываюсь, и ссылки, где почитать дальше — по запросу, спрашивайте. Про терапию рекомендую читать тут: http://spid.center/ru/articles/2678/. Для вдохновения и мысленных споров использовала https://elemental.medium.com/this-is-how-your-immune-system-reacts-to-coronavirus-cbf5271e530e и свою вирусологическо-иммунологическую ленту твиттера, например, https://twitter.com/VirusesImmunity/status/1243997325804142593.
Что почитать про упомянутые механизмы иммунитета
Материал подготовлен по заказу и при участии канала «Рационально о коронавирусе».
Антитела к коронавирусу. Что важно знать.
Коронавирусная инфекция изменила жизнь почти всей планеты в целом и каждого из нас в частности. Инфекция часто протекает без симптомов или в лёгкой форме. Как узнать, переболел я или нет (ведь кашлял же зимой)? Являюсь ли безопасным для окружающих? Могу без страха навещать бабушку, маму, друзей? Эти и другие вопросы волнуют многих людей. Прошло достаточно времени чтобы появилась возможность ответить на них. Для оценки возможного иммунитета есть скрининговое исследование на антитела к коронавирусу (IgM и IgG).
Коронавирусная инфекция
Что такое антитела к коронавирусу?
Антитела, или иммуноглобулины – специальные белки, которые вырабатывает иммунная система в ответ на попадание любого инфекционного агента, в том числе CoV-2 в организм человека, даже если не было ярких признаков болезни. Антитела распознают коронавирус, обезвреживают и сохраняют информацию об инфекции на случай новой встречи с инфекцией.
Как образуются антитела?
На первой неделе заболевания начинают синтезироваться иммуноглобулины М (IgM). Они первыми встречаются с инфекцией, поэтому считаются маркерами острой первичной инфекции. Однако, тест на определение антител класса М может давать неспецифическую реакцию, что в ряде случаев приводит к ложноположительному результату. Поскольку на антитела класса М возложена ответственность первыми начать отражать инфекцию и сделать максимально быстро, то эти белки не очень специфичны и могут не очень точно улавливать вирус. К неспецифической реакции с тест- системой могут привести процессы, связанные с воспалением в организме: острые и хронические воспалительные процессы, аутоиммунные заболевания, проблемы с щитовидной железой, беременность и так далее. Это называется «ложноположительный» результат.
При стандартном инфекционном заболевании (в том числе и при коронавирусной инфекции) обычно антитела IgM через месяц исчезают, заменяясь на более специфичные антитела IgG. Однако учёные выяснили, что при коронавирусе IgM могут сохраняться длительное время (до 1,5-3 месяцев от появления симптомов, когда уже сам вирус давно не обнаруживается).
Иммуноглобулины А (IgA) также вырабатываются в острый период инфекции. Их основная цель – защитить слизистые оболочки от коронавируса. IgA более избирательны (специфичны), вырабатываются строго на коронавирус. Их уровень снижается после выздоровления, примерно к 1,5- 2 месяцам после инфицирования.
Иммуноглобулины G (IgG) синтезируются последними, через 5-6 недель с момента попадания вируса в организм, и сохраняют информацию о коронавирусе. Обычно IgG являются архивом памяти перенесеных инфекций, в большинстве случаев пожизненно, либо на несколько лет. Механизмы развития иммунной реакции на коронавирус пока изучаются. Неясно, стойкий иммунитет формируется или нет. Это предстоит узнать. Но в любом случае, выявление IgG свидетельствует о факте попадания коронавируса в организм и иммунном ответе организма.
Лаборатория KDL представляет линейку тестов на определение антител к новой коронавирусной инфекции.
Кому они показаны?
Также возможно анонимное выполнение исследование на антитела к коронавирусу с указанием возраста и пола.
Давайте о каждом исследовании по порядку.
Антитела IgM/IgG к вирусу SARS-CoV-2.
Это комплексный тест, скрининговый. Одновременно определяет иммуноглобулины классов М и G, результат по каждому антителу. Выполняется иммунохроматографическим методом (ИХГА). Ответ выдаётся в формате «обнаружено/не обнаружено».
Как понимать результат исследования?
Если Ig M (+) обнаружены, IgG (-)не обнаружены:
Поэтому целесообразно провести исследование мазка из зева методом ПЦР. Если результат ПЦР отрицательный или нет признаков болезни, повторить тест на антитела через 2-3 недели.
Если IgM (+) обнаружены, IgG (+) обнаружены:
Если IgM (-) не обнаружены, IgG (+) обнаружены:
Если IgM (-) не обнаружены, IgG (-) не обнаружены:
Антитела IgA к коронавирусу SARS-CoV-2.
Тест выполняется методом ИФА на анализаторе, производитель Евроиммун, Германия. Результат выдается в виде цифрового значения (коэффициент позитивности = КП).
IgA – показатели ранней инфекции, являются более точными в отличие от IgM, поскольку более специфичны.
Как правильно прочитать результат?
Положительный результат – более 1,1. Говорит об обнаружении IgA и может означать:
Пограничный результат – в интервале 0,8 – 1,1. Требует повторного исследования через 2 недели, поскольку может означать:
Отрицательный результат –менее 0,8. Означает отсутствие антител IgA, что возможно, если:
Антитела IgG к коронавирусу SARS-CoV-2.
Исследование выполняется на анализаторе методом ИФА, производитель Евроиммун, Германия. Результат в виде цифрового значения (коэффициент позитивности = КП).
Расшифровка результатов:
Положительный результат –более 1,1. IgG выявлены, а это может быть в следующих случаях:
Пограничный результат –в интервале 0,8 – 1,1.
Возможно, IgG ещё немного, что требует повторить исследование через 2 недели и возможно, когда:
Отрицательный результат –менее 0,8.
IgG не обнаружены, что может быть, если:
Обнаружение антител IgG к коронавирусу SARS-CoV-2.
Выполняется методом ИФА, методика автоматизированная, тест-системы российского производства. Заключение в виде цифры (коэффициент позитивности)
Выявление антител класса IgG говорит о наличии иммунного ответа на встречу с инфекцией в прошлом и является признаком перенесенного заболевания
Нужна ли специальная подготовка для определения антител к коронавирусу?
Подготовка не нужна. Для исследования сдаётся венозная кровь утром натощак или днём в часы работы медицинских офисов через 3 часа после еды. Чистую воду без газа пить можно.
Обращаю Ваше внимание, что все результаты исследований должен интерпретировать врач! Ведь полноценная картина складывается из данных истории болезни, осмотра, лабораторных и инструментальных данных. Будьте здоровы с лабораторией KDL, берегите себя и близких!
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
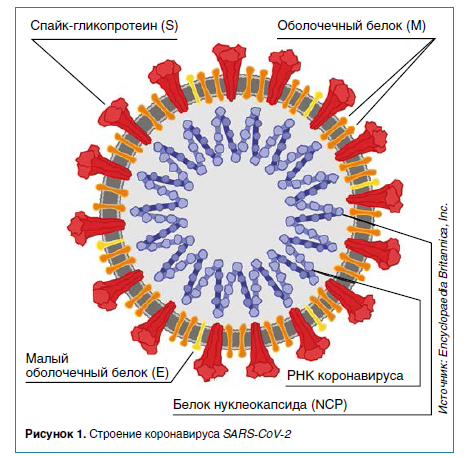
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета “Педиатрия сегодня” №6, 2021





