Индуцибельная резистентность к клиндамицину что
Индуцибельная резистентность к клиндамицину что
Стафилококк признан одним из наиболее распространенных возбудителей различных инфекций человека. Устойчивость к антимикробным препаратам среди стафилококков является растущей проблемой. Это привело к возобновлению интереса к использованию макролидов, линкозамидов и стрептограминов [6, 7]. Макролиды, линкозамиды и стрептограмины были объединены в одну группу (МЛС), это связано с общностью их механизмов действия и резистентности к ним микроорганизмов. Устойчивость к препаратам группы МЛС может быть связана с модификацией мишени действия, их активным выведением и быстрой инактивацией [4].
В последнее время, клиндамицин из-за его активного проникновения в ткани, является одним из наиболее эффективных антибиотиков в лечении инфекций, вызванных Staphylococcus aureus, особенно кожи и мягких тканей и остеомиелита [8].
Тем не менее выявленные чувствительные к клиндамицину стафилококки могут проявить индуцибельную резистентность во время проводимого лечения. На основании проведенных исследований было сделано заключение, что резистентные к эритромицину и чувствительные к клиндамицину стафилококки в ходе антибиотикотерапии могут приобретать резистентность, что и приводит к неэффективности проводимого лечения. Исходя из этого, возникает необходимость определения индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста, для выявления антагонизма между клиндамицином и эритромицином [9, 10].
Цель исследования: выявление частоты встречаемости индуцибельного типа резистентности к клиндамицину среди стафилококков, выделенных у больных хроническим остеомиелитом, леченных в Российском научном центре «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова.
Материалы и методы исследования
Исследование проводилось в 2013–2014 гг. При микробиологическом исследовании содержимого ран, свищей у больных хроническим остеомиелитом взято 308 проб и выявлено 230 штаммов различных видов стафилококков. Идентификация бактерий и их антибиотикочувствительность проводилась как в соответствии с общепринятыми рекомендациями, так и при помощи баканализатора «WalkAway-40 Plus» («Siemens»), с использованием коммерческих микротест-систем [1, 2, 3]. Нами проведено определение индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста у 29 штаммов стафилококков, устойчивых к эритромицину и восприимчивых к клиндамицину [5].
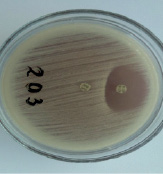
Рис. 1. Д-зона ингибирования вокруг диска с клиндамицином указывает на индуцибельный тип резистентности
Методика постановки D-теста и интерпритация результатов осуществлялась следующим образом: суспензию Staphylococcus spp. мутностью 0,5 McFarland наносили на поверхность Мюллера-Хинтон агара в чашке Петри, затем помещали диски с эритромицином (15 мкг) и клиндамицином (2 мкг) на расстоянии между ними 15 мм. После инкубации при 37°C в течение 18–24 часов уплощение зоны (D-образные) вокруг клиндамицина указывало на индуцибельный тип резистентности к клиндамицину (рис. 1). Если D-тест положительный (D+), то изолят следует считать устойчивым к клиндамицину, если отрицательный (D-), то чувствительным.
Результаты исследования и их обсуждение
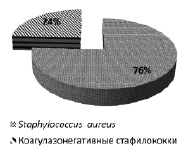
По результатам идентификации установлено, что видовой состав выявленных стафилококков включал: коагулазоположительный вид S. aureus – 174 шамма и ряд коагулазонегативных видов (S. epidermidis, S. hyicus, S. auricularis, S. haemolyticus, S. hominis, S. capitis, S. saprophyticus) – 56 штаммов. Среди выявленных стафилококков S. aureus встречался в три раза чаще (рис. 2).
Рис. 2. Частота выявления Staphylococcus aureus и коагулазонегативных стафилококков из ран и свищей у больных хроническим остеомиелитом
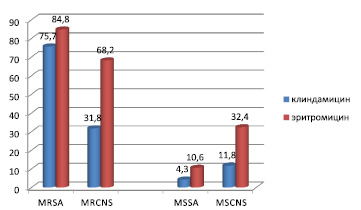
Проведена сравнительная характеристика восприимчивости стафилококков к эритромицину и клиндамицину (рис. 3). Было установлено, что чаще встречаются штаммы, резистентные к эритромицину, причем у метициллинрезистентных коагулазонегативных стафилококков (MRCNS) эта разница составляла 36,4 %.
Среди метициллинрезистентных штаммов устойчивых к клиндамицину и эритромицину лидирующее положение занимает S. aureus, среди метициллинчувствительных – коагулазонегативные стафилококки (CNS).
Рис. 3. Сравнительная характеристика резистентности эритромицина и клиндамицина к стафилококкам. Примечание. MRSA – метициллинрезистентные Staphylococcus aureus, MRCNS – метициллинрезистентные коагулазонегативные стафилококки, MSSA – метициллинчувствительные Staphylococcus aureus, MSCNS – метициллинчувствительные коагулазонегативные стафилококки
Сравнение различных типов восприимчивости стафилококка к клиндамицину и эритромицину
Индуцибельная резистентность к клиндамицину что
Стафилококк признан одним из наиболее распространенных возбудителей различных инфекций человека. Устойчивость к антимикробным препаратам среди стафилококков является растущей проблемой. Это привело к возобновлению интереса к использованию макролидов, линкозамидов и стрептограминов [6, 7]. Макролиды, линкозамиды и стрептограмины были объединены в одну группу (МЛС), это связано с общностью их механизмов действия и резистентности к ним микроорганизмов. Устойчивость к препаратам группы МЛС может быть связана с модификацией мишени действия, их активным выведением и быстрой инактивацией [4].
В последнее время, клиндамицин из-за его активного проникновения в ткани, является одним из наиболее эффективных антибиотиков в лечении инфекций, вызванных Staphylococcus aureus, особенно кожи и мягких тканей и остеомиелита [8].
Тем не менее выявленные чувствительные к клиндамицину стафилококки могут проявить индуцибельную резистентность во время проводимого лечения. На основании проведенных исследований было сделано заключение, что резистентные к эритромицину и чувствительные к клиндамицину стафилококки в ходе антибиотикотерапии могут приобретать резистентность, что и приводит к неэффективности проводимого лечения. Исходя из этого, возникает необходимость определения индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста, для выявления антагонизма между клиндамицином и эритромицином [9, 10].
Цель исследования: выявление частоты встречаемости индуцибельного типа резистентности к клиндамицину среди стафилококков, выделенных у больных хроническим остеомиелитом, леченных в Российском научном центре «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова.
Материалы и методы исследования
Исследование проводилось в 2013–2014 гг. При микробиологическом исследовании содержимого ран, свищей у больных хроническим остеомиелитом взято 308 проб и выявлено 230 штаммов различных видов стафилококков. Идентификация бактерий и их антибиотикочувствительность проводилась как в соответствии с общепринятыми рекомендациями, так и при помощи баканализатора «WalkAway-40 Plus» («Siemens»), с использованием коммерческих микротест-систем [1, 2, 3]. Нами проведено определение индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста у 29 штаммов стафилококков, устойчивых к эритромицину и восприимчивых к клиндамицину [5].
Рис. 1. Д-зона ингибирования вокруг диска с клиндамицином указывает на индуцибельный тип резистентности
Методика постановки D-теста и интерпритация результатов осуществлялась следующим образом: суспензию Staphylococcus spp. мутностью 0,5 McFarland наносили на поверхность Мюллера-Хинтон агара в чашке Петри, затем помещали диски с эритромицином (15 мкг) и клиндамицином (2 мкг) на расстоянии между ними 15 мм. После инкубации при 37°C в течение 18–24 часов уплощение зоны (D-образные) вокруг клиндамицина указывало на индуцибельный тип резистентности к клиндамицину (рис. 1). Если D-тест положительный (D+), то изолят следует считать устойчивым к клиндамицину, если отрицательный (D-), то чувствительным.
Результаты исследования и их обсуждение
По результатам идентификации установлено, что видовой состав выявленных стафилококков включал: коагулазоположительный вид S. aureus – 174 шамма и ряд коагулазонегативных видов (S. epidermidis, S. hyicus, S. auricularis, S. haemolyticus, S. hominis, S. capitis, S. saprophyticus) – 56 штаммов. Среди выявленных стафилококков S. aureus встречался в три раза чаще (рис. 2).
Рис. 2. Частота выявления Staphylococcus aureus и коагулазонегативных стафилококков из ран и свищей у больных хроническим остеомиелитом
Проведена сравнительная характеристика восприимчивости стафилококков к эритромицину и клиндамицину (рис. 3). Было установлено, что чаще встречаются штаммы, резистентные к эритромицину, причем у метициллинрезистентных коагулазонегативных стафилококков (MRCNS) эта разница составляла 36,4 %.
Среди метициллинрезистентных штаммов устойчивых к клиндамицину и эритромицину лидирующее положение занимает S. aureus, среди метициллинчувствительных – коагулазонегативные стафилококки (CNS).
Рис. 3. Сравнительная характеристика резистентности эритромицина и клиндамицина к стафилококкам. Примечание. MRSA – метициллинрезистентные Staphylococcus aureus, MRCNS – метициллинрезистентные коагулазонегативные стафилококки, MSSA – метициллинчувствительные Staphylococcus aureus, MSCNS – метициллинчувствительные коагулазонегативные стафилококки
Сравнение различных типов восприимчивости стафилококка к клиндамицину и эритромицину
Индуцибельная резистентность к клиндамицину что
ГКБ №14 им. В.Г. Короленко
ГКБ № 14 им. В.Г. Короленко, Москва
Проблемы резистентности к антибиотикам микрофлоры кожи лица у больных акне
Журнал: Клиническая дерматология и венерология. 2013;11(2): 33-35
Каратаева Н. Н., Соркина И. Л., Сюч Н. И., Корсунская И. М., Дворянкова Е. В. Проблемы резистентности к антибиотикам микрофлоры кожи лица у больных акне. Клиническая дерматология и венерология. 2013;11(2):33-35.
Karataeva N N, Sorkina I L, Siuch N I, Korsunskaia I M, Dvoriankova E V. Problems of antibiotic resistance of the facial skin microflora in patients with acne. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(2):33-35.
ГКБ №14 им. В.Г. Короленко
ГКБ №14 им. В.Г. Короленко
ГКБ № 14 им. В.Г. Короленко, Москва
Термин «акне» в настоящее время обозначает этиологически гетерогенную группу поражений сальных желез обструктивного и воспалительного характера. Современное представление о патогенезе данного заболевания основано на взаимодействии основных четырех факторов — избыточного образования кожного сала, фолликулярном гиперкератозе сально-волосяных фолликулов, колонизации оппортунистической микрофлорой с последующим развитием воспаления.
Гипертрофия и гиперпродукция сальных желез, возникающая под воздействием нейрогенных и эндокринных факторов, на фоне гиперкератоза устьев сально-волосяных фолликулов создают условия, препятствующие нормальному оттоку кожного сала и приводящие к образованию микрокомедонов с последующей окклюзией сальных желез. Это формирует благоприятные условия для размножения резидентной микрофлоры — Propionibacterium acnes, эпидермальных стафилококков и др.
Патогенетическое значение увеличения роста и размножения разных микроорганизмов при акне заключается не только в непосредственном разрушении тканей и запуске каскада иммунных реакций, результатом которого является развитие воспаления, но и в их липолитической активности. Липаза бактерий высвобождает в сальной железе свободные жирные кислоты, обладающие токсическим действием и приводящие к спонгиозу и последующей перфорации стенок сальных желез и их выводных протоков. Данный эффект также усиливают синтезируемые микроорганизмами протеолитические ферменты [1].
Развитию выраженной воспалительной реакции при акне способствует как наличие патогенных микроорганизмов, так и попадание в окружающие ткани детрита сальных желез, отторгшихся клеток рогового слоя, свободных жирных кислот, образовавшихся в процессе жизнедеятельности микроорганизмов и высвободившихся в результате разрывов стенок сальных желез. При этом наиболее реактогенными считают свободные жирные кислоты [1].
В патогенезе акне, особенно сопровождающихся появлением большого количества воспалительных элементов, особое значение принадлежит Propionibacterium acnes. Данные микроорганизмы являются липофильными анаэробами и колонизируют в глубине фолликулярного канала. Основа их патогенного воздействия заключается в образовании жирных кислот, обладающих выраженным провоспалительным действием. Другие представители патогенной флоры располагаются более поверхностно — преимущественно в верхних отделах выводных протоков сальных желез и, несмотря на наличие у них липолитической активности, не являются непосредственными этиологическими агентами, приводящими к развитию акне, но поддерживают и усиливают воспаление в коже [2].
В настоящее время существует большое количество лекарственных препаратов, а также средств немедикаментозного воздействия для терапии акне. При лечении данного дерматоза применяют лекарственные средства, как для местного применения, так и для системного воздействия.
При местной терапии акне наиболее часто используют топические препараты ретиноидов и их аналогов, бензоила пероксид, азелаиновую кислоту и антибиотики.
Антибиотики давно применяются для местной терапии акне, при этом наиболее часто используются препараты на основе эритромицина и клиндамицина. Их эффективность при лечении акне связана прежде всего с антибактериальной активностью в отношении Propionibacterium acnes, и, в меньшей степени, Staphylococcus epidermidis.
Клиндамицин — антибиотик группы линкозамидов начал применяться для лечения инфекционных заболеваний, вызванных S. aureus, более 30 лет назад [3]. Препарат обладает широким спектром действия. Бактериостатический эффект клиндамицина осуществляется за счет связывания с 50S-субъединицей рибосомальной мембраны и подавления синтеза белка в микробной клетке.
В последнее время в научном мире все больше внимания уделяется проблеме развития резистентности, в том числе перекрестной, к разным группам антибиотиков, в том числе и при лечении акне. Первые указания на отсутствие чувствительность флоры к антибиотикам у больных данным дерматозом были получены еще в 60-70-е годы XX века. Наиболее часто в этой связи в научной литературе упоминаются эритромицин и клиндамицин. Однако результаты современных исследований демонстрируют достаточно высокий уровень (более 66%) чувствительности флоры у больных акне к разным группам антибиотиков, в том числе клиндамицину [4].
Предполагают, что развитие бактериальной устойчивости не только к топическим формам эритромицина, но и клиндамицина у пациентов с акне связано с предшествующим частым и длительным (более 6—8 нед) приемом эритромицина внутрь, в связи с чем перед выбором препарата для местной терапии необходим тщательный сбор анамнеза для выяснения данных о возможной предшествующей терапии системными антибиотиками.
Для изучения возможности эффективного применения антибиотиков у пациентов с акне на базе ГКБ №14 им. В.Г. Короленко нами было проведено собственное исследование, направленное на изучение чувствительности к антибиотикам микроорганизмов, полученных при посеве у больных акне.
Под нашим наблюдением находились 40 больных (18 мужчин, 22 женщины) 18—35 лет с папуло-пустулезными акне средней степени тяжести с преимущественной локализацией на коже лица.
Для определения чувствительности флоры к лекарственным препаратам было проведено культуральное исследование. Для этого пустулу, локализованную на коже лица, вскрывали стерильным скарификатором, содержимое пустулы забирали стерильным тампоном на пластиковой палочке и помещали в транспортную систему со средой Амиеса, содержащей активированный уголь. Образец доставляли в лабораторию в течение 48 ч.
Для проведения исследований на анаэробную инфекцию образец материала помещали в анаэробную транспортную среду без кислорода (BD Port-A-Cul) и использовали в течение 2—3 ч или замораживали.
Для выделения и идентификации микроорганизмов образец асептично извлекали из пробирки, и производили посевы на кровяном агаре, среде Сабуро и среде для выращивания анаэробов. Через 24 ч проводили микроскопию окрашенных по Граму препаратов, приготовленных из выращенных культур. При необходимости выделяли чистую культуру. Из чистой культуры через 24 ч культивирования готовили взвесь микроорганизмов, которую в соответствии с результатами микроскопии заливали в аппарат Crystal для идентификации грамположительных, грамотрицательных и анаэробных микроорганизмов. Результат учитывали в помощью автоматизированного бактериологического анализатора BD BBL «Crystal» Autoreader.
Чувствительность к антибактериальным препаратам определяли диско-диффузионным методом.
Результаты культурального исследования свидетельствовали о том, что в исследуемых образцах преобладали St. saprophyticus, St. epidermidis, St. aureus, Pantoea agglomerans, Enterococcus facealis и Proteus inconstans. При этом Malassezia furfur и Propionibacterium acnes высеяны не были, что, на наш взгляд, объясняется проведением длительной (более 12 мес) предшествующей антибактериальной терапии как системной, так и топической.
По результатам анализа чувствительности выделенных культур к основным, наиболее часто назначаемым антибиотикам низкая чувствительность отмечалась к линкомицину, эритромицину и доксициклину, довольно высокая — к клиндамицину и гентамицину (см. таблицу). 
Таким образом, ранее опубликованные данные, а также результаты наших собственных исследований свидетельствуют о необходимости проведения культурального исследования с определением антибиотикочувствительности микрофлоры кожи больных акне для последующего назначения эффективной терапии. Необходимо учитывать также лекарственную форму топических антибиотиков, которая в основном представлена кремом или гелем, тогда как при терапии акне предпочтителен раствор.
В настоящее время на Российском рынке появился новый топический препарат клиндамицина Зеркалин («Ядран», Хорватия) в форме 1% раствора.
Препарат наносят 2 раза в сутки на предварительно очищенную и высушенную кожу. Средний курс лечения составляет 6—8 нед. При необходимости более длительного (до 6 мес) применения Зеркалин целесообразно сочетать с бензоилом пероксида (Зеркалин наносят утром, а бензоила пероксид — вечером).
Появление клиндамицина в форме раствора позволяет расширить возможности подбора лечения пациентам с акне.
Клиндамицин
, PharmD, University of Washington School of Pharmacy
Фармакокинетика
Клиндамицин хорошо абсорбируется перорально и может назначаться парентерально. Клиндамицин хорошо распространяется в жидкостях тела, за исключением спинномозговойжидкости; он концентрируется в фагоцитах. Большая часть препарата метаболизируется; метаболиты выводятся с желчью и мочой.
Показания к назначению клиндамицина
Аэробные грамотрицательные бациллы и энтерококки являются резистентными.
Клиндамицин обычно используется при анаэробных инфекциях; однако в некоторых регионах среди этих микроорганизмов появилась устойчивость к клиндамицину. Поскольку эти инфекции часто обусловлены и аэробными грамотрицательными бациллами, дополнительные антибиотики также используются. Клиндамицин является частью комбинированной терапии в следующих случаях:
С пеницилином при инфекциях, вызванных токсигенными стрептококками (потому что клиндамицин уменьшает продуцирование токсина бактерий)
С пириметамином при церебральном токсоплазмозе Токсоплазмоз ЦНС Токсоплазмоз – инфекция, вызываемая Toxoplasma gondii. Симптомы варьируются от их отсутствия или доброкачественного увеличения лимфатических узлов (болезнь, подобная мононуклеозу) до опасного. Прочитайте дополнительные сведения
С хинином при бабезиозе Бабезиоз Бабезиоз – инфекция, вызываемая простейшими вида Babesia. Инфекции могут быть бессимптомными или вызвать клинические проявления, похожие на малярию с лихорадкой и гемолитической анемией. Болезнь. Прочитайте дополнительные сведения 
Клиндамицин может использоваться при инфекциях (например, инфекции кожи и мягких тканей) в тех сообществах, где распространен внебольничный метициллин-резистентный Staphylococcus aureus (СА-MRSA); полезен ли клиндамицин, зависит от локальных паттернов резистентности.
Клиндамицин может использоваться при инфекциях, обусловленных клиндамицин- и эритромицин-восприимчивыми штаммами. Однако некоторые штаммы СА-MRSA восприимчивы к клиндамицину и резистентны к эритромицину; резистентность эритромицина в этих штаммах может быть обусловлена активным механизмом его выведения из клетки или модификацией мишени. Если инфицирующий штамм восприимчивого к клиндамицину СА-MRSA резистентен к эритромицину из-за механизма выведения, то можно ожидать, что пациенты ответят на клиндамицин. Однако, если штамм резистентен к эритромицину из-за модификации мишени, пациенты могут клинически не ответить на клиндамицин, потому что определенные мутанты могут появиться во время терапии клиндамицином; эти мутанты резистентны к клиндамицину и эритромицину из-за конститутивной модификации мишени. (Конститутивный означает, что резистентность проявляется всегда, независимо от того, присутствует ли индуктор, такой как эритромицин).
Резистентность эритромицина из-за выведения можно отличать от той резистентности, которая обусловлена индуцированной модификацией мишени при помощи обычно используемого анализа двойной дисковой диффузии (D анализ). Диск клиндамицина помещают на стандартном расстоянии от диска эритромицина на агаровой поверхности, засеянной культурой исследуемого штамма СА-MRSA. Зона подавления роста (в форме буквы «D») вокруг диска клиндамицина, со сглаженной зоной близко к диску эритромицина, указывает на индуцированную рибосомную резистентность. Пациентам с умеренно-тяжелой инфекцией с индуцированным рибосомно-резистентным СА-MRSA штаммом и положительным D-анализом нельзя назначать клиндамицин.
Клиндамицин не может использоваться при инфекциях центральной нервной системы (кроме церебрального токсоплазмоза), из-за плохого проникновения в головной мозг и спинномозговую жидкость.
Противопоказания к назначению клиндамицина
Клиндамицин противопоказан пациентам с аллергической реакцией на него, его следует применять с осторожностью у пациентов, имеющих в анамнезе болезнь Крона, язвенный колит или ассоциированный с антибиотиком энтероколит.
Назначение во время беременности и кормления грудью
Исследования репродукции животных во время применения клиндамицина не подтвердили наличие риска для плода. В клинических испытаниях с участием беременных женщин назначение им клиндамицина во 2-м и 3-м триместрах беременности не показало повышения частоты появления врожденных дефектов плода. По медицинским показаниям клиндамицин может применяться во время беременности.
Клиндамицин проникает в грудное молоко. Использование во время кормления грудью не рекомендуется.
Побочные эффекты клиндамицина
Основным побочным эффектом клиндамицина является
РЕЗИСТЕНТНОСТЬ МИКРООРГАНИЗМОВ И АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
S.V.Sidorenko — Department of Microbiology and Clinical Chemotherapy, Russian Medical Academy of Postgraduate Training, Moscow
S.V.Sidorenko — Department of Microbiology and Clinical Chemotherapy, Russian Medical Academy of Postgraduate Training, Moscow
| Ферменты | Устойчивость к антибиотикам |
| Грам (+) микроорганизмы | |
| APH (3′)-III | Кан, Нео, Амк, Изп |
| ANT (4′)-I | Тоб, Амк, Изе |
| ANT (6)-I | Стр |
| ААС (6′)-APH (2”) | Ген, Тоб, Нтл, Амк, Изп |
| Грам (-) микроорганизмы | |
| ANT(2″) | Кан, Ген, Тоб |
| ААС (2′) | Ген, Тоб, Сиз, Нтл |
| AAC(3)-V | Ген, Тоб, Нтл |
| AAC(3)-I | Ген, Сиз |
| AAC(6′)-I | Тоб, Нтл, Амк, Сиз |
| APH(3′)-I | Кан, Нео, Мон |
| APH (3′)-II | Кан, Нео, Мон, Ген |
| APH (3′)-VI | Кан, Амк, Изп |
| Примечание: Кан – канамицин, Нео – неомицин, Мон – мономицин, Стр – стрептомицин, Ген – гентамицин, Тоб – тобрамицин, Нтл – нетилмицин, Сиз – сизомицин, Амк – амикацин, Изп – изепамицин. | |
Мировое научное сообщество осознало бесперспективность пассивного отношения к процессам возникновения и распространения резистентности, поскольку оно неизбежно приводит к проигрышу человека в борьбе с микроорганизмами на популяционном уровне. Подобно тому как в подавляющем большинстве областей внутренней медицины приоритет отдается выявлению и коррекции ранних стадий патологических процессов у отдельных пациентов, так и в отношении всей популяции человека необходимо выявлять ранние стадии распространения резистентных микроорганизмов и предпринимать адекватные меры. При этом речь идет не столько о пропаганде и быстрейшем внедрении в практику новых АБП, к чему непроизвольно подталкивает фармацевтическая индустрия, сколько о раннем выявлении неблагоприятных тенденций и разработке мер, направленных на “продление жизни” известных препаратов. Работы в этом направлении находятся в центре внимания ряда международных и национальных организаций (Всемирной Организации Здравоохранения, Международного и Европейского обществ химиотерапии, Альянса за разумное использование антибиотиков и др.), однако в Российской Федерации уровень осознания проблем антибиотикорезистентности все еще можно относить к рудиментарному.
Вполне естественно, что для профессионалов в большинстве областей медицины сегодня уже недостаточно банального общего представления о возможности формирования у микроорганизмов устойчивости к АБП. Необходимо владение информацией о тех микроорганизмах и АБП, для которых наиболее характерно формирование устойчивости, а также об основных закономерностях и механизмах этого процесса.
Понятие и механизмы резистентности к АБП
Основным отличием, хотя и не принципиальным, АБП от антисептиков является наличие механизма действия, направленного на угнетение более или менее специфичного для микроорганизмов (прокариот) метаболического процесса. Угнетение происходит в результате связывания АБП с некой мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма. Благодаря этому АБП подавляют жизнедеятельность микроорганизмов в концентрациях, не наносящих вреда эукариотическим клеткам организма хозяина.
Таблица 2. Возможные варианты перекрестной резистентности между хинолонами
| Налидиксовая кислота | Норфлоксацин | Пефлоксацин | Ципрофлоксацин Офлоксацин Ломефлоксацин | Спарфлоксацин Тровафлоксацин Грепафлоксацин |
| Примечание: S – чувствительность, R – резистентность. | ||||
Механизмы устойчивости к отдельным группам АБП
Ограниченный объем публикации позволяет остановиться только на механизмах устойчивости к клинически наиболее важным АБП.
Устойчивость к b- лактамным антибиотикам опосредуют в основном два механизма. Первым является модификация чувствительной мишени – появление пенициллинсвязывающих белков (ПСБ), обладающих пониженной аффинностью к b- лактамным антибиотикам. Второй – гидролиз антибиотиков, опосредуемый ферментами b- лактамазами. Более детально механизмы резистентности к b- лактамным антибиотикам и их клиническое значение рассмотрены в статье, ранее опубликованной в Русском медицинском журнале [1].
Механизмы устойчивости к аминогликозидным антибиотикам
Механизмы устойчивости к нефторированным и фторированным хинолонам
Механизмы устойчивости к макролидным, линкозамидным и стрептограминовым антибиотикам (МЛС группа)