Ингибитор что это значит
ИНГИБИТОРЫ
ИНГИБИТОРЫ (лат. inhibere останавливать, удерживать) — вещества разнообразной химической природы, тормозящие или полностью угнетающие скорость химических, физико-химических и биологических процессов; находят применение в медицине в качестве лекарственных средств, активность некоторых ингибиторов в сыворотке крови является дополнительным диагностическим тестом при ряде заболеваний; в народном хозяйстве используются в борьбе с сельскохозяйственными вредителями; многие ингибиторы являются отравляющими веществами.
И. хим. процессов тормозят реакции окисления смазочных масел, коррозии металлов, окисления различных видов топлива, останавливают или полностью предотвращают процесс полимеризации т. п. И. биофиз, процессов являются разнообразные хим. соединения, которые резко снижают скорость цепных реакций, т. к. при столкновении с образующимся в такой реакции свободным радикалом И. в свою очередь образуют малоактивные радикалы, не способствующие развитию цепного процесса. И. роста растений являются вещества, тормозящие или полностью угнетающие прорастание семян, рост стебля, распускание почек и т. п.
В биохим, литературе термином «ингибитор» чаще всего называется вещество, полностью или частично угнетающее ферментативный процесс. Иногда эти вещества называют еще ферментными или протоплазматическими ядами, к к-рым относятся, напр., цианиды, окись углерода, соли тяжелых металлов и т. п. Ферментативные процессы лежат в основе жизнедеятельности микро- и макроорганизмов, поэтому разнообразные вещества, подавляющие определенные физиол, функции или биол, процессы, относят также к разряду И. Таковы, напр., И. роста некоторых микроорганизмов (ряд аминокислот и их производных), И. репродукции вирусов (аминоптерины, тиоурацил и др.), И. митотического деления клеток (бета-галоидалкиламины), И. свертывания крови (антикоагулянты), отравляющие вещества и пр.
Случаи, когда И. ферментативного процесса избирательно угнетает только един фермент, очень редки. Чаще всего И. действуют на определенные центры фермента, а в них — на конкретные функциональные группы — SH-группы (так наз. сульфгидрильных яды), NH2-группы и др. К избирательным сульфгидрильным ядам относятся n-хлормеркурибензоат, йодацетамид, N-этилмалеимид, йодозобензоат, арсенит, феррицианид.
И. специфически связываются с активаторным, коферментным или субстратным центрами на молекуле фермента, лишая фермент возможности проявить свою активность. Ряд И. специфически связывается с имидазольной группой или остатком серина в активном центре фермента (напр., диизопропилфторфосфат). Ингибирующее действие на фермент могут оказать вещества, неспецифически адсорбирующиеся на поверхности ферментного белка, денатурирующие его или гидролитически его расщепляющие. Некоторые И., обладающие способностью образовывать внутрикомплексные (хелатные) соединения, извлекают из молекулы холофермента (собственно фермента — апофермента, связанного с коферментом) ион металла, без к-рого фермент не может проявить свою активность. К таким И. относятся ЭДТА (этилендиаминтетраацетат) и др.
И. фосфорилазы (КФ 2.4.1.1.) являются ацетилхолин, карбахол, действие которых в свою очередь ингибируется атропином.
Гексокиназа (см.) ингибируется адреналином и, возможно, глюкокортикоидами.
Монойодацетат, ингибируя глицеральдегидфосфатдегидрогеназу (КФ 1.2.1.9; 1.2.1.12 и 1.2.1.13) угнетает гликолиз на стадии реакции оксидоредукции (см. Гликолиз), а фтористый натрий, И. фосфопируват-гидратазы (КФ 4.2.1.11), ингибирует гликолиз уже после стадии фосфорилирования.
Фермент цикла Трикарбоновых к-т (см. Трикарбоновых кислот цикл)— сукцинатдегидрогеназа (КФ 1.3.99.1) ингибируется малонатом, а вступление ацетил-КоА в цикл блокируется фторацетатом.
Цитохромы (см.) ингибируются цианидом; антимицин А и амитал являются И., блокирующими дыхательную цепь: первый — между цитохромами b и c1 второй — между НАД-H2 и флавопротеидами. Динитрофенол разобщает окисление и фосфорилирование, ингибируя последнее.
Ферменты пентозного цикла ингибируются солями тяжелых металлов, которые, так же как и уабаин, являются И. и АТФ-азы (КФ 3.6.1.3. и 3.6.1.8).
В организме человека и животных имеются И. эндогенного происхождения, действие которых противоположно действию многочисленных активаторов, т. е. носит регуляторный характер. К таким регуляторам относится ацетилхолин (см.), регулирующий активность холинацетилтрансферазы (КФ 2. 3. 1. 6), фермента, участвующего в синтезе ацетилхолина, обеспечивающего ритмические сокращения сердца. При раздражении блуждающего нерва освобождается экстраацетилхолин, который ингибирует холинацетилтрансферазу по типу обратной связи, т. е. фермент ингибируется продуктом реакции. Феномен остановки сердца при раздражении и. vagus объясняется, т. о., действием И. Благодаря И. трипсина и пепсина железистые клетки желудка защищены от действия вырабатываемых ими протеолитических ферментов.
Все шире И. различных ферментов используются в качестве лекарственных средств.
При лечении острых панкреатитов применяют ингибитор трипсина и химотрипсина — трасилол (см.). Ингибиторы КоА альфа-фенилмасляная к-та и ее амид (гипостерол, артосклерол) обладают способностью снижать содержание холестерина в крови человека. При травматическом шоке, острой кровопотере, хирургических вмешательствах на сердце, легких, матке, предстательной железе и других органах происходит активирование фибринолитической системы. Одной из главных причин этого явления может быть выброс при повреждении клеток тканевого активатора плазминогена. Лечение фибринолиза успешно лишь в том случае, когда используется специфическая терапия, направленная на блокаду образования плазмина и ингибирование существующего плазмина. К таким препаратам относятся синтетические И. фибринолиза ε-аминокапроновая к-та (АКК), n-аминометилбензойная к-та (ПАМБК) и транс-4-аминометилциклогексанкарбоновая к-та (АМЦГКК). Кроме этих соединений, для ингибирования фибринолиза используют трасилол и контрикал (полипептид, получаемый из легких крупного рогатого скота), который также применяется как лекарственное средство для лечения острого панкреатита.
И. биохим, процессов, происходящих в микробной клетке, являются антибиотики; И. моноаминоксидазы (см.) используются в клинике в качестве антидепрессантов, И. карбоангидразы (см.) обладают мочегонным действием.
В сыворотке крови человека в сравнительно большом количестве присутствуют И. трипсина, связывающие этот фермент при повышенном поступлении его в кровь. Нормальные значения активности общего И. в сыворотке крови человека составляют от 300 до 600 миллиединиц (активность И. выражают в миллиединицах ингибируемого трипсина). При различных воспалительных процессах активность И. трипсина в сыворотке крови возрастает до 1500—2000 миллиединиц; при тяжелых формах хрон, панкреатита она может снижаться до 100—150 миллиединиц.
И. широко пользуются в экспериментальных исследованиях в области биохимии, физиологии, фармакологии, цитологии, генетики и др.
В практике находят широкое применение И. холинэстераз (см.), которые используются в народном хозяйстве в качестве гербицидов, фунгицидов, пестицидов и т. п. И. холинэстеразы являются четвертичные аммониевые соединения, сложные эфиры карбаминовой к-ты — карбаматы (см. Карбаминовые соединения) и фосфорорганические соединения (см.). Реактиваторы холинэстераз нашли практическое применение в качестве антидотов при отравлении фосфорорганическими соединениями животных и человека (см. Антидоты ОВ).
Библиография: Ашмарин И. П. и Ключapeв Л. А. Ингибиторы синтеза белка, Л., 1975, библиогр.; Биофизика, под ред. Б. Н. Тарусова и О. Р. Колье, М., 1968, библиогр.; Волькенштейн М. В. Молекулярная биофизика, с. 365 и др., М., 1975, библиогр.
Что такое ингибиторы

К группе ингибиторов относятся вещества, которые замедляют или полностью блокируют химические (в особенности, ферментативные) и физиологические процессы. Название происходит от латинского слова inhibere, что в переводе означает “захватывать”. Одна из групп – ингибиторы АПФ – используются для лечения патологий сердечно-сосудистой системы.
В числе известных АПФ ингибиторов можно выделить препарат Эналаприл, применяемый при сердечной недостаточности, эссенциальной и реноваскулярной гипертензии, а также для профилактики развития патологий.
Принцип действия
Ингибиторы действуют в цепных и каталитических реакциях с участием активных частиц. Вещества вступают в реакцию с частицами, затормаживая или предотвращая их реакцию, в результате чего образуются малоактивные радикалы. Для достижения эффекта ингибиторов требуется значительно меньше, чем реагентов.
Ингибиторы АПФ
Ангиотензинпревращающий фермент является одним из ключевых элементов системы регуляции давления. Под их воздействием неактивный гормон ангиотензин I превращается в ангиотензин II, который обладает сосудосуживающим эффектом. При использовании ингибиторов АПФ его действие подавляется, благодаря чему препараты группы способны понижать давление и эффективны в лечении гипертензии.
Кроме того, за счет выброса окиси азота и простагландина I2 препараты данной группы тормозят распад вазодилататора (вещества, сильно расширяющего сосуды) брадикинина.
Для лечения сердечной недостаточности ингибиторы обычно назначаются в дозах, не снижающих АД.
Препараты также назначают для лечения почечной недостаточности.
Польза препаратов ингибиторов
Классификация и формы
Ингибиторы АПФ выпускаются в двух видах:
Наиболее безопасными для длительного применения считаются ингибиторы АПФ, которые выводятся из организма через печень. Препараты гидрофильной группы не метаболизируются в организме и выводятся в первоначальном виде, липофильные ингибиторы подвергаются частичной метаболизации, образуют органические вещества, часть из которых биологически активна.
По продолжительности действия ингибиторы бывают:
Эналаприл
Применение
Широкое распространение ингибиторы АПФ получили в кардиологии. Препараты группы применяются для лечения:
В профилактических целях ингибиторы назначаются пациентам, перенесшим инфаркт миокарда.
Ингибиторы АПФ назначаются всем пациентам с хронической сердечной недостаточностью, независимо от стадии и этиологии заболевания. Первоначально врачи прописывают минимальные дозы препаратов, постепенно увеличивая их до целевых.
При гипертонии (артериальной гипертензии) ингибиторы используются в качестве самостоятельного терапевтического средства и в сочетании с другими препаратами.
По статистике, при лечении ингибиторами АПФ сахарный диабет развивается реже, чем при терапии диуретическими препаратами и β-блокаторами.
В неврологии препараты группы используются для первичной и вторичной профилактики инсульта головного мозга. Показанием для назначения ингибиторов также является транзиторная ишемическая атака и перенесенный инсульт. При этом пол, возраст пациента и исходные показатели артериального давления значения не имеют. Лечение ингибиторами АПФ приводит к снижению риска повторного приступа, общего риска осложнений на сердечно-сосудистую систему.
Препараты группы эффективны для лечения эндокринологических заболеваний: диабетической нефропатии, сахарного диабета. Ингибиторы показаны пациентам с ожирением и резистентностью к инсулину, поскольку они повышают чувствительность к данному гормону. Кроме того, препараты замедляют развитие почечной недостаточности на фоне диабета I и II типа, снижают частоту осложнений на сердечно-сосудистую систему.
Противопоказания для лечения ингибиторами
Несмотря на общее положительное действие на организм, у ингибиторов есть ряд противопоказаний, при которых лечение этой группой препаратов недопустимо. Это:
Также препараты не подходят для беременных и кормящих женщин.
Прием ингибиторов должен осуществляться строго по назначению лечащего специалиста. Бесконтрольное применение препаратов и самолечение приводят к осложнениям и развитию опасных для жизни патологий.
Ингибитор
Полезное
Смотреть что такое “Ингибитор” в других словарях:
Ингибитор — (лат. inhibere задерживать) вещество, замедляющее или предотвращающее течение какой либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др. Описание Например,… … Википедия
ингибитор — дифениламин, этаноламин, парализатор, мажеф, замедлитель Словарь русских синонимов. ингибитор сущ., кол во синонимов: 9 • аутоингибитор (1) • … Словарь синонимов
ингибитор — а, м. inhibiteur m. спец. Вещество, замедляющее протекание химических реакций или прекращающее их. Применять ингибитор. БАС 1. Замедлитель. Пищепром. Лекс. БСЭ 2: ингиби/тор … Исторический словарь галлицизмов русского языка
ингибитор — Вещество, замедляющее протекание химических реакций или прекращение их, а также вещество, тормозящее биологические процессы. [ГОСТ 21507 81] ингибитор Вещество, которое замедляет, воспрещает или изменяет некоторые химические реакции, например… … Справочник технического переводчика
ИНГИБИТОР — ИНГИБИТОР, вещество, которое останавливает или значительно замедляет скорость ХИМИЧЕСКОЙ РЕАКЦИИ. Действуют так же направленно, как и катализаторы, и их широко применяют для предотвращения коррозии, ОКИСЛЕНИЯ или ПОЛИМЕРИЗАЦИИ … Научно-технический энциклопедический словарь
ингибитор — ИНГИБИТОР, а, м. Тупой, медленно соображающий человек … Словарь русского арго
Ингибитор — вещество, присутствие которого в небольших количествах в среде приводит к предотвращению или замедлению некоторых нежелательных процессов (напр., горения, коррозии). Снижает скорость химических реакций или подавляет их. См. также Ингибирование… … Российская энциклопедия по охране труда
ИНГИБИТОР — вещество, замедляющее млн. предотвращающее течение различных хим. реакций в отрицательном (см.). Различают И. окисления, полимеризации, (см.) и др. Напр. соединения технеция И. коррозии сталей. Относительная масса И., добавляемых в реакционную… … Большая политехническая энциклопедия
Ингибитор — 4.10. Ингибитор D. Trocknungsverzögerer; Verzögerer E. Retarder F. Retardateur Источник: ГОСТ 28451 90: Краски и лаки. Перечень эквивалентных терминов оригинал документа 6.3.2 ингибитор: Вещес … Словарь-справочник терминов нормативно-технической документации
ингибитор — (лат. inhibere сдерживать, останавливать) 1) вещество, замедляющее хим. реакции или прекращающее их; примен. для замедления или предотвращения нек рых процессов, напр, коррозии металлов, окисления топлив (см. катализатор); 2) биол. природное или… … Словарь иностранных слов русского языка
Артериальная гипертензия: обзор препаратов
Тонкости консультирования клиентов аптеки с рецептами на ингибиторы АПФ и сартаны
Артериальная гипертензия — самая распространенная сердечно-сосудистая патология, которой страдает около 40 % взрослого населения Европы [1]. Разумеется, это приводит и высокому спросу на антигипертензивные препараты независимо от сезона. И хотя в задачу первостольника прежде всего входит предложить несколько вариантов ЛС согласно выписанному в рецепте МНН, ему также предстоит разъяснять побочные эффекты, дозировку, а иногда и отвечать на вопросы об особенностях механизма действия. Поэтому мы решили предложить нашим читателям цикл статей о группе антигипертензивных препаратов и особенностях работы с запросами на них. Начнем с блокаторов ренин-ангиотензин-альдостероновой системы.
РААС: основа основ
Прежде чем приступить к описанию препаратов, ненадолго погрузимся в тонкости фармакологии и еще раз вспомним, каков механизм действия ренин-ангиотензин-альдостероновой системы, или РААС.
РААС — сложная гормонально-ферментативная система, в которую вовлечены практически все органы и ткани организма, но ключевые роли в ней принадлежат печени, почкам, надпочечникам и легким.
В печени постоянно синтезируется альфа-2‑глобулин ангиотензиноген. В то же время в почках вырабатывается фермент ренин в ответ на снижение внутрипочечного давления, снижение доставки натрия и хлора, а также на гипоксию. Он поступает, так же как и ангиотензиноген, в системный кровоток, где и связывается с ним с образованием ангиотензина I.
Ангиотензин I — вещество практически инертное. Он не действует на сосуды и является лишь предшественником активного компонента ангиотензина II. В образовании последнего наряду с ангиотензином I участвует ангиотензинпревращающий фермент (АПФ), который вырабатывается в легких.
Ангиотензин II — главное звено схемы РААС. Он проявляет мощный сосудосуживающий эффект и воздействует на органы-мишени, в которых расположены рецепторы к нему. Прежде всего речь идёт об эндотелии, сердце и почках. Вот почему высокий уровень ангиотензина II связан не только с повышением давления, но и с поражением сосудистой стенки, миокарда, почек и с развитием хронической сердечной и почечной недостаточности.
Кроме того, ангиотензин II вызывает усиление синтеза гормона надпочечников альдостерона. Последний участвует в контроле артериального давления (АД), регулируя гомеостаз калия, натрия и объема внутриклеточной жидкости. Под его влиянием повышается давление, увеличивается чувствительность гладких мышц сосудов к сосудосуживающим веществам, в том числе ангиотензину II.
Таким образом, РААС напрямую вовлечена в драму под названием «артериальная гипертензия», играя в ней одну из главных ролей. К счастью, существует возможность заблокировать эту систему. Сделать это позволяют препараты двух фармакологических групп — ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина II (БРА, они же сартаны).
Первый класс препаратов — ингибиторы АПФ
Препараты этой группы стали одним из первых классов ЛС, которые эффективно снижают активность РААС, — их разработка началась еще в 60‑х годах прошлого века [2]. Сегодня они входят в категорию так называемых «лекарств, спасающих жизни» (life-saving drugs), в связи с доказанной способностью улучшать прогноз при ряде сердечно-сосудистых и почечных заболеваний [2].
Ингибиторы АПФ: механизм действия и эффект
Ингибиторы АПФ снижают уровень циркулирующего ангиотензина II за счет блокады ангиотензинпревращающего фермента, что обусловливает комплексный фармакологический эффект:
При приеме препаратов группы ингибиторы АПФ также улучшается углеводный обмен: повышается чувствительность тканей к инсулину и улучшается метаболизм глюкозы.
Показания и свойства
Спектр активности иАПФ позволяет использовать их при артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, нефропатиях и остром инфаркте миокарда [3].
Ингибиторы АПФ относятся к группе антигипертензивных препаратов, которые определенно снижают АД и замедляют прогрессирование сердечной недостаточности, что определяет их широкое применение в кардиологии. Данные обзора с участием 158 998 пациентов с АГ показали, что прием иАПФ позволяет снизить смертность от всех вышеперечисленных причин. Это — существенное преимущество препаратов иАПФ, в том числе и по сравнению с блокаторами ангиотензина II [4].
Однако иАПФ все‑таки не способны полностью предотвратить превращение ангиотензина I в ангиотензин II, поскольку существует ряд других ферментов, которые успешно «заменяют» АПФ. Именно так работают, к примеру, ферменты химаза, эластаза и катепсин G [5]. При применении иАПФ эти вещества компенсаторно активируются, и блокада РААС становится неполной. Это — существенный недостаток иАПФ.
О чем предупредить клиента?
Важно! Во время консультации уместно подчеркнуть, что препараты, блокирующие активность РААС — иАПФ и БРА, — при постоянном применении наряду с антигипертензивным эффектом защищают сердце и сосуды, достоверно снижая частоту сердечно-сосудистых катастроф. Это маленькое замечание может послужить убедительным аргументом в пользу регулярного и дисциплинированного употребления таких ЛС, согласно инструкции и рекомендациям врача.
Ингибиторы АПФ: вспомним поименно
Рассмотрим особенности некоторых препаратов — представителей группы иАПФ.
Переносимость иАПФ
Предмет особого внимания первостольников, как специалистов, отпускающих препарат, — побочные эффекты иАПФ. Несмотря на в целом благоприятный профиль безопасности, неблагоприятные реакции — слабое звено препаратов этой группы.
О чем предупредить клиента?
Второй класс препаратов — блокаторы рецепторов ангиотензина II
Исследования, которые были сконцентрированы на изучении возможностей блокады РААС, привели к открытию группы препаратов, лишенных классического недостатка иАПФ — побочного эффекта в виде кашля. БРА, или сартаны, более полно блокируют РААС, за счет чего обеспечивают лучшую переносимость, чем их предшественники. Несмотря на относительно недавнее введение в клиническую практику — сартаны начали использоваться для длительного лечения АГ только в 1999 году, — представители этой группы сегодня стали одними из наиболее популярных антигипертензивных ЛС [12].
Сартаны: механизм действия и эффект
Фармакологический эффект сартанов идентичен эффекту иАПФ. За счет конкурентной блокады рецепторов ангиотензина II они подавляют вазоконстрикцию, секрецию альдостерона, уменьшают гипертрофию миокарда, а также улучшают функцию эндотелия.
Механизм действия БРА заключается не в блокаде ангиотензинпревращающего фермента, как в случае с иАПФ, а в блокаде рецепторов ангиотензина АТ1, через которые и реализуется подавляющее большинство физиологических эффектов ангиотензина II (вазоконстрикция и так далее). АТ1‑рецепторы расположены преимущественно в гладкой мускулатуре сосудов, сердце, печени, коре надпочечников, почках, легких и мозге.
За последние 10 лет появились препараты, которые некоторые специалисты предлагают выделить в отдельное, второе поколение БРА. Они не только блокируют АТ1‑рецепторы, но и способствуют нормализации обмена углеводов и липидов.
Показания и свойства
Сартаны, так же как и иАПФ, назначают при целом ряде заболеваний, в том числе при артериальной гипертензии, хронической сердечной недостаточности, перенесенном инфаркте миокарда, диабетической нефропатии, фибрилляции предсердий и метаболическом синдроме. Кроме того, БРА становятся препаратами выбора в ситуациях, когда на фоне приема иАПФ развивается кашель [13].
Доказана эффективность сартанов выраженно снижать артериальное давление и оказывать кардиопротективное действие [13, 14], а также:
Кроме того, некоторые БРА, так же как и иАПФ, снижают вероятность развития диабета и проявляют нефропротективный эффект.
Отдельные представители сартанов
Большинство сартанов имеет схожие свойства и мало чем отличается друг от друга как по фармакокинетическим показателям, так и по гипотензивной и кардиопротективной активности. Но всё же некоторые БРА имеют особенности:
Переносимость сартанов
БРА отличаются хорошей переносимостью, в том числе и по сравнению с иАПФ, поскольку не вызывают кашель. Высокий профиль безопасности препаратов этой группы — залог приверженности больных лечению и успешного результата. Побочные эффекты, которые могут возникать при приеме сартанов, обычно мало выражены. Как правило, они носят преходящий характер и редко становятся основанием для отмены лечения.
О чем предупредить клиента?
В заключение еще раз подчеркнем: иАПФ и БРА доказали и гипотензивный, и кардиопротективный эффект. Подавляющее большинство препаратов этих групп (за исключением фимасартана) сегодня применяется для лечения широкого спектра сердечно-сосудистых заболеваний. Единственное важное условие их эффективности — регулярный, длительный прием и соблюдение всех рекомендаций врача. Напомнив об этом посетителю с рецептом на иАПФ и БРА в конце консультации, первостольник выполнит свой профессиональный долг, приобретет лояльного клиента, а заодно внесет свой вклад в борьбу с одним из самых распространенных заболеваний в мире.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Отряд самоубийц в медицине
Отряд самоубийц в медицине
Необратимый ингибитор (оранжевый), подобно диверсанту, подрывает работу фермента (синий). Это потенциальное лекарство против трипаносомы крузи — главной причины болезни сердца в Латинской Америке.
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Многие лекарства конкурируют с природными молекулами за связывание со своей мишенью. Большинство таких препаратов связывается с белками за счет слабых взаимодействий, но некоторые способны образовывать прочные связи, «выключая» свою мишень до конца ее «жизни», пусть и ценой собственной. Такие лекарства относятся к классу необратимых ковалентных ингибиторов, получивших образное название суицидных ингибиторов (англ. suicide inhibitors). О них и пойдет речь в нашей статье. Как работают и насколько опасны одни из самых эффективных лекарств? Чья болезнь помогла открыть аспирин? Что общего между никотином и грейпфрутовым соком? Ответы на эти и многие другие вопросы вы найдете далее.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Из чего же, из чего же сделаны эти лекарства?
Сегодня сложно представить себе человека, который ни разу в жизни не принял ни одной таблетки. Каждый год прилавки аптек пополняются все новыми и новыми лекарствами. Независимо от цвета упаковки препарата и его лекарственной формы (будь то таблетка, мазь, капсула, раствор для инъекций и т.д.) внутри всегда содержится главный компонент лекарства — действующее вещество. Именно оно и обеспечивает терапевтический эффект.
Большинство действующих веществ является ингибиторами, то есть они блокируют функцию того или иного белка (чаще фермента, но иногда и рецептора) в нашем или чужеродном организме. Многие из них связываются со своей мишенью обратимо, то есть после встраивания в мишень молекула может выйти обратно, так что их возможности сильно ограничены. Но необратимые ковалентные ингибиторы «намертво» связываются со своей мишенью. В результате фермент больше не способен функционировать до тех пор, пока клетка не синтезирует его новые копии.
Низкомолекулярные «взломщики»
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
| Тип связи | Энергия, ккал/моль |
|---|---|
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
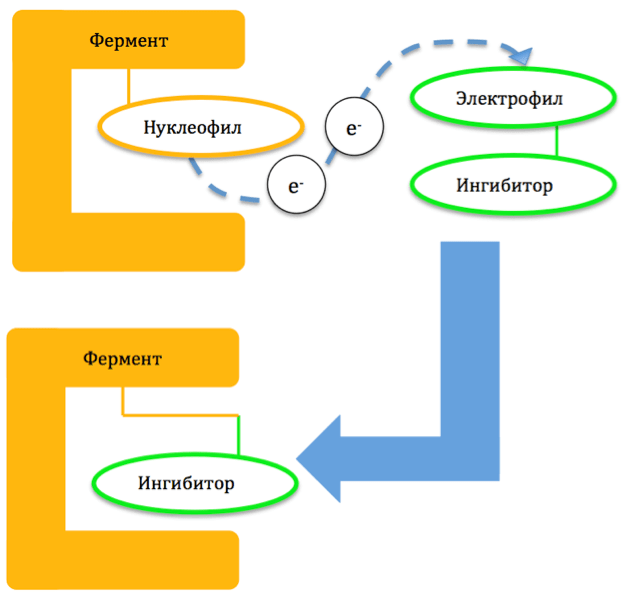
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
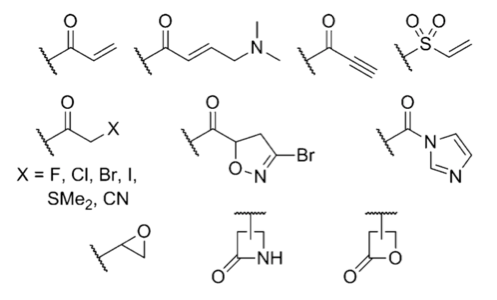
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
| Преимущества | Недостатки |
|---|---|
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].
«Ветераны» борьбы за здоровье человечества
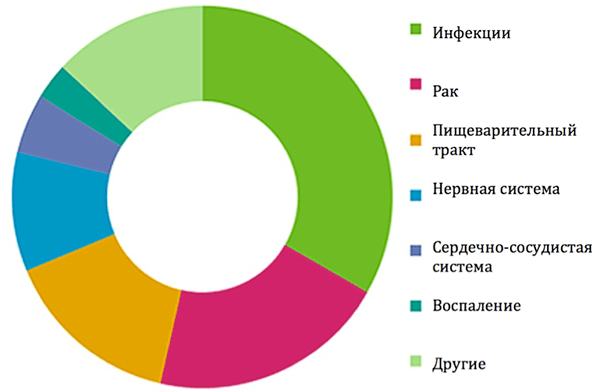
Многие из широко применяемых успешных препаратов — необратимые ковалентные ингибиторы [6]. Например, в 2009 году три необратимо связывающихся ингибитора попали в топ-10 наиболее продаваемых лекарств [2]. В 2011 году из 39 ковалентных лекарств, одобренных в США, 33% являлись противоинфекционными, 20% нашли применение в лечении рака, 15% применялись при болезнях пищеварительного тракта, 10% — при нарушении работы центральной нервной системы, 5% использовались при лечении сердечно-сосудистых заболеваний и один препарат обладал противовоспалительными свойствами (рис. 3) [6], [11].
Рисунок 3. Области применения одобренных в США необратимо связывающихся ингибиторов (данные за 2011 год).
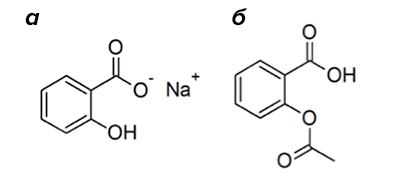
Рисунок 4. Структура салицилата натрия (а) и аспирина (б).
Давайте же поговорим о нескольких наиболее успешных примерах необратимых ковалентных ингибиторов.
Натрия салицилат впервые применили в качестве противовоспалительного лекарства в 1875 году (рис. 4а). Препарат обладал ужасным вкусом и вызывал язвы ротовой полости и желудка. В конце XIX века отец одного из химиков компании Bayer Company, страдающий от тяжелого ревматоидного артрита, упросил своего сына, Феликса Хоффмана, заняться поиском менее опасного аналога салицилата натрия. Феликс синтезировал различные производные и обнаружил, что ацетилсалициловая кислота обладает лучшими свойствами. Так был обнаружен аспирин (рис. 4б). В 1899 году Bayer выпустила аспирин как противовоспалительное, обезболивающее и жаропонижающее средство [2]. Как и в случае многих других препаратов, механизм его действия открыли только спустя 70 лет после коммерциализации препарата [6], за что в 1982 году была вручена Нобелевская премия [2], [12]. Аспирин оказался необратимым ингибитором ферментов, участвующих в реакции воспаления — циклооксигеназ [6].
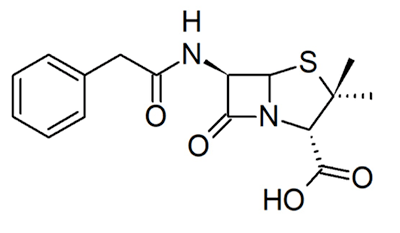
Рисунок 5. Структура пенициллина.
Другие примеры необратимых ковалентных ингибиторов — пенициллины [6]. Их родоначальника, пенициллин (рис. 5), открыл в 1928 году Александр Флеминг [13]. Ученым понадобилось еще 15 лет, чтобы достаточно изучить и начать использовать этот препарат в качестве антибактериального лекарственного средства, что спасло миллионы жизней во время Второй мировой войны [12]. Пенициллин нарушает синтез клеточной стенки бактерий. Он связывается с транспептидазой — ферментом, обеспечивающим первый этап сшивки пептидогликана, который является основным компонентом бактериальной клеточной стенки. Когда пенициллин связывается с транспептидазой, синтез бактериальной клеточной стенки блокируется, и многие бактерии погибают от разрыва клеточной мембраны под воздействием осмотического давления [1].
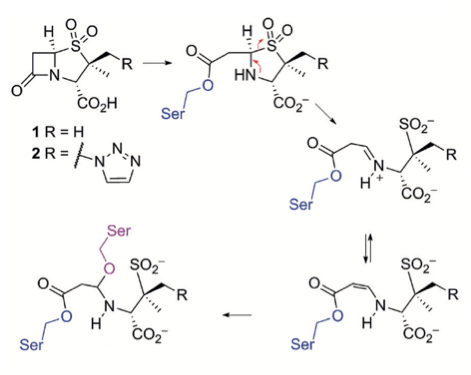
Однако все оказалось не так радужно — у бактерий обнаружились механизмы устойчивости [14]. В частности, резистентность к пенициллинам обеспечивается за счет наличия β-лактамаз — ферментов, расщепляющих пенициллины. Ученые не остановились на достигнутом и разработали ингибиторы этого фермента — сульбактам, тазобактам и клавулановую кислоту. Подобно пенициллинам, в результате нуклеофильной атаки эти соединения претерпевают открытие β-лактамного кольца. Отличие в том, что ингибиторы β-лактамаз подвергаются раскрытию и второго цикла, содержащегося в их структуре. При этом появляется возможность образования дополнительных связей, в том числе и ковалентных (рис. 6) [6], [15].
Рисунок 6. Механизм действия ингибиторов β-лактамаз
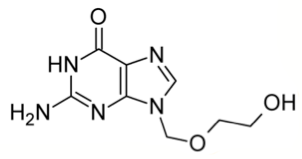
Рисунок 7. Структура ацикловира.
Ацикловир — один из самых эффективных препаратов с противовирусной активностью (рис. 7). Он был открыт в 1974 году крупной ныне фармацевтической компанией — GlaxoSmithKline (тогда она называлась Burroughs Wellcome) — в ходе широкомасштабного поиска противовирусного средства, начавшегося еще в 1960-е годы. А в 1988 году за изучение механизмов действия ацикловира и других препаратов вручили Нобелевскую премию [16].
В клинической практике ацикловир применяют для лечения вируса герпеса. Важно, что здоровые клетки человека не подвергаются действию препарата. Ведь ацикловир попадает в клетку благодаря одному из ферментов вируса — тимидинкиназе! Способность ацикловира связываться с этим ферментом в 200 раз выше, чем с любым ферментом нашего организма. Оказавшись в зараженных клетках, ацикловир преобразуется в ацикловир трифосфат, который связывается с вирусной ДНК и в таком виде необратимо ингибирует вирусные ДНК-полимеразы, необходимые для размножения вируса [17].
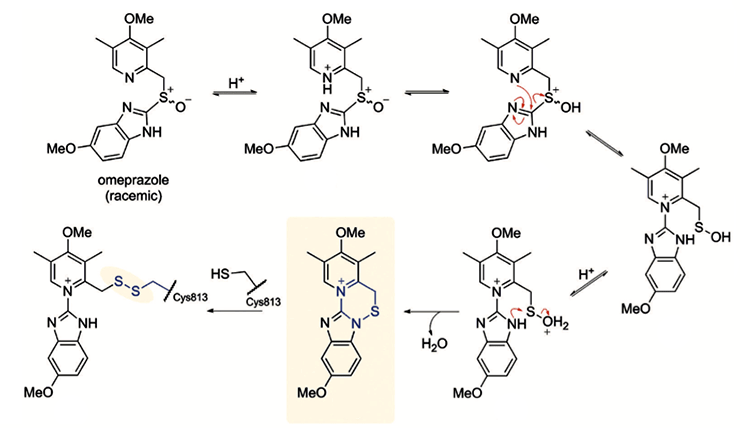
Другим широко известным примером необратимых ингибиторов является омепразол, одобренный к применению в 1980-х. Его применяют при заболеваниях пищеварительной системы, сопровождающихся усиленным выделением желудочной кислоты, таких как изжога или язва желудка. В нейтральной среде омепразол не оказывает действия на наш организм, но при ее закислении желудочным соком необратимо связывается с протонной помпой, ответственной за образование кислоты в желудке. Это происходит потому, что благодаря кислой среде омепразол претерпевает ряд внутримолекулярных перестроек и становится способным принять на себя нуклеофильную атаку каталитического цистеина протонной помпы, тем самым образуя прочную ковалентную связь и выключая этот белок (рис. 8) [6], [18], [19].
Рисунок 8. Механизм действия омепразола.
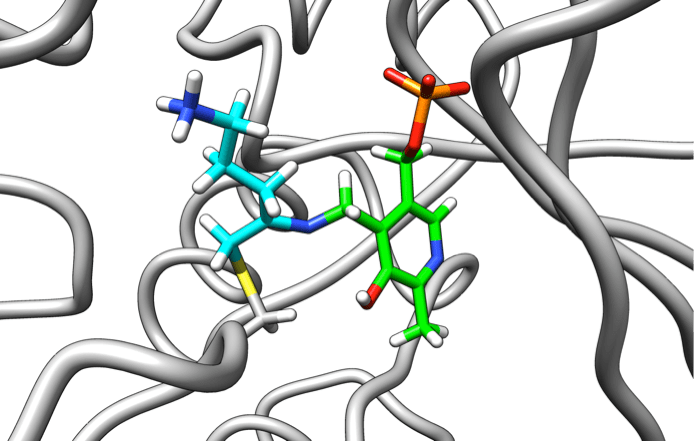
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими рода трипаносома. До конца XX века эта болезнь была практически неизлечима. Вакцины оказались неэффективны против трипаносом из-за того, что последние имеют механизмы обхода иммунной системы человека. Поэтому, основываясь на знаниях о жизненно необходимых ферментах этих простейших, ученые прибегли к разработке механизм-опосредованно связывающихся ингибиторов. Ахиллесовой пятой в метаболизме трипаносом оказался путь биосинтеза полиаминов, вовлеченных в процессы упаковки ДНК и в больших количествах необходимых при делении клеток. Первый этап их синтеза обеспечивает фермент орнитиндекарбоксилаза при участии вспомогательной молекулы — витамина В6. В клетках млекопитающих фермент синтезируется быстро, а у трипаносом этот процесс занимает гораздо больше времени. Именно поэтому необратимые ингибиторы орнитиндекарбоксилазы мало влияют на человеческие клетки, но крайне губительно действуют на паразита [1]. На базе этого механизма был разработан дифторметилорнитин (ДФМО). ДФМО достаточно инертен в растворе, но в результате реакции с витамином В6 приобретает способность связываться с орнитиндекарбоксилазой, которая быстро инактивируется (рис. 9). Эта реакция необратима. Таким образом ДФМО использует собственные реакции фермента для его уничтожения. Препарат показал высокую эффективность против африканской сонной болезни в клинических исследованиях и используется в настоящее время для ее лечения [1].
Рисунок 9. Комплекс производного ДФМО (голубой) с витамином В6 (зеленый) и ферментом орнитиндекарбоксилазой (серый).
А недавно ученые обнаружили, что ДФМО также может использоваться в качестве препарата против рака! Механизм действия ДФМО по отношению к раковым клеткам хорошо изучен. Так же, как и в случае лечения трипаносомоза, этот агент ингибирует действие орнитиндекарбоксилазы. Ведь, что интересно, в опухолевых клетках количество этого белка значительно выше, так как они интенсивно делятся! При инактивации орнитиндекарбоксилазы в раковых клетках падает уровень полиаминов, что нарушает правильную упаковку ДНК, в результате чего клетки перестают делиться. Этот эффект препарата называется цитостатическим. Однако если препарат применять долго, то происходит не замедление деления, а гибель раковых клеток! ДФМО сам по себе не обеспечивает достаточный противораковый эффект, но в комбинации с другими химиотерапевтическими препаратами этот компонент показал увеличение выживаемости пациентов и ускорение темпов выздоровления. Поэтому ДФМО имеет потенциал применения в качестве лекарства, предотвращающего возникновение онкологии, либо снижающего вероятность рецидива рака после удаления опухолевых клеток [20].
Есть ли будущее у необратимых ковалентных ингибиторов?
Долгие годы необратимые ингибиторы были окружены аурой скептицизма, возникшей из-за токсичности некоторых представителей этой группы, обнаруженной в 1970-е годы. Но эффективность и избирательность многих препаратов этой серии доказали, что страхи в их отношении не были оправданными. Конечно, они обладают потенциальной опасностью из-за возможности неспецифических взаимодействий и аллергических реакций, но клиническая практика показывает их незаменимость в лечении целого ряда заболеваний. Сейчас число препаратов этой группы неуклонно растет [6].
Сложность в том, что исследователь должен преследовать сразу несколько целей: повысить избирательность лекарства к ферменту-мишени и тщательно продумать механизм его действия. Но такие свойства необратимых ковалентных ингибиторов, как высокие избирательность и эффективность, высокая продолжительность действия, сниженный риск развития устойчивости к препарату, делают эту группу лекарств незаменимым инструментом в арсенале врачей и разработчиков лекарств [6].