Ингибиторы ферментов это что
Отряд самоубийц в медицине
Отряд самоубийц в медицине
Необратимый ингибитор (оранжевый), подобно диверсанту, подрывает работу фермента (синий). Это потенциальное лекарство против трипаносомы крузи — главной причины болезни сердца в Латинской Америке.
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Многие лекарства конкурируют с природными молекулами за связывание со своей мишенью. Большинство таких препаратов связывается с белками за счет слабых взаимодействий, но некоторые способны образовывать прочные связи, «выключая» свою мишень до конца ее «жизни», пусть и ценой собственной. Такие лекарства относятся к классу необратимых ковалентных ингибиторов, получивших образное название суицидных ингибиторов (англ. suicide inhibitors). О них и пойдет речь в нашей статье. Как работают и насколько опасны одни из самых эффективных лекарств? Чья болезнь помогла открыть аспирин? Что общего между никотином и грейпфрутовым соком? Ответы на эти и многие другие вопросы вы найдете далее.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Из чего же, из чего же сделаны эти лекарства?
Сегодня сложно представить себе человека, который ни разу в жизни не принял ни одной таблетки. Каждый год прилавки аптек пополняются все новыми и новыми лекарствами. Независимо от цвета упаковки препарата и его лекарственной формы (будь то таблетка, мазь, капсула, раствор для инъекций и т.д.) внутри всегда содержится главный компонент лекарства — действующее вещество. Именно оно и обеспечивает терапевтический эффект.
Большинство действующих веществ является ингибиторами, то есть они блокируют функцию того или иного белка (чаще фермента, но иногда и рецептора) в нашем или чужеродном организме. Многие из них связываются со своей мишенью обратимо, то есть после встраивания в мишень молекула может выйти обратно, так что их возможности сильно ограничены. Но необратимые ковалентные ингибиторы «намертво» связываются со своей мишенью. В результате фермент больше не способен функционировать до тех пор, пока клетка не синтезирует его новые копии.
Низкомолекулярные «взломщики»
«В чем же секрет столь сильного связывания этих ваших необратимых ингибиторов?» — спросите вы. В ковалентной связи. Существует несколько механизмов связывания лекарств с их молекулярными мишенями. Обычно связывание происходит при помощи слабых взаимодействий [4]. Ковалентная же связь является сильнейшим из возможных взаимодействий и превосходит любые другие в десятки, а то и сотни раз (табл.1) [5]!
| Тип связи | Энергия, ккал/моль |
|---|---|
| Ковалентная | 50–150 |
| Электростатическая | 5–10 |
| Водородная | 2–5 |
| Гидрофобная | 0,5–1 |
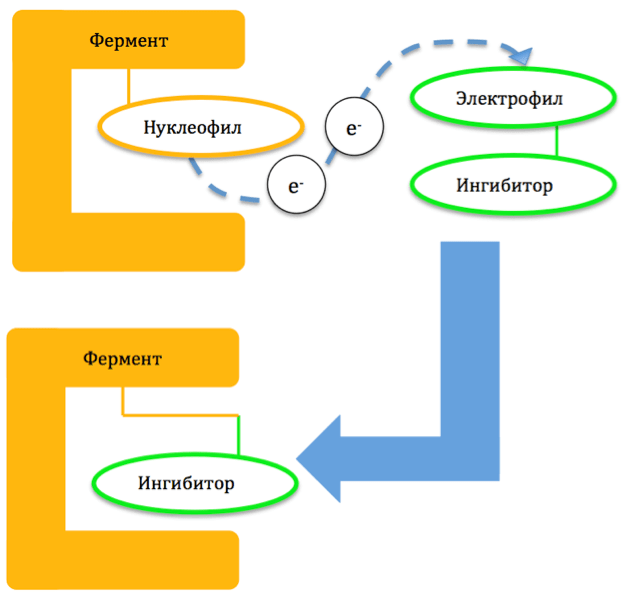
Механизм образования ковалентной связи строится на том, что пара электронов одного из атомов молекулярной мишени (нуклеофила) распределяется между ним и одним из атомов ингибитора (электрофилом) (рис. 1). Из-за высокой прочности связи ингибитор оказывается необратимо присоединен к ферменту и приводит к разрушению последнего. Восстановление функции фермента наступает только после синтеза его новых копий [5].
Рисунок 1. Общий механизм действия необратимых ингибиторов.
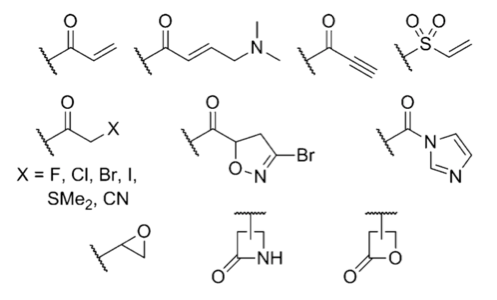
Как же выглядят эти электрофильные группы, которые используются для создания ковалентных необратимых ингибиторов? Найти ответ вы сможете, посмотрев на рисунок 2. Наличие одного из этих фрагментов в структуре лекарства может говорить о том, что оно действует по уже известному вам механизму [6].
Рисунок 2. Примеры электрофильных групп, встречающихся в необратимых ингибиторах.
Несмотря на то, что связывание необратимых ингибиторов приводит к гибели фермента, не следует думать, что одна доза такого лекарства может полностью уничтожить фермент в организме. Наличие и работа генов позволит создать его новые копии, пусть на это и понадобится от нескольких часов до пары дней [2].
Как и все в мире, ковалентные необратимые ингибиторы имеют свои преимущества и недостатки, которые мы представили в формате таблицы 2 [6].
| Преимущества | Недостатки |
|---|---|
| Высокие эффективность и избирательность позволяют использовать меньшие дозы и уменьшить риск побочных эффектов | Высокая активность некоторых представителей может приводить к некрозу печени, мутациям и даже раку! |
| Связывание с важными остатками фермента предотвращает развитие устойчивости микробов, что важно при лечении инфекций | Потенциальная иммуногенность, так как полученный продукт реакции может вызывать аллергический ответ |
| Длительное действие, так как активность фермента вновь появляется только при синтезе его новых копий |
Тернистые пути разработки эффективных лекарств
Если вы думаете, что разработка необратимых ковалентных ингибиторов — легкое дело, то вы глубоко заблуждаетесь. Даже если закрыть глаза на то, что разработка любого лекарства является крайне трудоемким и времязатратным процессом [7], задача не сильно упростится — ведь необратимые ингибиторы требуют особого подхода к своей персоне. Сегодня не так много одобренных препаратов действуют именно таким образом. А механизм действия многих из них открыли только спустя годы после разработки! Ученые на этом пути сталкиваются с большим количеством порой неразрешимых проблем.
Одна из них — участие одного фермента сразу в нескольких метаболических каскадах. Обсуждаемые лекарства необратимо связываются с ферментом-мишенью, уничтожая его на то время, которое требуется на синтез новых копий фермента. Этот процесс может занимать до нескольких суток! В том случае, если фермент-мишень выполнял несколько функций, это чревато серьезными побочными эффектами. Чтобы обойти проблему, необратимо связывающиеся ингибиторы чаще всего применяют для блокирования одного из ферментов потенциально опасных для человека вирусов, бактерий и т. д. [3].
Вторая проблема заключается в том, что при низкой избирательности необратимые ингибиторы могут связываться с нежелательными мишенями, похожими на выбранную нами для ингибирования. Это тоже может приводить к серьезным побочным эффектам. Поэтому важная задача при оптимизации структуры ингибиторов — повышение избирательности к своей мишени [3].
Опасения в отношении побочных эффектов необратимых ингибиторов не лишены оснований. Бум гонений на эту группу препаратов вызвали исследования 1970-х годов. Тогда выяснили, что два из наиболее широко известных представителей этой группы — парацетамол и фуросемид — обладают высокой токсичностью в связи с тем, что, метаболизируясь в печени, они образовывают активные производные, формирующие ковалентные связи с ее белками [2], [8]. Как выяснилось позже, эти единичные случаи не имеют отношения ко многим препаратам из группы необратимых ингибиторов, а парацетамол и фуросемид до сих пор активно используются в клинической практике.
Другим распространенным примером нежелательного необратимого ингибирования является цитохром P450. Цитохромы — группа ферментов в нашем организме, главной задачей которых является обезвреживание потенциально опасных веществ. Первыми необратимыми ингибиторами цитохрома стали алкены и алкины. В результате ингибирования этого фермента процессы детоксикации становятся невозможными. Неполный список препаратов, способных вступать в подобную реакцию, включает 17α-алкенил-стероиды, левомицетин, циклофосфамид, спиронолактон, фурокумарины, никотин, изониазид и барбитураты. Звучит опасно, не правда ли? Не многим опаснее, чем пить грейпфрутовый сок! Его компоненты способны необратимо связываться с цитохромом кишечника и лишать этот фермент активности на 24 часа! К чему это может привести? К тому, что принимаемые в это время лекарства будут более эффективно поступать в наш организм, а рост их концентрации повышает риск развития нежелательных эффектов [5]. Именно поэтому врачи рекомендуют запивать таблетки только водой.
Но всегда ли можно считать необратимые ингибиторы безопасными лекарствами? Конечно же, нет. Поиск необратимых ингибиторов, и правда, не всегда оборачивается успехом для исследователей. В частности, полным провалом завершились исследования мышьяк-содержащих органических соединений для лечения трипаносомоза [9]. Эти соединения необратимо ингибировали жизненно необходимые ферменты трипаносомы за счет образования связей между атомом мышьяка в составе исследуемых веществ и серосодержащими остатками фермента. Но они оказались токсичными не только для трипаносомы, но и для организма человека [5].
К счастью, несмотря на все перипетии судьбы, ученые вновь сфокусировали свои пристальные взгляды на необратимых ковалентных ингибиторах. Лучшее понимание реально существующих рисков и знание механизма химических преобразований открыли множество возможностей для разработки более эффективных лекарств и привели к резкому росту встречаемости необратимых ингибиторов в различных исследованиях [10].
«Ветераны» борьбы за здоровье человечества
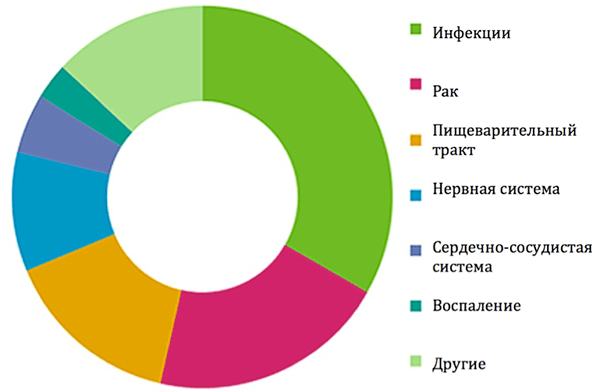
Многие из широко применяемых успешных препаратов — необратимые ковалентные ингибиторы [6]. Например, в 2009 году три необратимо связывающихся ингибитора попали в топ-10 наиболее продаваемых лекарств [2]. В 2011 году из 39 ковалентных лекарств, одобренных в США, 33% являлись противоинфекционными, 20% нашли применение в лечении рака, 15% применялись при болезнях пищеварительного тракта, 10% — при нарушении работы центральной нервной системы, 5% использовались при лечении сердечно-сосудистых заболеваний и один препарат обладал противовоспалительными свойствами (рис. 3) [6], [11].
Рисунок 3. Области применения одобренных в США необратимо связывающихся ингибиторов (данные за 2011 год).
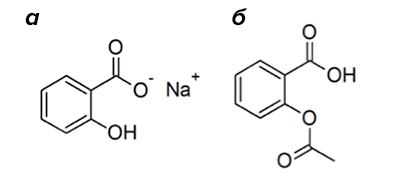
Рисунок 4. Структура салицилата натрия (а) и аспирина (б).
Давайте же поговорим о нескольких наиболее успешных примерах необратимых ковалентных ингибиторов.
Натрия салицилат впервые применили в качестве противовоспалительного лекарства в 1875 году (рис. 4а). Препарат обладал ужасным вкусом и вызывал язвы ротовой полости и желудка. В конце XIX века отец одного из химиков компании Bayer Company, страдающий от тяжелого ревматоидного артрита, упросил своего сына, Феликса Хоффмана, заняться поиском менее опасного аналога салицилата натрия. Феликс синтезировал различные производные и обнаружил, что ацетилсалициловая кислота обладает лучшими свойствами. Так был обнаружен аспирин (рис. 4б). В 1899 году Bayer выпустила аспирин как противовоспалительное, обезболивающее и жаропонижающее средство [2]. Как и в случае многих других препаратов, механизм его действия открыли только спустя 70 лет после коммерциализации препарата [6], за что в 1982 году была вручена Нобелевская премия [2], [12]. Аспирин оказался необратимым ингибитором ферментов, участвующих в реакции воспаления — циклооксигеназ [6].
Рисунок 5. Структура пенициллина.
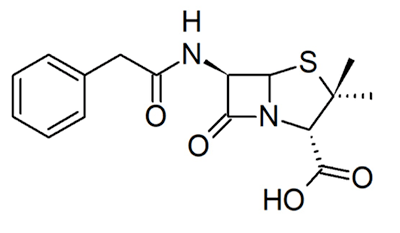
Другие примеры необратимых ковалентных ингибиторов — пенициллины [6]. Их родоначальника, пенициллин (рис. 5), открыл в 1928 году Александр Флеминг [13]. Ученым понадобилось еще 15 лет, чтобы достаточно изучить и начать использовать этот препарат в качестве антибактериального лекарственного средства, что спасло миллионы жизней во время Второй мировой войны [12]. Пенициллин нарушает синтез клеточной стенки бактерий. Он связывается с транспептидазой — ферментом, обеспечивающим первый этап сшивки пептидогликана, который является основным компонентом бактериальной клеточной стенки. Когда пенициллин связывается с транспептидазой, синтез бактериальной клеточной стенки блокируется, и многие бактерии погибают от разрыва клеточной мембраны под воздействием осмотического давления [1].
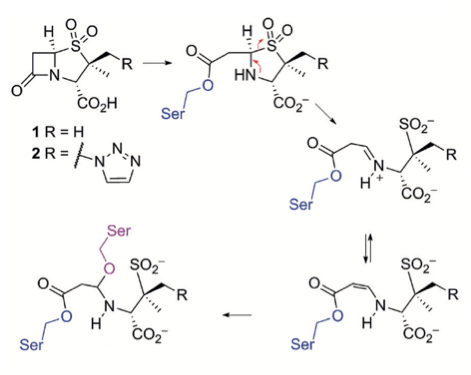
Однако все оказалось не так радужно — у бактерий обнаружились механизмы устойчивости [14]. В частности, резистентность к пенициллинам обеспечивается за счет наличия β-лактамаз — ферментов, расщепляющих пенициллины. Ученые не остановились на достигнутом и разработали ингибиторы этого фермента — сульбактам, тазобактам и клавулановую кислоту. Подобно пенициллинам, в результате нуклеофильной атаки эти соединения претерпевают открытие β-лактамного кольца. Отличие в том, что ингибиторы β-лактамаз подвергаются раскрытию и второго цикла, содержащегося в их структуре. При этом появляется возможность образования дополнительных связей, в том числе и ковалентных (рис. 6) [6], [15].
Рисунок 6. Механизм действия ингибиторов β-лактамаз
Рисунок 7. Структура ацикловира.
Ацикловир — один из самых эффективных препаратов с противовирусной активностью (рис. 7). Он был открыт в 1974 году крупной ныне фармацевтической компанией — GlaxoSmithKline (тогда она называлась Burroughs Wellcome) — в ходе широкомасштабного поиска противовирусного средства, начавшегося еще в 1960-е годы. А в 1988 году за изучение механизмов действия ацикловира и других препаратов вручили Нобелевскую премию [16].
В клинической практике ацикловир применяют для лечения вируса герпеса. Важно, что здоровые клетки человека не подвергаются действию препарата. Ведь ацикловир попадает в клетку благодаря одному из ферментов вируса — тимидинкиназе! Способность ацикловира связываться с этим ферментом в 200 раз выше, чем с любым ферментом нашего организма. Оказавшись в зараженных клетках, ацикловир преобразуется в ацикловир трифосфат, который связывается с вирусной ДНК и в таком виде необратимо ингибирует вирусные ДНК-полимеразы, необходимые для размножения вируса [17].
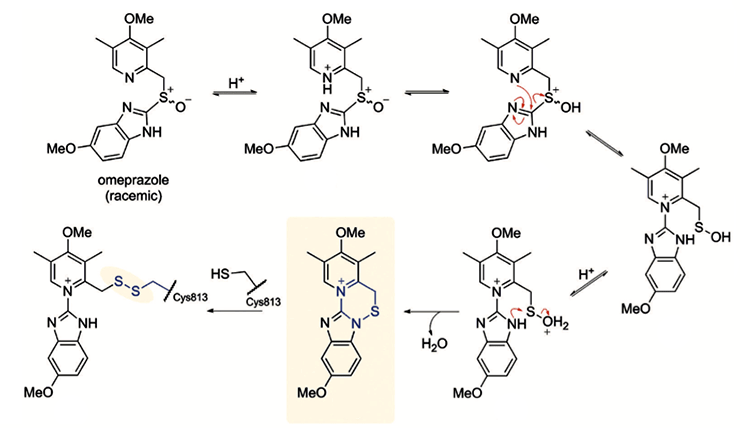
Другим широко известным примером необратимых ингибиторов является омепразол, одобренный к применению в 1980-х. Его применяют при заболеваниях пищеварительной системы, сопровождающихся усиленным выделением желудочной кислоты, таких как изжога или язва желудка. В нейтральной среде омепразол не оказывает действия на наш организм, но при ее закислении желудочным соком необратимо связывается с протонной помпой, ответственной за образование кислоты в желудке. Это происходит потому, что благодаря кислой среде омепразол претерпевает ряд внутримолекулярных перестроек и становится способным принять на себя нуклеофильную атаку каталитического цистеина протонной помпы, тем самым образуя прочную ковалентную связь и выключая этот белок (рис. 8) [6], [18], [19].
Рисунок 8. Механизм действия омепразола.
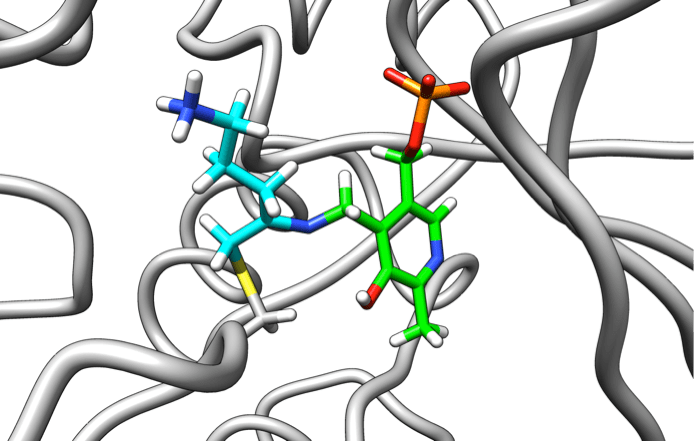
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими рода трипаносома. До конца XX века эта болезнь была практически неизлечима. Вакцины оказались неэффективны против трипаносом из-за того, что последние имеют механизмы обхода иммунной системы человека. Поэтому, основываясь на знаниях о жизненно необходимых ферментах этих простейших, ученые прибегли к разработке механизм-опосредованно связывающихся ингибиторов. Ахиллесовой пятой в метаболизме трипаносом оказался путь биосинтеза полиаминов, вовлеченных в процессы упаковки ДНК и в больших количествах необходимых при делении клеток. Первый этап их синтеза обеспечивает фермент орнитиндекарбоксилаза при участии вспомогательной молекулы — витамина В6. В клетках млекопитающих фермент синтезируется быстро, а у трипаносом этот процесс занимает гораздо больше времени. Именно поэтому необратимые ингибиторы орнитиндекарбоксилазы мало влияют на человеческие клетки, но крайне губительно действуют на паразита [1]. На базе этого механизма был разработан дифторметилорнитин (ДФМО). ДФМО достаточно инертен в растворе, но в результате реакции с витамином В6 приобретает способность связываться с орнитиндекарбоксилазой, которая быстро инактивируется (рис. 9). Эта реакция необратима. Таким образом ДФМО использует собственные реакции фермента для его уничтожения. Препарат показал высокую эффективность против африканской сонной болезни в клинических исследованиях и используется в настоящее время для ее лечения [1].
Рисунок 9. Комплекс производного ДФМО (голубой) с витамином В6 (зеленый) и ферментом орнитиндекарбоксилазой (серый).
А недавно ученые обнаружили, что ДФМО также может использоваться в качестве препарата против рака! Механизм действия ДФМО по отношению к раковым клеткам хорошо изучен. Так же, как и в случае лечения трипаносомоза, этот агент ингибирует действие орнитиндекарбоксилазы. Ведь, что интересно, в опухолевых клетках количество этого белка значительно выше, так как они интенсивно делятся! При инактивации орнитиндекарбоксилазы в раковых клетках падает уровень полиаминов, что нарушает правильную упаковку ДНК, в результате чего клетки перестают делиться. Этот эффект препарата называется цитостатическим. Однако если препарат применять долго, то происходит не замедление деления, а гибель раковых клеток! ДФМО сам по себе не обеспечивает достаточный противораковый эффект, но в комбинации с другими химиотерапевтическими препаратами этот компонент показал увеличение выживаемости пациентов и ускорение темпов выздоровления. Поэтому ДФМО имеет потенциал применения в качестве лекарства, предотвращающего возникновение онкологии, либо снижающего вероятность рецидива рака после удаления опухолевых клеток [20].
Есть ли будущее у необратимых ковалентных ингибиторов?
Долгие годы необратимые ингибиторы были окружены аурой скептицизма, возникшей из-за токсичности некоторых представителей этой группы, обнаруженной в 1970-е годы. Но эффективность и избирательность многих препаратов этой серии доказали, что страхи в их отношении не были оправданными. Конечно, они обладают потенциальной опасностью из-за возможности неспецифических взаимодействий и аллергических реакций, но клиническая практика показывает их незаменимость в лечении целого ряда заболеваний. Сейчас число препаратов этой группы неуклонно растет [6].
Сложность в том, что исследователь должен преследовать сразу несколько целей: повысить избирательность лекарства к ферменту-мишени и тщательно продумать механизм его действия. Но такие свойства необратимых ковалентных ингибиторов, как высокие избирательность и эффективность, высокая продолжительность действия, сниженный риск развития устойчивости к препарату, делают эту группу лекарств незаменимым инструментом в арсенале врачей и разработчиков лекарств [6].
Ингибиторы ферментов это что
А. Типы ингибирования
Так называемые аналоги субстрата ( 2 ) имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа Михаэлиса K m растет ( Б ). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V (см. с. 98) при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния ( 3 ) также действуют как конкурентные ингибиторы.
В случае так называемых ” суицидных субстратов ” ( 5 ) речь идет о субстратных аналогах, содержащих дополнительно реакционную группу. Вначале они связываются обратимо, а затем образуют ковалентное соединение с активным центром фермента. Поэтому ингибирование такими соединениями проявляется как неконкурентное. Известным примером такого ингибитора является антибиотик пенициллин (см. с. 250).
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра ( 6 ). Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности (см. с. 118). Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Б. Кинетика ингибирования
Современные препараты для лечения язвы
Поделиться:
Язвенная болезнь желудка и двенадцатиперстной кишки по-прежнему остается одной из самых частых проблем ЖКТ. В последние годы подходы к лечению язвы постепенно изменяются в связи с выдающимися достижениями микробиологии, физиологии и анатомии.
Что такое язва
Морфологический субстрат — язва — представляет собой дефект слизистой оболочки, который образуется под агрессивным воздействием желудочного содержимого на фоне сниженной способности слизистой к восстановлению и защите самой себя. Все направления терапии сводятся к устранению этих факторов агрессии и повышению защитных свойств слизистой.
Ингибиторы протонной помпы и их действие
В лечении язвы на первом месте стоит проблема повышенной кислотности, и пути решения этой проблемы были разработаны десятки лет назад, после открытия в 1973 году особого белкового «насоса» — протонной помпы, поставляющей протоны водорода для образования соляной кислоты в желудке.
Читайте также:
Как лечить язву желудка
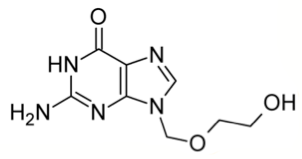
Ингибиторы протонной помпы (ИПП) впервые заявили о себе в 1974 году, когда был синтезирован первый представитель этого ряда. А уже через 5 лет он появился на рынке в виде широко известного сегодня омепразола.
В настоящее время существует уже 5 поколений ИПП, а в России зарегистрированы 6 таких препаратов: омепразол, пантопразол, лансопразол, рабепразол, эзомепразол, декслансопразол.
Лекарства различаются в основном по их фармакокинетике — т. е. «пути» по организму к органу-мишени. Традиционно используемый омепразол прочно занимает лидирующие позиции, но фармацевтическое производство не стоит на месте, и другие препараты из этой же группы на данный момент представляют большой интерес.
К примеру, у лансопразола минимальная действующая доза особенно мала. Он начинает действовать быстрее, чем всем известный омепразол, но и стоит дороже. Декслансопразол имеет модифицированное высвобождение и длительное действие, которое продолжается даже ночью, что позволяет избежать так называемого «ночного кислотного прорыва» (повышения кислотности ночью).
Еще одной проблемой, которую позволяют решить современные ингибиторы, является устойчивость к ним — например, рабепразол не зависит от действия ферментов, вызывающих эту самую устойчивость. Он также не влияет на метаболизм других лекарственных средств, что нередко бывает проблемой при использовании омепразола. В отношении безопасности взаимодействия с другими препаратами хорошие результаты также дает пантопразол.
Для подбора наиболее подходящего препарата используют 24-часовую pH-метрию. Она нужна, чтобы отследить состояние среды в ЖКТ и ее изменение под действием лекарства. Обычно лекарства применяют месяцами для того, чтобы язва «зажила» — т. е. образовался рубец. Но, по данным некоторых исследований, эпителизация язвы под действием омепразола в 95 % случаев происходит уже через 8 недель.
Для того чтобы отследить процесс рубцевания, целесообразно провести ФГДС через 1–1,5 месяца после начала лечения, поскольку, во-первых, ИПП, как и все лекарства, имеют свои побочные эффекты, и длительное бесконтрольное их применение нежелательно, а во-вторых, это позволит оценить эффективность терапии вообще и снять с повестки вопрос о необходимости замены препарата или, наоборот, искать замену.
Последние рекомендации и вовсе рекомендуют принимать ИПП в пределах эрадикационной схемы (7–14 дней в зависимости от ее эффективности). Но если язва образовалась вне связи с Helicobacter рilori, имеет смысл поддерживать кислотность ингибиторами протонной помпы до заживления язвы.
Блокаторы Н2-гистаминовых рецепторов
Другая группа препаратов, которая снижает кислотность желудка, действует опосредованно, блокируя рецепторы гистамина. Гистамин повышает образование соляной кислоты, пепсина. За открытие эффектов этого вещества в 1936 году была присуждена Нобелевская премия по медицине.
Препараты, соответственно, называются блокаторы Н2-гистаминовых рецепторов. Кроме основного эффекта — уменьшения кислотообразования — они также усиливают защитные свойства слизистой, повышая образование бикарбонатов и простагландинов, которые являются ее естественными защитниками.
Основными представителями этой группы являются ранитидин, фамотидин, циметидин. До появления ИПП эти препараты были лидерами в кислотоподавлении, но с приходом омепразола им пришлось потесниться. В настоящее время данная группа препаратов применяется как альтернатива или дополнение к терапии ИПП. Особенно эффективны внутривенные формы препаратов, которые позволяют быстро купировать болевой синдром при обострении язвенной болезни.
Борьба с бактериями
Роль Helicobacter рilori в развитии язвенной болезни была доказана в 1990-х годах американскими учеными Робином Уорреном и Барри Маршаллом, которые в 2005-м получили за это Нобелевскую премию по медицине. Эта бактерия обладает прямым повреждающим действием на эпителий желудка, поселяясь на нем и фактически его и разрушая.
Однако, по мнению некоторых ученых, колонизация Helicobacter рilori не всегда означает развитие язвы, а в случае, если это все же произошло, говорит скорее о сбоях в иммунной системе. Тем не менее бактерию необходимо ликвидировать.
Сообществом гастроэнтерологов выработаны схемы по эрадикации, которые основаны на международных соглашения экспертов Маастрихтской согласительной конференции. Поскольку эти схемы включают в себя антибиотики, которые применяются уже достаточно длительное время, необходимо учитывать возможную резистентность микроорганизмов к препаратам первой линии и желательно контролировать эффективность терапии на всем ее протяжении. Для этого можно использовать большой арсенал современных методов — как ФГДС с прямой биопсией и микроскопией, так и дыхательный тест.
В случае неэффективности первой линии нужно приступать к смене антибиотика следующим же курсом. Современные диагностические центры обладают необходимой аппаратурой для проведения проб на чувствительность к антибиотику, а также определения минимальной концентрации лекарства, необходимой для подавления бактерии: возможно, доза, которую вы получаете, недостаточна для ликвидации микроба.
Пробиотики
Еще одним перспективным направлением в лечении язвы является использование пробиотиков, которые не только нормализуют микрофлору после агрессивного действия антибиотиков, но и способствуют укреплению иммунитета, как местного, так и общего.
Поскольку в желудке среда кислая, разнообразие штаммов микроорганизмов, которые могут там успешно выживать и помогать организму бороться с язвой, ограничено. Фактически таким микроорганизмам может требоваться подкрепление, которое и приходит в виде пробиотиков. Здесь имеет значение форма выпуска препарата — кислотоустойчивые капсулы будут иметь большое преимущество.
Средством, успешно сочетающим эти характеристики, является бифиформ, который был исследован в 2005 году в рамках противоязвенной терапии как дополнительный компонент к стандартной схеме. У больных, которые его принимали, удалось исправить иммунные нарушения и добиться более высокого процента ликвидации бактерии Helicobacter pilori и заживления дефекта. Препарат включал в себя 2 штамма — Bifidobacterium longum и Enterococcus faecium.
В ряде исследований нашел эффективное применение другой штамм — Saccharomyces boulardii, применение пробиотика на его основе улучшило как результаты лечения, так и его переносимость. Что важно, прием пробиотиков необходимо осуществлять более длительно, чем саму эрадикационную схему, — на 2 и более недели дольше.
Препараты ближайшего будущего
Патогенез язвенной болезни довольно сложен и включает в себя также и влияние стресса, лекарственных препаратов (к примеру, НПВС достоверно ухудшают течение язвенной болезни и могут послужить причиной самостоятельной патологии — лекарственной язвы). В рамках решения этой проблемы были исследованы препараты, которые защищают слизистую от этих воздействий: мексидол, гипоксен, диосмин.
Все они относятся к разным группам по своему строению, но имеют общие свойства — антигипоксическое и антиоксидантное. Данные препараты пока не вошли в клиническую практику для лечения язвенной болезни, они еще только рекомендуются к клиническим испытаниям, но первую фазу — эксперименты на животных — эти средства уже успешно прошли.
Среди препаратов, которые в практике используются для защиты желудка, стоит упомянуть о гевисконе. В своем составе он имеет альгинат натрия (добывается из водорослей), который при взаимодействии с кислотой образует защитную пленку. В отличие от других лекарств гевискон не имеет системного действия и может использоваться длительное время без побочных эффектов.
Еще одна группа лекарств — защитников слизистой — это препараты простагландинов. Они улучшают кровоток в оболочке желудка, стимулируют образование защитной слизи и бикарбонатов.
Хорошо зарекомендовали себя синтетические аналоги простагландинов, поскольку они обладают более продолжительным эффектом: мизопростол, арбопростил, риопростил. Их терапевтическую эффективность можно сравнить с блокаторами Н2-гистаминовых рецепторов.
Для заживления язв будут полезны другие вещества — «репаранты». Они способствуют заживлению уже образовавшихся дефектов, однако механизм действия их еще недостаточно изучен и довольно сложен. Среди репарантов выделяются метилурацил (метацил) и пентоксил. Оба лекарства стимулируют процесс заживления и регенерации. Форма выпуска — таблетки.
Современная медицина располагает большими возможностями и в диагностике, и в лечении язвенной болезни благодаря научным открытиям в практической медицине и развитию фармацевтической промышленности. Это предоставляет возможность подходить к терапии язвы индивидуально, подбирая препараты с учетом их эффективности у конкретного человека.
Наряду с традиционными схемами эрадикации исследуются способы восстановления защитных свойств желудка, ускорения заживления язв. Соответствующие препараты следует иметь в виду при назначении комплексной противоязвенной терапии.
Товары по теме: [product strict=” омепразол”]( омепразол), [product strict=” пантопразол”]( пантопразол), [product strict=” лансопразол”]( лансопразол), [product strict=” РАБЕПРАЗОЛ-СЗ”]( рабепразол) [product strict=” эзомепразол”]( эзомепразол) [product strict=” ранитидин”]( ранитидин) [product strict=” фамотидин”]( фамотидин) [product strict=” бифиформ”]( бифиформ) [product strict=” метилурацил”]( метилурацил) [product strict=” мексидол”]( мексидол) [product strict=” гипоксен”]( гипоксен) [product strict=” диосмин”]( диосмин)




 Читайте также:
Читайте также: 



